Неорганические материалы, 2022, T. 58, № 3, стр. 235-257
Двойные фториды лития и редкоземельных элементов – материалы фотоники. 1. Физико-химическая характеристика
П. П. Федоров 1, *, В. В. Семашко 2, 3, С. Л. Кораблева 2
1 Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
2 Казанский (Приволжский) федеральный университет
420008 Казань, ул. Кремлевская, 18, Россия
3 Казанский физико-технический институт им. Е.К. Завойского Казанского научного центра
Российской академии наук
420029 Казань, ул. Сибирский тракт, 10/7, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 21.08.2021
После доработки 07.12.2021
Принята к публикации 10.12.2021
- EDN: LMFGUN
- DOI: 10.31857/S0002337X22030046
Аннотация
Фториды лития и редкоземельных элементов (РЗЭ) LiRF4, образующиеся в системах LiF–RF3, являются важными лазерными материалами. В обзоре рассмотрены фазовые равновесия в системах LiF–RF3, структура соединений LiRF4, особенности выращивания монокристаллов из расплава. Проанализированы данные о коэффициентах распределения примесей и предложены общие аналитические зависимости для ряда РЗЭ. Рассмотрено использование систем LiF–RF3 для синтеза других функциональных материалов. Представлена информация о соединениях, образующихся в тройных системах с участием фторидов лития и РЗЭ, а также о нано- и микроматериалах на основе LiRF4.
ВВЕДЕНИЕ
Фториды лития-редкоземельных элементов (РЗЭ) впервые изучены Thoma с соавторами в ходе выполнения американского проекта по атомной энергетике [1, 2]. Построен ряд фазовых диаграмм LiF–RF3 и выявлено образование соединений LiRF4 (R = Eu–Lu, Y), характер плавления которых меняется от инконгруэнтного к конгруэнтному при уменьшении ионного радиуса РЗЭ. Систематический синтез и измерение параметров решетки соединений LiRF4 проведены в работе [3]. Несмотря на то что американские исследователи пользовались некорректной схемой фазовых превращений трифторидов РЗЭ RF3 [4], искаженной вследствие частичного пирогидролиза (заниженные температуры фазовых превращений у трифторидов Gd, Er, Tm, Yb, Lu, Y; ложные полиморфные превращении у TbF3, DyF3, HoF3) [5–9], построенная схема фазовых превращений в ряду систем LiF–RF3 оказалась вполне удачной, что в значительной степени подтверждено в ходе дальнейших исследований [10–13].
Кристаллическая структура LiRF4 близка к структуре шеелита. К. ч. R3+ равно 8, координационный полиэдр лития – искаженный тетраэдр [14].
Соединения LiRF4, особенно LiYF4 и LiLuF4, оказались прекрасными матрицами для твердотельных лазеров при легировании их активными ионами РЗЭ. Это обстоятельство вызвало цикл исследовательских работ по выращиванию монокристаллов [15]. Впервые монокристаллы LiYF4, легированные ионами РЗЭ, были выращены методом Чохральского сотрудниками Массачусетского технологического института (США) [16, 17]. Вскоре за разработками американских фирм [18–22] последовали систематические исследования британских [23, 24] и советских ученых, в первую очередь Государственного оптического института [25–27].
Для этого класса соединений появились аббревиатуры: YLF (для LiYF4), или ИЛФ, LLF (для LiLuF4). Широко распространено также обозначение “фториды типа шеелита”.
Выращивание монокристаллов этих соединений – весьма сложная технология, требующая высокой очистки реактивов от примеси кислорода, жесткого фторирования, нестандартной конфигурации теплового узла, строгого соблюдения технологического режима и многочисленных ноу-хау [27–29]. Особенности выращивания, в том числе, связаны с характером фазовых равновесий в системе LiF–YF3, характером плавления соединения LiYF4, которое лежит на границе конгруэнтного плавления в окрестности точки бифуркации фазовых диаграмм [11, 22–24].
В настоящее время кристаллы ИЛФ – один из наиболее востребованных классов лазерных твердотельных материалов, занимающих коммерческую нишу. Помимо США [30], кристаллы выращиваются во Франции [29, 31], Японии [32], Бразилии [33, 34], Италии [35], Китае [36] и др. В России ведущие позиции занимает Казанский федеральный университет, в котором исследования этих материалов насчитывают несколько десятилетий [27, 37–42].
Двойные фториды лития-иттрия или лития-лантаноидов (кристаллы LiRF4, где R = Y, Gd–Yb и их твердые растворы) открывают возможность создания эффективных функциональных материалов квантовой электроники и оптимизации кристаллохимическим путем их свойств под конкретные прикладные задачи. Активированные кристаллы ИЛФ демонстрируют эффективную лазерную генерацию в различных спектральных диапазонах. Это одни из наиболее перспективных материалов, с которыми связывается прогресс в области фотоники, квантовых компьютеров и квантовых коммуникаций. Соответствующие лазерные системы важны для биомедицинских приложений, мониторинга окружающей среды и др.
Значительный теоретический интерес представляют магнитные свойства соединений LiRF4, в том числе низкотемпературные фазовые переходы [43, 44]. Некоторые монокристаллы (R = Tb, Dy, Ho, Er, Yb) зарекомендовали себя в качестве магнито-оптических вращателей плоскости поляризации света, основанных на эффекте Фарадея (“ротаторы Фарадея”) [45]. Данные материалы перспективны в качестве оптических изоляторов для мощных лазерных систем широкого спектрального диапазона.
В последние годы активно исследуются нанофториды LiRF4 в виде как порошков, так и стеклокерамики [46–52], в том числе для биомедицинских приложений. На наночастицах ИЛФ зафиксирована высокая эффективность ап-конверсии ИК-излучения в видимое [49]. Оптические нанотермометры на их основе демонстрируют рекордные характеристики [50, 52].
ФАЗОВЫЕ РАВНОВЕСИЯ В СИСТЕМАХ LiF–RF3
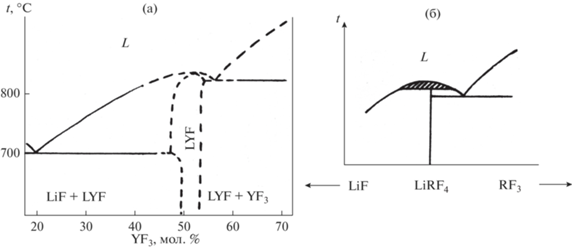
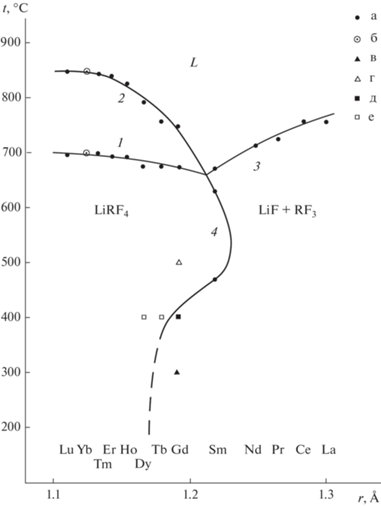
Общая схема фазовых равновесий в системах представлена в работах Тома [1, 2, 53]. Дальнейшие тщательные уточнения, связанные с особенностями роста кристаллов, проводились в работах [10–12, 24, 30, 54–56]. Многолетние работы британских исследователей [24, 54, 55] привели к противоречивым выводам относительно характера плавления LiYF4 (см. рис. 1). Изучение различных участков слитков составов LiRF4 (R = Y, Er), подвергнутых зонной кристаллизации, методом термического анализа привело к предположению о наличии области гомогенности этих соединений (рис. 1а) [54]. Однако повторное исследование этих систем с контролем микроструктуры сплавов [55] привело к предположению о синтектическом характере плавления LiYF4 (рис. 1б), при этом предположение о наличии области гомогенности на основе этого соединения сочтено маловероятным. Отмечено также, что очистка зонной плавкой повышает температуры конгруэнтного плавления LiYF4 и LiLuF4 с 820 до 837°С и с 835 до 843°С соответственно [24].
Проведено термодинамическое моделирование систем, в т. ч. с фторидами РЗЭ цериевой подгруппы, связанное с аналогичным поведением актиноидов во фторидных расплавах [57–60]. Фазовая диаграмма системы LiF–GdF3, опубликованная в работе [61], некорректна.
Наиболее надежные данные получены в работах [10–12], в которых применена специальная методика исследования фазовых равновесий. Ранее эта методика использована для изучения фазовых равновесий в рядах систем фторидов РЗЭ с фторидами магния, кальция, стронция, бария [13], а также NaF–RF3 [62]. В установке ДТА использована вакуумированная камера, не имеющая керамических деталей. Установка снабжена специальным дозатором, позволяющим менять состав анализируемого вещества без разгерметизации установки и вывода ее из рабочего режима, что в разы повышает воспроизводимость результатов эксперимента. Реактивы очищались переплавкой во фторирующей атмосфере. Исследование проводилось в статической атмосфере высокочистого гелия. Исследовано влияние материала тигля на переохлаждение расплавов фторидов лития-РЗЭ. Разработана специальная методика циклирования, позволяющая определять температуру ликвидуса в случае переохлаждения расплава [63].
Тщательные измерения фазовых превращений в средней части системы LiF–YF3 проведены также в работе [64].
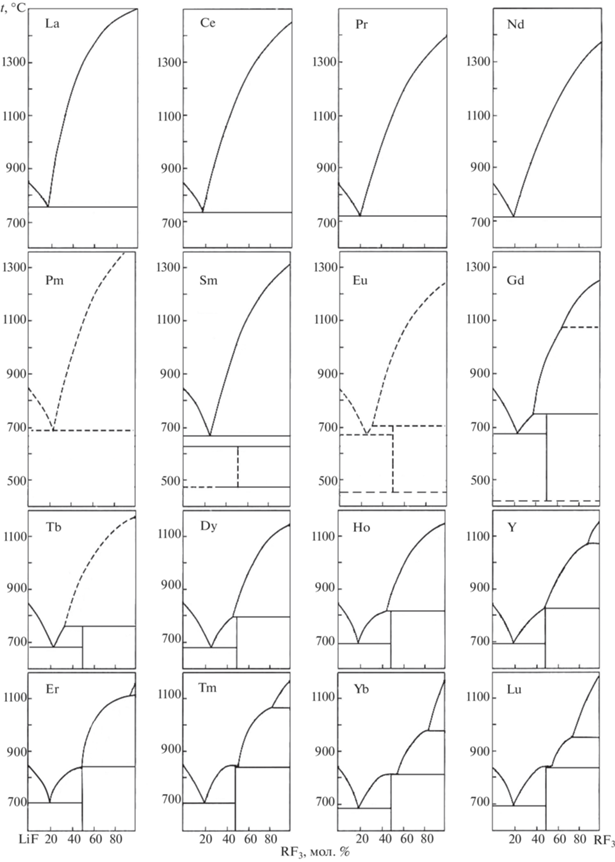
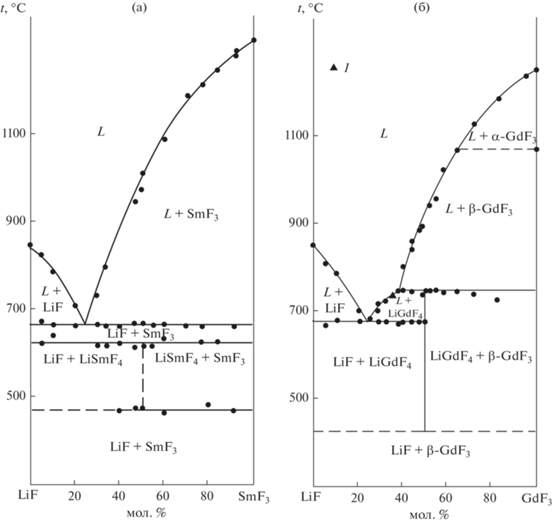
Фазовые диаграммы систем LiF–RF3 представлены на рис. 2, координаты нонвариантных точек представлены в Supplement (табл. 1) с учетом данных [65–67], а их изменение по ряду РЗЭ – на рис. 3 и 4. Системы LiF–YF3 [68, 69], LiF–SmF3 и LiF–GdF3 [12] представлены на рис. 5 и 6.
Таблица 1.
Эффективные коэффициенты распределения катионов РЗЭ при кристаллизации расплавов LiRF4
| Примесный катион | Ионный радиус r, Å | k | Источник | k | Источник |
|---|---|---|---|---|---|
| LiYF4 | LiLuF4 | ||||
| Ce | 1.283 | 0.116* | [119] | 0.054* | [119] |
| 0.12 | [36] | 0.066(3) | [121] | ||
| 0.26 | [92, 118] | 0.18 | [92] | ||
| Pr | 1.266 | 0.158 ± 0.03 | [41] | 0.097 ± 0.01 | [41] |
| Nd | 1.249 | 0.31 ± 0.02 | [120] | 0.2 | [124] |
| 0.38 | [106] | 0.31(6) | [91] | ||
| 0.33 | [122] | ||||
| Ho | 1.155 | 1.1*** | [104] | 0.90*** | [104] |
| Tm | 1.134 | 1.0 | [106] | 0.94*** | [104] |
| 1.02*** | [104] | ||||
| Yb | 1.125 | 0.96 | [123] | ||
| Lu | 1.117 | 1.065** | 1.00 | ||
| Y | 1.159 | 1.00 | |||
Рис. 3.
Составы нонвариантных точек в системах LiF–RF3 [10]: 1 – эвтектика LiF + LiRF4 ↔ L, 2 – равновесия L + LiRF4 + RF3 (перитектика для R = Gd–Ho, эвтектика для R = Tm–Lu и переходная точка для R = Er), 3 – эвтектика LiF + RF3 ↔ L.
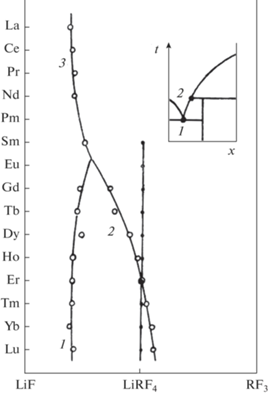
Рис. 4.
Фазовые равновесия в системах LiF–RF3 в координатах температура превращения–ионный радиус R3+: 1 – эвтектика LiF + LiRF4 ↔ L, 2 – равновесия L + LiRF4 + RF3, 3 – эвтектика LiF + RF3 ↔ L, 4 – равновесия LiF + RF3 ↔ ↔ LiRF4; а – температуры превращений по данным [10], б – температуры превращений по данным [2], в – образование GdF3 по данным [66], г – образование LiGdF4 по данным [66], д – образование GdF3 по нашим данным, е – oбразование LiRF4 по нашим данным (ионные радиусы R3+ по данным [70], к. ч. 8; линии являются ориентировочными).
Системы LiF–RF3 с R цериевой подгруппы относятся к эвтектическому типу. При уменьшении ионного радиуса R3+ (лантаноидное сжатие) [70] происходит образование соединений 1 : 1 с последовательным увеличением их устойчивости. В системе с самарием методом ДТА установлено существование в узком температурном интервале соединения LiSmF4, существующего на границе термодинамической устойчивости [10]. При уменьшении ионного радиуса РЗЭ устойчивость соединений повышается, инконгруэнтный характер плавления имеют соединения с R = = Gd, Tb, Dy, Ho, конгруэнтный – с R = Tm, Yb, Lu. Соединения с иттрием и эрбием находятся вблизи перехода от конгруэнтного плавления к инконгруэнтному, чем определяется сложность выращивания их монокристаллов. Характер плавления, переходный от конгруэнтного к инконгруэнтному, – простейшая бифуркация фазовых равновесий в бинарных системах [71, 72].
В работе [66] выявлена нижняя граница устойчивости для LiGdF4. При исследовании синтеза LiGdF4 и LiYF4 золь–гель-методом обнаружено, что при 300°С вместо LiGdF4 образуется GdF3, а для синтеза LiGdF4 необходимо поднять температуру до 550°С. При этом образование LiYF4 успешно происходит и при 300°С [66]. Синтезы в расплаве нитрата натрия [67] показали, что при 400°С LiGdF4 не образуется, в отличие от LiRF4 (R = Y, Tb, Dy). Зависимость температурных границ существования LiRF4 от ионных радиусов R3+ (рис. 4) однозначно свидетельствует о наличии нижней температурной границы устойчивости для LiEuF4 при 450 ± 15°С. Примерами соединений, устойчивых выше определенной температуры, являются NaLaF4, KCaF3 [73, 74].
Таким образом, ниже 430 ± 15°С фаза LiGdF4 термодинамически неустойчива. Однако выращенные из расплава кристаллы LiGdF4 не демонстрируют признаков распада при хранении годами и являются основой функциональных материалов, несмотря на термодинамическую метастабильность. Этим данное соединение выгодно отличается от LiSmF4. Для разложения LiGdF4 при комнатной температуре требуется приложение давления около 13 ГПа [75]. Низкотемпературная устойчивость соединения LiTbF4 требует дополнительных исследований. Диаграмма зависимости трехфазного равновесия от температуры и ионного радиуса (рис. 4) должна иметь вертикальную асимптоту при приближении к абсолютному нулю температуры [76].
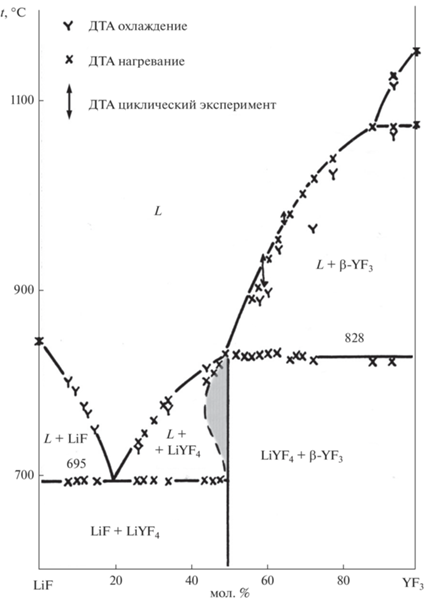
На рис. 5 изображена область гомогенности на основе LiYF4. Наличие нестехиометрии в кристаллах LiRF4 описано Абелем и др. [54] на основе исследования методом ДТА слитков, полученных методом зонной плавки, а также в работе Заморянской и др. [69]. Однако в работе [10] зафиксировано постоянство параметров решетки LiYF4 для образцов, составы которых были взяты по обе стороны от стехиометрии 1 : 1, после отжигов порошков при 660°С. Это свидетельствует о малой ширине области гомогенности при этой температуре. Таким образом, нестехиометрия имеет место только вблизи температуры плавления соединения. Это приводит к ретроградной зависимости растворимости фторида лития в матрице LiYF4 (рис. 5). Такая форма кривой растворимости означает, что в некотором интервале концентраций при охлаждении должно наблюдаться частичное плавление уже выросшего кристалла, что может приводить к образованию пузырей при охлаждении нестехиометрического слитка. Это объясняет явление, наблюдавшееся в работе [55]. Таким образом, нет предпосылок предполагать существование синтектического равновесия в системе LiF–YF3 (рис. 1б).
Проведенные исследования [10, 11] показали, что имеет место сильное (десятки °С) переохлаждение расплавов LiYF4 и LiLuF4 при кристаллизации в графитовых и стеклоуглеродных тиглях. При этом затвердевание LiYF4 может осуществляться как по конгруэнтному, так и по инконгруэнтному механизму. Этим объясняется фиксация в сплавах эвтектической структуры LiYF4 + YF3 [55].
Структура соединений LiRF4 расшифрована для R = Yb [2] и Y [14, 77, 78]. Результаты работ [77, 78] практически совпадают, причем Garcia и Ryan [78] не цитируют более ранние работы [14, 77]. Соединения кристаллизуются в тетрагональной сингонии, пр. гр. I41/a, Z = 4. Структуру можно рассматривать как производную от структуры флюорита с дифференциацией катионов по кристаллографическим позициям перепендикулярно оси с с удвоением параметра решетки в этом направлении. Параметры решетки соединений приведены в Supplement (табл. 2 ), температурная зависимость параметров решетки для LiYF4 и LiYbF4 – в работе [79]. К. ч. РЗЭ – 8. Координационный полиэдр {YF8} сложной формы можно описать как искаженный додекаэдр или искаженную пентагональную бипирамиду с дополнительным ионом фтора над одним из ребер [77]. Все четыре иона РЗЭ в элементарной ячейке занимают эквивалентные положения и имеют точечную симметрию S4. Координационный полиэдр {LiF4} представляет собой искаженный тетраэдр. Полиэдры {YF8} соединены по общим ребрам, тетраэдры {LiF4} соединены с ними вершинами, образуя трехмерный каркас (рис. 7).
Широко распространенное утверждение, что соединения LiRF4 кристаллизуются в структуре шеелита CaWO4 [3, 80–82] не совсем точно: структуры близки, но не тождественны, поскольку полиэдры {CaO8} имеют несколько другую форму. В целом кристаллохимическое описание восьмивершинных полиэдров представляет собой сложную проблему [83]. Кроме шеелита, структура соединений LiRF4 имеет общие кристаллохимические мотивы со структурами циркона ZrSiO4 и ксенотима YPO4.
При приложении высокого давления LiYF4 и LiLuF4 без разложения претерпевают фазовый переход в структуру фергусонита [80–82].
Таким образом, с кристаллохимической точки зрения область существования соединений LiRF4 ограничена РЗЭ-катионами, которым присуще к. ч. 8. Для крупных катионов цериевой подгруппы такое к. ч. не характерно [84], что и определяет понижение устойчивости и исчезновение соединений LiRF4 при увеличении ионного радиуса катиона в системах LiF–RF3 (рис. 2, 4).
С другой стороны, к. ч. 8 не характерно для самого маленького РЗЭ-катиона – скандия, для которого во фторидах наблюдаются координационные числа 6 и 7. Первоначальное сообщение Бабаевой и Бухаловой [85] о составе соединения, образующегося в системе LiF–ScF3, было ошибочно. Вместо LiScF4 образуется соединение Li3ScF6, существующее в твердом состоянии ниже 480°С (ниже температуры эвтектики 617°С) [86]. Структуру Li3ScF6 можно описать как плотнейшую гексагональную упаковку ионов фтора, в которой катионы занимают места в октаэдрических пустотах, т.е. скандий имеет координационное число 6 [87]. Аналогичная ситуация имеет место и для фторида индия [88]: при нормальном давлении LiInF4 не существует, есть соединение 3 : 1. Однако при повышении давления анионы сжимаются сильнее катионов, координационные числа катионов повышаются, и в работе Tyagi и др. [89] при 5.5 ГПа и 575°С зафиксировано образование LiScF4 типа шеелита, пр. гр. I41/a.
Исследованы фазовые равновесия в некоторых системах LiRF4–LiR'F4. Непрерывные твердые растворы образуются в системах LiYF4–LiErF4, LiYF4–LiLuF4 [24, 68], и, по-видимому, в системе LiYF4–LiGdF4 (но не в системе LiLuF4–LiGdF4). Изоструктурность компонентов, близость параметров решетки и температур плавления обуславливают близость кривых ликвидуса и солидуса, что важно для получения монокристаллов высокого оптического качества [40, 90–93]. Разбавление иттрия лютецием позволяет избежать проблем, связанных с переходным характером плавления LiYF4 и плохой воспроизводимостью условий затвердевания расплава LiYF4 [92]. Состав LiLu0.7Y0.3F4 является эффективной матрицей для легирования РЗЭ-ионами [41].
ВЫРАЩИВАНИЕ МОНОКРИСТАЛЛОВ LiRF4
Основными методами выращивания кристаллов LiRF4, как и других фторидов, выращиваемых из расплава, являются методы Бриджмена–Стокбаргера и Чохральского, основанные на процессе направленной кристаллизации: метод Бриджмена – прямое затвердевание расплава при передвижении контейнера с расплавленным веществом в поле вертикального температурного градиента, метод Стокбаргера отличается введением диафрагмы, позволяющей создавать большой температурный градиент, метод Чохральского – вытягивание затравочного кристалла из расплава при неподвижном контейнере [94].
Выбор метода выращивания и его аппаратурного решения, помимо физических и химических свойств выращиваемого вещества, во многом зависит от требований, предъявляемых к кристаллу, таких как размер, чистота, дефектность. Процесс кристаллизации значительно усложняется при переходе от конгруэнтно плавящихся соединений к инконгруэнтно плавящимся. Конгруэнтно плавящиеся соединения химически устойчивы и характеризуются постоянной температурой плавления. Инконгруэнтно плавящиеся соединения LiRF4 характеризуются перитектической реакцией расплава с твердой фазой с образованием химического соединения.
Соединения LiYF4 и LiErF4 имеют переходный характер плавления, при выращивании монокристаллов этих соединений из расплава целесообразно использовать небольшой (1–2 мол. %) избыток LiF. При выращивании инконгруэнтно плавящихся соединений состав шихты для роста кристаллов отличается от стехиометрического состава соединения и должен соответствовать области первичной кристаллизации LiRF4 из расплава. Чем больше это различие, тем труднее вырастить из расплава монокристалл, не содержащий примеси исходных реактивов.
Методика выращивания кристаллов заключается в выборе и установлении основных параметров кристаллизации, среди которых особое место занимают:
– состав шихты и ее чистота;
– кристаллизационная атмосфера;
– материал и конструкция тигля;
– градиент температуры и форма фронта кристаллизации;
– скорость выращивания и степень ее стабилизации;
– ориентировка затравочного кристалла.
Первые работы по выращиванию кристаллов LiYF4 были выполнены [18] методом Стокбаргера. В своей работе Шанд опирался на диаграмму фазового равновесия системы LiF–YF3, определенную в [1]. Фазовая диаграмма показала, что соединение LiYF4 плавится инконгруэнтно при температуре 819°С и при составе перитектического расплава 49 мол. % YF3. Таким образом, кристаллы должны быть выращены из расплава, содержащего небольшой избыток LiF, чтобы предотвратить осаждение YF3. Чтобы учесть испарение LiF в процессе роста кристаллов, используют состав расплава, отличный от перитектического, а именно, 52 мол. % LiF или более в зависимости от конструкции теплового узла ростовой установки и соответствующих потерь шихты в процессе выращивания кристаллов.
Метод Бриджмена–Стокбаргера используют обычно для получения небольших кристаллов LiYF4, активированных ионами РЗЭ, для научных целей. Метод аппаратурно более простой и экономичный, чем метод Чохральского. Метод Бриджмена–Стокбаргера позволяет выращивать кристаллы в течение одной недели из небольшого объема шихты (несколько граммов), нужного для исследований размера [79]. В этом методе используют как индукционный нагрев, так и резистивный. Резистивный нагрев имеет преимущество перед индукционным. В установке с резистивным нагревом температуру контролируют в процессе роста кристаллов с более высокой точностью (±0.5°С). Нагреватель изготавливают из особо чистого графита, что требует проводить процесс роста в высоком вакууме (порядка 10–5 Па) и использовать высокочистые газы: Ar (99.999%) или смеси Ar и CF4 (99.999%). Скорость выращивания кристаллов варьируется от 0.5 до 5 мм/ч при градиенте в зоне роста 50–60°C/см.
Тигли при выращивании фторидов изготавливают из чистого графита [27, 79, 92–95] либо стеклографита [96–98], редко из платины [36, 99]. Расплавы фторидов не смачивают графитовые и стеклографитовые тигли, в отличие от платиновых, что дает им неоспоримое технологическое преимущество. Однако при кристаллизации расплавов ИЛФ в графитовых и стеклографитовых тиглях наблюдается сильное нерегулярное переохлаждение расплава (см. рис. 8) [100]. Для платины переохлаждение существенно меньше. Это обстоятельство обуславливает необходимость использования графитовых тиглей сложной конструкции (рис. 9). Для предотвращения переохлаждения используют затравочный канал или специальный затравочный объем. Более надежным является использование кристаллической затравки, позволяющей контролировать ориентацию выращенного кристалла.
Рис. 8.
Температуры затвердевания расплавов LiYF4 и LiLuF4 в зависимости от скорости охлаждения в тиглях из различного материала [100].
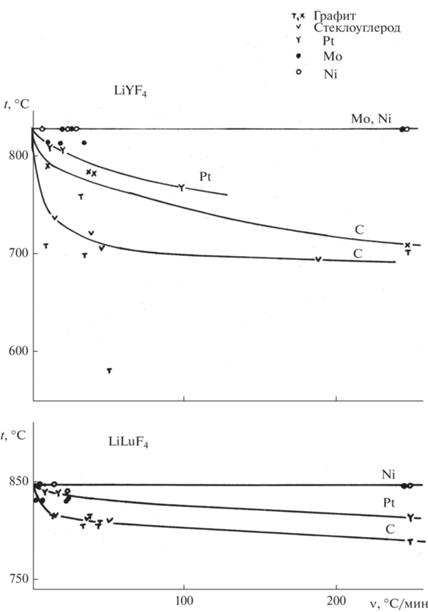
Рис. 9.
Конструкции ростовых тиглей из стеклоуглерода (а, б) [96], комбинированный тигель (в) [101] и тигли из графита (г, д) [27]: 1 – корпус тигля, 2 – крышка, 3 – канал отбора зародышей, 4 – затравочная камера, 5 – основание затравочной камеры, 6 – тигледержатель, 7 – контейнер для затравки, 8 – канал для удаления затравки, 9 – затравка.
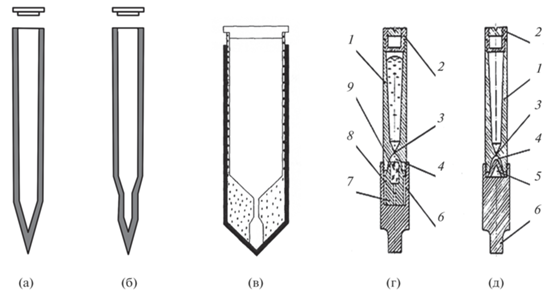
В [96] была описана конструкция простейшего стеклографитового тигля как с затравочным каналом, так и без него (рис. 9а, 9б). Внутренняя конфигурация этих тиглей позволяет осуществлять спонтанное зарождение одного кристалла у нижнего кончика тигля, а затем в процессе роста разрастание этой затравки в кристалл. Угол в конце тигля должен составлять порядка 30°, так как при выращивании кристаллов методом Бриджмена без затравки в каждом кристалле ось с лежит под углом около 30° к оси були. Этот угол соответствует углу между направлениями [001] и [111], равному ∼33° в структуре шеелита. Как установлено в [102], в структуре LiYF4 плоскость (221) имеет самое большое число позиций для иона РЗЭ на поверхности, а следовательно, эта плоскость будет плоскостью роста, а нормаль к плоскости (221) составляет угол в 27° к направлению [001]. Отсюда нормаль к плоскости (221) – это направление преимущественного роста кристаллов структуры шеелита, если выращивание кристаллов осуществляется без затравки. Использование стеклографитового тигля и радиочастотного нагрева с частотой 46 кГц приводит к росту поликристаллических образцов, так как тонкий слой радиочастотного поля приводит к нагреву только поверхности тигля. В результате стеклографитовый тигель действует как эффективный тепловой экран, подавляя передачу тепла к кончику тигля и, таким образом, устанавливая избыточный вертикальный температурный градиент, приводящий к образованию поликристаллов. Следовательно, для успешного выращивания кристаллов LiYF4 оптического качества использование стеклографитовых тиглей возможно только в случае резистивного нагрева, хотя и здесь имеются трудности с выращиванием кристаллов на затравку.
В [96] описана конструкция графитового тигля и двузонного нагревателя с градиентом в зоне роста 30–40°С/см, что позволяет выращивать на затравку кристаллы LiYF4 диаметром 12 и длиной 65 мм. Но, как отмечено в этой работе, при выращивании кристаллов LiYF4 инконгруэнтное плавление и подавление конвекции расплава в узком и длинном тигле приводят к образованию включений LiF в образцах. В случае LiLuF4 с конгруэнтным характером плавления этим методом получены кристаллы хорошего оптического качества. Кроме всего прочего, во время роста по методу Бриджмена–Стогбаргера в кристалле образуются дефекты в результате термомеханической деформации, связанной с наличием тиглей, которая уменьшается, когда используют умеренный температурный градиент [36].
Метод Бриджмена создает трудности и в случае выращивания ориентированных кристаллов в графитовых тиглях. Это связанно с тем, что процесс происходит в закрытом тигле и нет возможности визуально за ним наблюдать. Чтобы улучшить процесс затравления кристалла, нужно точно контролировать перегрев в зоне роста и использовать оптимизацию температурного профиля. Создание специальной конструкции графитового тигля и формирование определенного градиента в зоне роста позволяют преодолеть эти трудности и успешно осуществлять выращивание ориентированных кристаллов методом Бриджмена [27].
Выращивание кристаллов методом Бриджмена в платиновых тиглях осуществляют довольно редко. В работе [36] описано выращивание кристаллов Ce3+:LiYF4 методом Бриджмена в двузонной печи с резистивным нагревом в платиновом запаянном тигле диаметром 25 и длиной 250 мм, для того чтобы предотвратить испарение расплава во время роста. Температурный градиент на границе твердое тело – расплав был порядка 20–30°С/см скорость перемещения тигля ∼0.6 мм/ч. Температура в печи контролировалась с точностью ±0.5°С. Потери при росте кристалла составили ∼1 мас. %. Контроль качества кристалла методом ИК-спектроскопии показал отсутствие оксидов и оксифторидов в образцах. Это говорит о том, что заваренный платиновый тигель не только уменьшает испарение компонентов, но и защищает расплав. Этот процесс исключает появление групп OH– в кристалле, даже если не использовать атмосферу HF. Но метод выращивания кристаллов в запаянных платиновых тиглях не нашел дальнейшего развития в силу дороговизны.
Метод Чохральского технически более развит [16, 17, 21, 26, 32–34, 90, 91, 93]. Это касается контроля процесса, а именно: температурного поля, конвекции, тепловых потоков и распределения напряжений в выращиваемых кристаллах. Смоделированы компьютерные программы для управления процессом роста кристаллов, осуществлен автоматический контроль диаметра растущего кристалла. Однако устройство установки Чохральского довольно сложное, так как требует наличия точных механизмов протяжки и вращения тигля при выращивании кристаллов. Метод Чохральского позволяет выращивать качественные кристаллы, так как имеется возможность наглядно проводить процесс затравливания кристалла и автоматически контролировать его диаметр по весу образца. Метод Чохральского используется для выращивания кристаллов больших размеров [32, 103]. Процесс идет в открытом тигле, в который помещают исходный материал, расплавляют и осуществляют затравливание кристалла у поверхности расплава. Затравка крепится в специальный держатель над поверхностью расплава. Затем затравку поднимают из расплава при ее вращении. Трудность возникает в самом процессе затравливания: когда затравку окунают в расплав, она должна, не расплавляясь, потянуть за собой массу расплава. Хотя процесс идет в открытом платиновом тигле диаметром 100–130 мм и за затравливанием кристалла можно визуально наблюдать, необходимо точно поддерживать нужную температуру на поверхности расплав–затравка–кристалл и подобрать соответствующую скорость вытягивания, а главное – создать нужный температурный градиент на границе, чтобы сохранить растущий на затравку кристалл. Это делается экспериментально. Рост осуществляют при перемещении затравки со скоростью 0.5 мм/ч в начале процесса, а затем со скоростью 1 мм/ч по мере увеличения диаметра кристалла. Скорость вращения затравки – от 15 до 26 об./мин. После выращивания кристалла температуру в зоне роста медленно понижают со скоростью 30°С/ч до температуры окружающей среды. В методе Чохральского, так же как и в методе Бриджмена, используют как высокочастотный нагрев, так и резистивный. При этом используется нагреватель из высокочистого графита. Он более конструкционный материал и позволяет лучше стабилизировать температуру в процессе роста монокристаллов.
Важная проблема в использовании метода Чохральского – это образование шлака на поверхности расплава. Во многих случаях, когда образуется большое количество шлака, наблюдается быстрый рост поликристаллов на стадии контакта затравки с расплавом. Как предполагают в работе [104], основная причина образования шлака связана со следами кислорода и углерода в исходных реактивах. Этот шлак удаляют и вновь расплавляют смесь.
Описано использование и других методов выращивания кристаллов ИЛФ, в частности зонной плавки [54]. Вытягивание кристаллов из расплава нестехиометрического состава (вариант метода Чохральского) получило название Top-seeded solution growth [30]. Кристаллические нити получаются методом вытягивания с пьедестала с использованием лазерного нагрева [105, 106]. Для получения кристаллических пленок (планарных волноводов) использован метод жидкофазной эпитаксии [31, 64]. Большую экономию реактивов при выращивании образцов для исследований дает метод micro-pulling down (μ-PD) [92].
Для выращивания качественных кристаллов важен не только процесс роста, но и чистота исходных материалов, в первую очередь – содержание кислорода и влаги. Вода – главный враг фторидов вследствие подверженности их пирогидролизу, т.е. взаимодействию с парами воды при нагревании [28, 107]. Образующиеся в результате пирогидролиза оксофториды РЗЭ являются неизоморфный примесью. Их присутствие даже в небольших количествах приводит к ухудшению оптического качества кристаллов, появлению рассеивающих центров в образцах [95, 108]. Присутствие нежелательных примесей сильно затрудняет процесс выращивания, а при большом их содержании вырастить монокристаллы вообще не удается.
Порошкообразные фториды в той или иной степени имеют тенденцию поглощать влагу. Для снижения вредного влияния влаги на процесс выращивания кристаллов осуществляют предварительную просушку исходных компонентов при 100–500°С в токе аргона. После этого фториды очищают от следов оксидов и оксофторидов с помощью фторирующих агентов: газообразных фтористого водорода [21, 26, 97, 99], CF4 или фторида свинца [79]. Добавка PbF2 используется в количестве ∼1–2 мас. %. Реакции с оксидом и оксофторидом протекают согласно уравнениям
(1)
${{{\text{R}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 4{\text{Pb}}{{{\text{F}}}_{2}} = 2{\text{R}}{{{\text{F}}}_{3}} + 3{\text{PbO}} + {\text{Pb}}{{{\text{F}}}_{2}},$Эта процедура продолжается около 3–5 ч при температурах выше, чем температуры плавления соответствующих материалов. Оксид свинца и избыточный фтористый свинец, образовавшиеся при плавлении фторидов РЗЭ иттриевой подгруппы, полностью возгоняются. LiF очищают при выращивании фторида лития методом Стокбаргера либо зонной плавкой. В некоторых случаях шихту для получения кристаллов ИЛФ также подвергали финишной очистке методом зонной плавки [17, 109].
Для получения монокристаллов двойных фторидов LiRF4 используют в основном коммерческие фториды РЗЭ и LiF чистоты более 99.99%. Качество кристаллов повышается, если использовать высокочистые фториды (99.9999%), но они труднодоступны. Поэтому оксиды и карбонаты РЗЭ, обладающие высокой чистотой (99.999% или даже 99.9999%), использовались для получения соответствующих фторидов высокой чистоты при помощи реакций с бифторидом аммония или плавиковой кислотой [15, 17, 110, 111].
В случае синтеза с бифторидом аммония смешивают оксид РЗЭ и раствор бифторида аммония. Реакция идет при нагревании до 150°С по следующей схеме:
(3)
${{{\text{R}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 6{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{H}}{{{\text{F}}}_{2}} = 2{\text{R}}{{{\text{F}}}_{3}} + 6{\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{F}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Вода испаряется, и весь оксид переходит во фторид. При дальнейшем нагреве полученного продукта при температуре 650°С в нейтральной среде удаляется NH4F.
В случае синтеза с HF используют плавиковую кислоту (40%) или фтористоводородный газ при температуре 650°C:
(4)
${{{\text{R}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + 6{\text{HF}} = 2{\text{R}}{{{\text{F}}}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Кроме оксидов, могут быть использованы карбонаты по той же схеме. В дальнейшем полученные фториды обрабатываются дополнительно фторирующим агентом.
Например, в работе [96] для выращивания кристаллов LiYF4 и LiRF4 высокого оптического качества для радиационных исследований использовали фториды, полученные из карбоната лития Li2CO3 (99.999%) и оксидов Y2O3 (99.999%), Lu2O3 (99.999%). Они были переведены во фториды при нагреве в плавиковой кислоте (40%) в тефлоновом стакане. Затем продукты высушивались, размалывались в тонкий порошок, помещались в стеклографитовый сосуд и дополнительно фторировались в течение 12 ч в токе смеси газов HF + Ar при температуре 550°С.
Необходимость предотвращения пирогидролиза предъявляет особые требования к атмосфере роста кристаллов фторидов. Во-первых, необходимо исключить контакт с воздухом. Обычно выращивание проводят на специальных установках, имеющих вакуумируемую камеру из нержавеющей стали. Однако в некоторых случаях используют только герметизацию ростового узла с протоком газа, выводя нагреватель наружу. Это менее надежная конструкция, но в некоторых случаях она позволяет достигнуть желаемого результата [79, 95, 97].
Как правило, только инертного газа высокой чиcтоты недостаточно для получения монокристаллов высокого оптического качества. Концепция активной фторирующей атмосферы была сформулировна Паcтором и Робинсоном [22]. Однако до них Гугенгейм проводил выращивание фторидов в атмосфере фтористого водорода [112]. Этот газ обеспечивает эффективную очистку от кислородсодержащих примесей, но работа с ним опасна и неудобна, причем этот газ часто вызывает коррозию камеры ростовой установки [113].
Осико и др. [114] предложили удобный метод создания фторирующей атмосферы путем термического разложения фторопласта. При термолизе фторполимера в атмосфере появляются фторуглеводороды (С2F4, CF4 и др.), которые являются активными фторирующими агентами. В дальнейшем стали использовать газообразный CF4 из баллона. Он менее агрессивен, чем газообразный фтористый водород, более эффективно удаляет влагу [113]. Небольшое же количество образовавшегося HF помогает удалять следы оксидов. Реакция идет по схеме
Проведенный анализ [115–117] показал, что эффективность наиболее активных газообразных агентов по отношению к воде уменьшается в следующем ряду: C2F4 > NF3 > CF4 > COF2 > SF6.
В работе [105] исследована зависимость качества кристаллов от атмосферы роста. Для этого эксперименты проводились в атмосфере Ar чистоты 99.999%, смеси Ar и CF4 (5%) и с использованием газа CF4 чистоты 99.995%. Ростовая камера предварительно откачивалась в течение 24 ч сначала механическим насосом до вакуума 10–3 Па, а затем турбомолекулярным насосом до 10–6 Па. Использование смеси газов Ar (99.999%) и CF4 (5%) в ростовом процессе приводит к образованию микрокристаллов оксофторидов на поверхности выращиваемого кристалла, а вакуумирование ростовой камеры до 10–3 Па, независимо от атмосферы, приводит к появлению белых кристаллов, что связывают с образованием оксофторидов.
Таким образом, выращивание кристаллов LiRF4 высокого оптического качества осуществляют в атмосфере газообразного CF4 (99.9999%) [33, 103, 118]. Отмечено [111], что выращивание кристаллов LiYF4 оптического качества в атмосфере CF4 возможно без предварительного использования HF как на начальном этапе для фторирования исходных компонентов, так и в самом процессе роста кристаллов. Это упрощает процесс роста кристаллов.
Заметим, что использование фторирующей атмосферы не приводит к полному удалению кислородных примесей. Серия анализов показала, что в тщательно профторированных реактивах трифторидов РЗЭ иттриевой подгруппы содержание кислорода составляет 0.00n мас. % [5]. Несмотря на оптическую прозрачность выращенных во фторирующей атмосфере кристаллов ИЛФ, по спектрам поглощения в кристаллах лазерного качествам выявляется наличие примесей OH– и комплексов HCO– [33, 118]. Ион гидроксила по размеру близок к иону фтора и обладает способностью изоморфно замещать его в структуре фторидов без разрушения кристаллической решетки. Считается, что эти примеси снижают эффективность лазерной генерации.
КОЭФФИЦИЕНТЫ РАСПРЕДЕЛЕНИЯ ПРИМЕСЕЙ РЗЭ В КРИСТАЛЛАХ LiRF4
Важной характеристикой качества лазерных кристаллов является коэффициент распределения примеси. Равномерное распределение легирующей примеси – это важное условие для качественных лазерных кристаллов. Во многих работах по выращиванию кристаллов LiYF4 и LiLuF4, активированных ионами РЗЭ, были определены коэффициенты распределения легирующей примеси (k) [104, 106, 118–123]. Полученные величины сведены в табл. 1. Заметим, что коэффициенты распределения приведены для замещений по схеме ${\text{Li}}{{{\text{R}}}_{{1--x}}}{\text{R}}_{x}^{'}{{{\text{F}}}_{4}}.$ Коэффициенты распределения РЗЭ в LiYF4 систематически немного выше, чем в LiLuF4.
Данные получены в основном с использованием уравнения Галливера–Пфанна, отражающего распределение примеси вдоль направления роста кристалла [126, 127]:
где Cg – концентрация примеси в части g закристаллизовавшегося расплава, C0 – начальная концентрация примеси в расплаве. Использовались различные методы определения концентрациии, как разрушающие, так и неразрушающие [41, 120, 122].У РЗЭ иттриевой группы ионные радиусы близки к ионным радиусам иттрия и лютеция. Небольшое различие между ионными радиусами примеси и замещаемого иона в кристаллической матрице во многих случаях обеспечивает образование твердых растворов между изоструктурными фазами, что удобно для роста кристаллов и дает величину коэффициета распределения, близкую к единице (см. табл. 1). Для РЗЭ цериевой группы разница в ионных радиусах примеси и иттрия или лютеция в матрицах LiYF4 и LiLuF4 велика, ухудшаются условия изоморфного замещения, а следовательно, и качество кристаллов.
Заметим, что эффективный коэффициент распределения зависит от скорости кристаллизации, ориентации кристалла, концентрации примеси. Он может существенно меняться при изменении диаметра растущего кристалла, а также при использовании методов Стокбаргера или Чохральского. Эти факторы могут быть причиной большого различия в величинах k, определенных в разных работах: например, kэф церия в LiYF4, неодима в LiLuF4. Исходное уравнение (6) имеет ряд ограничений, в частности, оно пренебрегает концентрационной зависимостью коэффициента распределения; справедливо только при первоначальном равномерном распределении примеси в столбе расплава, т.е. при отсутствии гравитационной дифференциации, что редко контролируется.
Тем не менее весь массив полученных данных (табл. 1) может быть количественно описан (см. рис. 10).
Рис. 10.
Зависимости коэффициентов распределения РЗЭ при кристаллизации расплавов LiYF4 (a) и LiLuF4 (б) от их ионных радиусов: 1 – функция k = = 1.075exp[–69.5(r – 1.117)2], 2 – функция k = = exp[‒97.6(r – 1.117)2].
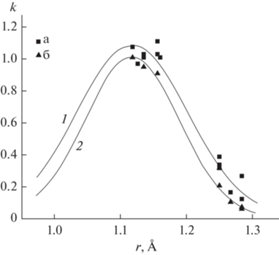
Зависимость эффективных коэффициентов распределения примесей РЗЭ в матрице LiYF4 с коэффициентом корреляции 92% описывается уравнением
где r – ионный радиус РЗЭ по системе Шеннона [70]. Для матрицы LiLuF4 аналогичное уравнение имеет видкоэффициент корреляции R = 98%.
Для использования гауссиана с целью описания зависимостей коэффициента распределения от ионного радиуса примеси имеется теоретическое обоснование [128]. В расчетах использованы “кристаллические” ионные радиусы РЗЭ по системе Шеннона для к. ч. 8 [70]. Полученные уравнения позволяют оценить неизвестные коэффициенты распределения всех РЗЭ в матрицах LiYF4 и LiLuF4.
Данных по коэффициентам распределения примесей в других матрицах немного. В работе [129] оценен коэффициент распределения неодима (k = 0.8) в матрице LiGdF4.
Близость к единице коэффициентов распределения РЗЭ иттриевой подгруппы позволяет выращивать монокристаллы сложного химического состава высокого качества. Так, в работе [33] получены монокристаллы LiY0.555Er0.38Tm0.06Ho0.005F4 с практически однородным распределением компонентов по длине.
Исследованы коэффициенты распределения РЗЭ цериевой группы при частичной замене иттрия на лютеций. Выращены серии монокристаллов LiY1 –xLuxF4, легированные Се (2 ат. %) [92], Pr (1 ат. %) [41], Nd (2.3–2.7 ат. %) [90, 91]. Выращивание проводилось методами Стокбаргера (в атмосфере аргона) и Чохральского (в атмосфере CF4). Обнаружено, что коэффициенты распределения иттрия и лютеция очень близки к единице.
ИСПОЛЬЗОВАНИЕ СИСТЕМ LiF–RF3 ДЛЯ СИНТЕЗА ДРУГИХ ФУНКЦИОНАЛЬНЫХ МАТЕРИАЛОВ
Особенности фазовых диаграмм систем LiF–RF3 позволяют получать помимо LiRF4 и другие функциональные материалы.
Следует отметить выращивание монокристаллов фторидов РЗЭ из раствора-расплава LiF–RF3. Монокристаллы низкотемпературных ромбических (пр. гр. Pnma) модификаций трифторидов, имеющих фазовые переходы, таких как YF3 [130], GdF3 [131], LuF3 [132], выращены из флюса LiF. При этом состав расплава должен быть выбран таким образом, чтобы соответствовать ветви первичной кристаллизации низкотемпературной модификации. В частности, при выращивании монокристаллов GdF3:Nd методом Чохральского (фторирующая атмосфера Ar + HF + CF4) использован состав, содержащий 41% LiF [131].
Разработаны композиционные твердые электролиты с участием фторидов лития и РЗЭ [133]. Материалы представляют собой эвтектические композиты, полученные направленной кристаллизацией расплавов этих систем (рис. 11) [134]. При переходе от лантана к РЗЭ иттриевой подгруппы меняется морфология композита – от пластинчатой к упорядоченной стерженьковой. Стерженьковая структура наблюдалась также для эвтектики LiF + LiLuF4 [55].
Рис. 11.
Микроструктура эвтектических сплавов: LiF–LaF3 (а), LiF–SmF3 (б), LiF–LiGdF4 (в) [134] (черная фаза – фторид лития).

ТРОЙНЫЕ СИСТЕМЫ С УЧАСТИЕМ ФТОРИДОВ ЛИТИЯ И РЗЭ
Модификация соединений LiRF4 изоморфными замещениями практически не исследована. Методом рентгенофазового анализа зафиксировано вхождение двухвалентных катионов Mn [135] и Cd [136] в структуру нано-LiYF4.
Близкую к LiRF4 структуру имеют тройные соединения с фторидами четырехвалентных элементов типа Li2CaHfF8 (пр. гр. $I\bar {4},$ Z = 2 [137]). Их образование можно рассматривать как изоморфизм 2R3+ ↔ Ca2+ + Hf4+. Функциональные характеристики этих матриц неизвестны.
Структуру LiYbF4 имеет кристалл LiBiF4 [138]. Заметим, что при первоначальном исследовании фазовой диаграммы LiF–BiF3 соединение не было обнаружено [139]. Согласно данным [140], LiBiF4 плавится инконгруэнтно при 450°С. Возможно эффективное легирование матрицы LiBiF4 ионами РЗЭ [141], так же как и LiYF4 ионами Bi3+ [142].
Известен ряд тройных соединений с участием фторидов лития и РЗЭ. Семейство LiNaR2F8 (R = = Ho–Lu, Y) [143–145] находится на границе термодинамической устойчивости, соединения имеют узкую температурную область устойчивости [143]. Только соединения Yb и Lu устойчивы при низких температурах, что обеспечивает возможность их гидротермального синтеза [144]. Детали структурных расшифровок противоречивы [144, 146, 147]. Связанные ребрами полиэдры {RF8} образуют каркас вместе с полиэдрами {NaF7} и {LiF6} [146].
В системах LiF–KF–RF3 образуются два типа соединений. Для цериевой подгруппы РЗЭ характерны соединения типа K5Li2LaF10 (KLLF) [148–151]. Они кристаллизуются в ромбической сингонии (пр. гр. Pnma). В структуре имеются изолированные друг от друга додекаэдры {RF8}, не имеющие общих анионов фтора. Додекаэдры соединены тетраэдрами {LiF4} с образованием каркаса. Значительное расстояние между изолированными полиэдрами РЗЭ исключает взаимодействие ионов РЗЭ между собой, и концентрационное тушение люминесценции подавляется. Легированные монокристаллы KLLF выращены методом Бриджмена [149].
Для иттриевой подгруппы РЗЭ существует ряд соединений LiKRF5 (R = Gd–Lu, Y) [14, 146, 150–157]. Эти кристаллы представляют собой лазерные материалы. В структуре к. ч. РЗЭ равно 8, однако полиэдры {RF8} отличаются от присутствующих в LiRF4. По-видимому, в этом ряду есть полиморфное (морфотропное) превращение. Серия монокристаллов выращена как методом гидротермального синтеза [146, 152, 153], так и вытягиванием из раствора в расплаве (TSSG) [155].
НАНО- И МИКРОМАТЕРИАЛЫ НА ОСНОВЕ ИЛФ
Ограниченная растворимость фторида лития в воде является существенным фактором, влияющим на процессы синтеза нано- и микропорошков LiRF4. Растворимость LiF повышается в гидротермальных условиях, что дает возможность синтезировать наночастицы LiRF4 из водных растворов [146, 158]. Вариант сольвотермального синтеза описан в работе [159]. Однако наиболее эффективны безводные методы синтеза.
Наночастицы LiYF4 получены методом механохимического синтеза путем перетирания смеси фторидов 4 ч в планетарной мельнице с шарами из ZrO2 на воздухе [160].
Порошки LiRF4 микронных размеров получаются при синтезе из нитратных расплавов при 400°С. При этом в качестве фторирующего агента используется LiF [67, 161, 162] или NaF [163].
Наночастицы LiRF4 могут быть синтезированы путем растворения хлоридов металлов в органических растворителях (олеиновая кислота и 1‑октадецен) с последующим взаимодействием с раствором NH4F в метаноле [52, 164, 165]. Однако чаще всего для синтеза используется термолиз смесей трифторацетатов в смеси органических растворителей: олеиновая кислота + олеамин + + 1-октадецен [49, 52, 135, 166–171].
Кристаллические наночастицы LiRF4 в стеклянной матрице получены термообработкой алюмосиликатных стекол SiO2–Al2O3–LiF–RF3 [172–176]. Методом золь–гель-синтеза получены SiO2-стекла, содержащие наночастицы LiRF4 [177]. Обработка фтороводородной кислотой позволяет вытравить оксидную матрицу [178].
Золь–гель-синтез также использован для получения LiRF4 [179–181].
ЗАКЛЮЧЕНИЕ
Фториды лития-РЗЭ LiRF4 являются основой многих функциональных материалов. Следует отметить их биомедицинские приложения, в частности использование твердотельных лазеров с безопасной для глаз длиной волны 2.065 мкм [33, 104]. В последние годы активно развиваются разработки биомедицинских применений люминесцентных наночастиц фторидов [182, 183].
Природа высокотемпературной нестехиометрии соединений LiRF4 не исследована. Необходимы дополнительные работы, включающие точный химический анализ (в т. ч. на содержание кислорода) вместе с измерениями плотности. Различие координационных полиэдров лития и РЗЭ затрудняет решение проблемы. Можно провести аналогию с не решенной до конца проблемой нестехиометрии ниобата лития. В случае LiRF4 можно предположить частичное вхождение иттрия в позиции лития с внедрением дополнительных (интерстициальных) ионов фтора в решетку: Li+ ↔ Y3+ + 2F–.
Построенные зависимости коэффициентов распределения примесей от их ионных радиусов позволяют прогнозировать возможное вхождение скандия в матрицы LiYF4 и LiLuF4 с коэффициентом распределения ~0.3.
Кристаллохимический интерес представляет существование соединений в ограниченном температурном интервале на границе термодинамической (кристаллохимической) устойчивости (LiRF4, R = = Sm, Eu, Gd). “Язык” высокотемпературной стабильности на границе устойчивости, уходящий в область больших ионных радиусов катионов, типичен для рядов бинарных соединений с фторидами РЗЭ [62]. Можно сделать вывод, что при повышении температуры уменьшается отношение rcat/rF, т.е. катионы РЗЭ расширяются при нагревании слабее, чем анион фтора. Это согласуется с расчетами [184].
Представляется интересным систематическое исследование возможности вхождения двухвалентных катионов (в частности, кальция) в структуру ИЛФ по механизму Li+ + R3+ ↔ 2M2+.
Интересно изучить спектрально-генерационные свойства циркона, в структуре которого имеются родственные LiRF4 мотивы.
Список литературы
Thoma R.E., Weaver C.F., Friedman H.A., Insley M., Harris L.A., Yakel R.J. Phase Equilibrium in the System LiF–YF3 // J. Phys. Chem. 1961. V. 65. № 7. P. 1096–1099. https://doi.org/10.1021/j100825a00
Thoma R.E., Branton G.D., Penneman R.A., Keenan T.K. Equilibrium Relations and Crystal Structure of Lithium Fluorolanthanate Phases // Inorg. Chem. 1970. V. 9. P. 1096–1101. https://doi.org/10.1021/ic50087a019
Keller C., Schmutz H. Die Reaktion von Lithiumfluorid mit den Trifluoriden der Lanthaniden und Einiger Actiniden // J. Inorg. Nucl. Chem. 1965. V. 27. P. 900–901.
Thoma R.E., Brunton G.D. Equilibrium Dimorphism of the Lanthanide Trifluorides // Inorg. Chem. 1966. V. 5. P. 1937–1939.
Sobolev B.P., Fedorov P.P., Steynberg D.B., Sinitsyn B.V., Shakhkalanian G.S. On the Problem of Polymorphism and Fusion of Lanthanide Trifluorides. I. Influence of Oxygen on Phase Transition Temperatures // J. Solid State Chem. 1976. V. 17. № 1/2. P. 191–199. https://doi.org/10.1016/0022-4596(76)90220-6
Sobolev B.P., Fedorov P.P., Seiranyan K.B., Tkachenko N.L. On the Problem of Polymorphism and Fusion of Lanthanide Trifluorides. II. Interaction of LnF3 with MF2 (M = Ca, Sr, Ba). Change in Structural Type in the LnF3 Series and Thermal Characteristics // J. Solid State Chem. 1976. V. 17. № 1/2. P. 201–212.
Spedding F.H., Henderson D.C. High-temperature Enthalpies and Related Thermodynamic Functions of Seven Trifluorides of the Rare Earths: Y, La, Pr, Nd, Gd, Ho, and Lu // J. Chem. Phys. 1971. V. 54. № 6. P. 2476–2483.
Spedding F.H., Beaudry B.J., Henderson D.C., Moorman J. High-Temperature Enthalpies and Related Thermodynamic Functions of the Trifluorides of Sc, Ce, Sm, Eu, Gd, Tb, Dy, Er, Tm, and Yb Y, La, Pr, Nd, Gd, Ho, and Lu // J. Chem. Phys. 1974. V. 60. № 4. P. 1578–1588.
Greis O., Cader M.S.R. Polymorphism of High Purity Rare Earth Trifluorides // Thermochim. Acta. 1985. V. 87. P. 145–150.
Fedorov P.P., Sobolev B.P., Medvedeva L.V., Reiterov V.M. Revised Phase Diagrams of LiF–RF3 (R = La–Lu, Y) Systems // Growth of Crystals. V. 21 / Eds. Givargizov E.I., Melnicova A.M. N.Y.; L. Consultants Bureau, 2002. P. 141–154.
Федоров П.П., Медведева Л.В., Соболев Б.П. Бифуркации Т-х фазовых диаграмм конденсированного состояния бинарных систем. Флуктуация типа фазового превращения в системе LiF–YF3 // Журн. физ. химии. 2002. Т. 76. № 3. С. 1410–1415.
Fedorov P.P. Comment on the Paper “Experimental Evaluation and Thermodynamic Assessment of the LiF–LuF3 Phase Diagram” by dos Santos I.A., Klimm D., Baldochi S.L., Ranieri I.M. // Thermochim. Acta. 2014. V. 578. P. 33–34. https://doi.org/10.1016/j.tca.2013.12.020
Sobolev B.P. The Rare Earth Trifluorides. P. 1. The High-Temperature Chemistry of the Rare Earth Trifluorides. Barcelona: Institut d’estudis Catalans, 2000. 520 p.
Goryunov A.V., Popov A.I., Khajdukov N.M., Fedorov P.P. Crystal Structure of Lithium and Yttrium Complex Fluorides // Mater. Res. Bull. 1992. V. 27. P. 213–220. https://doi.org/10.1016/0025-5408(92)90215-L
Sobolev B.P. The Rare Earth Trifluorides. P.2. Introduction to Materials Science of Multicomponent Metal Fluoride Crystals. Barcelona: Institut d’estudis Catalans, 2001. 460 p.
Gabbe D., Harmer A.L. Scheelite Structure Fluorides: the Growth of Pure and Raredoped // J. Cryst. Growth. 1968. V. 34. P. 544.
Linz A., Gabbe D.R. Growth of Fluoride Laser Host Crystals // Tunable Solid State Lasers. Proc. 1st Int. Conf. USA, La Jolla. 1984. P. 115–121.
Shand W.A. Single Crystal Growth and Some Properties of LiYF4 // J. Cryst. Growth. 1969. V. 5. № 2. P. 143–145.
Chicklis E.P., Neiman C.S., Folweiler R.C., Gabbe D.R., Jennsen H.P., Linz A. High-Efficiency Room-Temperature 2.06 µm Laser Using Sensitized Ho3+:YLF // Appl. Phys. Lett. 1971. V. 19. № 4. P. 119–121.
Watts R.K., Holton W.C. Infrared to Green Conversion in LiYF4: Yb, Ho // Solid State Commun. 1971. V. 9. № 2. P. 137–139.
Sharp E.G., Horrowitz D.J., Miller J.E. High Efficiently Nd3+: LiYF4 Laser // J. Appl. Phys. 1973. V. 44. № 12. P. 5399–5401.
Pastor R.C., Robinson M., Akutagawa W.M. Congruent Melting and Crystal Growth of LiRF4 // Mater. Res. Bull. 1975. V. 10. № 6. P. 501–510.
Jones D.A., Cockayane B., Clay R.A., Forrester P.A. Stockbarger Crystal Growth, Optical Assessment and Laser Performance of Holmium-Doped Yttrium-Erbium Lithium Fluoride // J. Cryst. Growth. 1975. V. 30. № 1. P. 21–26.
Abell J.S., Harris I.R., Cockayne B. A Study of the LiYF4–LiErF4 Pseudo-Binary System // J. Mater. Sci. 1977. V.12. P. 670–674.
Морозов А.М., Подколзина И.Г., Ткачук А.М., Федоров В.А., Феофилов П.П. Люминесценция и вынужденное излучение двойных фторидов лития-эрбия и лития-гольмия // Оптика и спектроскопия. 1975. Т. 39. № 3. С. 605–607.
Иванова И.А., Морозов А.М., Петрова М.А., Подколзина И.Г., Феофилов П.П. Выращивание кристаллов двойных фторидов лития-редкоземельных металлов и их свойства // Изв. АН СССР. Неорган. материалы. 1975. Т. 11. № 12. С. 2175–2179.
Кораблева С.Л. Выращивание монокристаллов двойных фторидов со структурой перовскита и шеелита и исследование их методом ЭПР: Дис. … канд. физ.-мат. наук. Казань. 1980. 142 с.
Fedorov P.P., Osiko V.V. Crystal Growth of Fluorides // Bulk Crystal Growth of Electronic, Optical and Optoelectronic Materials / Ed. Capper P. Wiley Series in Materials for Electronic and Optoelectronic Applications. Chichester: Wiley, 2005. P. 339–356. https://doi.org/10.1002/9780470012086.ch11
Moncorge R., Braud A., Camy P., Doualan J.L. Fluoride Laser Crystals // Handbook on Solid-State Lasers: Materials, Systems and Applications / Ed. Denker B., Shklovsky E. Oxford: Woodhead, 2013. P. 82–109.
Chai B., Lefaucher J., Pham A. Growth of Nd:GdLiF4 Single Crystals // Proc. SPIE. 1993. V. 1863. P. 9–12.
Loiko P., Soulard R., Brasse G., Doulan J.-L., Brayd A., Tyazhev A., Hideur A., Camy P. Tm,Ho:LiYF4 Planar Waveguide Laser at 2.5 μm // Opt. Lett. 2018. V. 43. № 18. P. 4341–4344.
Shimamura K., Sato H., Bensalah A., Sudesh V., Machida H., Sarukura N., Fukuda T. Crystal Growth of Fluorides for Optical Applications // Cryst. Res. Technol. 2001. V. 36. P. 801–813. https://doi.org/10.1002/1521-4079(200110)36:8/10<801: :AID-CRAT801>3.0.CO;2-6
Ranieri I.M., Baldochi S.L., Santo A.M.E., Gomes L., Courrol L.C., Tarelho L.V.G., Rossi W de, Berreta J.R., Costa F.E., Nogueira G.E.C., Wetter N.U., Zezell D.M., Vieira N.D., Morato S.P. Growth of LiYF4 Crystals Doped with Holmium, Erbium and Thulium // J. Cryst. Growth. 1996. V. 166. P. 423–428. https://doi.org/10.1016/0022-0248(95)00506-4
Vieira N.D., Ranieri I.M., Tarelho L.V.G., Wetter N.U., Baldochi S.L., Gomes L., de Matos P.S.F., Rossi W de, Nogueira G.E.C., Courrol L.C., Barbosa E.A., Maldonado E.P., Morato S.P. Laser Development of Rare-Earth Doped Crystals // J. Alloys Compd. 2002. V. 344. P. 231–239.
Cornacchia F., Sani E., Toncelli A., Marano M., Taccheo S., Galzerano G., Laporta P. Optical Spectroscopy and Diode-Pumped Laser Characteristics of Codoped Tm-Ho: YLF and Tm-Ho: BaYF: a Comparative Analysis // Appl. Phys. B. 2002. V. 75. P. 817–822.
Chen H., Fan S., Xia H., Xu J. Bridgman Growth of Fluoride Laser Crystal Ce3+:LiYF4 // J. Mater. Sci. Lett. 2002. V. 21. P. 457–459.
Казаков Б.Н., Кораблева С.Л., Рахматулин Р.М., Чиркин Ю.К., Федин А.А. Спин-решеточная релаксация и полимеризация ядер в примесных монокристаллах RE3+ YLiF4 // Изв. вузов. Физика. 1978. № 9. С. 93–99.
Кораблева С.Л., Тагиров М.С., Теплов М.А. Выращивание монокристаллов и контроль их качества методом магнитного резонанса // Парамагнитный резонанс. Вып. 16. Изд. Казанского университета. 1980. С. 7–14.
Sarukura N., Liu Z., Segawa Y., Edamatsu K., Suzuki Y., Itoh T., Semashko V.V., Naumov A.K., Korableva S.L., Abdulsabirov R.Yu., Dubinskii M.A. Ce3+:LuLiF4 as a Broad Band Ultraviolet Amplification Medium // Opt. Lett. 1995. V. 20. P. 294–297.
Nizamutdinov A.S., Semashko V.V., Naumov A.K., Korableva S.L., Abdulsabirov R.Yu., Polivin A.N., Marisov M.A. Optical and Gain Properties of Series of Crystals LiF–YF3–LuF3 Doped with Ce3+ and Yb3+ Ions // J. Lumin. 2007. V. 127. P. 71–75.
Gorieva V.G., Lyapin A.A., Korableva S.L., Kazakov B.N., Pavlov V.V., Kyashkin V.M., Mishkin V.P., Ryabochkina P.A., Semashko V.V. Structural Features and Distribution Coefficients of Pr3+, Y3+ and Lu3+ Ions in LiY1 –xLuxF4 Mixture Crystals // J. Alloys Compd. 2017. V. 720. P. 1–7. https://doi.org/10.1016/j.jallcom.2017.04.327
Kukharchyk N., Sholokhov D., Morozov O., Korableva S. Optical Vector Network Analysis of Ultranarrow Transitions in Er3+:LiYF4 Crystal // Opt. Lett. 2018. V. 43. № 4. P. 935–938. https://doi.org/10.1088/1367-2630/aaa7e4
Romanova I.V., Tagirov M.S. Magnetic and Magnetoelastic Properties of Non-Conducting Rare-Earth Single Crystals LiLnF4 (Ln = Tm, Tb, Ho, Dy) (Review) // Magn. Reson. Solids. 2019. V. 21. № 4. 19412 (26 p.). https://doi.org/10.26907/mrsej-19412
Alakshin E.M., Klochkov A.V., Korableva S.L. Magnetic Properties of Powders LiTbF4 and TbF3 // Magn. Reson. Solids. 2016. V. 18. № 2. Art. 16204.
Vasyliev V., Villora E.G., Nakamura M., Sugahara Y., Shimamura K. UV-Visible Faraday Rotators Based on Rare-Earth Fluoride Single Crystals: LiREF4 (RE = = Tb, Dy, Ho, Er and Yb), PrF3 and CeF3 // Opt. Express. 2012. V. 20. № 13. P. 14460–14470.
Fedorov P.P., Luginina A.A., Kuznetsov S.V., Osiko V.V. Nanofluorides // J. Fluor. Chem. 2011. V. 132. № 12. P. 1012–1039. https://doi.org/10.1016/j.jfluchem.2011.06.025
Fedorov P.P., Luginina A.A., Popov A.I. Transparent Oxyfluoride Glass Ceramics // J. Fluor. Chem. 2015. V. 172. P. 22–50. https://doi.org/10.1016/j.jfluchem.2015.01.009
Fedorov P.P., Alexandrov A.A. Synthesis of Inorganic Fluorides in Molten Salt Fluxes and Ionic Liquid Mediums // J. Fluor. Chem. 2019. V. 227. Art. 109374. https://doi.org/10.1016/j.jfluchem.2019.109374
Huang P., Zheng W., Zhou S., Tu D., Chen Z., Zhu H., Li R., Ma E., Huang M., Chen. X. Lanthanide-Doped LiLuF4 Upconversion Nanoprobed for the Detection of Disease Biomarker // Angew. Chem. Int. Ed. 2014. V. 53. P. 1252–1257.
Pudovkin M.S., Korableva S.L., Koryakovtseva D.A., Lukinova E.V., Lovchev A.V., Morozov O.A., Semashko V.V. The Comparison of Pr3+:LaF3 and Pr3+:LiYF4 Luminescent Nano- and Micro- Thermometer Performances // J. Nanoparticle Res. 2019. V. 21. P. 266–280. https://doi.org/10.1007/s11051-019-4713-0
Carl F., Birk L., Grauel B., Pons M., Wurth C., Resch-Genger U., Haase M. LiYF4:Yb/LiYF4 and LiYF4: Yb,Er/LiYF4 Core/Shell Nanocrystals with Luminescence Decay Times Similar to YLF Laser Crystals and the Upconversion Quantum Yield of the Yb,Er Doped Nanocrystals // Nano Res. 2021. V. 14. P. 797–806. https://doi.org/10.1007/s12274-020-3116-y
Kaczmarek A.M., Suta M., Rijckaert H., van Swieten T.P., van Driessche I., Kaczmarek M.K., Meijerink A. High Temperature (nano)Thermometers Based on LiLuF4:Er,Yb Nano- and Microcrystals. Confounded Results for Core-Shell Nanocrystals // J. Mater. Chem. C. 2021. https://doi.org/10.1039/d0tc05865c
Bergmann H. Sc, Y, La und Lanthanide. Fluoride, Oxidfluoride und Zugehorige Alkalidoppelverbindugen // Gmelin Handbook der Anorganischen Chemie. Seltendelemente. Teil C 3. System – Nummer 39. Berlin: Springer-Verlag, 1976. 439 s.
Abell J.S., Harris I.R., Cockayne B., Plant J.G. A DTA Study of Zone-Refined LiRF4 (R = Y, Er) // J. Mater. Sci. 1976. V. 11. P. 1807–1816.
Harris I.R., Safi H., Smith N.A., Altunbas M., Cockayne B., Plant J.G. The Relationship between Crystal Growth Behavior and Constitution in the Systems LiF–LuF3, LiF–ErF3 and LiF–YF3 // J. Mater. Sci. 1983. V. 18. P. 1235–1243.
Иванова И.А., Петрова М.А., Подколзина И.Г. Система LiF–ErF3 // Журн. неорган. химии. 1975. Т. 20. № 8. С. 2292–2293.
Abdoun F., Gaune-Escard M., Hatem G. Calorimetric and Thermal Analysis Investigations of the MF-LaF Mixtures (M = alkali metals) // J. Phase Equilib. 1997. V. 18. P. 6–20.
Van der Meer J.P.M., Koning R.J.M., Jacobs M.H.G., Oonk H.A.J. Thermodynamic Modeling of LiF–LnF3 and LiF–AnF3 Phase Diagrams // J. Nucl. Mater. 2004. V. 335. P. 345–352.
Dos Santos I.A., Klimm D., Baldochi S.L., Ranieri I.M. Thermodynamic Modeling of the LiF–YF3 Phase Diagram // J. Cryst. Growth. 2012. V. 360. P. 172–175.
Dos Santos I.A., Klimm D., Baldochi S.L., Ranieri I.M. Experimental Evaluation and Thermodynamic Assessment of the LiF–LuF3 Phase Diagram // Thermochim. Acta. 2013. V. 552 P. 137–141.
Ranieri I.M., Bressiani A.H.A., Morato S.P., Baldochi S.L. The Phase Diagram of the System LiF–GdF3 // J. Alloys Compd. 2004. V. 379. P. 95–98.
Федоров П.П. Системы из фторидов щелочных и редкоземельных элементов // Журн. неорган. химии. 1999. Т.44. № 11. С. 1792–1818.
Федоров П.П., Медведева Л.В. О термографическом определении температур ликвидуса // Журн. неорган. химии. 1989. Т. 34. № 10. С. 2674–2677.
Rogin P., Hulliger J. Liquid Phase Epitaxy of LiYF4 // J. Cryst. Growth. 1997. V. 179. P. 551–558.
Barton C.J., Gilpatrick L.O., Insley H. Phase Equilibria in the Systems BeF2–CeF3, LiF–CeF3 and LiF–BeF2–CeF3 // J. Inorg. Nucl. Chem. 1974. V. 36. P. 1271–1275.
Lepoutre S., Boyer D., Potdevin A., Dubois M., Briois V., Mahiou R. Structural Investigation of Sol-Gel-Derived LiYF4 and LiGdF4 Powders // J. Solid State Chem. 2007. V. 180. P. 3049–3057.
Fedorov P.P., Mayakova M.N., Аlexandrov А.А., Voronov V.V., Kuznetsov S.V., Baranchikov A.E., Ivanov V.K. The Melt of Sodium Nitrate as a Medium for Synthesis of Fluorides // Inorganics. 2018. V. 6(2). P. 38–55. https://doi.org/10.3390/inorganics6020038.
Семашко В.В., Кораблева С.Л., Низамутдинов A., Кузнецов С.В., Пыненков А.А., Попов П.А., Баранчиков А.Е., Нищев К.Н., Иванов В.К., Федоров П.П. Фазовые равновесия в системе LiYF4–LiLuF4 и теплопроводность монокристаллов LiY1 –хLuхF4 // Журн. неорган. химии. 2018. Т. 64. № 4. С. 405–410.
Заморянская М.В., Петрова М.А., Егоров В.Ю. Исследование фазовых и структурных особенностей кристаллов LiYF4 локальными методами // Журн. неорган. химии. 2003. Т. 48. № 8. С. 1372–1380.
Shannon R.D. Revised Effective Ionic Radii and Systematic Studies of Interatomic Distances in Halides and Chalcogenides // Acta Crystallogr. 1976. V. 32. P. 751–767.
Новиков И.Н. Два типа фазовых диаграмм с конгруэнтно плавящимися химическими соединениями // Докл. АН СССР. 1955. Т. 100. № 6. С. 1119–1121.
Федоров П.П. Трансформации фазовых T-х диаграмм конденсированного состояния бинарных систем. II. Равновесие фаз с дополнительно наложенными условиями // Журн. физ. химии. 1999. Т. 73. № 9. С. 1551–1556.
Kuznetsov S.V., Ovsyannikova A.A., Tupitsyna E.A., Yasyrkina D.S., Voronov V.V., Fedorov P.P., Batyrev N.I., Iskhakova L.D., Osiko V.V. Phase Formation in LaF3–NaGdF4, NaGdF4–NaLuF4, NaYF4–NaLuF4 Systems: Synthesis of Powders by Co-precipitation from Aqueous Solutions // J. Fluor. Chem. 2014. V. 161. P. 95–101. https://doi.org/10.1016/j.jfluchem.2014.02.011
Fedorov P.P., Luginina A.A., Alexandrov A.A., Chernova E.V. Transformation of Calcite CaCO3 to Fluorite CaF2 by Action of KF Solution // J. Fluor. Chem. 2021. V. 251. Art. 109898. https://doi.org/10.1016/j.jfluchem.2021.109898
Grzechnik A., Crichton W.A., Bouvier P., Dmitriev V., Weber H.P., Gesland J.Y. Decomposition of LiGdF4 Sheelite at High Pressures // J. Phys.: Condence Matter. 2004. V. 16. P. 7779–7786.
Федоров П.П., Медведева Л.В., Соболев Б.П. Трансформации фазовых Т-х диаграмм бинарных систем при понижении температуры трехфазного равновесия до абсолютного нуля // Журн. физ. химии. 1993. Т. 67. № 5. С. 1073–1075.
Горюнов А.В., Попов А.И. Кристаллическая структура LiYF4 // Журн. неорган. химии. 1992. Т. 37. № 2. С. 276–279.
Garcia E., Ryan R.R. Structure of the Laser Host Material LiYF4 // Acta Crystallogr., Sect. C. 1993. V. 49. P. 2053–2054. https://doi.org/10.1107/S0108270193005876
Misiak L., Mikoeajczak P., Subotowicz M. Lithium Rare-Earth Fluoride Crystal Growth and Thermal Variation of Lattice Constants // Phys. Status Solidi A. 1986. V. 97. P. 353–359. https://doi.org/10.1002/pssa.2210970204
Grzechnik A., Syassen K., Loa I., Hanfland M., Gesland J.Y. Scheelite to Fergusonite Phase Transition in YLiF4 at High Pressure // Phys. Rev. B. 2002. V. 65. P. 104102 (5 p.).
Grzechnik A., Friese K., Dmitriev V., Weber H.P., Gesland J.Y., Crichton W.A. Pressure-Induced Tricritical Phase Transition from the Sheelite Structure to the Fergusonite Structure in LiLuF4 // J. Phys. Condens. Matter. 2005. V. 17. P. 763–770.
Errandonea D., Manjon F.J., Somayazulu M., Hausermann D. Effects of Pressure on the Local Atomic Structure of CaWO4 and YLiF4: Mechanism of the Scheelite-to-Wolframite and Scheelite-to-Fergusonite Transitins // J. Solid State Chem. 2004. V. 177. P. 1087–1097.
Порай-Кошиц М.А., Асланов Л.А. Некоторые аспекты стереохимии восьмикоординационных комплексов // Журн. структур. химии. 1972. Т. 13. № 2. С. 266–276.
Бандуркин Г.А., Джуринский Б.Ф., Тананаев И.В. Особенности кристаллохимии соединений редкоземельных элементов. М.: Наука, 1984.
Бабаева Э.П., Бухалова Г.А. Система Li+, Cs+, Sc3+ // F– // Журн. неорган. химии. 1966. Т. 11. № 3. С. 648–651.
Федоров П.П., Кочерба Г.И., Соболев Б.П., Чугунов В.Д., Карфидов В.П., Федоров П.И. Система LiF–ScF3 // Журн. неорган. химии. 1989. Т. 34. № 7. С. 1912–1913.
Вальковский М.Д., Федоров П.П. О структуре Li3ScF6 // Журн. неорган. химии. 1994. Т. 39. № 9. С. 1446–1448.
Davidovich R.V., Fedorov P.P., Popov A.I. Structural Chemistry of Anionic Fluoride and Mixed-ligand Fluoride Complexes of Indium(III) // Rev. Inorg. Chem. 2016. V. 36. № 3. P. 105–133. https://doi.org/10.1515/revic-2015-0019
Tyagi A.K., Kӧhler J., Balog P., Weber J. Syntheses and Structures of Li3ScF6 and High Pressure LiScF4, Luminescence Properties of LiScF4, a New Phase in the System LiF–ScF3 // J. Solid State Chem. 2005. V. 178. P. 2620–2625.
Ranieri I.M., Morato S.P., Courrol L.C., Shihomatsu H.M., Bressiani A.H.A., Moraes N.M.P. Growth of LiY1 – x – yLuxNdyF4 Crystals for Optical Applications // J. Cryst. Growth. 2000. V. 209. P. 906–910. https://doi.org/10.1016/S0022-0248(99)00528-X
Ranieri I.M., Morato S.P., Bressianib A.H.A., Courrola L.C., Maldonadoa E.P., Wettera N.U., Baldochi S.L., Vieira N.D., Shimamura K., Fukuda T. Growth of LiY1 –xLuxF4 Crystals under CF4 Atmosphere // J. Alloys Compd. 2002. V. 344. P. 203–206. https://doi.org/10.1016/S0925-8388(02)00341-9
Yokota Y., Yamaji A., Yanagida T., Kawaguchi N., Fukuda K. The Control of Mean Ionic Radius at Y Site by Lu Co-doping for Ce:LiYF4 Single Crystals // J. Cryst. Growth. 2013. V. 362. P. 243–246.
Ranieri J.M., Shimamura K., Nakano K., Fujita T., Courrol L.C., Morato S.P., Fukuda T. Growth and Characterization of LiGd1 –x – yYxNdyF4 Single Crystals // J. Cryst. Growth. 2000. V. 217. P. 145–150.
Wilke K.Th. Kristallzüchtung. Berlin: VEB, 1973. http://refhub.elsevier.com/S0022-1139(19)30211-8/ sbref0455
Roth M., Schieber M. Purification and Crystal Growth in LiY0.5Er0.5F4 // Mater. Res. Bull. 1981. V. 16. P. 381–388.
Azzara V., Junwei M., Albrecht V., Krämer K., Markus W., Hehlen P. Bridgman Growth of LiYF4 and LiLuF4 Crystal for Radiation-Balanced Lasers // Proc. SPIE. 2019. V. 10936. https://doi.org/10.1117/12.2510691
Rogin P., Hulliger J. Growth of LiYF4 by the Seeded Vertical Gradient Freezing Technique // J. Cryst. Growth. 1997. V. 172. P. 200–208.
Jones D.A., Cockayne B., Clay R.A., Forrester P. Stokbarger Crystal Growth, Optical Assessment and Laser Performance of Holmium Doped Yttrium Erbium Lithium Fluoride // J. Cryst. Growth. 1975. V. 30. P. 21–26.
Walker P.J. Melt Growth of LiHoF4 // J. Cryst. Growth. 1980. V. 49. P. 77–80.
Федоров П.П. Высокотемпературная химия конденсированного состояния систем с трифторидами редкоземельных элементов как основа получения новых материалов: Дис. … докт. хим. наук. М. 1991. 608 с.
Cockayne B., Lloyd K.H., Abell J.S., Harris I.R., Jones D.A. A Characterization of the Solidification Behavior of Stocbarger Single Crystal // J. Cryst. Growth. 1976. V. 36. P. 205–211.
Woodruff D.P. The Solid-Liquid Interface. Cambridge University Press, 1973.
Sato H., Bensalah A., Machida H., Niklc M., Fukuda T. Growth and Characterization of 3-in Size Tm, Ho-codoped LiYF4 and LiLuF4 Single Crystals by the Czochralski Method // J. Cryst. Growth. 2003. V. 253. P. 221–229. https://doi.org/10.1016/S0022-0248(03)00998-9
Bensalah A., Shimamura K., Sudesh V., Sato H., Ito K., Fukuda T. Growth of Tm, Ho-Codoped YLiF4 and LuLiF4 Single Crystals for Eye-Safe Lasers // J. Cryst. Growth. 2001. V. 223. P. 539–544. https://doi.org/10.1016/j.optmat.2003.09.015198
Maier D., Bertram R., Klimm D., Fornari R. Influence of the Atmosphere on the Growth of LiYF4 Single Crystal Fibers by the Micro-Pulling-Down Method // Cryst. Res. Technol. 2009. V. 44. №. 2. P. 137–140. https://doi.org/10.1002/crat.200800400
Shaw L.B., Chang R.S.F. Rare Earth Doped YLF Grown by Laser-Heated Pedestal Growth Technique // J. Cryst. Growth. 1991. V. 112. P. 731–736.
Кузнецов С.В., Осико В.В., Ткаченко Е.А., Федоров П.П. Неорганические нанофториды и нанокомпозиты на их основе // Успехи химии. 2006. Т. 75. № 12. С. 1193–1211.
Safi H., Harris I.R., Cockayne B., Plant J.G. A Study of the Oxidation Products of Some LiRF4 Phases // J. Mater. Sci. Lett. 1981. V. 16. P. 3203–3210. https://doi.org/10.1007/BF00540330
Cockayne B., Plant J.G., Clay R.A. The Czochralski Growth and Laser Characteristics of Li(Y,Er,Tm,Ho)F4 and Li(Lu,Er,Tm,Ho)F4 Scheelite Single Crystals // J. Cryst. Growth. 1981. V. 54. P. 407–413.
Лугинина А.А., Ольховая Л.А., Икрами Д.Д., Рейтеров В.М., Перамзин А.С. Взаимодействие оксидов и карбонатов щелочно-земельных металлов с фторидом и бифторидом аммония // Журн. неорган. химии. 1981. Т. 26. № 2. С. 332–336.
Burkhalter R., Dohnke I., Hulliger J. Growing of Bulk Crystals and Structuring Waveguides of Fluoride Materials for Laser Applications // Progr. Cryst. Growth Charact. Mater. 2001. V. 42. № 1–2. P. 1–64. https://doi.org/10.1016/S0960-8974(01)00002-X
Guggenheim H.J. Growth of Highly Perfect Fluoride Single Crystals for Optical Masers // J. Appl. Phys. 1963. V. 34. № 8. P. 2482–2485.
Uhrin R. Belt R.F., Rosaty V. Preparation and Crystal Growth of Lithium Yttrium Fluoride for Laser Applications // J. Cryst. Growth. 1977. V. 38. № 1. P. 38–44. https://doi.org/10.1016/0022-0248(77)90370-0
Воронько Ю.К., Осико В.В., Удовенчик В.Т., Фурсиков М.М. Оптические свойства кристаллов CaF2-Dy3+ // ФТТ. 1965. Т. 7. № 1. С. 267–273.
Pastor R.C. Crystal Growth of Metal Fluorides for CO2 Laser Operation. I. The Necessity of the RAP Approach // J. Cryst. Growth. 1999. V. 200. P. 510–514.
Pastor R.C. Crystal Growth of Metal Fluorides for CO2 Laser Operation. II. Optimization Reactive Atmosphere Process (RAP) Choice // J. Cryst. Growth. 1999. V. 203. P. 421–424.
Pastor R.C. Crystal Growth of Metal Fluorides for CO2 Laser Operation. III. The Use of Another Reaction Sequence // J. Cryst. Growth. 1999. V. 207. P. 201–103.
Baldochi S.L., Shimamura K., Nakano K., Mujilatu N., Fukuda T. Ce-Doped LiYF4 Growth under CF4 Atmosphere // J. Cryst. Growth. 1999. V. 205. P. 537–542. https://doi.org/10.1016/S0022-0248(99)00164-5
Shimamura K., Sato H., Bensalah A., Machida H., Sarukura N., Fukuda T. Growth of Ce-Doped Colquiriite – and Scheelite-Type Single Crystals for UV Laser Applications // Opt. Mater. 2002. V. 19. P. 109–116.
Ткачук А.М., Полетимова А.В., Петрова М.А., Егоров В.Ю., Королев Н.Е. Вхождение ионов в матрицу и определение концентрации неразрушающим спектрофотометрическим методом // Оптика и спектроскопия. 1991. Т. 70. № 6. С. 1230–1235.
Ranieri I.M., Shimamura K., Nakano K., Fujita T., Liu Z., Sarukura N., Fukuda T. Crystal Growth of Ce:LiLuF4 for Optical Applications // J. Cryst. Growth. 2000. V. 217. P. 151–156.
Fornoni M., Bulou A., Breteau J.M., Gesland J.Y., Rousseau M. Neodymium Concentrathion Measurements in Nd:YLF Laser Rods: a Nondestructive Method // Appl. Opt. 1990. V. 29. № 12. P. 1758–1764. https://doi.org/10.1364/AO.29.001758
Bensalah A., Guyot Y., Ito M., Brenier V., Sato H., Fukuda T., Boulon G. Growth of Y3+-doped YLiF4 Laser Crystal by the Czochralski Method. Attempt of Energy Level Assignment and Estimation of the Laser Potentiality // Opt. Mater. 2004. V. 26. P. 375–383. https://doi.org/10.1016/j.optmat.2003.09.015
Barnes N.P., Walsh B.M., Murray K.E., Quarles G.J., Castillo V.K. Nd: LuLF A New Nd Laser Material // Advanced Solid-State Lasers / Eds. Pollock C.R., Rosenberg W.R. Optical Society of America. 1997. V. 10. P. 448–450. https://doi.org/10.1364/ASSL.1997.SC10
Пригожин И., Дэфей Р. Химическая термодинамика. Новосибирск: Наука, 1966. 510 с.
Gulliver G.H. Metallic Alloys. Chase Griffen. L. 1922.
Pfann W.G. Principles of Zone Meltting // Trans. Am. Inst. Min. Metall. Eng. Met. Div. 1952. V. 194. P. 747–753.
Урусов В.С., Кравчук И.Ф. Энергетический анализ и расчеты коэффициентов распределения изовалентных изоморфных примесей при кристаллизации расплавов // Геохимия. 1976. № 8. С. 1204–1222.
Zhang X.X., Bass M., Villaverde A.B., Lefaucheur J., Pham A., Chai B.H.T. Efficient Laser Performance of Nd:GdLiF4: A New Laser Crystal // Appl. Phys. Lett. 1993. V. 62. P. 790–796.
Rotereau K., Gesland J.Y., Daniel P., Bulou A. Raman Scattering Study of Czochralski-Grown Yttrium Fluoride Single Crystals // Mater. Res. Bull. 1993. V. 28. P. 813–819.
Breteau J.M., Gesland J.Y. Spectroscopic and Lasing Properties of a Diode Pumpable Nd:GdF3 Crystal // Opt. Mater. 1996. V. 5. P. 267–271.
Guedes K.J., Krambrock K., Gesland J.Y. Characterization of Czochralski-Grown Orthorhombic β-LuF3:Ce by Electron Paramagnetic Resonance // Radiat. Eff. Defects Solids. V. 155. № 1–4. P. 101–105. https://doi.org/10.1080/10420150108214100
Медведева Л.В., Сорокин Н.И., Вистинь Л.Л., Федоров П.П., Соболев Б.П. Фазовые равновесия в системе LiF–SrF2–LaF3 и ионная проводимость эвтектического композита // Журн. неорган. химии. 1994. Т. 39. № 2. С. 316–318.
Trnovcova V., Fedorov P.P., Barta C., Labas V., Meleshina V.A., Sobolev B.P. Microstructure and Physical Properties of Superionic Eutectic Composites of the LiF–RF3 (R = rare earth element) System // Solid State Ionics. 1999. V. 119. P. 173–180. https://doi.org/10.1016/S0167-2738(98)00500-1
Zhou B., Xu B., He H., Gu Z., Tang B., Ma Y., Zhai T. Enhanced Green Upconversion Luminescence in Tetragonal LiYF4:Yb/Er Nanoparticles by Manganese(II)-doping: The Key Role of Host Lattice // Nanoscale. 2018. V. 10. P. 2834–2840. https://doi.org/10.1039/C7NR07709B
Zhu Y., Zhao S., Zhou B., Zhu H., Wang Y. Enchancing Upconversion Luminescence of LiYF4:Yb/Er Nanocrystals by Cd2+ Doping and Core-Shell Structure // J. Phys. Chem. C. 2017. V. 121. № 34. P. 18909–18916. https://doi.org/10.1021/acs.jpcc.7b04782
Ayala A.P., Guedes I., Freire P.T.C., Sasaki J.M., Melo F.E.A., Mendes Filho J., Gesland J.Y. Raman Spectroscopy Characterization of Li2CaHfF8 Crystals // J. Phys.: Condens. Matter. 1999. V. 11. № 27. P. 5343–5354.
Schultheiss E., Scharmann A., Schwabe D. Single Crystal Growth and Structure Analysis of BiLiF4 // J. Cryst. Growth. 1987. V. 80. P. 261–269.
Калинченко Ф.В., Борзенкова М.П., Новоселова А.В. Системы MF-M"F3 (M = Li, Na, K; M" = Sb, Bi) // Журн. неорган. химии. 1982. Т. 27. № 11. С. 2916–2920.
Nakamura G.H.G., Klimm D., Baldochi S.L. Thermal Analysis and Phase Diagram of the LiF–BiF3 System // Thermochim. Acta. 2013. V. 551. P. 131–135.
Duan Xiao M.L., Kuang X.Y., Zhang C.X., Chai R.P. Comparative Analysis of Energy-Level Splitting of Pr3+ Doped in LiYF4 and LiBiF4 Crystals: a Complete Energy Matrix Calculation // Chin. Phys. B. 2011. V. 20. № 1. P. 013102. https://doi.org/10.1088/1674-1056/20/1/013102
Дубинский М.А., Кораблева С.Л., Никитин С.И. Выращивание и спектрально-люминесцентные свойства монокристаллов LiYF4, LiLuF4, активированных ионами Bi3+ // Тез. докл. VI Всес. конф. по росту кристаллов. Т. 1. Ереван: Изд. Арм. ССР, 1985. С. 212–213.
Федоров П.П., Медведева Л.В., Бондарева О.С., Соболев Б.П. Термическая устойчивость соединений LiNaR2F8 (R = Ho–Lu, Y) // Журн. неорган. химии. 1990. Т. 35. № 11. С. 2828–2830.
Dib A., Gorius M.F., Aleonard S. Structure Crystalline de NaLiYb2F8:Composes Isotypes // J. Solid State Chem. 1986. V. 65. P. 205–214.
Zambon D., Metin J., Fournier M. Fluorescence et Dynamique Dans LiNaY2F8:Eu3+ // J. Less-Common. Met. 1988. V. 143. P. 345–362.
Colin S.C., McMillen D., Kolis J.W. Hydrothermal Growth of LiLuF4 Crystals and New Lithium Lutetium Fluorides LiKLuF5 and LiNaLu2F8 // Solid State Sci. 2013. V. 17. P. 90–96. https://doi.org/10.1016/j.solidstatesciences.2012.11.019
McCollum B.C., Lempcki A. A New High Yield Luminescent Compound: K5NdLi2F10 // Mater. Res. Bull. 1978. V. 13. P. 883–888.
Dominiak-Dzik G., Golab S., Baluka M., Pietraszko A., Hermanowicz K. K5Li2LaF10:Er3+ Crystals. Growth, Structure and Optical Properties // J. Phys.: Condens. Matter. 1999. V. 11. P. 5245–5256.
Dominiak-Dzik G., Sokolska I., Golab S., Baluka M. K5Li2LaF10:Ln3+ (Ln–Pr3+, Er3+, Er3+) Crystals // J. Alloys Compd. 2000. V. 300–301. P. 254–260.
Solarz P., Soko’ska I., Ryba-Romanowski W. Photoluminescence of K5Li2LaF10:Ho3+ and K5Li2LaF10: :Ho3+, Yb3+ // J. Mol. Struct. 2002. V. 614. P. 325–331.
Solarz P., Ryba-Romanowski W. Effect of Temperature and Activator Concentration on Relaxation of Excited States of Eu3+ in K5Li2La1 –xExF10 Crystals // J. Phys. Chem. Solids. 2003. V. 64. P. 1289–1296.
Горюнов А.В., Попов А.И., Хайдуков Н.М., Федоров П.П. Исследование строения фаз, образующихся в системе LiF–KF–YF3 // Журн. неорган. химии. 1992. Т. 37. № 12. С. 2813–2819.
Федоров П.П., Вальковский М.Д., Медведева Л.В., Бондарева О.С., Хайдуков Н.М., Соболев Б.П. Синтез соединений LiKRF5 (R = Gd–Lu) // Журн. неорган. химии. 1993. Т. 38. № 3. С. 432–435.
Каминский А.А., Хайдуков Н.М. Анизотропный фторид LiKYF5–Nd3+-новый одноцентровый лазерный кристалл // Докл. АН СССР. 1992. Т. 323. № 3. С. 470–474.
Chai B., Pham A., Lutts G. Growth of High Quality Single Crystal of KLiYF5 by TSSG Method // Proc. SPIE. 1993. V.1863. P. 160–163.
Summers P.L., Weidner H., Peale R.E., Chai B.H.T. Spectroscopy of Nd in KLiYF5 and KLiGdF5 // J. Appl. Phys. 1994. V. 75. № 4. P. 2184–2188. https://doi.org/10.1063/1.356279
Balda R., Fernandez J., de Ocariz I.S., Voda M., Garcia A.J., Khaidukov N. Laser Spectroscopy of Pr3+ Ions in LiKY1 –xPrxF5 Single Crystals // Phys. Rev. B. 1999. V. 59. № 15. P. 9972–9980.
Zhang X.Y., Wang M.Q., Ding J.J., Gao D.L., Shi Y.H., Song X.H. The Novel Upconversion Properties of LiYbF4:Er Microcrystals Compared to the Na Counterpart // CrystEngComm. 2012. V. 14. P. 8357.
Ye S., Hu R., Jiang N., Wang H., Wang D. pH Value Manipulated Phase Transition, Microstructure Evolution and Tunable Upconversion Luminescence in Yb3+-Er3+ Codoped LiYF4/YF3 Nanoparticles // Dalton Trans. 2015. V. 44. P. 15583–11590. https://doi.org/10.1039/c5dt01552a
Lu J., Zhang Q., Saito F. Mechanochemical Synthesis of Nano-Sized Complex Fluorides from Pair of Different Constituent Fluoride Compounds // Chem. Lett. 2002. P. 1176–1177.
Ding M., Lu C., Cao L., Huang W., Ni Y., Xu Z. Molten Salt Synthesis of Tetragonal LiYF4:Yb3+/Ln3+ (Ln = = Er, Tm, Ho) Microcrystals with Multicolor Upconversion Luminescence // CrystEngComm. 2013. V. 15. P. 6015–6021. https://doi.org/10.1039/c3ce40477c
Niu N., He F., Wang L., Wang L., Wang Y., Gai S., Yang P. Tuning Upconversion Luminescence of LiYF4:Yb3+,Er3+/Tm3+/Ho3+ Microcrystals Synthesized through a Molten Salt Process // J. Nanosci. Nanotechnol. 2014. V. 14. № 5. P. 3509–3514. https://doi.org/10.1166/jnn.2014.7976
Pornpatdetaudom T., Serivalsatit K. Effect of Molten Salts on Synthesis and Upconversion Luminescence of Ytterbium and Thulium-Doted Alkaline Yttrium Fluorides // Key Eng. Mater. V. 766. P. 34–39.
Wang F., Deng R., Liu X. Preparation of Core-Shell NaGdF4 Nanoparticles Doped with Luminescent Lanthanide Ions to be Used as Upconversion-Based Probes // Nature Protocols. 2014. V. 9. P. 1634–1644.
Liu J., Rijckaert A., Zeng M., Haustraete K., Laforce B., Vincze L., van Driessche I., Kaczmarek A.M., van Deun R. Simultaneously Excited Downshifting/ Upconversion Luminescence from Lanthanide-Doped Core/Shell Fluoride Nanoparticles for Multimode Anticounterfeiting // Adv. Funct. Mater. 2018. 1707365. 10 p.
Yi G.S., Lee W.B., Chow G.M. Synthesis of LiYF4, BaYF5, and NaLaF4 Optical Nanocrystals // J. Nanosci. Nanotechnol. 2007. V. 7. № 8. P. 2790–2794.
Du Y.P., Zhang Y.W., Sun L.D., Yan C.H. Optically Active Uniform Potassium and Lithium Rare Earth Fluoride Nanocrystals Derived from Metal Trifluroacetate Precursors // Dalton Trans. 2009. P. 8574–8581.
Mahalingam V., Naccache R., Vetrone F., Capobianco J. A. Sensitized Ce3+ and Gd3+ Ultraviolet Emissions by Tm3+ in Colloidal LiYF4 Nanocrystals // Chem. Eur. J. 2009. V. 15. P. 9660–9663.
Huang P., Zheng W., Tu D., Shang X., Zhasng M., Li R., Xu J., Liu Y., Chen X. Unraveling the Electronic Structures of Neodymium in LiLuF4 Nanocrystals for Ratiometric Temperature Sensing // Adv. Sci. 2019. V. 6. 1802282 (7 p.). https://doi.org/10.1002/advs.201802282
Skripka A., Morinvil A., Matulionyte M., Cheng T., Vetrone F. Advancing Neodymium Single-Band Nanotermometry // Nanoscale. 2019. V. 11. P. 11322–11330.
Cai L., Huang Y., Sun P., Zheng W., Zhou S., Huang P., Wei J., Tu D., Chen X., Liang Z. Accurate Detection of β-hCG in Women’s Serum and Cervical Secretions for Predicting Early Pregnancy Viability Based on Time-Resolved Luminescent Lanthanide Nanoprobes // Nanoscale. 2020. V. 12. P. 6729–6735. https://doi.org/10.1039/c9nr10973k
Chen D., Yu Y., Huang P., Weng F., Lin H., Wang Y. Optical Spectroscopy of Eu3+ and Tb3+ Doped Glass Ceramics Containing LiYbF4 Nanocrystals // Appl. Phys. Lett. 2009. V. 94. P. 041909–041912.
Deng D., Xu S., Zhao S., Li C., Wang H., Ju H. Enhancement of Upconversion Luminescence in Tm3+/Er3+/Yb3+-Codoped Glass Ceramic Containing LiYF4 Nanocrystals // J. Lumin. 2009. V. 129. P. 1266–1270.
Chen D.Q., Yu Y.L., Huang P., Weng F.Y., Lin H., Wang Y.S. Optical Spectroscopy of Eu3+ and Tb3+ Doped Glass Ceramics Containing LiYbF4 Nanocrystals // Appl. Phys. Lett. 2009. V. 94. 041909. https://doi.org/10.1063/1.3076111
Takenobu S., Masaki S.I., Mizuno K., Ohishi Y. Synthesis and Luminescent Properties of Transparent Oxyfluoride Glass-Ceramics Containing Er3+:YLiF4 Nanocrystals // Appl. Phys. Express. 2010. V. 3. № 7. 072601. https://doi.org/10.1143/APEX.3.072601
Lakshminarayana G., Qiu J.R. Photoluminescence of Eu3+, Tb3+ and Tm3+-Doped Transparent SiO2–Al2O3–LiF–GdF3 Glass Ceramics // J. Alloys Compd. 2009. V. 476. P. 720–727. https://doi.org/10.1016/j.jallcom.2008.09.068
Kawamura G., Yoshimura R., Ota K., Oh S.Y., Hakiri N., Muto H., Hayakawa T., Matsuda A. A Unique Approach to Characterization of Sol-Gel-Derived Rare-Earth-Doped Oxyfluoride Glass-Ceramics // J. Am. Ceram. Soc. 2013. V. 96. P. 476–480. https://doi.org/10.1111/jace.12053
Kawamura G., Yoshimura R., Ota K., Oh S.Y., Muto H., Hayakawa T., Matsuda A. Extraction of Nd3+-Doped LiYF4 Phosphor from Sol-Gel-Derivedoxyfluoride Glass Ceramics by Hydrofluoric Acid Treatment // Opt. Mater. 2013. V. 35. P. 1879–1881. https://doi.org/10.1016/j.optmat.2013.07.015
Boyer D., Kharbache H., Mahiou R. Comparison between the Optical Properties of Sol-Gel Process and Solid State Reaction Derived LiYF4:Eu3+ Powders // Opt. Mater. 2006. V. 28. P. 53–57.
Jia P.Y., Lin J., Yu M. Sol-Gel Deposition and Luminescence Properties of LiYF4:Tb3+ Thin Films // J. Lumin. 2007. V. 122–123. P. 134–136.
Secu C.E., Negrea R.F., Secu M. Eu3+ Probe Ion for Rare-Earth Dopant Site Structure in Sol-Gel Derived LiYF4 Oxyfluoride Glass-Ceramic // Opt. Mater. 2013. V. 35. P. 2456–2460.
Semashko V.V., Pudovkin M.S., Cefalas A.C., Zelenikhin P.V., Gavriil1 V.E., Nizamutdinov A.S., Zoe K., Ferraro A., Sarantopoulou E. Tiny Rare-Earth Fluoride Nanoparticles Activate Tumour Cell Growth via Electrical Polar Interactions // Nanoscale Res. Lett. 2018. V. 13. Art. 3.70.
Bastos A.R.N., Brites C.D.S., Rojas-Gutierres P.A., DeWolf C., Ferreira R.A.S., Capobianco J.A., Carlos L.D. Thermal Properties of Lipid Bilayers Determined Using Upconversion Nanoterhermometry // Adv. Funct. Mater. 2019. 1905474 (10 p.).
Крестов Г.А., Крестова Н.В. Температурные коэффициенты радиусов ионов редкоземельных и актинидных элементов // Радиохимия. 1969. Т. 11. № 2. С. 200–210.
Дополнительные материалы
- скачать ESM.docx
- Таблица 1. Координаты некоторых нонвариантных точек в системах LiF - RF3.
Таблица 2. Параметры решетки LiRF4.
Инструменты
Неорганические материалы