Неорганические материалы, 2022, T. 58, № 3, стр. 297-301
Ионообменное извлечение из растворов катионов Zn2+, Co2+ и Ni2+ фосфатотитановыми матрицами
Р. И. Корнейков 1, *, В. И. Иваненко 1, С. В. Аксенова 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального исследовательского центра “Кольский научный центр Российской академии наук”
184209 Апатиты, Мурманской обл., Академгородок, 26а, Россия
* E-mail: r.korneikov@ksc.ru
Поступила в редакцию 22.09.2021
После доработки 28.11.2021
Принята к публикации 29.11.2021
- EDN: ZFXMFD
- DOI: 10.31857/S0002337X22030071
Аннотация
Экспериментально полученные данные свидетельствуют о перспективности ионообменных материалов на основе гидрофосфатов оксотитана(IV) для извлечения из растворов катионов тяжелых металлов. Изучена ионообменная активность фосфатов титана в отношении катионов Zn2+, Co2+ и Ni2+ во времени, в зависимости от соотношения жидкой и твердой фаз, температуры и равновесных значений рН катионообменного процесса. Установлено, что селективность ионита к катиону металла определяется размерами его ионного радиуса. Экспериментально определены оптимальные условия эффективного применения фосфатотитановых материалов для извлечения из растворов катионов Zn2+, Co2+ и Ni2+ (отношение жидкой и твердой фаз, температура, рН).
ВВЕДЕНИЕ
Ежегодно в окружающую среду сбрасывается большое количество сточных вод, образующихся на объектах горнодобывающей и перерабатывающей отраслей промышленности. Такие технологические стоки содержат катионы высокотоксичных тяжелых металлов (ТМ), содержание которых многократно выше предельно допустимых концентраций [1–3]. Токсичность катионов ТМ обусловлена их биоаккумуляцией в живых организмах, что оказывает на последние негативное воздействие [3, 4].
Для извлечения катионов ТМ из промышленных стоков на практике применяются методы осаждения, экстракции, электрокоагуляции и др. [5–8]. Однако данные технологические подходы имеют недостатки. При осаждении и электрокоагуляции возможно образование плохо отделяемых от раствора осадков, при экстракции – растворение экстрагента и т.д. Указанные недостатки ограничивают применение этих методов [9–11].
Для извлечения из технологических растворов катионов ТМ перспективны подходы, основанные на методах ионного обмена. Среди ионообменников интерес могут представлять аморфные гидратированные гидрофосфаты оксотитана(IV) с мольным соотношением Р : Ti ≤ 1. Такие материалы обладают высокими сорбционными характеристиками, устойчивостью в водных средах и способны обеспечивать надежную иммобилизацию высокотоксичного сорбата в течение длительного хранения [12–14].
Цель работы заключалась в изучении ионообменных свойств материалов на основе гидрофосфатов оксотитана(IV) по отношению к некоторым катионам ТМ, в частности цинка, кобальта и никеля, а также поиск оптимальных условий эффективного применения указанных ионообменных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез гидратированного фосфатотитанового ионита осуществляли постадийно. На первой стадии получали высокогидратированный оксогидроксидный титановый прекурсор (TiO(OH)2·nH2O) из титансодержащего реагента. В качестве Ti-содержащего реагента использовали сернокислый раствор оксотитана(IV), в качестве осадителя – раствор гидроксида натрия. После чего отделяли и отмывали прекурсор дистиллированной водой от маточного электролита. На второй стадии проводили ионообменное замещение гидроксогрупп прекурсора на гидрофосфатные группы обработкой ортофосфорной кислотой с последующей сушкой. При таком подходе образуется рентгеноаморфный гидрофосфат оксотитана(IV) [14]. Содержание фосфора в составе полученных сорбционных материалов определяли фотоколориметрически с молибдатом аммония (фотоэлектроколориметр Leki-1107), титана – атомно-абсорбционным и фотоколориметрическим (с пероксидом водорода) методами.
Соотношение аквалигандов и гидрофосфатных групп определяли, сопоставляя данные химического, дифференциального термического (ДТА) и термогравиметрического (ТГА) методов анализа. Для ДТА твердых фаз использовали низкочастотный термографический регистратор НТР-70 с программным нагревательным устройством ПРТ-1000М (эталоном выступал прокаленный оксид алюминия). ТГА проводили с помощью тензорных весов ВТ-1000. Температуру измеряли платина-платинородиевыми термопарами в комплекте с потенциометром ПП-63. Скорость нагрева на воздухе составляла 10°С/мин.
Удельную поверхность воздушно-сухого исходного сорбента (Sуд) определяли методом термической десорбции азота на электронном измерителе удельной поверхности TriStar II 3020 фирмы Micrometritics. Распределение по размерам частиц (PSD) определяли методом лазерной дифракции на анализаторе SALD-201 фирмы Shimadzu. Содержание катионов ТМ в растворах определяли методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС) на приборе ELAN 9000 DRC-e фирмы Perkin Elmer. Погрешность измерений не превышала 4%.
Ионообменное замещение протонов гидрофосфатных групп синтезированного материала проводили в статических условиях при эквимолярных концентрациях катионов ТМ в монокомпонентных растворах, различных отношениях жидкой и твердой фаз (Ж : Т), температуре и равновесных значениях рН. Для контроля и поддержания выбранной рабочей температуры использовали LOIP LB-140. Корректировку равновесных значений рН ионного обмена осуществляли раствором гидроксида лития. Выбор раствора LiOH основан на том, что катионы Li+ обладают несколько меньшими ионными радиусами (r) (кристаллохимическими) по сравнению радиусами катионов ТМ: (r (Å) по Полингу): Li+ – 0.60, Zn2+ – 0.74, Co2+ – 0.72, Ni2+ – 0.69 [15]. Такая разница в r должна снизить при ионном обмене конкуренцию со стороны катионов лития к ТМ. Рабочие равновесные значения рН при ионообменном процессе были ниже значений рН осадкообразования катионов ТМ [15]. Значения рН контролировали рН-метром “Анион 7000”. Индикаторным электродом служил селективный по отношению к протонам электрод марки ЭСЛ-43-07, вспомогательным – хлорсеребряный электрод Ag/AgCl марки ЭВЛ-1М3. Степень извлечения катионов ТМ из растворов (R) рассчитывали согласно уравнению: R = (Vх/Vисх) × × 100%, где Vх – количество извлеченного фосфатотитановой матрицей катиона металла, Vисх – исходное количество катиона металла в аликвоте. Коэффициенты распределения (Kd) рассчитывали по уравнению: Kd = Аα/(100 – А), где А – процентное содержание сорбированного катиона металла, α – отношение объема жидкой фазы к массе сорбента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Определен химический состав синтезированного ионообменного материала (мас. %): TiO2 – 34.01, P2O5 – 30.25, H2O – 35.74. Такому составу соответствует рассчитанная при сопоставлении результатов химического анализа, ДТА и ТГА формула TiOНPO4·4.16Н2О. Предварительно, перед изучением ионообменных свойств по отношению к катионам ТМ, образец подвергали размолу и ситованию, были определены следующие физические параметры: Sуд – 13.89 м2/г, PSD – 7–20 мкм. Такие удельная поверхность и гранулометрический состав способны обеспечить доступность катионов ТМ к ионогенным центрам материала и интенсивное протекание процесса ионного обмена протонов функциональных групп на катионы металлов.
Исследования по ионообменному извлечению катионов Zn2+, Co2+ и Ni2+ образцом TiOНPO4· ·4.16Н2О осуществляли в зависимости от соотношения жидкой и твердой фаз (табл. 1). При введении ионита в раствор, содержащий катионы ТМ, равновесное значение рН снижается до 2, что связано, во-первых, с кислотным характером фосфатотитановых ионитов, а во-вторых – с протеканием процесса ионного замещения.
Таблица 1.
Зависимость R и Kd по катионам Zn2+, Co2+и Ni2+ на сорбенте TiOНPO4·4.16Н2О от соотношения жидкой и твердой фаз
| Ж : Т | Остаточное содержание, г/л | R, % | Kd, мл/г | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Zn2+ | Co2+ | Ni2+ | Zn2+ | Co2+ | Ni2+ | Zn2+ | Co2+ | Ni2+ | |
| 100 | 0.0256 | 0.04 | 0.0571 | 85 | 76 | 64 | 564 | 315 | 177 |
| 300 | 0.0739 | 0.091 | 0.1070 | 57 | 45 | 32 | 390 | 247 | 143 |
| 500 | 0.1251 | 0.131 | 0.1453 | 26 | 21 | 8 | 179 | 134 | 44 |
Установлено, что зависимость извлечения ТМ от соотношения жидкой и твердой фаз носит антибатный характер: с увеличением отношения Ж : Т наблюдается существенное снижение извлечения для всех катионов, о чем свидетельствуют рассчитанные значения степеней извлечения и коэффициентов распределения. Оптимальным экспериментально определенным значением соотношения фаз является 100.
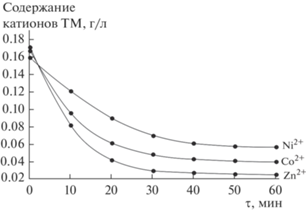
Далее были проведены исследования по извлечению катионов цинка, кобальта и никеля ионобменником во времени при оптимальном отношении фаз Ж : Т = 100 (рис. 1). Видно, что равновесие при сорбционном извлечении катионов ТМ достигается достаточно быстро. Несколько интенсивнее равновесие устанавливается для более крупных катионов Zn2+ и Co2+ в отличие от Ni2+, что, вероятно, связано с бóльшим сродством ионообменной матрицы к более крупным катионам металлов.
Рис. 1.
Извлечения во времени катионов ТМ из растворов ионитом состава TiOНPO4·4.16Н2О при Ж : Т = = 100 и рН 2.
В работе экспериментально установлено влияние температуры на извлечение из растворов катионов ТМ фосфатотитановым ионитом при рН 2 и Ж : Т = 100 (табл. 2).
Таблица 2.
Зависимость R и Kd по катионам Zn2+, Co2+ и Ni2+ на сорбенте TiOНPO4·4.16Н2О от температуры ионообменного процесса
| t, °С | Остаточное содержание, г/л | R, % | Кd, мл/г | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Zn2+ | Co2+ | Ni2+ | Zn2+ | Co2+ | Ni2+ | Zn2+ | Co2+ | Ni2+ | |
| 20 | 0.0256 | 0.04 | 0.0571 | 85 | 76 | 64 | 564 | 315 | 177 |
| 40 | 0.0177 | 0.0315 | 0.0526 | 90 | 81 | 67 | 860 | 427 | 200 |
| 60 | 0.0088 | 0.0230 | 0.0459 | 95 | 86 | 71 | 1832 | 621 | 244 |
Видно, что увеличение температуры ионообменного процесса с 20 до 60°С приводит к повышению извлечения катионов металлов из водных растворов. По-видимому, это связано с частичной дегидратацией катионов ТМ и, как следствие, уменьшением эффективного радиуса, что облегчает катионообменный процесс. Однако такое повышение извлечения незначительно.
В работе проведено извлечение катионов ТМ фосфатотитановой матрицей в зависимости от равновесного значения рН процесса ионного замещения (табл. 3). Установлено, что увеличение равновесного значения рН ионного обмена способствует существенному повышению извлечения катионов Zn2+ и Co2+ из растворов, о чем свидетельствуют значения степеней извлечения и коэффициентов распределения, которые мало отличаются, поскольку катионы цинка и кобальта обладают близкими значениями ионных радиусов. Наибольшее извлечение достигается при рН 6, поскольку в этой области отсутствует конкуренция ионов водорода и усиливается подвижность иона Н+ функциональных групп образца $\left( {{\text{НРО}}_{4}^{{2 - }}} \right)$ в отличие от кислой области (рН 2). Для извлечения катионов Ni2+ наиболее оптимально равновесное значение рН 4, поскольку при повышении рН ионообменного процесса до 6 происходит снижение их выделения, о чем свидетельствуют показатели процесса (R, Kd). Возможно, это связано с частичным гидролизом катионов никеля, что осложняет его замещение на протоны ${\text{НРО}}_{4}^{{2 - }}$-групп ионообменника.
Таблица 3.
Зависимость R и Kd по катионам Zn2+, Co2+ и Ni2+ на сорбенте TiOНPO4·4.16Н2О от рН ионообменного процесса
| рН | Остаточное содержание, г/л | R, % | Кd, мл/г | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Zn2+ | Co2+ | Ni2+ | Zn2+ | Co2+ | Ni2+ | Zn2+ | Co2+ | Ni2+ | |
| 2 | 0.0256 | 0.04 | 0.0571 | 85 | 76 | 64 | 564 | 315 | 177 |
| 4 | 0.32 × 10–3 | 0.50 × 10–3 | 0.43 × 10–2 | 100 | 100 | 97 | 5.3 × 104 | 3.3 × 104 | 3574 |
| 6 | 0.34 × 10–4 | 0.81 × 10–4 | 0.77 × 10–2 | 100 | 100 | 95 | 5 × 105 | 2.1 × 105 | 1952 |
Таким образом, экспериментально показана возможность применения ионообменных материалов на основе гидрофосфатов оксотитана(IV) для извлечения из сточных вод катионов тяжелых металлов – цинка, кобальта, никеля.
ЗАКЛЮЧЕНИЕ
Экспериментально данные, полученные при изучении возможного применения ионитов на основе гидрофосфатов оксотитана(IV) для извлечения из модельных растворов некоторых катионов ТМ (Zn2+, Co2+ и Ni2+), свидетельствуют об эффективности их применения при очистке сточных вод предприятий горнодобывающей и перерабатывающей промышленности. Показано, что оксогидрофосфаты титана(IV) обладают повышенным сродством к катионам цинка, кобальта и никеля, которое повышается в ряду Ni2+ < Co2+ < Zn2+ и определяется размерами ионного радиуса. Гранулометрический состав синтезированного ионообменного материала способен обеспечивать быстроту и эффективность процесса ионного замещения протонов ${\text{НРО}}_{4}^{{2 - }}$-групп на катионы ТМ.
Установлено, что с повышением отношения жидкой и твердой фаз снижаются степень извлечения катионов ТМ и коэффициент распределения. Оптимальным соотношением Ж : Т является 100 (при данном исходном содержании катионов ТМ).
Показано, что увеличение температуры с 20 до 60°С при ионообменном процессе способствует повышению извлечения для всех катионов ТМ, однако это повышение и не превышает 10%.
Установлено, что увеличение равновесного значения рН способствует повышению извлечения катионов Zn2+, Co2+, Ni2+ фосфатом титана(IV). Извлечение значительно возрастает для катионов цинка и кобальта и достигает максимального значения при рН, равном 6, в отличие от катионов никеля, извлечение которого эффективно происходит при рН 4. Дальнейшее повышение значения рН ионообменного процесса снижает выделение из раствора Ni2+.
Определены оптимальные условия эффективного применения фосфатотитанового ионита для извлечения катионов ТМ: отношение жидкой и твердой фаз – 100; равновесное значение рН ионообменного процесса для Zn2+ и Co2+ – 6, для Ni2+ – 4; t – 20°С.
Список литературы
Novais R.M., Carvalheiras J., Seabra M.P., Pullar R.C., Labrincha J.A. Highly Efficient Lead Extraction from Aqueous Solutions Using Inorganic Polymer Foams Derived from Biomass Fly Ash and Metakaolin // J. Environ. Manage. 2020. № 272. P. 111049. https://doi.org/10.1016/j.jenvman.2020.111049
Mohammed A.A., Selman H.M., Abukhanafer G. Liquid Surfactant Membrane for Lead Separation from Aqueous Solution: Studies on Emulsion Stability and Extraction Efficiency // J. Environ. Chem. Eng. 2018. V. 6. № 6. P. 6923–6930. https://doi.org/10.1016/j.jece.2018.10.021
Mohmood I., Lopes C.B., Lopes I., Ahmad I., Duarte A.C., Pereira E. Nanoscale Materials and Their Use in Water Contaminants Removal – a Review // Environ. Sci. Pollut. Res. 2013. V. 20. № 3. P. 1239–1260. https://doi.org/10.1007/s11356-012-1415-x
Chandra R., Yadav S. Phytoremediation of Cd, Cr, Cu, Mn, Fe, Ni, Pb and Zn from Aqueous Solution Using Phragmites Cummunis, Typha Angustifolia and Cyperus Esculentus // Int. J. Phytoremed. 2011. № 13. P. 580–591. https://doi.org/10.1080/15226514.2010.495258
Mohammed A.A., Dia A.-M., Dhia M. Removal of Lead from Simulated Wastewater by Electrocoagulation Method // J. Eng. 2010. V. 16. № 4. P. 5811–5821. https://www.researchgate.net/publication/323429642
Kavak D. Removal of Lead from Aqueous Solutions by Precipitation: Statistical Analysis and Modeling // Desalin. Water Treat. 2013. V. 51. № 7–9. P. 1720–1726. https://doi.org/10.1080/19443994.2012.714652
Konczyk J., Kozlowski C., Walkowiak W. Lead(II) Removal from Aqueous Solutions by Solvent Extraction with Tetracarboxylresorcin [4] Arene // Physicochem. Problems Miner. Process. 2013. V. 49. № 1. P. 213–222. https://doi.org/10.5277/ppmp130119
Stefaniak J., Karwacka S., Janiszewska M., Dutta A., Rene E.R., Regel-Rosocka M. Co(II) and Ni(II) Transport from Model and Real Sulfate Solutions by Extraction with bis(2,4,4-trimethylpentyl)Phosphinic Acid (Cyanex 272) // Chemosphere. 2020. № 254. P. 126869. https://doi.org/10.1016/j.chemosphere.2020.126869
Pang F.M., Teng S.P., Teng T.T., Omar A. Heavy Metals Removal by Hydroxide Precipitation and Coagulation-Flocculation Methods from Aqueous Solutions // Water Qual. Res. J. 2009. V. 44. № 2. P. 174–182. https://doi.org/10.2166/WQRJ.2009.019
Pang F.M., Kumar P., Teng T.T., Omar A.M., Wasewar K.L. Removal of Lead, Zinc and Iron by Coagulation-Flocculation // J. Taiwan Inst. Chem. Eng. 2011. V. 42. № 5. P. 809–815. https://doi.org/10.1016/j.jtice.2011.01.009
Ласкорин Б.Н. Сорбционные и экстракционные процессы в гидрометаллургии цветных и редких металлов // Разделение близких по свойствам редких металлов. М.: Металлургиздат, 1962. С. 11–27.
Корнейков Р.И., Иваненко В.И. Извлечение катионов цезия и стронция из растворов ионитами на основе фосфатов титана(IV) // Неорган. материалы. 2020. Т. 56. № 5. С. 528–532. https://doi.org/10.31857/S0002337X20050085
Корнейков Р.И., Аксенова С.В., Иваненко В.И., Локшин Э.П. Устойчивость оксогидрофосфатов титана(IV) в водных средах // Неорган. материалы. 2018. Т. 54. № 7. С. 727–732. https://doi.org/10.7868/S0002337X18070126
Иваненко В.И., Корнейков Р.И., Локшин Э.П. Иммобилизация катионов металлов титанофосфатными сорбентами // Радиохимия. 2016. Т. 58. № 2 С. 140–146.
Краткий справочник по химии / Под ред. Куриленко О.Д. Киев: Наукова думка, 1965. 835 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


