Неорганические материалы, 2022, T. 58, № 4, стр. 432-436
Высокотемпературная теплоемкость и термодинамические свойства германатов CaY2Ge3O10 и CaY2Ge4O12
Л. Т. Денисова 1, *, М. С. Молокеев 1, 2, Ю. Ф. Каргин 3, Н. А. Галиахметова 1, В. В. Белецкий 1, В. М. Денисов 1
1 Сибирский федеральный университет
660041 Красноярск, пр. Свободный, 79, Россия
2 Институт физики им. А.В. Киренского ФИЦ КНЦ СО Российской академии наук
660036 Красноярск, Академгородок, 50, Россия
3 Институт металлургии и материаловедения им. А.А. Байкова Российской академии наук
119991 Москва, Ленинский пр., 49, Россия
* E-mail: ldenisova@sfu-kras.ru
Поступила в редакцию 30.11.2021
После доработки 01.02.2022
Принята к публикации 02.02.2022
- EDN: FAPSAX
- DOI: 10.31857/S0002337X22040030
Аннотация
По стандартной керамической технологии из CaCO3, Y2O3, GeO2 синтезированы германаты CaY2Ge3O10 и CaY2Ge4O12. Методом рентгеновской дифракции уточнена их кристаллическая структура. С использованием экспериментальных результатов, полученных при измерении высокотемпературной теплоемкости (350–1000 K) методом дифференциальной сканирующей калориметрии, рассчитаны основные термодинамические характеристики германатов.
ВВЕДЕНИЕ
В последнее время наблюдается устойчивый интерес к германатам CaY2Ge3O10 и CaY2Ge4O12, о получении которых в 2006 г. было сообщено авторами [1]. Проведенные ими дифференциальный термический и термогравиметрический анализы показали, что CaY2Ge3O10 устойчив до 1653 K (предположительно имеет конгруэнтный характер плавления), тогда как CaY2Ge4O12 в области 1503–1523 K разлагается на жидкую фазу и CaY2Ge3O10 (инконгруэнтное плавление). Германат CaY2Ge3O10 обладает моноклинной структурой (пр. гр. P21/c), CaY2Ge4O12 – тетрагональной (пр. гр. P4/nbm) [1]. Структура первого германата исследована также в работах [2, 3]. Его кристаллохимическая формула в [1] представлена в виде (Ca0.45Y0.55) (Ca0.46Y0.54)(Ca0,09Y0.01)Ge3O10. Изучению кристаллической структуры CaY2Ge4O12 посвящены работы [4–8]. Полагая, что такие материалы могут быть использованы в фотонике в качестве преобразователей лазерного излучения [6], были проведены многочисленные исследования их оптических свойств: CaY2Ge3O10 [2, 3, 9], CaY2Ge4O12 [4–6, 11]. В большинстве случаев эти германаты получают твердофазным методом [2, 4–10]. В ряде случаев синтез проводят методами “мокрой” химии [2, 3, 9, 12].
Несмотря на такое внимание к данным германатам, многие их свойства к настоящему времени исследованы крайне мало. В первую очередь это относится к теплофизическим свойствам. Диаграмма состояния тройной системы CaO–Y2O3–GeO2 полностью не построена. Имеются данные только о квазибинарной системе GeO2–CaY2Ge3O10 [1] и изотермическом сечении системы CaO–Y2O3–GeO2 при 1473 K [13]. Для компьютерного моделирования необходимы сведения о термодинамических свойствах всех оксидных соединений, образующихся в тройной системе. Такие данные в литературе отсутствуют.
Цель данной работы – синтез и исследование высокотемпературной теплоемкости германатов CaY2Ge3O10 и CaY2Ge4O12.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Германаты синтезировали по стандартной керамической технологии. Стехиометрические смеси предварительно прокаленных исходных компонентов – CaCO3 – “х. ч.”, Y2O3 – “ос. ч.” и GeO2 – 99.999% – гомогенизировали в планетарной шаровой мельнице PM 100 фирмы Retsch (Германия) со стаканами и шарами из ZrO2 в этаноле. После механоактивации в течение 6 ч при 260 об./мин образцы сушили и помещали в полиэтиленовые контейнеры, вакуумировали и запаивали. Затем прессовали на изостатическом прессе YLJ-CIP-20B (P = 150 МПа, τ = 5 мин). Полученные образцы обжигали на воздухе: CaY2Ge3O10 – два раза по 10 ч при 1423 K и два раза по 10 ч при 1473 K; CaY2Ge4O12 – два раза по 10 ч при 1423 K. После каждого цикла образцы перетирали и снова прессовали. Для подготовки образцов к измерениям их перетирали 1 ч при 260 об./мин.
Контроль фазового состава синтезированных германатов проводили методом рентгеновской дифракции. Порошковые рентгенограммы сняты при комнатной температуре на дифрактометре XʹPert Pro MPD PANalytical (Нидерланды) на CuKα-излучении. Регистрацию дифрактограмм выполняли высокоскоростным детектором PIXcel с шагом 0.013°. Параметры решетки определены путем полнопрофильного уточнения методом минимизации производной разности [14].
Теплоемкость германатов измеряли с использованием термоанализатора STA 449 C Jupiter (NETZSCH, Германия) методом дифференциальной сканирующей калориметрии. Методика экспериментов аналогична описанной ранее [15]. Погрешность измерения теплоемкости не превышала 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
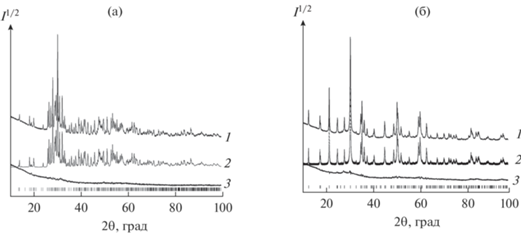
Дифрактограммы синтезированных германатов CaY2Ge3O10 и CaY2Ge4O12 показаны на рис. 1. Параметры их элементарных ячеек приведены в табл. 1 и 2 соответственно. Видно, что полученные результаты и данные других авторов достаточно хорошо согласуются между собой.
Рис. 1.
Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограмм CaY2Ge3O10 (а) и CaY2Ge4O12 (б) после уточнения методом Ритвельда (штрихи указывают расчетные положения рефлексов).
На рис. 2 показано влияние температуры на молярную теплоемкость CaY2Ge3O10 и CaY2Ge4O12. Значения Cp с ростом температуры от 350 до 1000 K закономерно увеличиваются, а отсутствие экстремумов на зависимости Cp = f(T) свидетельствует об отсутствии полиморфных превращений у этих германатов в данной области температур. Установлено, что из всех уравнений, описывающих температурную зависимость твердых тел [16], лучше для исследованных соединений подходит соотношение Майера–Келли [17]
Для CaY2Ge3O10 и CaY2Ge4O12уравнение (1) имеет соответственно следующий вид (Дж/(моль K)):(2)
$\begin{gathered} {{C}_{p}} = \left( {368.40 \pm 1.05} \right) + \left( {28.42 \pm 1.10} \right) \times {{10}^{{--3}}}T-- \\ - \,\,\left( {61.91 \pm 1.12} \right) \times {{10}^{5}}{{T}^{{--2}}}, \\ \end{gathered} $(3)
$\begin{gathered} {{C}_{p}} = \left( {419.46 \pm 0.74} \right) + \left( {52.14 \pm 1.10} \right) \times {{10}^{{--3}}}T-- \\ - \,\,\,\left( {58.11 \pm 0.80} \right) \times {{10}^{5}}{{T}^{{--2}}}. \\ \end{gathered} $Рис. 2.
Влияние температуры на молярную теплоемкость CaY2Ge3O10 (а) и CaY2Ge4O12 (б): экспериментальные данные (1), расчет методом НК2 (2), НК3 (3).
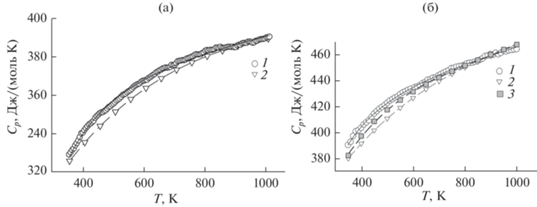
Для уравнений (2) и (3) коэффициенты корреляции равны 0.9984, а максимальное отклонение экспериментальных точек от сглаживающих кривых – 0.94.
С использованием уравнений (2) и (3) по известным термодинамическим соотношениям рассчитаны основные термодинамические функции исследованных германатов. Эти результаты приведены в табл. 3. Из нее следует, что значения Cp при всех исследованных температурах не превышают классический предел Дюлонга–Пти 3Rs, где R – универсальная газовая постоянная, s – число атомов в формульной единице соединения.
Таблица 3.
Термодинамические свойства CaY2Ge3O10 и CaY2Ge4O12
| T, K | Cp, Дж/(моль K) |
H°(T) – H°(350 K), кДж/моль |
S°(T) – S°(350), Дж/(моль K) |
–ΔG/T*, Дж/(моль K) |
|---|---|---|---|---|
| CaY2Ge3O10 | ||||
| 350 | 327.8 | – | – | – |
| 400 | 341.1 | 16.74 | 44.70 | 2.84 |
| 450 | 350.7 | 34.0 | 85.45 | 9.79 |
| 500 | 357.9 | 51.77 | 122.8 | 19.25 |
| 550 | 363.6 | 69.81 | 157.2 | 30.25 |
| 600 | 368.3 | 88.11 | 189.0 | 42.16 |
| 650 | 372.3 | 106.6 | 218.7 | 54.61 |
| 700 | 375.7 | 125.3 | 246.4 | 67.33 |
| 750 | 378.7 | 144.2 | 272.4 | 80.14 |
| 800 | 381.5 | 163.2 | 296.9 | 92.93 |
| 850 | 384.0 | 182.3 | 320.1 | 105.6 |
| 900 | 386.4 | 201.6 | 342.2 | 118.2 |
| 950 | 388.6 | 221.0 | 363.1 | 130.5 |
| 1000 | 390.7 | 240.4 | 383.1 | 142.6 |
| CaY2Ge4O12 | ||||
| 350 | 390.3 | – | – | – |
| 400 | 404.0 | 19.87 | 53.06 | 3.37 |
| 450 | 414.2 | 40.34 | 101.3 | 11.61 |
| 500 | 422.3 | 61.26 | 145.3 | 22.81 |
| 550 | 428.9 | 82.55 | 185.9 | 35.82 |
| 600 | 434.6 | 104.1 | 223.5 | 49.91 |
| 650 | 439.6 | 126.0 | 258.6 | 64.62 |
| 700 | 444.1 | 148.1 | 291.2 | 79.65 |
| 750 | 448.2 | 170.4 | 322.0 | 94.79 |
| 800 | 452.1 | 192.9 | 351.0 | 109.9 |
| 850 | 455.7 | 215.6 | 378.6 | 124.9 |
| 900 | 459.2 | 238.5 | 404.7 | 139.7 |
| 950 | 462.5 | 261.5 | 429.6 | 154.3 |
| 1000 | 465.8 | 284.7 | 453.4 | 168.7 |
Из-за отсутствия данных по теплоемкости CaY2Ge3O10 и CaY2Ge4O12 сравнение полученных результатов проводили с величинами, рассчитанными по различным модельным представлениям – аддитивным методом Неймана–Коппа (НК) [18, 19]: 1) расчет с использованием данных по теплоемкости оксидов CaO, Y2O3, GeO2 [18] (НК1), 2) расчет на основе сведений по теплоемкости CaO, GeO2 [18] и Y2Ge2O7 [20] (НК2)), инкрементным методом Кумока (ИМК) [21]; методом групповых вкладов (ГВ) [22]; Келлога (К) [23]; методом Ивановой (И) [24]. Из табл. 4 следует, что лучшее согласие с экспериментом дают ИМК и НК2. При расчете Cp методом И необходимы данные по температуре плавления (фазового перехода), которых для CaY2Ge3O10 в литературе нет (для CaY2Ge4O12 температура плавления приведена в работе [1]). Отметим, что особенности использования этих модельных представлений для расчета теплоемкости твердых неорганических материалов описаны нами ранее [25].
Таблица 4.
Сравнение данных по теплоемкости CaY2Ge3O10 (уравнение (2)) и CaY2Ge4O12 (уравнение (3)) с рассчитанными величинами при 298 K
| Cp, Дж/(моль К) | ||||||
|---|---|---|---|---|---|---|
| эксперимент | НК1 | НК2 | ИМК | ГВ | К | И |
| CaY2Ge3O10 | ||||||
| 307.2(2) | 300.8 (–2.1) | 313.9 (–2.2) | 311.3 (+1.3) | 304.2 (–1.0) | 318.9 (+3.8) | – |
| CaY2Ge4O12 | ||||||
| 369.6(3) | 352.7 (–4.6) | 366.0 (–1.0) | 367.7 (–0.5) | 358.8 (–2.9) | 375.8 (+1.7) | 380 (+2.8) |
Прогнозировать температурную зависимость теплоемкости твердых неорганических веществ можно различными методами: Эрдоса и Черны [26, 27], Кубашевского [23, 26, 27], НК [19] и ГВ [22]. Поскольку для расчета зависимости Cp = f(T) в последнем случае не требуется какой-либо дополнительной информации (для уравнения Cp = a + + bT + cT–2+ dT2 коэффициенты a, b, c и d приведены в виде таблиц), нами рассчитаны температурные зависимости теплоемкости CaY2Ge3O10 и CaY2Ge4O12 (на рис. 2 не показаны). Установлено, что при низких температурах (350–450 K) рассчитанные величины Cp близки к экспериментальным значениям. С ростом температуры рассчитанные величины становятся выше экспериментальных (чем выше температура, тем больше их различие). Подобное явление отмечено как самими авторами метода ГВ [22], так и в работе [28], в которой проведен анализ применимости этого метода для расчета Cp = f(T) для различных сложных оксидных соединений. Это позволяет допустить, что метод ГВ, несмотря на его простоту, не является универсальным.
На рис. 2 для сравнения с экспериментальными результатами приведены данные Cp = f(T), полученные методом НК2. Видно, что для CaY2Ge3O10 наблюдается лучшее согласие с результатами экспериментов. В случае CaY2Ge4O12 некоторое расхождение проявляется в области низких температур (до 750 K). Необходимые значения для расчета брали из литературы: Cp(CaO) = f(T) [23, 29], Cp(GeO2) = f(T) [30] и Cp(Y2Ge2O7) = f(T) [20]. Особенно следует отметить следующее: расчет Cp = = f(T) для CaY2Ge4O12 на основании полученной нами температурной зависимости теплоемкости CaY2Ge3O10 (уравнение (2)) и литературных данных для GeO2 [30] (НК3) показал, что в этом случае наблюдается лучшее согласие с экспериментом по сравнению с НК2 (рис. 2). Заметим, что наблюдаемые как положительные, так и отрицательные отклонения от аддитивного правила НК связывают с изменениями в частотах колебаний атомов в сложных оксидах по сравнению с простыми [31].
ЗАКЛЮЧЕНИЕ
С использованием в качестве исходных компонентов CaCO3, Y2O3 и GeO2 твердофазным синтезом получены германаты CaY2Ge3O10 и CaY2Ge4O12. Рентгенографическим методом уточнена их кристаллическая структура. Методом дифференциальной сканирующей калориметрии исследовано влияние температуры на молярную теплоемкость этих германатов. Установлено, что зависимости Cp = f(T) в интервале температур 350–1000 K хорошо описываются уравнением Майера–Келли. На основании экспериментальных данных по теплоемкости рассчитаны термодинамические функции сложных оксидных соединений CaY2Ge3O10 и CaY2Ge4O12.
Список литературы
Yamane H., Tanimura R., Yamada T. et al. Synthesis and Crystal Structure of CaY2Ge3O10 and CaY2Ge4O12 // J.Solid State Chem. 2006. V. 179. P. 289–295. https://doi.org/10.1016/j.jss.2005.10.023
Липина О.А., Сурат Л.Л., Мелкозерова М.А. и др. Синтез, кристаллическая структура и люминесцентные свойства CaY2Ge3O10:Ln3+, Ln = Eu, Tb // Оптика и спектроскопия. 2014. Т. 116. № 5. С. 751–756. https://doi.org/10.7868/S0030403414050134
Lipina O.A., Surat L.L., Tyutyunnik A.P. et al. Synthesis and Structural Study of a New Group of Trigermanates, CaRE2Ge3O10 (RE = La–Yb) // CrystEngComm. 2015. P. 1–12. https://doi.org/10.1039/c5ce00063g
Leonidov I.I., Petrov V.P., Chernyshev V.A. et al. Structural and Vibrational Properties of the Ordered Y2CaGe4O12 Germanate: A Periodic Ab Initio Study // J. Phys. Chem. C. 2014. V. 118. P. 8090–8101. https://doi.org/10.1021/jp410492a
Zubkov V.G., Leonidov I.I., Tyutyunnik A.P. et al. Luminescence in Ln2CaGe4O12 under Infrared Laser Excitation // J. Lumin. 2009. V. 129. P. 1625–1628. https://doi.org/10.1016/jlumin.2009.03.037
Зубков В.Г., Леонидов И.И., Тютюнник А.П. и др. Кристаллическая структура и оптические свойства германатов Ln2Ca(GeO3)4, Ln = Gd, Ho, Er, Yb, Y // Физика твердого тела. 2008. Т. 50. № 9. С. 1635–1641.
Tarakina N.V., Zubkov V.G., Leonidov I.I. et al. Crystal Structure of the Group of Optical Materials Ln2MeGe4O12 (Me = Ca, Mn) // Z. Kristallogr. Suppl. 2009. V. 30. P. 401–406. https://doi.org/10.1524/zksu.2009.0059
Zubkov V.G., Tarakina N.V., Leonidov I.I. et al. Synthesis and Crystal Structure of Ln2M2+Ge4O12, Ln = Rare-Earth Element of Y; M = Ca, Mn, Zn // J. Solid State Chem. 2010. V. 183. P. 1186–1194. https://doi.org/10.1016/j.ssc.2010.03.027
Lipina O.A., Surat L.L., Melkozerova M.A. et al. Synthesis, Crystal Structure and Luminescence Properties of CaY2 –xEuxGe3O10 (x = 0–2) // J. Solid State Chem. 2013. V. 206. P. 117–121. https://doi.org/10.1016/j.jssc.2013.08.002
Leonidov I.I., Zubkov V.G., Tyutyunnik A.P. et al. Upconversion Luminescence in Er3+/Yb3+ Codoped Y2CaGe4)12 // J. Alloys Compd. 2011. V. 509. P. 1339–1346. https://doi.org/10.1016/j.jallcom.2010.10.051
Piccinelli F., Lausi A., Bettinelli M. Structural Investigation of the New Ca3Ln2Ge3O12 (Ln = Pr, Nd, Sm, Gd and Dy) Compounds and Luminescence Spectroscopy // J. Solid State Chem. 2013. V. 205. P. 190–196. https://doi.org/10.1016/j.jssc.2013.07.021
Melkozerova M.A., Tarakina N.V., Maksimova L.G. et al. Application of Modified Pechini Method for the Synthesis of Ln2MGe4O12 (Ln = Y, Eu; M = Ca, Zn, Mn) Optical Hosts // J. Sol-Gel. Sci. Technol. 2011. V. 59. P. 338–344. https://doi.org/10.1007/s10971-011-2508-6
Леонидов И.И. Кристаллохимический дизайн оптических материалов на основе германатов системы CaO–GeO2–Y2O3 // Тез. докл. IX нац. кристаллохимической конф. (Суздаль. 2018). М.: Изд-во Граница, 2018. С. 69.
Solovyov L.A. Full-Profile Refinement by Derivative Difference Minimization // J. Appl. Crystallogr. 2004. V. 37. P. 743–749. https://doi.org/10.1107/S0021889804015638
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. Высокотемпературная теплоемкость и термодинамические свойства Tb2Sn2O7 // Неорган. материалы. 2017. Т. 53. № 1. С. 71–73. https://doi.org/10.7868/S0002337X17010043
Чудненко К.В. Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: Гео, 2010. 287 с.
Maier C.G., Kelley K.K. An Equation for the Representation of High Temperature Heat Content Data // J. Am. Chem. Soc. 1932. V. 54. № 8. P. 3243–3246. https://doi.org/10.1021/ja01347a029
Leitner J., Chuchvalec P., Sedmidubský D. et al. Estimation of Heat Capacities of Solid Mixed Oxides // Thermochim. Acta. 2003. V. 395. P. 27–46. https://doi.org/10.1016/S0040-6031(02)00176-6
Leitner J., Voňka P., Sedmidubský D., Svoboda P. Application of Neumann-Kopp Rule for Estimation of Heat Capacity of Mixed Oxides // Thermochim. Acta. 2010. V. 497. P. 7–13. https://doi.org/10.1016/j.tca.2009.08.002
Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. Синтез и исследование высокотемпературной теплоемкости Y2Ge2O7 // Журн. неорган. химии. 2018. Т. 63. № 3. С. 338–340. https://doi.org/10.7868/S0044457X1803011X
Кумок В.Н. Проблема согласования методов оценки термодинамических характеристик // Прямые и обратные задачи химической термодинамики. Новосибирск: Наука, 1987. С. 108–123.
Mostafa A.T.M.G., Eakman J.M., Montoya M.M., Yarbra S.L. Prediction of Heat Capacities of Solid Inorganic Salts from Group Contributions // Ind. Eng. Chem. Tes. 1996. V. 35. P. 343–348.
Кубашевский О., Олкокк С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 392 с.
Иванова Л.И. Зависимость между теплоемкостью твердых веществ и температурой первого фазового перехода // Журн. неорган. химии. 1961. Т. 35. № 9. С. 1809.
Денисова Л.Т., Молокеев М.С., Каргин Ю.Ф. и др. Синтез, кристаллическая структура и термодинамические свойства CuSm2Ge2O8 // Журн. неорган. химии. 2021. Т. 66. № 12. С. 1700–1705. https://doi.org/10.31857/S0044457X21120023
Морачевский А.Г., Сладков И.Б., Фирсова Е.Г. Термодинамические расчеты в химии и металлургии. СПб.: ЛаньБ, 2018. 208 с.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А., Ильиных Н.И. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных АСТРА. OWN). Екатеринбург: УрО РАН, 1997. 230 с.
Leitner J., Sedmidubský D., Chuchvalec P. Prediction of Heat Capacities of Solid Binary Oxides from Group Contribution Method // Ceramics-Silikáty. 2002. V. 46. № 1. P. 29–32.
Третьяков Ю.Д. Твердофазные реакции. М.: Химия, 1978. 360 с.
Тананаев И.В., Шпирт М.Я. Химия германия. М.: Химия, 1967. 451 с.
Резницкий Л.А. Калориметрия твердого тела (структурные, магнитные, электронные превращения). М.: Изд-во МГУ, 1981. 184 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


