Неорганические материалы, 2022, T. 58, № 5, стр. 521-529
Синтез Мo2С методом температурно-программируемого карбидирования с использованием ксерогелей молибденовых синей
Н. Н. Гаврилова 1, *, М. Д. Баженова 1, М. А. Мячина 1, В. В. Назаров 1
1 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: gavrilova.n.n@muctr.ru
Поступила в редакцию 30.12.2021
После доработки 05.02.2022
Принята к публикации 07.02.2022
- EDN: NGDGMQ
- DOI: 10.31857/S0002337X22050037
Аннотация
Впервые успешно проведен синтез Мо2С методом температурно-программируемого карбидирования с использованием наночастиц молибденовых синей в качестве прекурсора. Установлены условия образования карбида молибдена. Показано влияние условий активации на характеристики карбидов: фазовый состав, морфологию и удельную поверхность. Установлено, что в зависимости от условий проведения активации (с предварительной термообработкой на воздухе и без) возможно образование как β-Mo2C, так и α-Mo2C.
ВВЕДЕНИЕ
Карбиды переходных металлов известны как материалы, имеющие уникальные свойства, такие как высокие твердость и температура плавления, электро- и теплопроводность, коррозионная устойчивость. Эти соединения давно и успешно используются для изготовления режущих инструментов и износостойких деталей [1].
Известно также, что карбиды переходных металлов обладают высокой каталитической активностью. В частности, карбиды молибдена проявляют каталитическую активность в риформинге углеводородов [2–7], селективном окислении [8], реакции водяного газа [9–12], обессеривании [13], ароматизации [14], изомеризации [15] и селективном восстановлении СО2 [16].
Немаловажным достоинством карбидов молибдена является их устойчивость к закоксовыванию и действию многих каталитических ядов [17, 18]. Уникальные физико-химические свойства карбидов молибдена, а также их меньшая стоимость, механическая прочность, более высокая электропроводность позволяют рассматривать данные соединения как альтернативу катализаторам на основе металлов платиновой группы.
Среди известных способов синтеза карбидов молибдена наибольшее распространение получил способ температурно-программируемого карбидирования (ТПК), который основан на реакциях газ-твердое вещество. В качестве источников молибдена как правило используется МоО3 [19–21], а в качестве источника углерода – смесь углеводородных газов (CH4, C2H6, C3H8, C4H10) с H2 или ароматические соединения [22–24]. В качестве исходных реагентов также могут быть использованы соли молибдена – гептамолибдат аммония или молибдаты натрия и калия, которые переводятся в соответствующие триоксиды путем термообработки на воздухе, а затем происходит их карбидизация с использованием описанных выше газовых смесей [18, 25].
В работах, посвященных синтезу карбидов молибдена методом ТПК, приводятся различные условия проведения процесса: скорость изменения температуры, конечная температура процесса, источник углерода и соотношение H2/CnH2n + 2. Однако необходимо отметить, что изменение этих параметров влияет в основном на удельную поверхность, морфологию, размер частиц образующегося карбида, а также на величину каталитической активности [26]. Одним из ограничений метода ТПК является то, что в большинстве случаев удается синтезировать β-Мо2С с гексагональной кристаллической решеткой, при этом в каталитической химии востребованными являются и другие модификации [27].
В работах, посвященных ТПК, недостаточно внимания уделяется выбору источника молибдена, т.е. использованию других кислородсодержащих соединений молибдена.
В данной работе предложено в качестве исходных реагентов карбида молибдена использовать молибденовые сини – устойчивые дисперсии наноразмерных кластеров (полиоксометаллатного типа). Интерес к данным соединениям с точки зрения катализа обусловлен рядом особенностей. Во-первых, дисперсная фаза представлена наноразмерными частицами (кластерами) одинаковых формы и размера, т.е. система является монодисперсной [28, 29]. В настоящей работе использовались дисперсии, содержащие торообразные кластеры семейства Мо154, диаметр которых составляет 3.5 нм [30]. Во-вторых, отличительной особенностью молибденовых синей является присутствие молибдена в кластерных соединениях в переходной степени окисления (от 5+ до 6+), что может положительно сказаться на протекании температурно-программируемой реакции карбидирования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез молибденовых синей. Дисперсии молибденовых синей были получены восстановлением гептамолибдата аммония в кислой среде в присутствии глюкозы [30]. К раствору гептамолибдата аммония (0.07 М) добавляли требуемое количество восстановителя (мольное соотношение [C6H12O6]/[Mo] составляло 7/1) при интенсивном перемешивании, затем добавляли раствор соляной кислоты до значения рН 2.0.
Синтез карбида молибдена. Для получения карбида молибдена молибденовые сини высушивали на воздухе при комнатной температуре до ксерогелей, затем подвергали термообработке в различных условиях.
Первый вариант синтеза заключался в получении МоО3 из молибденовых синей путем термообработки на воздухе с последующим ТПК. Конечная температура нагревания на воздухе (в окислительной среде) составляла 600°С. ТПК осуществляли в реакторе проточного типа метан-водородной смесью СН4/Н2 = 60/40 при расходе 100 мл/мин.
Второй вариант синтеза заключался в ТПК ксерогелей, полученных сушкой молибденовых синей при 25°С без какой-либо дополнительной термообработки. ТПК осуществляли в аналогичных условиях: реакция проводилась в реакторе проточного типа с использованием метан-водородной смеси состава СН4/Н2 = 60/40 при расходе 100 мл/мин.
Третий вариант синтеза состоял в термообработке ксерогелей молибденовых синей в инертной атмосфере (N2, “ос. ч.”). Термообработка осуществлялась в реакторе проточного типа при температуре 900°С, скорость подъема температуры составляла 5°С/мин.
Анализ газов осуществлялся с помощью газового хроматографа “КристалЛюкс-4000М”, снабженного двумя детекторами по теплопроводности и двумя хроматографическими колонками. Для обработки хроматограмм использовалась программа NetCrom 2.1.
Методы исследования. Термический анализ (ТА) ксерогелей молибденовых синей проводили в открытых корундовых тиглях на дериватографе Q-1500D МОМ в атмосфере воздуха и на анализаторе SDT Q600 Thermal Analyzer (TA Instruments, USA) в атмосфере азота в режиме линейного подъема температуры со скоростью 5°С/мин.
Фазовый состав образцов определяли на дифрактометре Rigaku D/MAX 2500 (Япония) с CuKα-излучением. Идентификацию фаз проводили в соответствии с данными картотеки JCPDC.
Морфологию образцов изучали с помощью сканирующей электронной микроскопии. Исследования проводили на микроскопе Mira Tescan (Чехия) при ускоряющем напряжении 20 кВ.
Удельную поверхность образцов определяли методом БЭТ с помощью автоматического анализатора Gemini VII 2390t Micromeritics (США) на оборудовании ЦКП им. Д.И. Менделеева.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В первом способе синтеза перед проведением ТПК молибденовые сини подвергались обжигу на воздухе. Для выбора конечной температуры обжига использовались данные ТА и РФА.
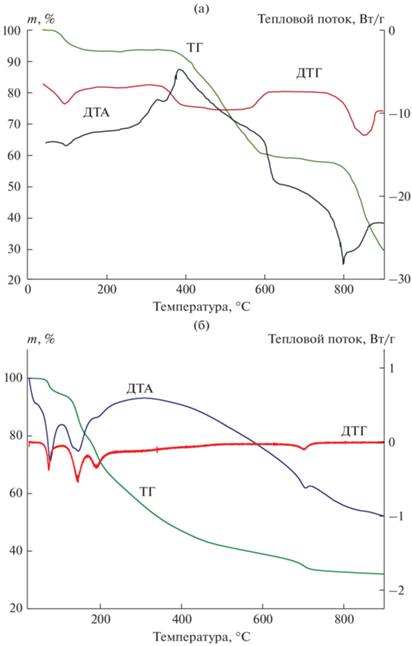
В процессе термообработки ксерогелей (рис. 1а) происходит ступенчатая потеря массы образца. Первый участок (до 100°С) соответствует потере воды, а также разрушению структуры молибденоксидных кластеров, температура деструкции которых составляет 80°С [31]. Второй участок наблюдается в интервале температур 350–600°С и соответствует двум процессам: термическому разложению глюкозы (восстановитель в синтезе молибденовых синей) с ярко выраженным экзоэффектом и окислению кислородсодержащих кластеров молибдена до МоО3. При температуре выше 800°С наблюдается еще один участок со значительной потерей массы образца, которая обусловлена возгонкой МоО3. Таким образом, в дальнейшем при получении триоксида молибдена температура обжига ксерогелей составляла 500°С. Образец триоксида молибдена, полученный в этих условиях, представляет собой МоО3 орторомбической модификации (см. рис. 2а) с удельной поверхностью 0.3 м2/г.
Рис. 2.
Дифрактограммы триоксида молибдена (а); полученного его карбидированием карбида молибдена (способ 1) (б); карбидов молибдена, полученных карбидированием ксерогелей молибденовых синей (способ 2) (в) и их обжигом в инертной среде (способ 3) (г).
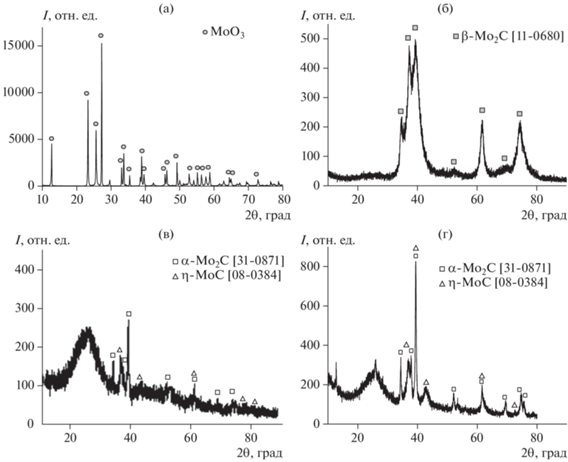
Далее полученный МоО3 подвергался ТПК с использованием газовой смеси СН4/Н2 состава 60/40, выбор состава смеси был осуществлен на основании анализа данных [32, 33]. На рис. 3а показано изменение состава газовой смеси при взаимодействии с МоО3. Как видно из представленных данных, при температуре 625°С происходит уменьшение концентрации H2, что свидетельствует о процессе восстановления МоО3 до МоО2 [34]. При повышении температуры до 680°С наблюдаются уменьшение концентрации СН4, увеличение содержания H2 и появление в продуктах реакции СО и СО2. Такие изменения свидетельствуют об образовании из МоО2 карбида молибдена. Полученные зависимости хорошо согласуются с данными по ТПК MoO3 [31]. Согласно данным РФА (см. рис. 2б), продуктом реакции является β‑Мо2С с гексагональной кристаллической решеткой [11-0680]. Удельная поверхность карбида молибдена, синтезированного данным способом, составила 1.5 м2/г.
Рис. 3.
Изменение мольных потоков веществ, входящих в карбидирующую смесь, при активации порошкообразного МоО3 (а), ксерогелей молибденовых синей (б).
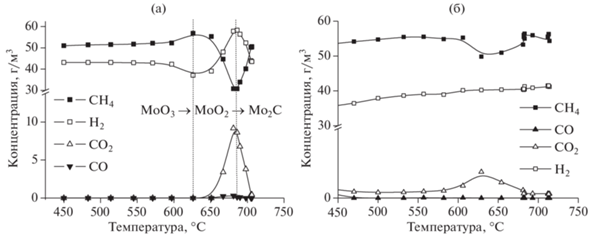
Согласно второму способу синтеза, ксерогели молибденовых синей подвергались ТПК без предварительной термообработки на воздухе. Изменение концентрации компонентов газовой смеси приведено на рис. 3б. Как видно из представленных данных, значительные изменения концентрации СН4 с одновременным появлением в смеси СО2 наблюдаются при температуре 625°С, что свидетельствует о протекании процесса карбидирования. Участок, соответствующий восстановлению МоО3 до МоО2, в данном случае не наблюдается, поскольку частицы молибденовых синей уже представлены полиоксометаллатными соединениями молибдена с переменной степенью окисления, реакционная способность которых может сильно отличаться от таковой для триоксида молибдена.
На дифрактограмме образца ксерогеля молибденовой сини после воздействия карбидирующей смеси (t = 680°С) наблюдаются широкие рефлексы аморфного углерода, рефлексы α-Мо2С с орторомбической кристаллической решеткой [31-0871] и η-МоС [08-0384] (см. рис. 2в). Удельная поверхность образца составила 28 м2/г, что в основном обусловлено наличием мезопор.
Синтез карбида молибдена термическим разложением ксерогелей молибденовых синей в инертной среде описан в предыдущих исследованиях [35], а в настоящей работе использован для сравнения. Его суть заключается в термообработке ксерогелей молибденовой сини в инертной атмосфере, в результате чего происходит деструкция молибденоксидных кластеров, глюкозы, продуктов ее окисления с последующим образованием карбидов молибдена. Состав молибденовых синей и условия их получения были аналогичны [35].
На рис. 1б приведены данные термического разложения ксерогелей молибденовых синей в инертной среде. Как видно из представленных данных, потеря массы образца происходит в несколько этапов. Первые этапы потери массы наблюдаются при температурах 100 и 180°С, они связаны с удалением свободной и связанной воды. При этом на кривой ДТА регистрируется несколько эндотермических эффектов. При температуре выше 250°С начинается разложение органических веществ (глюкозы и продукта ее окисления глюконовой кислоты), а также хлорида аммония. В этой области наблюдается размытый экзотермический эффект с максимумом при ~350°С.
Последний этап изменения массы начинается при 680–700°С и может свидетельствовать об образовании карбида из углерода и оксидов молибдена, что сопровождается небольшим эндотермическим эффектом.
Согласно данным РФА, заметные рефлексы, характерные для карбидов молибдена, начинают появляться при температуре выше 850°С. На рис. 2г приведена дифрактограмма образца, полученного при 900°С. Фазовый состав представлен аморфным углеродом, α -Мо2С [31-0871] и η-МоС [08-0384].
Удельная поверхность карбида молибдена, полученного данным способом, составила 175 м2/г, что, как показали расчеты (t-метод), является суммарной величиной поверхности микропор углерода и поверхности мезопор карбида молибдена. В табл. 1 приведены некоторые характеристики полученных материалов.
Таблица 1.
Некоторые свойства Мо2С, синтезированного различными способами
| Способ синтеза | 1 | 2 | 3 |
| Фазовый состав | β-Мо2С | α -Мо2С, η-МоС, С | α -Мо2С, η-МоС, С |
| Sуд (БЭТ), м2/г | 1.5 | 28.0 | 175.0 |
| Sуд микро (t-метод), м2/г | – | – | 111.0 |
| ∑Vпор, см3/г | 0.01 | 0.04 | 0.08 |
| Vмезопор, см3/г | – | 0.03 | 0.01 |
| Vмикропор, см3/г | – | – | 0.05 |
Интересно отметить, что морфология образцов карбида молибдена, полученных методом ТПК, независимо от источника молибдена, является схожей (см. рис. 4). Карбиды молибдена представлены агрегатами из первичных частиц угловатой формы, а их размер составляет порядка 2–5 мкм.
Рис. 4.
Микрофотографии частиц порошков Мо2С, синтезированных способом 1 (ТПК порошкообразного МоО3) (а, б), 2 (ТПК ксерогелей молибденовых синей) (в, г).

Микрофотографии частиц порошка, полученного термообработкой молибденовых синей в инертной среде при температуре 900°С, приведены на рис. 5. На снимках видны частицы двух типов. В образце присутствуют агрегаты из частиц карбида молибдена, а также частицы неправильной формы с четкими гранями, расположенные в матрице другого материала. На рис. 5в и 5г представлены фотографии одного и того же участка поверхности образца, сделанные в обычном режиме съемки (рис. 5в) и в режиме фазового контраста (рис. 5г). Из представленных данных видно, что образец состоит из двух фаз: светлые области – частицы Мо2С, темная область – аморфный углерод. Таким образом, частицы катализатора оказываются распределенными в углеродной матрице.
ЗАКЛЮЧЕНИЕ
В традиционном варианте ТПК карбид молибдена β-Mo2C получают воздействием газовой смеси (CnH2n + 2/H2) на MoO3 [17, 31, 32]. В данной работе в качестве источника молибдена впервые использованы ксерогели молибденовых синей. Установлено, что в зависимости от условий проведения карбидирования (с предварительной термообработкой на воздухе и без) возможно образование как β-Mo2C, так и α-Mo2C.
Разница в фазовом составе образцов, получаемых методом ТПК, может быть объяснена различием механизма образования Mo2C. При воздействии газовой смеси СН4/Н2 на МоО3 вначале происходит образование МоО2 за счет восстановления МоО3, за этим следует замещение атомов кислорода атомами углерода (процесс карбидирования) при взаимодействии с СН4, т.е. процесс протекает не по топотактическому механизму [36]. В результате этой реакции в подавляющем большинстве случаев образуется β-Mo2C, о чем свидетельствуют данные многочисленных исследований в этой области [6, 22, 24, 26, 31, 32].
При карбидировании ксерогелей молибденовых синей без предварительного обжига на воздухе происходит формирование мезопористого материала, представленного α-Mo2C и нестехиометрическим карбидом η-МоС. Это возможно при протекании реакции карбидирования по топотактическому механизму с образованием в качестве промежуточного продукта MoOxCy. Возможность реализации данного механизма обеспечивается сложным составом молибденовых синей как дисперсных систем, в дисперсионной среде которых присутствуют частицы нестехиометрических кислородсодержащих соединений молибдена, а также глюкоза и продукты ее окисления.
При использовании термического разложения ксерогелей молибденовых синей происходит также образование α-Mo2C и нестехиометрического карбида η-МоС. Такой подход позволяет получить карбиды молибдена, частицы которых фактически распределены в углеродной матрице. И как следствие этот материал имеет бидисперсную пористую структуру: микропористую структуру углерода и мезопористую структуру карбидов молибдена.
Таким образом, на основе ксерогелей молибденовых синей, синтезированных с использованием органического восстановителя (глюкозы), могут быть получены карбиды молибдена, имеющие различные характеристики: фазовый состав, морфологию и пористую структуру, которые могут быть востребованы в качестве катализаторов различных реакций.
Список литературы
Toth L.E. Transition Metal Carbides and Nitrides N. Y.: Academic Press, 1971. P. 279.
Tominaga H., Nagai M. Theoretical Study of Methane Reforming on Molybdenum Carbide // Appl. Catal., A. 2007. V. 328. P. 35–42.
Christofoletti T., Assaf J., Assaf E. Methane Steam Reforming on Supported and Nonsupported Molybdenum Carbides // Chem. Eng. J. 2005. V. 106. P. 97–103.
La Mont D.C., Thomson W.J. Dry Reforming Kinetics over a Bulk Molybdenum Carbide Catalyst // Chem. Eng. Sci. 2005. V. 60. P. 3553–3559.
Marin Flores O.G., Ha S. Study of the Performance of Mo2C for Iso-octane Steam Reforming // Catal. Today. 2008. V. 136. № 3–4. P. 235–242.
York A.P.E., Clarige J.B., Marquez-Alvarez C., Brungs A.J., Tsang S.C., Green M.L.H. Synthesis of Early Transition Metal Carbides and Their Application for the Reforming of Methane to Synthesis Gas // Stud. Surf. Sci. Catal. 1997. V. 110. P. 711–720.
Clarige J.B., York A.P.E., Brungs A.J., Marquez-Alvares C., Sloan J., Tsang S.C., Green M.L.H. New Catalysts for Conversion of Methane to Synthesis Gas: Molybdenum and Tungsten Carbide // J. Catal. 1998. V. 180. № 1. P. 85–100.
Solymosi F., Németh R., Oszkó A. The Oxidative Dehydrogenation of Propane with CO2 over Supported Mo2C Catalyst // Stud. Surf. Sci. Catal. 2001. V. 136. P. 339–344.
Patt J., Moon D.J., Phillips C., Thompson L. Molybdenum Carbide Catalysts for Water-Gas Shift // Catal. Lett. 2000. V. 65. P. 193–195.
Liu P., Rodriguez J.A. Water-gas-shift Reaction on Molybdenum Carbide Surfaces: Essential Role of the Oxycarbide // J. Phys. Chem. B. 2006. V. 110. P. 19418–19425.
Tominaga H., Nagai M. Density Functional Theory of Water-gas Shift Reaction on Molybdenum Carbide // J. Phys. Chem. B. 2005. V. 109. P. 20415–20423.
Moon D.J., Rue J.W. Molybdenum Carbide Water-gas Shift Catalyst for Fuel Cell- Powered Vehicles Application // Catal. Lett. 2004. V. 92. № 1. P. 17–24.
Rodriguez J.A., Liu P., Takahashi Y., Nakamura K., Viñes F., Illas F. Desulfurization Reactions on Surfaces of Metal Carbides: Photoemission and Density–Functional Studies // Top. Catal. 2010. V. 53. P. 393–402.
Széchenyi A., Solymosi F. n-Octane Aromatization on Mo2C-Containing Catalysts // Appl. Catal., A. 2006. V. 306. № 1. P. 149–158.
Han J., Duan J., Chen P., Lou H., Zheng X., Hong H. Nanostructured Molybdenum Carbides Supported on Carbon Nanotubes as Efficient Catalysts for One-Step Hydrodeoxygenation and Isomerization of Vegetable Oils // Green Chem. 2011. V. 13. P. 2561–2568.
Porosoff M.D., Kattel S., Li W., Liu P., Chen J.G. Identifying Trends and Descriptors for Selective CO2 Conversion to CO over Transition Metal Carbides // Chem. Commun. 2015. V. 51. P. 6988–6991.
Izhar S., Yoshida M., Nagai M. Characterization of Cobalt-Tungsten and Molybdenum-Tungsten Carbides an Anode Catalyst for PEFC // Electrochem. Acta. 2009. V. 54. P. 1255–1262.
Darujati A.D.S., Thompson W.J. Kinetic study of a ceria-promoted Mo2C/γ-Al2O3 Catalyst in Dry-Methane Reforming // Chem. Eng. Sci. 2006. V. 61. P. 4309–4315.
Vitale G., Frauwallner M., Hernandez E., Scott C., Pereira-Almao P. Low Temperature Synthesis of Cubic Molybdenum Carbide Catalysts via Pressure Induced Crystallographic Orientation of MoO3 Precursor // Appl. Catal., A: 2011. V. 400. P. 221–229.
Zhu Q., Chen Q., Yang X., Ke D. A New Method for the Synthesis of Molybdenum Carbide // Mater. Lett. 2007. V. 61. P. 5173–5174.
Скудин В.В. Получение композиционных мембран со слоем материала массивного и нанесенного катализатора // Мембраны и мембранные технологии. 2012. Т. 2. № 4. С. 303–317.
Xiao T.C., York A.P., Williams V.C., Al-Megren H., Hanif A., Zhou X.Y., Green M.L.H. Preparation of Molybdenum Carbides Using Butane and Their Catalytic Performance // Chem. Mater. 2000. V. 12. P. 3896–3905.
Zhang A., Zhu A., Chen B., Zhang S., Au C., Shi C. In-Situ Synthesis of Nickel Modified Molybdenum Carbide Catalyst for Dry Reforming of Methane // Catal. Commun. 2011. V. 12. P. 803–807.
Zhang S., Shi C., Chen B., Zhang Y., Zhu Y., Qiu J., Au C. Catalytic Role of β-Mo2C in DRM Catalysts that Contain Ni and Mo // Catal. Today. 2015. V. 158. P. 254–258.
Darujati A.R.S., LaMont D.C., Thompson W.J. Oxidation Stability of Mo2C Catalysts under Fuel Reforming Conditions // Appl. Catal., A. 2003. V. 253. P. 397–407.
Mehdad A. Mixed Metal Carbides: Understanding the Synthesis, Surface Properties and Catalytic Activities: A Dissertation Submitted to the Graduate Faculty in Partial Fulfillment of the Requirements for the Degree of Doctor of Philosophy. University of Oklahoma. 2015. P. 180.
Семин Г.Л., Дубровский А.Р., Снытников П.В., Кузнецов С.А., Собянин В.А. Применение катализаторов на основе карбидов молибдена и вольфрама в реакции конверсии оксида углерода с водяным паром // Катализ в промышленности. 2011. № 5. С. 44–53.
Müller A., Roy S. En Route from the Mystery of Molybdenum Blue via Related Manipulatable Building Blocks to Aspects of Materials Science // Coord. Chem. Rev. 2003. V. 245. P. 153–166.
Liu T., Diemann E., Muller A. Hydrophilic Inorganic Macro-ions in Solution: Unprecedented Self-Assembly Emerging from Historical “Blue waters” // J. Chem. Educ. 2007. V. 84. №. 3. P. 526–532.
Баженова М.Д., Гаврилова Н.Н., Назаров В.В. Некоторые коллоидно-химические свойства молибденовых синей, синтезированных с использованием глюкозы в качестве восстановителя // Коллоид. журн. 2015. Т. 77. № 1. С. 3–8.
Остроушко А.А., Тонкушина М.О. Деструкция нанокластерных полиоксометаллатов на основе молибдена в водных растворах // Журн. физ. химии. 2015. Т. 89. № 3. С. 440–443.
Lee J.S., Oyama S.T., Boudart M. Molybdenum Carbide Catalysts: I. Synthesis of Unsupported Powders // J. Catal. 1987. V. 106. № 1. P. 125–133.
Volpe L., Boudart M. Compounds of Molybdenum and Tungsten with High Specific Surface Area: II. Carbides // J. Solid State Chem. 1985. V. 59. № 3. P. 348–356.
Hanif A., Xiao T., York A.P.E., Sloan J., Green M.L.H. Study on the Structure and Formation Mechanism of Molybdenum Carbides // Chem. Mater. 2002. V. 14. P. 1009–1015.
Gavrilova N., Myachina M., Nazarov V., Skudin V. Simple Synthesis of Molybdenum Carbides from Molybdenum Blue Nanoparticles // Nanomaterials. 2021. V. 11. P. 873.
Ma Y., Guan G., Hao X., Cao J., Abudula A. Molybdenum Carbide as Alternative Catalyst for Hydrogen Production — A Review // Renew. Sustain. Energy Rev. 2017. V. 75. P. 1101–1129.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы