Неорганические материалы, 2022, T. 58, № 5, стр. 538-547
Синтез и оптические свойства R2O2S:Ln3+ (R = Gd, Y; Ln = Eu, Tb)
Е. И. Сальникова 1, 2, *, Ю. Г. Денисенко 3, О. В. Андреев 1, 4
1 Тюменский государственный университет
625003 Тюмень, ул. Володарского, 6, Россия
2 Государственный аграрный университет Северного Зауралья
625003 Тюмень, ул. Республики, 7, Россия
3 Тюменский индустриальный университет
625000 Тюмень, ул. Володарского, 38, Россия
4 Институт химии твердого тела УрО Российской академии наук
620137 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: elenasalnikova213@gmail.com
Поступила в редакцию 07.12.2021
После доработки 16.02.2022
Принята к публикации 18.02.2022
- EDN: RKJICM
- DOI: 10.31857/S0002337X22050086
Аннотация
Методом водородного восстановления сульфата (Y0.95Eu0.05)2(SO4)3 с последующим сульфидированием продуктов реакции получен твердый раствор (Y0.95Eu0.05)2O2S (гексагональная сингония, пр. гр. P3m1, a = 3.810 Å, c = 6.62 Å, V = 83.269 Å3). При обработке в потоке H2S сульфатов гадолиния и тербия, полученных при совместном гидролизе в водно-этанольном растворе мочевины, и отожженных в инертной атмосфере (Gd0.95Tb0.05)2(SO4)3 и (Gd0.95Tb0.05)2O3 образуется (Gd0.95Tb0.05)2O2S (гексагональная сингония, a = 3.852 Å, c = 6.668 Å, V = 89.53 Å3). Проведена фазовая и морфологическая аттестация, выявлено различие формы и размеров частиц в зависимости от метода синтеза. Результаты исследования оптических свойств полученных люминофоров показали эффективную люминесценцию в зеленой области спектра при УФ-возбуждении для всех полученных образцов.
ВВЕДЕНИЕ
В работах [1–9] рассматриваются синтез и исследование свойств неорганических соединений, имеющих как прикладное, так и фундаментальное значение. В исследованиях [10, 11] изучены люминесцентные свойства материалов на основе La2O2S:Eu3+, выявлено эффективное излучение в желтой и красной областях электромагнитного спектра, продемонстрирована замечательная термочувствительность с точки зрения как интенсивности, так и времени жизни флуоресценции в диапазоне температур 15–60°C, что делает возможным их применение для флуоресцентного измерения физиологических температур. В соединениях La2О2S, содержащих 1% Ln3+ (Ln = Pr, Eu, Tb, Dy, Er), показано уменьшение ширины запрещенной зоны, а также увеличение показателя преломления по сравнению с чистым La2О2S [12]. В работах [13–16] рассмотрены новые методы синтеза допированных оксисульфидов Gd2O2S:Eu3+ и перспектива их использования в качестве новых флуоресцентных зондов для биомаркировки, поскольку длины волн возбуждения и эмиссии расположены внутри “окна прозрачности” биологических тканей (650–1200 нм). Возможность использования Gd2O2S:Tb3+ и La2O2S:Eu3+, синтезированных реакцией горения, в качестве рентгенолюминофоров рассмотрена в работе [17], а в [18] описан люминофор Gd2O2S:Tb с высокой интенсивностью рентгеновской люминесценции, пригодный для производства усиливающих экранов.
Описаны новые технологии получения полых нановолокон Y2O2S:Eu3+, которые демонстрируют характерное излучение с преобладающим пиком при 628 нм [19, 20]. В [21] получен люминофор белого света, состоящий из Y2O2S:Eu3+и ZnO в массовом соотношении 70 : 30. Полученный композитный люминофор может быть полезен для применения в белых светодиодах. В УФ-светодиодах включение ионов Eu3+ в красный люминофор позволяет настраивать интенсивность излучения, поэтому Y2O2S:Eu3+ можно рекомендовать в качестве красной компоненты для создания светодиодов при комбинировании с синим и зеленым люминофорами для создания белого света, применяемого в общем освещении [22, 23]. При УФ-возбуждении частицы Lu2O2S:Eu3+ демонстрируют сильное красное излучение, соответствующее 5D0 → 7F2-переходу ионов Eu3+.
Показана зависимость интенсивности эмиссии от формы образцов. Такие соединения с уникальной морфологией и превосходными люминесцентными свойствами могут иметь потенциальное применение в системах отображения, оптоэлектронных устройствах и биосенсорах [24]. В [25] синтезированы и протестированы оксисульфидные/оксисульфатные катализаторы для реакции водно-газовой конверсии. Они показали высокую каталитическую активность в наноразмерных состояниях. В работах [26–30] синтезированы образцы La2O2S:Yb3+,Er3+ c высокоэффективным повышающим преобразованием, они могут найти применение в качестве люминесцентных меток нового поколения и оптических датчиков температуры. Авторы [31] предлагают применять соединение Y2O2S:Eu,Dy в качестве твердотельного однокомпонентного люминофора для создания белого света. В работах [32–36] рассмотрены ап-конверсионные свойства соединений Y2O2S:Yb,Er для применения в биомедицине, а также для безопасного и точного измерения температуры. В работе [37] сообщается о системах Gd2O2S:Yb/Er (Yb/Ho, Yb/Tm) как об очень эффективных альтернативных люминофорах. Частицы обладают сильным магнитным действием, что делает их пригодными в качестве агента МРТ.
В работах [38, 39] получены соединения R2O2S: Ln3+, имеющие эффективную люминесценцию в красной, синей и зеленой областях спектра, что делает их перспективными в качестве люминофоров.
Таким образом, в литературе имеется большое количество работ, описывающих методы синтеза люминофоров и их оптические свойства для разных приложений. В каждой работе описывается определенный метод синтеза, при этом отсутствует сравнение свойств продуктов синтеза.
Целью настоящей работы является получение люминофоров Y2O2S:Eu3+, Gd2O2S:Tb3+ из соответствующих сульфатов двумя различными способами; характеризация оптических свойств и морфологии частиц; установление зависимости формы и размеров частиц от метода синтеза.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза (Y0.95Eu0.05)2O2S использовали сульфат (Y0.95Eu0.05)2(SO4)3, а для получения (Gd0.95Tb0.05)2O2S – сульфаты Gd2(SO4)3 и Tb2(SO4)3.
Все сульфаты получены при воздействии серной кислотой (“х.ч.”, ОАО “Вектон”, Россия) на нитраты, которые в свою очередь получены из товарных оксидов Y2O3, Gd2O3, Eu2O3 и Tb4O7 (99.999%, ОАО “ТДМ-72”, Россия) при воздействии на них азотной кислотой, (“х.ч.”, ОАО “Вектон”, Россия). Навески оксидов взвешивали на аналитических весах с точностью до 0.0001 г. Проводили подготовку оксидов к взвешиванию прокаливанием при 900°С в муфельной печи в течение суток для разложения карбонатов и гидроксидов. Отбор кислот проводили с помощью стеклянных пипеток с точностью до 0.1 мл. Навески оксидов в рассчитанных мольных соотношениях (95 : 5) общей массой 5 г растворяли в 12 М HNO3 до получения прозрачного раствора при постоянном перемешивании. Наблюдали протекание химической реакции
(1)
$\begin{gathered} 0.95{{{\text{Y}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 0.05{\text{E}}{{{\text{u}}}_{{\text{2}}}}{{{\text{O}}}_{3}} + 6{\text{HN}}{{{\text{O}}}_{3}} \to \\ \to 2\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right){{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{3}} + 3{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $В полученный раствор нитратов добавляли эквивалентный объем 7 М H2SO4 с избытком до 7%. Образование кристаллогидратов сульфатов описывается химической реакцией:
(2)
$\begin{gathered} {\text{2}}\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right){{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}}{\text{ + 3}}{{{\text{H}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 8}}{{{\text{H}}}_{{\text{2}}}}{\text{O }} \to \\ \to {\text{ }}{{\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}}{\kern 1pt} \cdot {\kern 1pt} {\text{8}}{{{\text{H}}}_{{\text{2}}}}{\text{O + 6HN}}{{{\text{O}}}_{{\text{3}}}}. \\ \end{gathered} $Полученный осадок высушивали при 80–100°С, а затем подвергали отжигу на воздухе при 600°С до 24 ч. Образовавшийся спек, представляющий из себя безводный сульфат твердого раствора, растирали до получения порошка с размерами частиц менее 100 мкм. Образец подвергали температурному воздействию водородом при 600°С в течение 3 ч, а затем обрабатывали в потоке H2S при 1000°С в течение 4 ч.
Обработка веществ в потоке газообразных реагентов проводилась на установке, состоящей из 2 печей, нагрев которых производили при помощи контроллера и трансформатора. Водород из генератора проходит через слой порошка и восстанавливает серу в сульфат-ионе до S0. Температуру химических реакций, протекающих на данном этапе, контролируют с помощью измерительного прибора “Термолюкс”. Для этапа сульфидирования образующийся по реакции S + H2$ \rightleftarrows $ H2S сероводород пропускают через смесь фаз, что приводит к образованию однофазного образца люминофора при реакции оксида с сероводородом.
Исходными соединениями для получения Gd2O2S:Tb3+ являются сульфаты гадолиния и тербия, получение которых описано ранее.
Содержание ионов Tb3+ составляло 5 мол. %. В качестве реагента применялся карбамид (99%, ОАО “Реактив”, Санкт-Петербург, Россия). Оптимальная концентрация лантаноидов – 5.69 × × 10–3 моль/л, концентрация мочевины составляла 0.25 моль/л. Молярное отношение мочевины к [Ln3+] 44.6. В качестве растворителя использовались деионизированная вода и этанол c cодержанием 96 мас. %. Навески Gd2(SO4)3 и Tb2(SO4)3 помещали в круглодонную колбу объемом 2 л и растворяли в небольшом объеме деионизированной воды. Затем добавляли мочевину, 400 мл этанола и доливали деионизированную воду до 2 л. Нагревание при 85°C проводили на масляной бане в течение 120 мин при интенсивном перемешивании. Для отделения частиц от жидкости образовавшуюся смесь центрифугировали в течение 10 мин при 6000 об./мин. Жидкость над осадком сливали, а твердую фазу промывали несколько раз. Твердое вещество сушили в печи при 80°С в течение 12 ч, затем проводили отжиг в потоке аргона (99.9999%, “Сибтехнология”, Россия) при нагреве со скоростью 5°С/мин от комнатной температуры до 800°С и выдержке в течение 2 ч. В результате происходило образование смеси фаз Gd2O2SO4:Tb3+ и Gd2O3:Tb3+. Однофазный образец твердого раствора получали при обработке в потоке H2S при 1000°С в течение 4 ч.
Рентгенофазовый анализ проводили с помощью дифрактометра ДРОН-7 с использованием CuKα-излучения (Ni-фильтр). Для качественного анализа полученных дифрактограмм применяли программный комплекс PDWin 4.0 с базой данных ICDD PDF-2. Электронно-микроскопический анализ осуществляли на растровом электронном микроскопе JEOL JSM-6510LV. Рентгеновский энергодисперсионный анализатор использовался для регистрации рентгеновских лучей при построении спектров элементов на выбранных участках поверхности образца. Погрешность определения содержания элементов составила ±0.2%.
Люминесцентные свойства регистрировали на спектрофлуориметре исследовательского класса Horiba JobinYvon Fluorolog-3, оснащенном двойными монохроматорами каналов возбуждения и излучения и ксеноновой лампой мощностью 450 Вт в качестве источника возбуждения. Для проведения измерений порошки наносили между предметным и покровным стеклами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
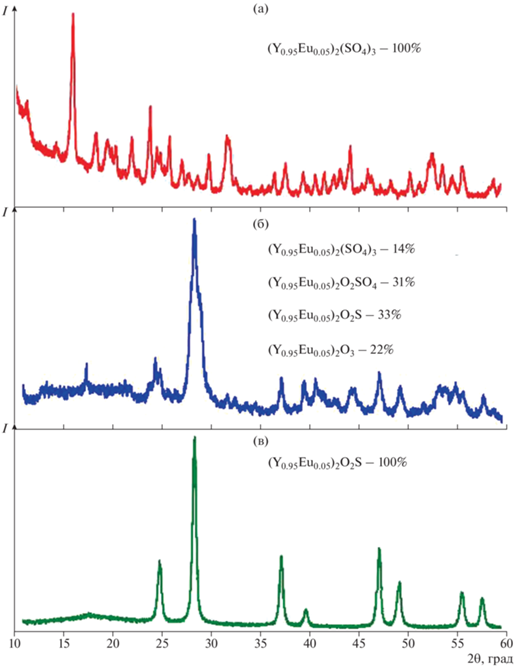
Для синтеза твердого раствора (Y0.95Eu0.05)2O2S использовали сульфат (Y0.95Eu0.05)2(SO4)3, полученный в результате воздействия серной кислоты на растворы нитратов иттрия и европия, последующего выпаривания суспензии до сухого остатка при 80–100°С и прокаливания его при 600°С на воздухе. По данным рентгенофазового анализа, данное химическое соединение является твердым раствором (рис. 1а), который кристаллизуется в ромбической сингонии (пр. гр. Pbcn, a = 12.77 Å, b = 9.19 Å, c = 9.28 Å, V = 933.51 Å3, Card 70-5315). После обработки образца (Y0.95Eu0.5)2(SO4)3 в потоке H2 при температуре 600°С в течение 5 ч фиксируются четыре фазы: (Y0.95Eu0.05)2(SO4)3 (ромбическая сингония, пр. гр. Pbcn, a = 12.79 Å, b = = 9.19 Å, c = 9.28 Å, V = 933.51 Å3, Card 70-5315); (Y0.95Eu0.05)2O2SO4 (ромбическая сингония, пр. гр. I222, a = 4.152 Å, b = 3.999 Å, c = 12.69 Å, V = 177.7 Å3, Card 41-685), (Y0.95Eu0.05)2O2S (гексагональная сингония, пр. гр. P3m1, a = 3.802 Å, c = 6.931 Å, V = = 83.269 Å3, Card 24-1424), (Y0.95Eu0.05)2O3 (моноклинная сингония, пр. гр. C2/m, a = 13.91 Å, b = = 3.52 Å, c = 8.63 Å, V = 337.7 Å3, β = 100.21°, Card 44-399) (рис. 1б).
Данные рентгенофазового анализа позволяют составить следующие уравнения химических реакций:
(3)
$\begin{gathered} {{{\text{(}}{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}{\text{)}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}}{\text{ + 6}}{{{\text{H}}}_{{\text{2}}}} \to \\ \to {{{\text{(}}{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}{\text{)}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 2S + 6}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(4)
$\begin{gathered} {{{\text{(}}{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}{\text{)}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 4}}{{{\text{H}}}_{{\text{2}}}} \to \\ \to {\text{ (}}{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}{{{\text{)}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S + 4}}{{{\text{H}}}_{{\text{2}}}}{\text{O\;,}} \\ \end{gathered} $(5)
$\begin{gathered} {{{\text{(}}{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}{\text{)}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 3}}{{{\text{H}}}_{{\text{2}}}} \to \\ \to {{{\text{(}}{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}{\text{)}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{ + S + 3}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $При данной температуре обработки возможно наличие фазы оксида иттрия, а также примеси сульфата и оксосульфата, поэтому применена обработка смеси в потоке сероводорода при температуре 1000°С в течение 3 ч.
Исходя из данных рентгенофазового анализа составлены уравнения химических реакций:
(6)
$\begin{gathered} {{\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}}{\text{ + 6}}{{{\text{H}}}_{{\text{2}}}}{\text{S }} \to \\ \to {{\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{2}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 8S + 6}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(7)
$\begin{gathered} {{\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 4}}{{{\text{H}}}_{{\text{2}}}}{\text{S }} \to \\ \to {{\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S + 4S + 4}}{{{\text{H}}}_{{\text{2}}}}{\text{O,\;}} \\ \end{gathered} $(8)
$\begin{gathered} {{\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{{{\text{3\;\;}}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{S }} \to \\ \to {{\left( {{{{\text{Y}}}_{{{\text{0}}{\text{.95}}}}}{\text{E}}{{{\text{u}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $В данном случае H2S выполняет двойственную функцию: в реакциях (6) и (7) он является восстановителем, а в реакции (8) он замещает один атом кислорода в (Y0.95Eu0.05)2O3.
Полученный образец (Y0.95Eu0.05)2O2S является однофазным твердым раствором замещения (гексагональная сингония пр. гр. P3m1, a = 3.810 Å, c = 6.62 Å, V = 83.269 Å (Card 24-1424)) (рис. 1в).
По данным растровой электронной микроскопии, прокаленный осадок (Y0.95Eu0.05)2(SO4)3 (рис. 2) состоит из частиц неправильной формы со средними размерами 5–30 мкм. Реакции, приведшие к образованию оксисульфида (Y0.99Eu0.01)2O2S, сопровождаются протеканием диффузионных и окислительно-восстановительных процессов. В результате этих превращений происходит изменение формы и размеров частиц, появляются плоские грани и характерные для гексагональной структуры геометрические очертания (рис. 3).
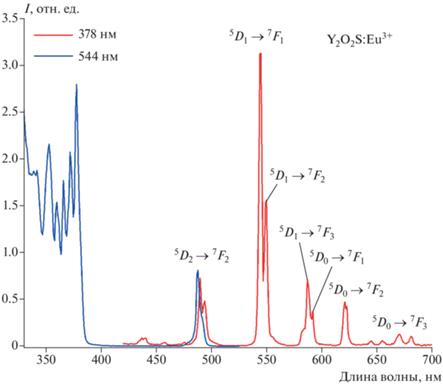
Спектры возбуждения и люминесценции образца (Y0.95Eu0.05)2O2S представлены на рис. 4. Спектр возбуждения (Y0.95Eu0.05)2O2S при 544 нм (5D1–7F1) состоит из следующих переходов: 7F0–5D4 (353 нм), 7F0–5L7 (377 нм) и 7F2–5D2 (488 нм). В спектре излучения видны узкие полосы от возбужденных уровней 5D1 и 5D0. Удивительно, но в спектре излучения (Y0.95Eu0.05)2O2S преобладает переход 5D1–7F1 (545 нм), тогда как наиболее заметные полосы люминесценции обычно приписываются переходу 5D0–7FJ. Такое поведение ранее сообщалось для объемных люминофоров La2O2S: Eu3+ [40, 41].
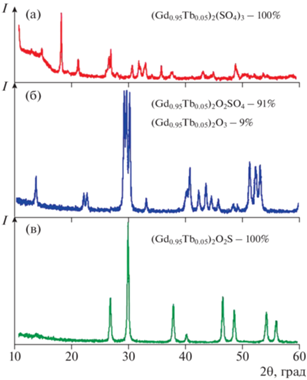
По результатам рентгенофазового анализа, сульфат гадолиния, предназначенный для роли матрицы в синтезируемом люминофоре, представляет собой химическое соединение с моноклинным типом сингонии (пр. гр. C2/c, а = 9.00 Å, b = 14.569 Å, c = = 6.425 Å, β = 97.41°, V = 220.47Å3) (рис. 5а).
В результате гидролиза сульфатов гадолиния и тербия в присутствии водно-этанольного раствора мочевины протекают следующие химические превращения:
I. Гидролиз мочевины
(9)
$\begin{gathered} {\text{1)}}\,\,\,\,\,\,\,\,{\text{N}}{{{\text{H}}}_{{\text{2}}}} - {\text{CO}} - {\text{N}}{{{\text{H}}}_{2}} \to {\text{N}}{{{\text{H}}}_{3}} + \\ + \,\,{\text{HNCO}} \rightleftarrows {\text{NH}}_{4}^{ + } + {\text{NC}}{{{\text{O}}}^{ - }}, \\ \end{gathered} $(10)
${\text{2) }}\,\,\,\,{\text{NC}}{{{\text{O}}}^{ - }} + {\text{ }}2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{NH}}_{4}^{ + } + {\text{CO}}_{3}^{{2 - }},$3) суммарное уравнение
(11)
${\text{N}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{CO}}{\kern 1pt} - {\kern 1pt} {\text{N}}{{{\text{H}}}_{2}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to 2{\text{NH}}_{4}^{ + } + {\text{CO}}_{3}^{{2 - }}$II. Образование (NH4)2[(Gd0.95Tb0.05)2(OH) × × (HCO3)(SO4)3]
(12)
$\begin{gathered} 0.{\text{95G}}{{{\text{d}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}}{\text{ + 0}}{\text{.05T}}{{{\text{b}}}_{{\text{2}}}}{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}_{{\text{3}}}}{\text{ + }} \\ + {\text{ O}}{{{\text{H}}}^{ - }} + {\text{HCO}}_{3}^{ - } + {\text{ }}2{\text{NH}}_{4}^{ + } \to \\ \to {{\left( {{\text{N}}{{{\text{H}}}_{{\text{4}}}}} \right)}_{2}}\left[ {{{{\left( {{\text{G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}} \right)}}_{{\text{2}}}}\left( {{\text{OH}}} \right)\left( {{\text{HC}}{{{\text{O}}}_{{\text{3}}}}} \right){{{\left( {{\text{S}}{{{\text{O}}}_{{\text{4}}}}} \right)}}_{{\text{3}}}}} \right]. \\ \end{gathered} $III. Обработка (NH4)2[(Gd0.95Tb0.05)2(OH)(HCO3) × × (SO4)3] в потоке аргона при температуре 800°С в течение 2 ч привела к образованию смеси твердых растворов (Gd0.95Tb0.05)2O2SO4 и (Gd0.95Tb0.05)2O3 (рис. 5б).
(13)
$\begin{gathered} {{({\text{N}}{{{\text{H}}}_{{\text{4}}}}{\text{)}}}_{{\text{2}}}}\left[ {{{{{\text{(G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}{\text{)}}}}_{{\text{2}}}}{\text{(OH)(HC}}{{{\text{O}}}_{{\text{3}}}}{\text{)(S}}{{{\text{O}}}_{{\text{4}}}}{{{\text{)}}}_{{\text{3}}}}} \right] \to \\ \to {\text{ (G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}{{{\text{)}}}_{{\text{2}}}}{{{\text{О}}}_{2}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + C}}{{{\text{O}}}_{{\text{2}}}}{\text{ + 2}}{{{\text{H}}}_{{\text{2}}}}{\text{O + }} \\ {\text{ + 2S}}{{{\text{O}}}_{{\text{2}}}}{\text{ + 2N}}{{{\text{H}}}_{{\text{3}}}}{\text{ + 2}}{{{\text{O}}}_{{\text{2}}}}, \\ \end{gathered} $(14)
$\begin{gathered} 2{{\left( {{\text{G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{2}}{{{\text{О}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} \to \\ \to \,\,2{{\left( {{\text{G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{2}}{{{\text{O}}}_{{\text{3}}}} + 2{\text{S}}{{{\text{O}}}_{2}} + {{{\text{O}}}_{2}}. \\ \end{gathered} $По результатам рентгенофазового анализа, (Gd0.95Tb0.05)2O2SO4, кристаллизуется в ромбической сингонии (a = 4.062 Å, b = 4.166 Å, c = 12.872 Å; V = 209.58 Å3, Card 29-613); (Gd0.95Tb0.05)2O3 – в гексагональной сингонии (пр. гр. P3m1, a = 3.621 Å; c = 6.78 Å; V = 76.92 Å3, Card 24-430).
В результате воздействия сероводорода в течение 4 ч при 1000°С, по данным рентгенофазового анализа, образуется оксисульфид
(15)
$\begin{gathered} {{\left( {{\text{G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}{\text{ + 4}}{{{\text{H}}}_{{\text{2}}}}{\text{S}} \to \\ \to {{\left( {{\text{G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S + 4S}}\,\,{\text{ + }}\,\,{\text{4}}{{{\text{H}}}_{{\text{2}}}}{\text{O,}} \\ \end{gathered} $(16)
$\begin{gathered} {{{\text{(G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}{\text{)}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{ + }}{{{\text{H}}}_{{\text{2}}}}{\text{S }} \to \\ \to {{\left( {{\text{G}}{{{\text{d}}}_{{{\text{0}}{\text{.95}}}}}{\text{T}}{{{\text{b}}}_{{{\text{0}}{\text{.05}}}}}} \right)}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}{\text{S + }}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}} \\ \end{gathered} $Полученный образец (Gd0.95Tb0.05)2O2S, по данным рентгенофазового анализа, является однофазным твердым раствором и кристаллизуется в гексагональной сингонии (пр. гр. P3m1, a = 3.852 Å, c = = 6.668 Å, V = 89.53 Å3) (рис. 5в).
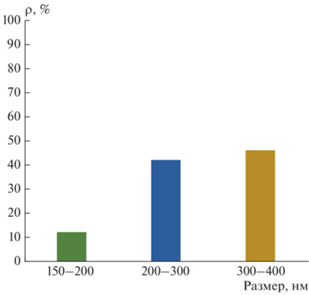
По данным растровой электронной микроскопии, частицы (Gd0.95Tb0.05)2O2S имеют преимущественно сферическую форму (рис. 6). Составлена гистограмма распределения частиц по размерам (рис. 7), которая демонстрирует наличие частиц с размерами 150–400 нм, большую часть из которых составляют частицы 200–400 нм (около 90%). Сравнительно малые размеры и сходная форма частиц позволят применять полученное соединение для производства люминофоров.
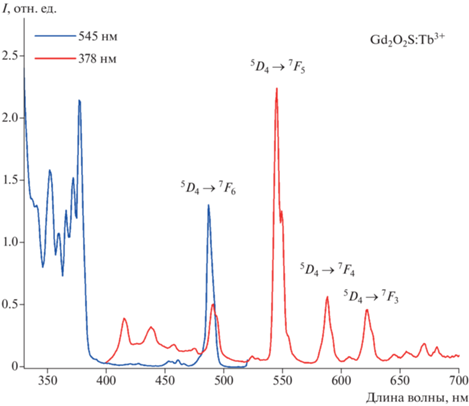
Спектры возбуждения и люминесценции образца (Gd0.95Tb0.05)2O2S представлены на рис. 8. Спектр излучения при возбуждении λ = 378 нм. Это световое возбуждение дает три четко определенных полосы, связанные с излучением электронных переходов 4f → 4f иона Tb3 +. Наиболее ярко выраженный пик люминесценции с центром при 489 нм соответствует переходу 5D4 → 7F6, при 545 нм – 5D4 → 7F5, при 584 нм – 5D4 → 7F4, при 623 нм – 5D4 → 7F3. Полоса 545 нм является наиболее интенсивной и соответствует зеленому цвету электромагнитного спектра, создаваемого переходом 5D4 → 7F5.
ЗАКЛЮЧЕНИЕ
Разработаны способы получения люминесцентных материалов на основе твердых растворов оксисульфидов редкоземельных элементов. Преимущество первого метода заключается в осаждении серосодержащего исходного для синтеза люминофоров вещества из гомогенного раствора нитрата и последующем превращении его в желаемый однофазный продукт в восстановительно-сульфидирующей атмосфере. Использование химической гомогенизации позволило добиться равномерного распределения катионов в структуре. Использование сульфатов в качестве прекурсоров ввиду наличия в структуре серы значительно упрощает процесс получения твердых растворов оксисульфидов. Все синтезированные образцы являются однофазными.
Синтез по второму методу приводит к образованию сферических частиц небольшого размера, что сделает возможным более широкое использование полученных материалов для биозондирования.
Спектры излучения Y2O2S:Eu3+ и Gd2O2S:Tb3+ имеют эмиссионные линии между 490 и 670 нм, наиболее интенсивные – при 545 нм. Предлагаемый подход открывает новые возможности синтеза люминофоров для сбора и хранения солнечного света, биомаркеров, использования их в качестве сцинтилляторов и компоненты для создания белого света.
Список литературы
Denisenko Yu.G., Khritokhin N.A., Andreev O.V., Basova S.A., Sal’nikova E.I., Polkovnikov A.A. Thermal Decomposition of Europium Sulfates Eu2(SO4)3·8H2O and EuSO4 // J. Solid State Chem. 2017. V. 255. P. 219–224. https://doi.org/10.1016/j.jssc.2017.08.020
Osseni S.A., Denisenko Yu.G., Fatombi J.K., Sal’nikova E.I., Andreev O.V. Synthesis and Characterization of Ln2O2SO4 (Ln = Gd, Ho, Dy and Lu) Nanoparticles Obtained by Coprecipitation Method and Study of Their Reduction Reaction Under H2 Flow // J. Nanostruct. Chem. 2017. № 7. P. 337–343. https://doi.org/10.1007/s40097-017-0243-4
Denisenko Yu.G., Molokeev M.S., Krylov A.S., Aleksandrovsky A.S., Oreshonkov A.S., Atuchin V.V., Azarapin N.O., Plyusnin P.E., Sal’nikova E.I., Andreev O.V. High-Temperature Oxidation of Europium(II) Sulfide // J. Indust. Eng. Chem. 2019. V. 79. P. 62–70. https://doi.org/10.1016/j.jiec.2019.05.006
Denisenko Yu.G., Sedykh A.E., Basova S.A., Atuchin V.V., Molokeev M.S., Aleksandrovsky A.S., Krylov A.S., Oreshonkov A.S., Khritokhin N.A., Sal’nikova E.I., Andreev O.V., Müller-Buschbaum K. Exploration of the Structural, Spectroscopic and Thermal Properties of Double Sulfate Donohydrate NaSm(SO4)2·H2O and its Thermal Decomposition Product NaSm(SO4)2 // Adv. Powder Technol. 2021. V. 32. № 11. P. 3943–3953. https://doi.org/10.1016/j.apt.2021.08.009
Веселова В.О., Юрлов И.А., Рябочкина П.А., Дудкина Т.Д., Егорышева А.В. Синтез и люминесцентные свойства нанокристаллических (1–х)ZrO2–хEr2O3(х = 0.015–0.5) твердых растворов // Журн. неорган. химии. 2020. Т. 65. № 9. С. 1298–1303. https://doi.org/10.31857/S0044457X20090214
Колесник И.В., Щербаков А.Б., Козлова Т.О., Козлов Д.А., Иванов В.К. Сравнительный анализ солнцезащитных характеристик нанокристаллического диоксида церия // Журн. неорган. химии. 2020. Т. 65. № 7. С. 872–879. https://doi.org/10.31857/S0044457X20070120
Андреев О.В., Денисенко Ю.Г., Сальникова Е.И., Хритохин Н.А., Зырянова К.С. Особенности взаимодействия сульфатов церия и европия с водородом // Журн. неорган. химии. 2016. Т. 61. № 3. С. 312–317. https://doi.org/10.7868/S0044457X16030028
Стеблевская Н.И., Белобелецкая М.В., Медков М.А. Люминесцентные свойства боратов лантана LaBO3:Eu и La(BO2)3:Eu, полученных экстракционно-пиролитическим методом // Журн. неорган. химии. 2021. Т. 66. № 4. С. 440–449. https://doi.org/10.31857/S0044457X21040218
Лукьяшин К.Е., Ищенко А.В. Синтез и оптические свойства керамики YAG:Ce с высокой концентрацией церия // Журн. неорган. химии. 2021. Т. 66. № 8. С. 1099–1107. https://doi.org/10.31857/S0044457X21080134
Yu L., Li F., Liu H. Fabrication and Photoluminescent Characteristics of One-Bimensional La2O2S:Eu3+ Nanocrystals // J. Rare Earths. 2013. V. 31. № 4. P. 356–359. https://doi.org/10.1016/S1002-0721(12)60285-3
Jiang G., Wei X., Chen Y., Duan C., Yin M., Yang B., Cao W. Luminescent La2O2S:Eu3+ Nanoparticles as Non-Contact Optical Temperature Sensor in Physiological Temperature Range // Mater. Lett. 2015. V. 143. P. 98–100. https://doi.org/10.1016/j.matlet.2014.12.057
Shah K., Ciric A., Murthy K. V.R., Chakrabarty B.S. Investigation of a New Way of Synthesis for Nano Crystallites of La2O2S & 1%Ln3+ (Ln = Pr, Eu, Tb, Dy, Er) Doped La2O2S and Study Their Structural and Optical Properties // J. Alloys Compd. 2021. V. 851. P. 156725. https://doi.org/10.1016/j.jallcom.2020.156725
Lu X., Yang L., Ma Q., Tian J., Dong X. A Novel Strategy to Synthesize Gd2O2S:Eu3+ Luminescent Nanobelts via Inheriting the Morphology of Precursor // J. Mater. Sci.-Mater. Electron. 2014. V. 25. P. 5388–5394. https://doi.org/10.1007/s10854-014-2317-0
Osseni S.A., Lechevallier S., Verelst M., Dujardin Ch., Dexpert-Ghys J., Neumeyer D., Leclercq M., Baaziz H., Cussac D., Santran V., Mauricot R. New Nanoplatform Based on Gd2O2S:Eu3+ Core: Synthesis, Characterization and Use for in vitro Bio-Labelling // J. Mater. Chem. 2011. V. 21. P. 18365–18372. https://doi.org/10.1039/C1JM13542B
Osseni S.A., Lechevallier S., Verelst M., Perriat P., Dexpert-Ghys J., Neumeyer D., Garcia R., Mayer F., Dja-nashvili K., Peters J.A., Magdeleine E., Gros-Dagnac H., Celsis P., Mauricot R. Gadolinium Oxysulfide Nanoparticles as Multimodal Imaging Agents for T2-Weighted MR, X-Ray Tomography and Photoluminescence // Nanoscale. 2014. V. 6. P. 555–564. https://doi.org/10.1039/C3NR03982J
Thirumalai J., Chandramohan R., Valanarasu S., Vijayan T.A., Somasundaram R.M., Mahalingam T., Srikumar S.R. Shape-Selective Synthesis and Opto-Electronic Properties of Eu3+-Doped Gadolinium Oxysulfide Nanostructures // J. Mater. Sci. 2009. V. 44. P. 3889–3899. https://doi.org/10.1007/s10853-009-3531-7
Xia T., Cao W.H., Luo X.X., Tian Y. Combustion Synthesis and Spectra Characteristic of Gd2O2S:Tb3+ and La2O2S:Eu3+ X-Ray Phosphors // J. Mater. Res. 2005. V. 20. № 9. P. 2274–2278. https://doi.org/10.1557/jmr.2005.0301
Rodionova A.V., Kuular V.I., Minakova T.S., Ustabaev P.Sh., Bakhmetyev V.V. Acid-Base and Luminescent Properties of Gd2O2S:Tb Luminescent Phosphors Synthesized in a Reducing Atmosphere // Key Eng. Mater. 2020. V. 854. P. 57–63. doi: 10.4028/www.scientific.net/KEM.854.57
Han L., Pan M., Lv Y., Gu Y., Wang X., Li D., Kong Q., Dong X. Fabrication of Y2O2S:Eu3+ Hollow Nanofibers by Sulfurization of Y2O3:Eu3+ Hollow Nanofibers // J. Mater. Sci.-Mater. Electron. 2015. V. 26. P. 677–684. https://doi.org/10.1007/s10854-014-2449-2
Guo C., Luan L., Chen C., Huang D., Su Q. Preparation of Y2O2S:Eu3+ Phosphors by a Novel Decomposition Method // Mater. Lett. 2008. V. 62. № 4–5. P. 600–602. https://doi.org/10.1016/j.matlet.2007.06.016
Sundararannan B., Kottaisamy M. Synthesis and Characterization of Near UV Excitable Y2O2S:Eu3+ Entrapped ZnO for White Light Emitting Diode Applications // J. Solid State Chem. 2021. V. 293. P. 121739. https://doi.org/10.1016/j.jssc.2020.121739
Cheng B.M., Duan C.K., Tanner P.A. Vacuum Ultraviolet and Visible Spectra of Eu3+ in Y2O2S and Eu2O2S // Opt. Mater. 2009. V. 31. № 6. P. 902–904. https://doi.org/10.1016/j.optmat.2008.10.036
Chou T.W., Mylswamy S., Liu R.S., Chuang S.Z. Eu Substitution and Particle Size Control of Y2O2S for the Excitation by UV Light Emitting Diodes // Solid State Commun. 2005. V. 136. P. 205–209. https://doi.org/10.1016/j.ssc.2005.07.032
Zhao Q., Zheng Y., Guo N., Jia Y., Qiao H., Lv W., You H. 3D-Hierarchical Lu2O2S:Eu3+ Micro/Nano-Structures: Controlled Synthesis and Luminescence Properties // CrystEngComm. 2012. V. 14. P. 6659–6664. https://doi.org/10.1039/C2CE25631B
Tan S., Paglieri S.N., Li D. Nano-Scale Sulfur-Tolerant Lanthanide Oxysulfide/Oxysulfate Catalysts for Water-Gas-Shift Reaction in a Novel Reactor Configuration // Catal. Commun. 2016. V. 73. P. 16–21. https://doi.org/10.1016/j.catcom.2015.10.007
Denisenko Yu.G., Sal’nikova E.I., Basova S.A., Molokeev M.S., Krylov A.S., Aleksandrovsky A.S., Oreshonkov A.S., Atuchin V.V., Volkova S.S., Khritokhin N.A., Andreev O.V. Synthesis of Samarium Oxysulfate Sm2O2SO4 in the High-Temperature Oxidation Reaction and Its Structural, Thermal and Luminescent Properties // Molecules. 2020. V. 25. № 6. P. 1330. https://doi.org/10.3390/molecules25061330
Denisenko Y.G., Sedykh A.E., Molokeev M.S., Oreshonkov A.S., Aleksandrovsky A.S., Krylov A.S., Khritokhin N.A., Sal’nikova E.I., Andreev O.V., Müller-Buschbaum K. Crystal and Electronic Structure, Thermochemical and Photophysical Properties of Europium-Silver Sulfate Monohydrate AgEu(SO4)2·H2O // J. Solid State Chem. 2021. V. 294. № 121898. https://doi.org/10.1016/j.jssc.2020.121898
Oreshonkov A.S., Roginskii E.M., Shestakov N.P., Gudim I.A., Temerov V.L., Nemtsev I.V., Molokeev M.S., Adichtchev S.V., Pugachev A.M., Denisenko Yu.G. Structural, Electronic and Vibrational Properties of YAl3(BO3)4 // Materials. 2020. V. 13. P. 545. https://doi.org/10.3390/ma13030545
Hakmeh N., Chlique Ch., Merdrignac-Conanec O., Fan B., Cheviré F., Zhang X., Fan X., Qiao X. Combustion Synthesis and Up-Conversion Luminescence of La2O2S:Er3+, Yb3+ Nanophosphors // J. Solid State Chem. 2015. V. 226. P. 255–261. https://doi.org/10.1016/j.jssc.2015.02.015
Yang Y., Mi C., Yu F., Su X., Guo C., Li G., Zhang J., Liu L., Liu Y., Li X. Optical Thermometry Based on the Upconversion Fluorescence from Yb3+/Er3+ Codoped La2O2S Phosphor // Ceram. Int. 2014. V. 40. № 7. P. 9875–9880. https://doi.org/10.1016/j.ceramint.2014.02.081
Som S., Mitra P., Kumar V., Kumar V., Terblans J.J., Swart H.C., Sharma S.K. The Energy Transfer Phenomena and Colour Tunability in Y2O2S:Eu3+/Dy3+ Micro-Fibers for White Emission in Solid State Lighting Applications // Dalton Trans. 2014. V. 43. P. 9860–9871. https://doi.org/10.1039 / C4DT00349G
Андреев П.О., Сальникова Е.И., Андреев О.В., Денисенко Ю.Г., Ковенский И.М. Синтез и спектры ап-конверсионной люминесценции твердых растворов (Y1 – x – yYbxEry)2O2S // Неорган. материалы. 2017. Т. 53. № 2. С. 185–191. https://doi.org/10.7868/S0002337X17020026
Kumar G.A., Pokhrel M., Martinez A., Dennis R.C., Villegas L.L., Sardar D.K. Synthesis and Spectroscopy of Color Tunable Y2O2S:Yb3+, Er3+ Phosphors with Intense Emission // J. Alloys Compd. 2012. V. 513. P. 559–565. https://doi.org/10.1016/j.jallcom.2011.11.006
Wang H., Xing M., Luo X.X., Zhou X., Fu Y., Jiang T., Peng Y., Ma Y., Duan X. Upconversion Emission Colour Modulation of Y2O2S: Yb, Er under 1.55 μm and 980 nm Excitation // J. Alloys Compd. 2014. V. 587. P. 344–348. https://doi.org/10.1016/j.jallcom.2013.10.163
Lu X., Yang M., Yang L., Ma Q., Dong X., Tian J. Y2O2S:Yb3+, Er3+ Nanofibers: Novel Fabrication Technique, Structure and Up-Conversion Luminescent Characteristics // J. Mater. Sci.-Mater. Electron. 2015. V. 26. P. 4078–4084. https://doi.org/10.1007/s10854-015-2947-x
Jiao J., Liu Y., Wang H., Yin X., Xing M., Luo X., Tian Y. Enhancing Upconversion Luminescence and Thermal Sensing Properties of Er/Yb Co-Doped Oxysulfide Core-Shell Nanocrystals // J. Am. Ceram. Soc. 2021. V. 104. № 2. P. 985–994. https://doi.org/10.1111/jace.17509
Ajithkumar G, Yoo B., Goral D.E., Hornsby P.J., Lin A.-L., Ladiwala U., Dravid V.P., Dhiraj K., Sardar D.K. Multimodal Bioimaging Using a Rare Carth Doped Gd2O2S:Yb/Er Phosphor with Upconversion Luminescence and Magnetic Resonance Properties // J. Mater. Chem. B. 2013. V. 1. P. 1561–1572. https://doi.org/10.1039/C3TB00551H
Sal’nikova E.I., Denisenko Yu. G., Kolesnikov I.E., Lahderanta E., Andreev O.V., Azarapin N.O., Basova S.A., Gubin A.A., Oreshonkov A.S. Synthesis and Luminescent Properties of (RE0.95Ln0.05)2O2S (RE = La, Y; Ln = = Ho, Tm) // J. Solid State Chem. 2021. V. 293. P. 121753. https://doi.org/10.1016/j.jssc.2020.121753
Sal’nikova E.I., Denisenko Yu.G., Aleksandrovsky A.S., Kolesnikov, I.E., Lahderanta E., Andreev P.O., Azarapin N.O., Andreev O.V., Basova S.A., Matigorov A.V. Synthesis and Optical Properties RE2O2S:Ln (RE = La, Y; Ln = Ce, Eu, Dy, Er) // J. Solid State Chem. 2019. V. 279. № 120964. https://doi.org/10.1016/j.jssc.2019.120964
Dai Q., Song H., Wang M., Bai X., Dong B., Qin R., Qu X., Zhang H. Size and Concentration Effects on the Photoluminescence of La2O2S:Eu3+ Nanocrystals // J. Phys. Chem. C. 2008. V. 112. № 49. P. 19399–19404. https://doi.org/10.1021/jp808343f
Krauss R.H., Hellier R.G., McDaniel J.C. Surface Temperature Imaging Below 300 K Using La2O2S:Eu // Appl. Opt. 1994. V. 33. № 18. P. 3901–3904. https://doi.org/10.1364/AO.33.003901
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы