Неорганические материалы, 2022, T. 58, № 8, стр. 924-928
Влияние добавки титана на коррозионно-электрохимические свойства алюминиевого сплава АБ1
И. Н. Ганиев 1, *, Н. О. Рахимова 2, М. З. Курбонова 2, Ф. С. Давлатзода 3, У. Ш. Якубов 1
1 Институт химии им. В.И. Никитина Национальной академии наук
Таджикистана
734063 Душанбе, ул. Айни, 299/2, Таджикистан
2 Таджикский национальный университет
734025 Душанбе, пр. Рудаки, 17, Таджикистан
3 Дангаринский государственный университет
735320 Данғара, ул. Маркази, 25, Таджикистан
* E-mail: ganievizatullo48@gmail.com
Поступила в редакцию 07.12.2021
После доработки 24.05.2022
Принята к публикации 06.06.2022
- EDN: WEJBFR
- DOI: 10.31857/S0002337X22080024
Аннотация
В статье потенциостатическим методом со скоростью развертки потенциала 2 мВ/с исследованы электрохимические свойства алюминиевого сплава АБ1 с титаном в среде электролита NaCl. Установлено, что легирование титаном до 1.0 мас. % повышает на 50% анодную устойчивость сплава АБ1 в среде электролита NaCl. При этом с ростом концентрации легирующего компонента увеличиваются потенциалы свободной коррозии, питтингообразования и репассивации сплавов. С увеличением концентрации хлорид-иона в электролите потенциалы свободной коррозии, питтингообразования и репасcивации сплавов уменьшаются, а скорость коррозии увеличивается.
ВВЕДЕНИЕ
Алюминий и его сплавы являются основным сырьем в авиационной и авиакосмической промышленностях и применяются в последнее время как композитные материалы [1–4].
Добавление незначительного количества титана к алюминию существенно улучшает механические свойства последнего: возрастает сопротивление разрыву и увеличивается предел упругости. Наилучшими механическими свойствами обладает алюминиевый сплав, содержащий 2% титана: сопротивление разрыву увеличивается в три раза по сравнению с сопротивлением алюминия, а эластичность приближается к эластичности пружинной бронзы. Но этот сплав очень неустойчив к кислороду воздуха. Введение более 2% титана повышает химическую стойкость алюминия, в частности, уменьшается его коррозия под напряжением. Электропроводность алюминия при легировании его титаном уменьшается. Титан улучшает также свариваемость алюминия [5–9].
Использование алюминиевых сплавов, легированных бериллием, магнием и титаном, относится к числу наиболее перспективных направлений.
Качество материала определяется его химическим составом и структурой [10–12].
Для оценки коррозионной стойкости металлов и сплавов может быть использована зависимость скорости растворения от потенциала. Измерить электродный потенциал металла (сплава) при пассивации и в пассивном состоянии можно потенциодинамическим методом [13–15].
Цель работы заключалась в исследовании влияния добавок титана на коррозионно-электрохимическое поведение алюминиевого сплава АБ1 (Al + 1 мас. % Be) в среде электролита NaCl.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследования был получен алюминиевый сплав АБ1 с содержанием титана 0.05, 0.1, 0.5 и 1.0 мас. %.
Из полученных сплавов в графитовой изложнице отливали стержни диаметром 8 и длиной 140 мм. Нерабочая часть образцов изолировалась смолой (смесь 50% канифоли и 50% парафина). Рабочей поверхностью служил торец электрода. Перед погружением образца в раствор электролита NaCl его торцевую часть зачищали наждачной бумагой, полировали, обезжиривали, тщательно промывали спиртом. Температура раствора в ячейке поддерживалась постоянной (20°С) с помощью термостата МЛШ-8.
Электрохимические исследования сплава АБ1 с титаном проводились на импульсном потенциостате ПИ-50-1.1 в потенциодинамическом режиме со скоростью развертки потенциала 2 мВ/с, с использованием программатора ПР-8 и самописца ЛКД-4 по методикам, описанным в работах [16, 17]. В работе использовалась трехэлектродная электрохимическая ячейка, которая позволяет изучать зависимость скорости процесса растворения (величины тока) от потенциала только на одном из электродов, который называется рабочим. Электродом сравнения служил хлорсеребряный электрод, вспомогательным – платиновый.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полная поляризационная (2 мВ/с) кривая алюминиевого сплава АБ1 с 1.0 мас. % Ti в среде электролита (3.0%-ный NaCl) представлена на рис. 1 . Сначала образцы поляризовали в положительном направлении от потенциала, установившегося при погружении, до резкого возрастания тока в результате питтингообразования (рис. 1 , кривая І). По пересечению кривых І и ІІ определяли величину потенциала репассивации, для чего образцы поляризовали в обратном направлении. Для удаления оксидных пленок с поверхности электрода (рис. 1 , кривая ІІІ), образовавшихся в результате подщелачивания, переходили в катодную область до значения потенциала –1.200 В. Из анодных кривых определяли основные электрохимические параметры процесса коррозии образцов в результате их поляризации в положительном направлении (рис. 1 , кривая ІV).
Рис. 1.
Полная поляризационная (2 мВ/с) кривая алюминиевого сплава АБ1 с 1 мас. % Ti в среде электролита (3.0%-ный NaCl): Есв.кор – потенциал свободной коррозии, Еп – потенциал питтингообразования, Ереп – потенциал репассивации.
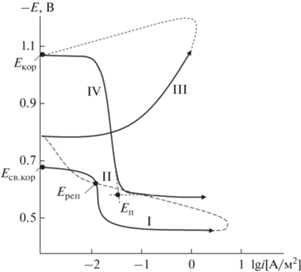
Путем сопоставления значений потенциала свободной коррозии (Есв.кор) и потенциала питтингообразования (Еп) в одних и тех же условиях может быть осуществлена оценка стойкости сплавов к питтинговой коррозии [18–20].
Расчет тока коррозии как основной электрохимической характеристики процесса коррозии проводили по катодной кривой с учетом углового коэффициента bk = 0.12 В, поскольку в нейтральных средах процесс питтинговой коррозии алюминия и его сплавов контролируется катодной реакцией ионизации кислорода. Скорость коррозии (K) определялась по формуле:
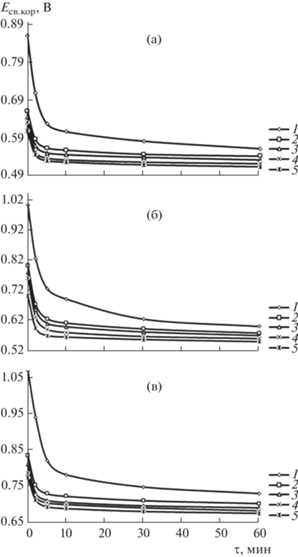
где k – электрохимический эквивалент, численное значение которого для алюминия составляет 0.335 г/А ч.Влияние концентрации коррозионно-активного хлорид-иона в электролите NaCl на коррозионную стойкость сплавов изучено при 10-кратном (0.3%) и 100-кратном (0.03%) ее уменьшении. Образцы выдерживали до достижения постоянного потенциала в электролите перед началом электрохимических измерений. На основании зависимости потенциала от времени устанавливали значения потенциала свободной коррозии. Временны́е зависимости потенциала свободной коррозии алюминиевого сплава АБ1, легированного титаном, в различных средах электролита NaCl приведены на рис. 2 . Видно, что в течение первого часа выдержки в электролите электродные потенциалы исследуемых сплавов становятся постоянными. Значения электродных потенциалов не меняются и при более длительной выдержке (1–3 сут). Как для исходного сплава АБ1, так и для сплавов, легированных титаном, характерно смещение потенциала свободной коррозии во времени. Сплавы подвергались поляризации после установления стационарного потенциала.
Рис. 2.
Временные зависимости потенциала свободной коррозии сплава AБ1 (1), содержащего 0.05 (2), 0.1 (3), 0.5 (4), 1.0 мас. % Ti (5), в среде электролита 0.03 (а), 0.3 (б) и 3.0%-ного NaCl (в).
Таким образом, коррозионную стойкость сплавов оценивали по полным потенциодинамическим кривым, рассчитывая потенциалы коррозии (–Екор), питтингообразования (–Еп) и репассивации (–Ереп) (табл. 1).
Таблица 1.
Коррозионно-электрохимические характеристики алюминиевого сплава АБ1 с титаном в среде электролита NaCl
| NaCl, мас. % | Содержание титана, мас. % | –Есв.кор, В | –Екор, В | –Еп, В | –Ереп, В | iкор × 102, А/м2 | K × 103, г/(м2 ч) |
|---|---|---|---|---|---|---|---|
| 0.03 | 0.0 | 0.560 | 1.010 | 0.490 | 0.540 | 0.031 | 10.38 |
| 0.05 | 0.540 | 0.980 | 0.450 | 0.510 | 0.026 | 8.71 | |
| 0.1 | 0.530 | 0.965 | 0.442 | 0.500 | 0.024 | 8.04 | |
| 0.5 | 0.520 | 0.950 | 0.430 | 0.490 | 0.022 | 7.37 | |
| 1.0 | 0.512 | 0.935 | 0.420 | 0.480 | 0.020 | 6.70 | |
| 0.3 | 0.0 | 0.600 | 1.114 | 0.560 | 0.580 | 0.036 | 12.06 |
| 0.05 | 0.578 | 1.080 | 0.530 | 0.548 | 0.032 | 10.72 | |
| 0.1 | 0.570 | 1.068 | 0.515 | 0.632 | 0.030 | 10.05 | |
| 0.5 | 0.560 | 1.055 | 0.500 | 0.516 | 0.028 | 9.38 | |
| 1.0 | 0.550 | 1.040 | 0.490 | 0.501 | 0.026 | 8.71 | |
| 3.0 | 0.0 | 0.728 | 1.160 | 0.670 | 0.700 | 0.042 | 14.07 |
| 0.05 | 0.700 | 1.126 | 0.600 | 0.645 | 0.037 | 12.39 | |
| 0.1 | 0.688 | 1.110 | 0.588 | 0.634 | 0.035 | 11.72 | |
| 0.5 | 0.680 | 1.095 | 0.576 | 0.622 | 0.033 | 11.05 | |
| 1.0 | 0.673 | 1.080 | 0.570 | 0.610 | 0.031 | 10.38 |
Потенциодинамические анодные поляризационные (2 мВ/с) кривые сплава АБ1, содержащего титан, в среде 0.03, 0.3 и 3.0%-ного NaCl приведены на рис. 3 . Видно, что добавки титана способствуют увеличению потенциала питтингообразования сплавов во всех исследованных средах. Наибольший рост электрохимических потенциалов наблюдается при добавках 0.05–1.0 мас. % титана, что способствует снижению скорости анодной коррозии.
Рис. 3.
Потенциодинамические анодные поляризационные (2 мВ/с) кривые алюминиевого сплава АБ1 (1), содержащего 0.05 (2), 0.1 (3), 0.5 (4), 1.0 мас. % Ti (5), в среде электролита 0.03 (а), 0.3 (б) и 3.0%-ного NaCl (в).
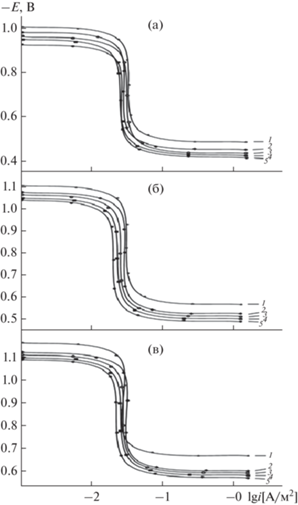
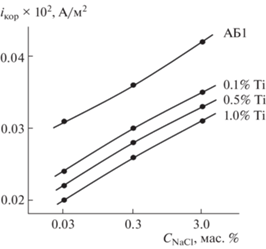
По мере увеличения концентрации хлорид-иона в электролите скорость коррозии сплавов увеличивается (табл. 1). Для исходного сплава АБ1 при переходе от электролита с концентрацией 0.03% к 0.3%- и 3.0%-ному NaCl Еп увеличивается соответственно от –0.490 до –0.560 и –0.670 В. Аналогичным образом изменяются потенциалы свободной коррозии (стационарный потенциал) и коррозии. Увеличение концентрации хлорид-иона способствует росту питтинговой коррозии сплавов, о чем свидетельствует скорость анодной коррозии сплавов. Из табл. 1 видно, что скорость коррозии исходного сплава в среде 0.03%-ного NaCl составляет 0.031 × 10–2 А/м2 и изменяется до 0.020 × 10–2 А/м2 при легировании 1.0 мас. % Ti, а в среде 0.3%-ного NaCl – от 0.036 × 10–2 до 0.026 × × 10–2 А/м2, в среде 3.0%-ного NaCl – от 0.042 × × 10–2 до 0.031 × 10–2 А/м2.
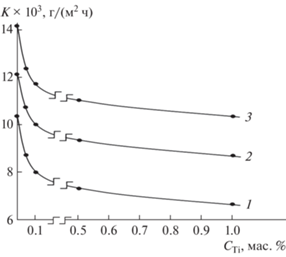
Скорость коррозии сплавов, содержащих 0.05–1.0% титана, почти на 30% меньше, чем у исходного сплава (табл. 1). Добавки титана к сплаву АБ1 способствуют снижению скорости анодной коррозии, при этом по мере увеличения концентрации электролита NaCl скорость коррозии сплавов увеличивается независимо от содержания легирующего компонента. Минимальными значениями плотности тока коррозии и скорости коррозии характеризуется сплав АБ1, содержащий 1.0 мас. % титана (рис. 4 и 5 ).
ЗАКЛЮЧЕНИЕ
Установлено, что легирование титаном до 1.0 мас. % алюминиевого сплава АБ1 повышает на 30% его анодную устойчивость в среде электролита NaCl. При этом с ростом концентрации титана отмечается рост потенциалов свободной коррозии, питтингообразования и репассивации сплавов. С увеличением концентрации хлорид-иона в электролите потенциалы свободной коррозии, питтингообразования и репасcивации сплавов уменьшаются, а скорость коррозии увеличивается.
Список литературы
Белецкий В.М., Кривов Г.А. Алюминиевые сплавы (Состав, свойства, технология, применение). Справочник / Под ред. И.Н. Фридляндера. К.: КОМИТЕХ. 2005. 365 с.
Molchanova L.V., Ilyushin V.N. Alloying of Aluminum-Beryllium Alloys // Rus. Metall. (Met.). 2013. P. 71–73.
Zhang X.D., Grensing F.C., Meisenkothen F., Wiezorek J.M.K., Meyrick G., Fraser H.L. Microstructural Characterization of Novel in-situ Al–Be Composites // Metall. Mater. Trans. A. 2012. V. 31. № 11. P. 2963–2971.
Курбонова М.З., Ганиев И.Н., Эшов Б.Б. Коррозия алюминиево-бериллиевых сплавов с щелочноземельными металлами. Берлин: LAP LAMBERT, 2012. 87 с.
Ryohei M. Recent Developments for Aluminum–Air Batteries // Electrochem. Energy Rev. 2020. V. 3. P. 344–369.
Manel B., Abdelbaki B., Ahmed H., Sarah Y. The Effect of Inhibiting Molybdate Used in Anodizing-Conversion Treatment to Improve Corrosion Protection of AA2030 Aluminum Alloy in Different Steps // J. Eng. App. Sci. 2022. V. 69. № 40. P. 2–17.
Jianping L., Xingyu B., Yong H., Junying M., Xinlei Q., Zhimin T., Jiajie Ch. Investigation on Yield Behavior of 7075-T6 Aluminum Alloy at Elevated Temperatures // Chin. J. Mech. Eng. 2020. V. 33. № 76. P. 2–12.
Sharma G.V.S.S., Srinivasa P.R., Surendra B.B. Process Capability Improvement through DMAIC for Aluminum Alloy Wheel Machining // J. Ind. Eng. Int. 2018. V. 14. № 220. P. 213–226.
Anna M.B., Marcus V.A., Julia R., Matthias S., Björn M., Georg R., Thomas T., Sebastian B. Does Galvanic Cathodic Protection by Aluminum Anodes Impact Marine Organisms // Environ. Sci. Eur. 2020. V. 32. № 157. P. 1–11.
Вол А.Е. Строение и свойства двойных металлических систем. Т. 1. М.: Физматгиз, 1959. 755 с.
Луц А.Р., Суслина А.А. Алюминий и его сплавы. Самара: Самарский гос. техн. ун-т, 2013. 81 с.
Мальцева Т.В., Озерец Н.Н., Левина А.В., Ишина Е.А. Цветные металлы и сплавы. Екатеринбург: Изд-во УрФУ, 2019. 176 с.
Томашов Н.Д., Чернова Г.П. Теория коррозии и коррозионностойкие конструкционные сплавы. М.: Металлургия, 1986. 359 с.
Дасоян М.А., Пальмская И.Я., Сахарова Е.В. Технология электрохимических покрытий. Л.: Машиностроение, 1989. 391 с.
Фрейман Л.И., Макаров В.А., Брыксин И.Е. Потенциостатические методы в коррозионных исследованиях и электрохимической защите / Под ред. Колотыркина Я.М. Л.: Химия, 1972. 240 с.
Ганиев И.Н., Додхоев Э.С., Якубов У.Ш. Коррозионно-электрохимическое поведение сплавов системы Mg–La в среде электролита NaCl // Вестн. Казанского гос. техн. ун-та им А.Н. Туполева. 2021. Т. 77. № 1. С. 19–23.
Ганиев И.Н., Додхоев Э.С., Сафаров А.Г., Якубов У.Ш. Анодное поведение сплавов системы Mg–Ce в среде электролита NaCl // Вестн. Пермского нац. исслед. политехн. ун-та. Машиностроение, материаловедение. 2021. Т. 23. № 1. С. 13–19.
Бокиев Л.А., Ганиев И.Н., Ганиева Н.И., Хакимов А.Х., Якубов У.Ш. Влияние лития на коррозионно-электрохимическое поведение алюминиевого сплава АЖ5К10 в среде электролита NaCl // Вестн. Тверского гос. ун-та. Серия: Химия. 2019. № 3 (37). С. 79–89.
Ганиев И.Н., Рашидов А.Р., Алиев Ф.А., Холов Ё.Ч., Абдулаков А.П. Электрохимическая коррозия проводникового алюминия, легированного медью, в среде электролита NaCl // Вестн. Казанского технологического ун-та. 2019. Т. 22. № 9. С. 56–60.
Ганиев И.Н., Бокиев Л.А., Хакимов А.Х., Саидзода Р.Х. Анодное поведение алюминиевого сплава АЖ5К10 с церием в среде электролита NaCl // Вестн. Санкт-Петербургского гос. ун-та технологии и дизайна. Серия Естественные и технические науки. 2019. № 4. С. 73–78.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы