Неорганические материалы, 2022, T. 58, № 8, стр. 829-835
Восстановление оксидных соединений тантала парами магния в интервале 540–680°С
В. М. Орлов 1, *, Е. Н. Киселев 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева – обособленное подразделение Федерального исследовательского центра “Кольский научный центр Российской академии наук”
184209 Мурманская обл., Апатиты, Академгородок, 26А, Россия
* E-mail: v.orlov@ksc.ru
Поступила в редакцию 02.03.2022
После доработки 23.03.2022
Принята к публикации 24.03.2022
- EDN: FJKRST
- DOI: 10.31857/S0002337X22080097
Аннотация
Исследованы характеристики и особенности образования пористой структуры порошков, полученных восстановлением Та2О5 и Mg4Ta2O9 парами магния в интервале 540–680°С. Показано, что снижение температуры восстановления позволяет в значительной степени предотвратить огрубление первичной структуры восстановленной частицы оксида и тем самым увеличить объем пор диаметром менее 5 нм. Это позволило восстановлением Та2О5 при температуре 540°С получить порошок тантала с удельной поверхностью 59 м2/г. При восстановлении Mg4Ta2O9 в этих условиях удельная поверхность порошка со снижением температуры восстановления уменьшается вследствие полного заполнения большинства пор естественным оксидом Та2О5.
ВВЕДЕНИЕ
Благодаря сочетанию уникальных свойств металлический тантал нашел применение в таких отраслях техники, как производство сплавов для аэрокосмической промышленности, теплообменников, используемых в агрессивных средах; биомедицина и, особенно, современная электроника. Танталовые конденсаторы, отличающиеся надежностью, высоким удельным зарядом и малыми токами утечки, являются неотъемлемой частью современной радиоэлектронной аппаратуры (РЭА) [1, 2]. В качестве порошков на их производство используется до 34% производимого металлического тантала [3].
Тенденция к миниатюризации РЭА требует постоянного совершенствования методов получения танталовых порошков с развитой поверхностью [4]. Наиболее широкомасштабным способом получения таких порошков является натриетермическое восстановление гептафторотанталата калия (K2TaF7) в расплаве, содержащем в качестве разбавителя галогениды щелочного металла [5–11]. Совершенствование условий восстановления позволило увеличить удельную поверхность получаемых порошков с 0.3–0.8 [5] до 3.2–5 м2/г [9, 10] и даже 12 м2/г [11]. Еще большей удельной поверхностью обладают порошки, получаемые восстановлением пентахлорида тантала (TaCl5) [12–14]. Восстановлением паров пентахлорида тантала натрием в пламенном реакторе получен порошок металла с размером частиц 30 нм [12]. При этом образующийся порошок тантала заключен в оболочку из NaCl, которая предохраняет его от взаимодействия с воздухом. Восстановлением паров TaCl5 водородом в струйном реакторе получен порошок с размером частиц 14–56 нм [13], а при восстановлении в низкотемпературной плазме удельная поверхность порошка тантала достигала 30 м2/г [14]. Однако способы получения порошков тантала с большой удельной поверхностью восстановлением пентахлорида тантала не нашли промышленного применения из-за неустойчивости TaCl5 на воздухе и ограниченных масштабов переработки танталового сырья хлорированием.
Более перспективно получение наноразмерных порошков тантала, используемых в производстве конденсаторов, восстановлением пентаоксида магнием. Реакция
сопровождается большим тепловыделением (1701 кДж на кг шихты). Ее адиабатическая температура составляет 2320°С [15]. Поэтому восстановление ведут либо в режиме самораспространяющегося высокотемпературного синтеза (СВС) [16–19], либо парами магния [20–28].При ведении процесса магниетермического восстановления в режиме СВС параметры процесса регулируют введением теплового балласта, которым могут служить нейтральный флюс (NaCl) [16, 17] или избыток восстановителя [18, 19]. Увеличение мольного отношения NaCl : Та2О5 в шихте с 3 до 6 привело к увеличению удельной поверхности порошка тантала с 2.4 до 13.2 м2/г. Размер частиц порошка уменьшился с 100–300 до 20–50 нм [16]. При четырехкратном избытке магния в шихте был получен нанопорошок тантала с размером частиц менее 50 нм и удельной поверхностью 31.47 м2/г [18, 19].
В процессе, когда восстановление ведется парами магния, характеристики получаемого порошка контролируются температурой и давлением аргона в реакторе. Так, при атмосферном давлении аргона в реакторе, по данным [20], снижение температуры с 1000 до 900°С привело к увеличению удельной поверхности порошка тантала с 3.7 до 7 м2/г. В работе [25] при повышении температуры восстановления с 850 до 950°С удельная поверхность порошка тантала изменилась также практически в 2 раза: с 12.23 до 6.52 м2/г. Аналогичным образом сказывается и изменение давления аргона в реакторе. В процессе восстановления Та2О5 при 800°С увеличение остаточного давления в реакторе с 10 Па до 10 кПа привело к росту удельной поверхности порошка тантала с 5.2 до 10 м2/г [24]. Эти данные говорят о том, что скорость поступления паров магния в зону реакции является одним из основных факторов, влияющих на характеристики получаемого порошка тантала.
Авторы [27, 28] для получения порошка с особыми характеристиками использовали в качестве прекурсора прессовки, полученные спеканием смеси пентаоксида тантала (средний размер частиц 0.2–0.3 мм) с CaCl2. Авторы отмечают кораллоподобный вид частиц и их укрупнение с ростом температуры от 700 до 1000°С [27]. Для снижения скорости испарения магния при температуре 1000°С в следующей работе они использовали сплавы Mg–Ag с содержанием Ag 25, 50 и 75 мол. % [28]. По сравнению с чистым магнием упругость его паров снизилась в 2, 6 и 50 раз соответственно, а средний размер частиц уменьшился с 1 мм до 0.5, 0.2 и 0.1 мм.
Полученные в рассмотренных работах зависимости параметров порошков тантала от условий восстановления Та2О5 парами магния обусловлены особенностями структуры восстановленной частицы [29]. Авторы [29] с помощью электронной микроскопии высокого разрешения исследовали сечение частицы пентаоксида тантала размером 30 мкм после восстановления в течение 0.5 ч при температуре 950°С и атмосферном давлении аргона в реакторе. Они показали, что на фронте реакции образуется тонкодисперсная полосчатая структура, состоящая из прожилок оксида магния и металлического тантала толщиной около 30 и 10 нм соответственно. Магний по микротрещинам и зазорам между прослойками MgO и Ta проникает в объем частицы пентаоксида вслед за фронтом реакции. Таким образом процесс восстановления происходит во всем объеме частицы. В дальнейшем вследствие процессов диффузии при высокой температуре структура существенно огрубляется. При таком механизме восстановления после выщелачивания оксида магния растворами минеральных кислот остается нанопористый металлический каркас, по форме и внешним размерам во многом соответствующий исходной частице пентаоксида. Удельная поверхность порошка в этом случае определяется в основном поверхностью образовавшихся внутренних пор.
Увеличение количества прослоек оксида магния в случае использования в качестве прекурсора танталата Mg4Ta2O9, приводит к многократному увеличению удельной поверхности порошка тантала. Удельная поверхность порошков, полученных восстановлением Та2О5 и Mg4Ta2O9 в течение 4 ч при температуре 830°С и остаточном давлении аргона в реакторе 10 кПа, составила 10 и 51 м2/г соответственно [24]. Мезопористая структура порошков подтверждена в работе [30], в которой восстановлением Mg4Ta2O9 получен порошок тантала с удельной поверхностью 85 м2/г.
В настоящей работе исследована перспектива увеличения удельной поверхности порошков тантала в процессе восстановления Та2О5 и Mg4Ta2O9 парами магния при минимальных возможных температурах. Это позволяет в большей степени сохранить первичную структуру восстановленной частицы оксида.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактором для восстановления служила реторта из нержавеющей стали внутренним диаметром 100 мм с рубашкой водяного охлаждения вакуумного уплотнения и крышкой, имеющей патрубки для ввода термопары и подсоединения вакуумной системы, внутри которой размещали реакционный стакан с плотно закрывающейся крышкой (рис. 1). В крышке реакционного стакана имелось отверстие для ввода чехла термопары с минимальным зазором между ними. Конструкция крышки позволяла извлекать термопару из реакционного стакана и вновь опускать без разгерметизации реактора. Контейнер с магнием устанавливали на дно реакционного стакана, выше (через 5 мм) размещали контейнер с восстанавливаемым материалом. Для измерения температуры использовали хромель-алюмелевую термопару, подключeнную к прибору ТЕРМОДАТ-13К5. После сборки реактор устанавливали в шахтную печь электросопротивления СШОЛ-1.1.16 мощностью 2.5 кВт, вакуумировали форвакуумным насосом 2НВР-5ДМ и нагревали до температуры 200–250°С для дегазации загрузки и рабочего объема. После дегазации реторту заполняли аргоном до давления 110 кПа и продолжали нагревать до требуемой температуры (540–680°С). Затем реактор вакуумировали при открытом отверстии крышки реакционного стакана, термопару опускали в реакционный стакан до уровня загрузки оксида и проводили выдержку в течение заданного времени при постоянном вакуумировании. После завершения выдержки реактор заполняли аргоном и охлаждали до комнатной температуры, после чего вакуумировали и дозировано заполняли воздухом до атмосферного давления для пассивации образовавшегося порошка тантала. Обработку продуктов реакции проводили 15%-ным раствором HNO3 при перемешивании верхнеприводной мешалкой в течение 1 ч. Операцию повторяли, затем порошок отмывали дистиллированной водой до нейтральной реакции и сушили на воздухе при 85°С.
Рис. 1.
Схема установки восстановления: 1 – реторта-реактор, 2 – крышка реторты, 3 – патрубок для вакуумирования и заполнения аргоном, 4 – вакуумное уплотнение, 5 – термопара с чехлом, 6 – регулятор температуры ТЕРМОДАТ-13К5, 7 – реакционный стакан, 8 – крышка реакционного стакана, 9 – контейнер с восстанавливаемым материалом, 10 – контейнер с магнием.
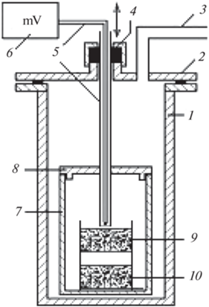
В качестве исходных материалов использовали пентаоксид тантала марки А производства ОАО “Соликамский магниевый завод”, термообработанный при температуре 1200–1300°С, магний металлический марки Мг 95 (ГОСТ 804-93), а также танталат магния Mg4Та2O9, синтезированный спеканием пентаоксида тантала со стехиометрическим количеством оксида магния квалификации “ч. д. а.” при температуре 1300°С [24]. Масса разовой загрузки восстанавливаемого Та2О5 составляла 6.5 г, толщина слоя 7 мм, Mg4Та2O9 – 4 г и 2 мм, что позволяло свести к минимуму разброс характеристик порошка по высоте слоя.
Удельную поверхность порошков измеряли адсорбционным статическим методом БЭТ, а параметры пористости – методом BJH на приборе Micromeritics TriStar II 3020. ДСК–ТГ-кривые порошков снимали методом синхронного термического анализа, прибор NETZSCH STA 409 PC Luxx, скорость нагрева 10°С/мин, атмосфера – воздух, расход 100 мл/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для восстановления 6.5 г Та2О5 или 4 г Mg4Та2O9 требуется соответственно 1.8 и 0.8 г магния. Рассчитанная по уменьшению массы магния в ходе экспериментов скорость его испарения составила около 0.09 и 0.04 г/мин при 680 и 550°С соответственно. Упругость паров магния при этих температурах отличается в 15 раз (4.5 и 0.3 мм рт. ст.), и незначительная разница в скоростях испарения объясняется тем, что восстановление ведется в замкнутом объеме, а потери магния через неплотности между крышкой и реакционным стаканом незначительны.
Снижение температуры восстановления пентаоксида тантала до 680°С, как и ожидалось, привело к существенному росту удельной поверхности порошка, которая составила 35.3 м2/г. Для сравнения, при восстановлении Ta2O5 в используемом нами оптимальном высокотемпературном режиме (830°С, остаточное давление аргона 10 кПа) были получены порошки тантала с удельной поверхностью всего 13 м2/г [30]. При дальнейшем снижении температуры удельная поверхность порошков тантала продолжала расти (рис. 2а).
Рис. 2.
Зависимости удельной поверхности порошков тантала от температуры восстановления, прекурсор: Та2О5 (а), Mg4Та2O9 (б).
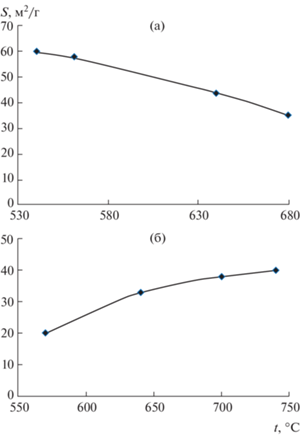
Совсем другая картина наблюдается при восстановлении танталата магния. Уже при температуре восстановления 680°С удельная поверхность порошков была в 2 раза меньше, чем у полученных восстановлением танталата в оптимальном высокотемпературном режиме [30] и продолжала уменьшаться с понижением температуры (рис. 2б). Такую аномалию в поведении измеренной удельной поверхности порошков можно объяснить одновременным влиянием двух факторов: изменением образующейся после выщелачивания прослоек оксида магния пористой структуры частиц и присутствием на поверхности металла пленки естественного оксида Ta2O5 [31].
В случае восстановления при температуре 830°С, остаточном давлении аргона в реакторе 5 кПа и использовании в качестве прекурсора Mg4Та2O9 удельная поверхность порошков была в 5 раз больше, чем у полученных из Ta2O5, за счет увеличения количества мезопор диаметром менее 10 нм и, особенно, менее 5 нм [30]. Снижение температуры восстановления не только уменьшает концентрацию магния в его парáх, но и замедляет диффузионные процессы. Это позволяет в большей степени сохранить первичную структуру восстановленной частички оксидного соединения. Следствием более тонкой полосчатой структуры с меньшей толщиной прослоек Та и MgO должно быть увеличение количества мезопор меньших размеров, образовавшихся после выщелачивания MgO, и, соответственно, рост удельной поверхности порошка. Это мы и наблюдаем при восстановлении пентаоксида тантала (рис. 2а). Данные о пористой структуре порошков в зависимости от температуры восстановления приведены в табл. 1, где dср – средний диаметр пор, V – объем пор, V1 – объем пор с диаметром >10 нм, V2 – объем пор с диаметром <5 нм. В порошках, полученных восстановлением пентаоксида тантала, с уменьшением температуры процесса общий объем пор снизился незначительно. При этом в 3 раза увеличился объем пор диаметром менее 5 нм, результатом чего является увеличение удельной поверхности порошка. Что касается порошков, полученных восстановлением танталата магния, то общий объем пор уменьшился в 5 раз, а объем пор менее 5 нм практически не изменился.
Таблица 1.
Зависимость удельной поверхности и пористой структуры порошков от температуры восстановления
| Прекурсор | t, °С |
S, м2/г |
dср, нм | Объем пор | ||||
|---|---|---|---|---|---|---|---|---|
| V, см3/г |
V1 (>10 нм) | V2 (<5 нм) | ||||||
| см3/г | % | см3/г | % | |||||
| Ta2O5 | 680 | 35.3 | 12.10 | 0.113 | 0.090 | 81 | 0.008 | 8 |
| 640 | 43.7 | 10.31 | 0.116 | 0.081 | 69 | 0.013 | 11 | |
| 560 | 57.4 | 6.09 | 0.087 | 0.028 | 32 | 0.023 | 26 | |
| 540 | 59.4 | 5.92 | 0.087 | 0.028 | 32 | 0.026 | 30 | |
| Mg4Ta2O9 | 680 | 43 | 9.77 | 0.101 | 0.067 | 66 | 0.012 | 12 |
| 640 | 38.8 | 5.90 | 0.051 | 0.015 | 29 | 0.015 | 29 | |
| 600 | 24.4 | 7.22 | 0.037 | 0.019 | 51 | 0.008 | 22 | |
| 570 | 21.7 | 4.63 | 0.020 | 0.007 | 32 | 0.011 | 53 | |
Следует учесть, что часть объема пор, образовавшихся после выщелачивания оксида магния, занимает естественная оксидная пленка на поверхности металла, тем самым уменьшая их объем. Количество естественного оксида можно рассчитать по массы порошков после окисления на воздухе. Результаты термического анализа порошков, полученных восстановлением Та2О5 при температуре 540°С и Mg4Ta2O9 при температуре 680°С (удельная поверхность 59 и 28 м2/г соответственно), приведены на рис. 3.
Рис. 3.
ДСК- и ТГ-кривые порошков, полученных восстановлением Та2О5 (а), Mg4Ta2O9 (б); температура восстановления 540 (а), 680°С (б).
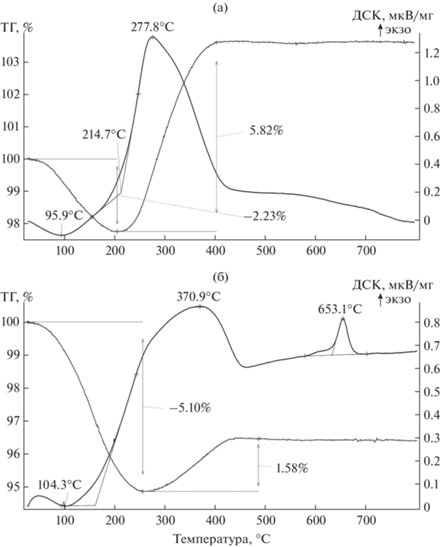
Убыль массы на первом этапе нагрева, наблюдавшаяся до температуры 200–260°С, связана с удалением сорбированной влаги. Ее испарению соответствуют эндопики на кривых ДСК. Последующее увеличение массы образцов обусловлено окислением металлической части порошка. При этом, судя по температуре и форме экзопиков на кривых ДСК, у порошков, полученных восстановлением Та2О5, процесс окисления протекает быстрее и при более низкой температуре (277.8°С). При окислении порошка, полученного восстановлением Mg4Ta2O9, соответствующий пик наблюдается при температуре 370.9°С. Возможно, это следствие затрудненной диффузии молекул кислорода к поверхности металла из-за малого размера пор в порошке или их заполнения естественным оксидом. Данные термогравиметрии коррелируют с результатами работы [13], в соответствии с которыми окисление нанодисперсного порошка тантала начиналось при 200°С и полностью заканчивалось при 400°С.
Рассчитанное по изменению массы образцов содержание в порошках металлического тантала, поверхностного оксида и кислорода приведено в табл. 2.
Таблица 2.
Состав порошков, рассчитанный на основании данных термического анализа
| Порошок | Прекурсор | t, °С |
S, м2/г |
Содержание, мас. % | ||
|---|---|---|---|---|---|---|
| Ta | Ta2O5 | O | ||||
| 1 | Та2О5 | 830 | 10 | 81.3 | 18.7 | 3.4 |
| 2 | 540 | 59 | 26.3 | 73.7 | 13.3 | |
| 3 | Mg4Ta2O9 | 830 | 53 | 31.2 | 68.8 | 12.5 |
| 4 | 830 | 75 | 25.5 | 74.5 | 13.7 | |
| 5 | 680 | 28 | 7.1 | 92.9 | 16.8 | |
Эти данные подтверждают, что причиной уменьшения поверхности порошков тантала, полученных восстановлением танталата Mg4Ta2O9 со снижением температуры процесса от 680 до 570°С, являются изменения в пористой структуре восстановленных частиц оксида. С уменьшением температуры восстановления снижается концентрация магния в парах. Соответственно, уменьшается локальная температура в зоне реакции восстановления, что в сочетании с замедлением диффузионных процессов, протекающих после прохождения фронта реакции, приводит к образованию более тонкой полосчатой структуры перемежающихся слоев оксида магния и металла. Такой структуре должен соответствовать рост удельной поверхности порошка. Действительно, увеличение содержания поверхностного оксида с 74.5 до 92.9% при снижении температуры восстановления Mg4Ta2O9 с 830 до 680°С отвечает увеличению удельной поверхности металлической фазы в продукте восстановления. Одновременно со снижением температуры уменьшается размер пор, образовавшихся после выщелачивания оксида магния. Размеры пор уменьшаются настолько, что большинство их заполнено естественным оксидом. В результате уменьшается измеренная удельная поверхность.
Порошки, полученные восстановлением Та2О5, характеризуются в целом более крупнопористой структурой. Снижение температуры восстановления привело к увеличению количества пор меньших, но не достигших критического размеров и, соответственно, к значительному росту удельной поверхности. Пористая структура такого порошка идентична структуре порошка, полученного восстановлением Mg4Ta2O9 при 830°С. Об этом свидетельствует соотношение между удельной поверхностью и содержанием оксидной фазы в порошках. В порошке, полученном восстановлением Та2О5 при температуре 540°С, с удельной поверхностью 59 м2/г содержание естественного оксида составило 73.7% (порошок 2, табл. 2). Эти параметры соответствуют порошкам, полученным восстановлением Mg4Ta2O9 при температуре 830°С (порошки 3 и 4, табл. 2), с удельной поверхностью 53 и 75 м2/г, содержание естественного оксида в них составило 68.8 и 74.5% соответственно [30]. В то же время пористая структура порошка, полученного восстановлением Mg4Ta2O9, такова, что подавляющее количество пор заполнено естественным оксидом Та2О5. Его содержание достигает 93 мас. %, а объем свободных пор уменьшился до 0.04 см3/г.
ЗАКЛЮЧЕНИЕ
Исследован процесс восстановления оксидных соединений тантала парами магния в интервале 540–680°С. Проанализированы изменения в пористой структуре полученных порошков.
Замедление диффузионных процессов, обусловленное снижением температуры восстановления, приводит к образованию более тонкой полосчатой структуры восстановленной частицы оксида. Это выражается в увеличении количества и объема пор, размеры которых менее 5 нм. В соответствии с этим должна увеличиться удельная поверхность порошков тантала. Восстановлением Ta2O5 при температуре 540°С получен порошок тантала с удельной поверхностью 59 м2/г, которая в 4–5 раз превышает удельную поверхность порошков, полученных ранее при температуре 800–830°С [24, 30].
С другой стороны, при восстановлении танталата Mg4Ta2O9 образуется настолько тонкая полосчатая структура, что большинство образовавшихся после выщелачивания оксида магния пор целиком заполняется слоем естественного оксида Ta2O5, растущего на поверхности металла. При этом значительная часть металла уходит на образование этого оксида. Количество пор таких размеров со снижением температуры восстановления увеличивается, а удельная поверхность порошков уменьшается.
Список литературы
Zednicek T. Tantalum Capacitors: Current Trends and Potentials Future // T.I.C. Bull. 2019. № 176. P. 15–21.
Freeman Y. Tantalum and Niobium-Based Capacitors. Science, Technology, and Applications. N.Y.: Springer, 2018. 120 p. https://doi.org/10.1007/978-3-319-67870-2_2
Stratton P., Anderson J., Baylis R. The Changing Face of Tantalum // T.I.C. Bull. 2018. № 172. P. 16–21.
Millman W., Huntington D. Tantalum Capacitors Bring Micro-Miniaturisation to Electronic Devices // Proc. CARTS Asia. Taipei 2006. P. 9–18.
Bergman R.M., Mosheim Ch.E. Tantalum Powder Process: US Patent. 4684399. 1987.
Purushotham Y., Balaji T., Kumar A. et al. Chemical and Physical Properties of Tantalum Powder // Mod. Phis Lett. B. 2001. V. 15. № 20. P. 867–871. https://doi.org/10.1142/S0217984901002622
Cho S.W., Shim G., Park J.S. et al. Making of Tantalum Powder Using the Hunter Process // Met. Mater. Int. 2006. V. 12. № 1. P. 51–56. https://doi.org/10.1007/BF03027523
Орлов В.М., Колосов В.Н., Прохорова Т.Ю. и др. Получение танталовых конденсаторных порошков с высокоразвитой поверхностью // Хим. технология. 2007. Т. 8. № 2. С. 62–65.
Орлов В.М., Колосов В.Н., Прохорова Т.Ю., Мирошниченко М.Н. Исследования по технологии высокоемких танталовых конденсаторных порошков // Цв. металлы. 2011. № 11. С. 30–35.
Колосов В.Н., Орлов В.М., Мирошниченко М.Н., Прохорова Т.Ю. Получение высокочистых порошков тантала натриетермическим методом // Неорган. материалы. 2012. Т. 48. № 9. С. 1023–1027.
Небера А.Л., Лизунов А.В., Семенов А.А. Танталовые порошки с нанокристаллической структурой: получение, свойства, перспективы использования // Композиты и наноструктуры. 2015. Т. 7. № 3. С. 121–126.
Barr J.L., Axelbaum R.L., Macias M.E. Processing Salt-Encapsulated Tantalum Nanoparticles for High Purity, Ultra High Surface Area Applications // J. Nanopart. Res. 2006. V. 8. № 1. P. 11. https://doi.org/10.1007/s11051-005-8336-2
Park K.Y., Kim H.J., Suh Y.J. Preparation of Tantalum Nanopowders through Hydrogen Reduction of TaCl5 Vapor // Powder Technol. 2007. V. 172. № 3. P. 144–148. https://doi.org/10.1016/j.powtec.2006.11.011
Blagoveshenskiy Y.V., Isaeva N.V., Melnik Y.I., Blagoveshenskaia N.V. Tantalum and Niobium Nanopowders for Nanoporous Material Creation // Rare Met. 2009. V. 28. Spec. Iss. Oct. P. 646–649.
Крыжанов М.В., Орлов В.М., Сухоруков В.В. Термодинамическое моделирование магнийтермического восстановления ниобия и тантала из пентаоксидов // ЖПХ. 2010. Т. 83. Вып. 3. С. 380–385.
Nersisyan H.H., Lee J.H., Lee S.I., Won C.W. The Role of the Reaction Medium in the Self-Propagating High Temperature Syntesis of Nanosized Tantalum Powder // Combust. Flame. 2003. V. 135. № 4. P. 539–545. https://doi.org/10.1134/S107042721003002X
Орлов В.М., Крыжанов М.В. Магниетермическое восстановление оксида тантала в режиме самораспространяющегося высокотемпературного синтеза // Металлы. 2010. № 3. С. 18–23.
Nersisyan H.H., Ryu H.S., Lee J.H., Suh H., Won H.I. Tantalum Network Nanoparticles from a Ta2O5 + kMg System by Liquid Magnesium Controlled Combustion // Combust. Flame. 2020. V. 219. September. P. 136–146. https://doi.org/10.1016/j.combustflame.2020.05.019
Ryu H.S., Nersisyan H.H., Park K.T., Lee J.H. Porous Tantalum Network Structures Exhibiting High Electrochemical Performance as Capacitors // J. Energy Storage. 2021. V. 34. February. 102222. https://doi.org/10.1016/j.est.2020.102222
Shekhter L.N., Tripp T.B., Lanin L.L. Method for Producing Tantallum/Niobium Metal Powders by the Reduction of Their Oxides with Gaseous Magnesium: US Patent. 6171363. 2001.
Haas H. Magnesium Vapour Reduced Tantalum Powders with Very High Capacitances // CARTS Europe 2004: 18th Ann. Passive Components Conf. 2004. P. 5–8.
Haas H., Schnitter Ch. Production of Capacitor Grade Tantalum and Niobium Powders Using the New Magnesium Vapour Reduction Process // Proc. EMC. 2005. P. 1–8.
Haas H., Schnitter Ch., Sato N. Challenge: Highest Capacitance Tantalum Powders // CARTS Europe 2008 Helsinki, 2008. P. 157–167.
Орлов В.М., Крыжанов М.В. Получение нанопорошков тантала магниетермическим восстановлением танталатов // Металлы. 2015. № 4. С. 93–97.
Hwang S.M., Wang, J.P., Lee D.W. Extraction of Tantalum Powder via the Magnesium Reduction of Tantalum Pentoxide // Metals. 2019. V. 9. № 2. P. 205–2017. https://doi.org/10.3390/MET9020205
Hwang S.M., Park S.J., Wang J.P. et al. Preparation of Tantalum Metal Powder by Magnesium Gas Reduction of Tantalum Pentoxide with Different Initial Particle Size // Int. J. Refract. Met. Hard Mater. 2021. V. 100. November. 105620. https://doi.org/10.1016/j.ijrmhm.2021.105620
Okabe T.H., Sato N., Mitsuda Y., Ono S. Production of Tantalum Powder by Magnesiothermic Reduction of Feed Preform // Mater. Trans. 2003. V. 44. № 12. P. 2646–2653. https://doi.org/10.2320/matertrans.44.2646
Yuan B., Okabe T.H. Production of Fine Tantalum Powder by Preform Reduction Process Using Mg–Ag Alloy Reductant // J. Alloys Compd. 2007. V. 443. № 1–2. P. 71–80. https://doi.org/10.1016/j.jallcom.2006.10.004
Müller R., Bobeth M., Brumm H., et al. Kinetics of Nanoscale Structure Development During Mg-vapour Reduction of Tantalum Oxide // Int. J. Mater. Res. 2007. V. 98. № 11. P. 1138–1145. https://doi.org/10.3139/146.101567
Орлов В.М., Крыжанов М.В., Князева А.И. Порошки тантала с мезопористой структурой // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 5. С. 500–504. https://doi.org/10.7868/S0044185616050181
Розенберг Л.А., Штельман С.В. Состояние кислорода в танталовых порошках // Изв. АН СССР. Металлы. 1985. № 4. С. 163–164.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


