Неорганические материалы, 2022, T. 58, № 9, стр. 931-937
Исследование состава гептасульфида рения, полученного различными способами
Н. Б. Егоров 1, *, Е. А. Исаева 1
1 Томский политехнический университет
634050 Томск, пр. Ленина, 30, Россия
* E-mail: egorov@tpu.ru
Поступила в редакцию 01.04.2022
После доработки 18.06.2022
Принята к публикации 21.06.2022
- EDN: GIQVOW
- DOI: 10.31857/S0002337X22090044
Аннотация
Синтезированы образцы Re2S7 тиосульфатным, сульфидным и тиоацетамидным способами. Определено, что по составу они практически не отличаются. Состав установлен по данным химического анализа, ИК-спектроскопии и РФЭС. Согласно химическому анализу, образцы содержат избыток серы по сравнению со стехиометрическим составом Re2S7. Результаты ИК-спектроскопии показали, что полученные образцы Re2S7 содержат воду, гидросульфат-ионы, а также тиоперренат-ионы. Методом РФЭС установлено, что на поверхности Re2S7 содержатся сульфид-ионы, дисульфид-ионы и сульфат-ионы. Также показано, что рений в полученных образцах имеет нечетную степень окисления. Обсуждены возможные причины различия в структурных моделях Re2S7, предлагаемых в литературе.
ВВЕДЕНИЕ
Изучение состава и свойств гептасульфида рения (Re2S7) представляет интерес из-за его применения в промышленности в качестве катализатора селективного гидрирования [1] и в медицине в качестве реагента для лимфосцинтиграфии [2]. Кроме этого, Re2S7 является осаждаемой формой в гидрометаллургии и аналитической химии рения, где предъявляются высокие требования к степени осаждения Re2S7 и его химической чистоте [3, 4].
Для получения Re2S7 чаще всего используют взаимодействие растворенных в воде перренатов с сероводородом или тиосульфатом натрия [5, 6]. Для аналитических целей в качестве сульфидирующих реагентов используют сульфид натрия или тиоацетамид [4, 7]. Осаждение Re2S7 проводят в сильно кислотной среде. При этом параллельно с его образованием в растворе происходит разложение сульфидирующих реагентов с накоплением элементарной серы [8, 9] и различных ее кислородсодержащих соединений [10, 11], что в дальнейшем приводит к лишним затратам на очистку Re2S7 и усложняет технологический процесс его получения [12, 13].
Известно [14–16], что при разных способах и условиях приготовления Re2S7 на его поверхности наблюдаются различия в химическом составе, что влияет на его физико-химические свойства.
Цель работы – сравнение состава Re2S7, полученного тиосульфатным, сульфидным или тиоацетамидным способами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали NaReO4 “ч. д. а.”, Na2S2O3⋅5H2O “ч. д. а.”, Na2S⋅9H2O “ч. д. а.” и CH3CSNH2 (Sigma-Aldrich). Получение Re2S7 в солянокислой среде осуществляли тиосульфатным способом по методике, описанной в [17], сульфидным и тиоацетамидным способами – по методикам, описанным в [4].
После получения из всех образцов Re2S7 экстрагировали элементарную серу (S), пятикратно обрабатывая их толуолом (по 10 мл), при комнатной температуре. После экстракции толуол из образцов удаляли в вакууме.
Полученные образцы Re2S7 растворяли в аммиачном растворе пероксида водорода, удаляли избыток последнего при нагревании и анализировали на содержание рения и серы на атомно-эмиссионном спектрометре iCAP 6300 (в каждом образце Re2S7 не менее трех раз).
Спектры электронного парамагнитного резонанса (ЭПР) регистрировали при комнатной температуре на спектрометре X-диапазона (ν ∼ 9.4 ГГц) Spinscan Х (ADANI) в интервале магнитных полей от 50 до 550 мТл при амплитуде модуляции 0.3 мТл и мощности 0.3 мВт.
ИК-спектры отражения снимали на ИК-фурье-спектрометре Nicolet 6700 в диапазоне 400–4000 см–1. Образцы перетирали с бромидом калия.
Рентгенограммы записывали на дифрактометре D8 DISCOVER (CuKα-излучение, λ = 0.154056 нм).
Размер и распределение частиц Re2S7 определяли с помощью анализатора DelsaMax PRO.
Рентгенофотоэлектронные спектры (РФЭС) получали на фотоэлектронном спектрометре для химического анализа Thermo Scientific K-Alpha Nexsa (рентгеновская трубка с анодом AlKα (1486.74 эВ).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтезированные образцы Re2S7 представляли собой порошки черного цвета, состоящие из частиц, размер которых варьируется в диапазоне от 100 до 140 нм со средней дисперсией не более 30%.
В табл. 1 представлены результаты количественного химического анализа полученных образцов Re2S7, которые сопоставлены с литературными данными. Видно, что в образцах содержится небольшой избыток серы по сравнению со стехиометрическим составом Re2S7, что согласуется с ранее полученными результатами [8, 15, 16].
Таблица 1.
Результаты количественного соотношения между рением и серой в образцах Re2S7, полученных различными способами
Известно, что соединения, содержащие ионы рения с нечетной степенью окисления (Re3+, Re5+, Re7+), не дают сигнала ЭПР, в отличие от соединений с ионами рения, имеющими четную степень окисления (Re2+, Re4+, Re6+) [18]. Наши результаты показали, что в полученных образцах Re2S7 отсутствует сигнал ЭПР. Это свидетельствует о том, что рений, входящий в состав полученных образцов, имеет нечетную степень окисления.
На рис. 1 представлены дифрактограммы исследуемых образцов Re2S7, наличие широких полос указывает на то, что они рентгеноаморфны. Для всех образцов в области углов 2θ от 30° до 65° наблюдаются один широкий рефлекс и один более выраженный пик в диапазоне углов от 10° до 25°. Из такого ограниченного набора рефлексов пик в области малых углов, в силу своей интенсивности и четкости, был выбран для сравнения с дифракционными данными, приведенными в карточках ICDD 00-012-0659 и PDF 00-014-0526, которые содержат одинаковые сведения о межплоскостных расстояниях (d) и параметрах элементарной ячейки Re2S7.
Рис. 1.
Дифрактограммы Re2S7, полученного тиосульфатным (1), сульфидным (2), тиоацетамидным способом (3).
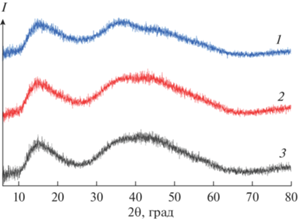
Сопоставление показало, что значения рефлексов исследуемых образцов Re2S7 не совпадают со справочными данными. В диапазоне углов 2θ от 10° до 25° пик у образцов Re2S7, синтезированных тиосульфатным, сульфидным и тиоацетамидным способами, имеет значения 15.23, 15.17, 15.27 соответственно. В картотеке для пика в этой области приводится значение угла 2θ, равное 17.30547°.
Несмотря на неоднократные попытки синтезировать указанными способами Re2S7, имеющий значение пика ∼17°, соответствующее картотеке, не удалось. При этом было замечено, что на положение пика на дифрактограммах влияют условия синтеза Re2S7, такие как температура, наличие или отсутствие ультразвука при промывке и последовательность выполнения операций при пробоподготовке. В результате были получены дифрактограммы образцов при одинаковых условиях съемки, в которых значение пика в области малых углов варьировалось в диапазоне от 15.0° до 15.6°, при этом количество рефлексов всегда оставалось одинаковым.
В базе данных ICDD 00-012-0659 приведена ссылка на работу [19], из которой взяты значения d и интенсивности рефлексов для Re2S7. В этой работе лишь уточнялись структурные данные Re2S7, которые были получены этими же авторами в более ранней работе [20]. В первой работе сообщается об условиях сероводородного синтеза Re2S7 и уточняется, что рентгенограмма порошка Re2S7 была получена после его нагревания при температуре 120°С в атмосфере азота. Это было необходимо для улучшения получаемого изображения и обработки рентгенограммы. Таким образом, сведений, содержащихся в базе данных ICDD 00-012-0659, недостаточно для однозначной диагностики синтезированных образцов Re2S7.
ИК-спектры поглощения образцов Re2S7 вследствие малой интенсивности и расплывчатости спектральных линий оказались малоинформативными, поэтому выявление различий в образцах осуществляли с использованием сравнения их ИК-спектров, полученных на приставке диффузного отражения (рис. 2).
Рис. 2.
ИК-спектры отражения–поглощения Re2S7, полученного тиоацетамидным (1), сульфидным (2), тиосульфатным способом (3).
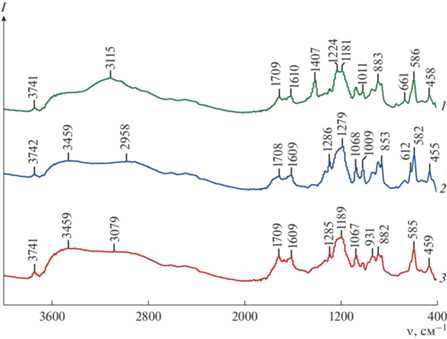
Анализ ИК-спектров показал, что в них присутствуют: сложная расщепленная система полос с максимумами в области 1030–1410 см–1, раздвоенная полоса с максимумами ∼855 и 880 см–1, а также полосы с максимумами ∼585, ∼612 и ∼457 см–1, характерные для валентных и деформационных колебаний SO-групп и SOH-групп, принадлежащих гидросульфат-ионам (${\text{HSO}}_{4}^{ - }$) [21, 22]. Кроме этих полос в ИК-спектре исследуемых образцов присутствуют пики в области 900–950 см–1 с максимумами ∼910 и ∼930 см–1, характерные для валентных колебаний ReO-групп, принадлежащих тиоперренат-ионам [23, 24].
Широкие полосы валентных колебаний OH-групп и наличие нескольких максимумов в области деформационных колебаний OH-групп имеются у всех образцов Re2S7. Это свидетельствует о наличии неравноценных по прочности водородных связей молекул воды, входящих в состав образцов Re2S7 и находящихся на их поверхности.
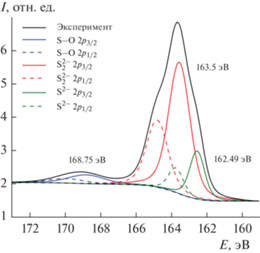
На рис. 3 и 4 представлены Re4f7/2- и S2p3/2-спектры, а в табл. 2 приведены значения максимумов в РФЭС образцов Re2S7, полученных в данной работе и известных из литературы.
Рис. 3.
Нормированные сглаженные Re4f-спектры Re2S7, полученного тиосульфатным (1), тиоацетамидным (2), сульфидным способом (3).
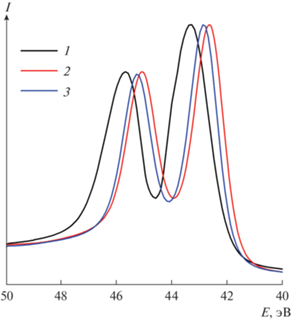
Таблица 2.
Результаты РФЭС образцов Re2S7
| Способ получения Re2S7 | Рентгеноэлектронные данные, эВ | ${\text{S}}_{2}^{{2 - }}{\text{/}}{{{\text{S}}}^{{2 - }}}$ | |||
|---|---|---|---|---|---|
| Re4f7/2 | S2p3/2 | ||||
| ${{{\text{S}}}^{{2 - }}}$ | ${\text{S}}_{2}^{{2 - }}$ | ${\text{SO}}_{4}^{{2 - }}$ | |||
| Тиосульфатный | 43.28 | 162.91 | 163.87 | 169.36 | 2.38 |
| Сульфидный | 42.62 | 162.49 | 163.50 | 168.75 | 3.91 |
| Тиоацетамидный | 42.83 | 162.50 | 163.50 | 169.09 | 4.30 |
| Сероводородный [15] | 42.90 | – | 163.90 | 169.60 | – |
| Тиомочевинный [15] | 43.50 | – | 163.90 | 169.90 | – |
В Re4f-спектре каждого образца присутствуют два пика, которые относятся к спин-орбитальному дублету Re4f7/2 и Re4f5/2, характерному для атомов рения (рис. 3). Положения максимумов Re4f7/2 образцов, синтезированных тиоацетамидным и сульфидным способами, различаются незначительно (∼0.21 эВ). У образца, полученного тиосульфатным способом, максимумы смещены в область меньших энергий связи и относительно Re2S7, синтезированного тиоацетамидным способом, разница составляет ∼0.45 эВ.
В РФЭС величину энергии связи используют для определения степени окисления элементов. В справочных изданиях отсутствует значение энергии связи Re4f7/2 для Re2S7 [25, 26]. Энергия связи Re4f7/2 в дисульфиде рения (ReS2), в котором рений имеет степень окисления 4+, имеет значение 41.5 эВ [27]. Регистрация бóльших энергий связи Re4f7/2 в исследуемых образцах Re2S7 указывает на то, что рений в них имеет бóльшую степень окисления, чем 4+ [28]. Если считать, что различие в 1 эВ приводит к изменению степени окисления на одну единицу, то в исследуемых образцах Re2S7 рений имеет степень окисления не ниже 5+. При этом полученные данные указывают на то, что в исследуемых образцах степень окисления рения не равна 7+. Если бы рений находился в Re2S7 в своей высшей степени окисления, то значения энергии связи Re4f7/2 соответствовали бы величине ∼44.5 эВ. Данное предположение согласуется с сопоставлением энергий связи Re4f7/2 для оксидов рения – ReO2 и Re2O7. Так, в [26] для ReO2 приводятся значения 42.3, 43.2 и 43.6 эВ, а для Re2O7 – 46.7 и 46.6 эВ, что отличается не менее чем на 3 эВ и, соответственно, на 3 единицы степени окисления для рения в меньшей и высшей степенях окисления.
Сравнение энергий связи Re4f7/2 для образцов Re2S7, полученных в данной работе, с известными из литературе показало, что значение колеблется от 42.4 до 43.5 эВ [14–16]. На положение максимума Re4f7/2 влияет не только способ получения Re2S7, но и какой перренат (аммония, натрия или калия) был использован для его синтеза.
S2p-спектры образцов Re2S7 одинаковы по своей структуре и близки по энергетическим параметрам, поэтому на рис. 4 приведен S2p-спектр Re2S7, полученного сульфидным способом.
Количественные соотношения на поверхности образцов Re2S7 между рением и серой определяли по отношению площадей уровней Re4f7/2,5/2 и S2p1/2,3/2 в РФЭС. Как видно из данных табл. 1, на поверхности исследуемых образцов регистрируется меньшее соотношение серы и рения, чем среднее соотношение серы и рения, найденное атомно-эмиссионном анализом. Снижение количества серы на поверхности образцов Re2S7 может быть связано с частичным ее нахождением в виде ${\text{HSO}}_{4}^{ - }$-ионов. Их наличие может быть результатом адсорбции поверхностью Re2S7 при его синтезе, а также частичным окислением поверхностных атомов серы кислородом воздуха на стадиях пробоподготовки Re2S7.
Деконволюция спектров S2p-уровня атомов серы показала наличие в них трех максимумов (рис. 4). Данные полосы были отнесены нами к сульфид-ионам (${{{\text{S}}}^{{2 - }}}$), дисульфид-ионам (${\text{S}}_{2}^{{2 - }})$ и ${\text{SO}}_{4}^{{2 - }}$-ионам (табл. 2).
Обнаружение ${\text{SO}}_{4}^{{2 - }}$-ионов на поверхности образцов Re2S7 в РФЭС соответствует данным ИК-спектроскопии, согласно которым в образцах присутствуют ${\text{HSO}}_{4}^{ - }$-ионы. В то же время наличие у образцов Re2S7 в ИК-спектрах колебаний ReO-групп не подтверждается данными РФЭС. Если бы эти группы присутствовали в образцах, то в их Re4f-спектрах регистрировались пики в области больших энергий связи [25, 26], что не наблюдается. Данный факт можно объяснить тем, что ИК-излучение имеет бóльшую проникающую способность, чем рентгеновское излучение РФЭС, и поэтому позволяет регистрировать состав образца не только на его поверхности, но и в объеме. Поэтому полученные ИК-спектры отражения содержат также данные о поглощающих группах в образцах Re2S7. Присутствие в ИК-спектрах колебаний ReO-групп, которые были объяснены нами наличием в образцах тиоперренат-ионов, указывает на то, что при синтезе Re2S7 в кислотной среде образующаяся элементарная S частично окклюдирует ренийсодержащие соединения, экранируя их, и тем самым препятствует полному протеканию реакции замещения атомов кислорода в тиоперренат-ионах на атомы серы.
В работе [29] авторы пришли к выводу, что Re2S7 содержит как ${{{\text{S}}}^{{2 - }}}$-, так и ${\text{S}}_{2}^{{2 - }}$-ионы. Однако в работах [30, 31] на основании совокупности данных анализов EXAFS и XANES было высказано предположение, что Re2S7 можно описать структурой ${\text{Re}}_{2}^{{3.5}}{{({\text{S}}_{2}^{{2 - }})}_{{3.5}}}$, которая содержит исключительно ${\text{S}}_{2}^{{2 - }}$-ионы. С этим не согласны авторы [32], которые после изучения сульфидных соединений рения методами EXAFS и XANES предложили рассматривать соединения ReS4 и Re2S7 как члены континуума структур ReS1.5–1(S2)1–1.5, которые отличаются только соотношением ${\text{S}}_{2}^{{2 - }}{\text{/}}{{{\text{S}}}^{{2 - }}}$. При этом Re2S7, по их мнению, следует рассматривать как ReV(S)1.5(S2)1, т.е. как соединение с бóльшим содержанием ${{{\text{S}}}^{{2 - }}}$-ионов, чем ${\text{S}}_{2}^{{2 - }}$. Однако найденные соотношения ${\text{S}}_{2}^{{2 - }}{\text{/}}{{{\text{S}}}^{{2 - }}}$ у образцов Re2S7, синтезированных в данной работе, которые определяли по отношению их площадей уровня S2p3/2, показывают, что ${\text{S}}_{2}^{{2 - }}$-ионов на их поверхности содержится значительно больше, чем ${{{\text{S}}}^{{2 - }}}$ (табл. 2). Подобное соотношение между ${\text{S}}_{2}^{{2 - }}$- и ${{{\text{S}}}^{{2 - }}}$-ионами наблюдалось в работе [33].
Разница в структурных моделях Re2S7, предложенных в работах [29–32], может быть связана с тем, что образцы Re2S7 для физических исследований были синтезированы различными химическим способами. Так, в работе [29] Re2S7 был синтезирован сероводородным способом, в работе [30] – тиосульфатным способом, а в работе [32] способ синтеза не указан. Для определения структуры был использован Re2S7, приобретенный у компании Aldrich.
Наличие в структуре исследуемых образцов ${\text{S}}_{2}^{{2 - }}$-ионов и образование элементарной S однозначно указывают на то, что при синтезе Re2S7, в котором используются химические восстановители (H2S, Na2S, Na2S2O3, CH3CSNH2) и растворимые перренаты в кислотной среде, протекают окислительно-восстановительные реакции. Поэтому степень окисления рения в процессе синтеза понижается и, как показали результаты ЭПР, имеет нечетное значение.
Для рения наиболее устойчивой нечетной степенью окисления ниже семи является степень окисления 5+. О возможном понижении степени окисления у рения в процессе синтеза Re2S7 указывает и тот факт, что в химической технологии рения для улучшения процесса осаждения Re2S7 в раствор добавляют, помимо сульфидирующих соединений, реагенты-восстановители типа гидразина или гидроксиламина [3]. В связи с этим причину структурных различий Re2S7 следует искать в окислительно-восстановительных свойствах соединений, участвующих в синтезе и условиях его проведения.
Также стоит отметить, что технеций, ближайший химический аналог рения, в соединении Tc2S7, полученном сульфидным или тиосульфатным способами в кислотной среде, имеет степень окисления 4+ [34–36].
ЗАКЛЮЧЕНИЕ
На основании проведенных исследований можно сделать следующие выводы.
Образцы рентгеноаморфного гептасульфида рения, полученного тиосульфатным, сульфидным и тиоацетамидным методами в солянокислой среде, содержат воду, избыток серы по сравнению со стехиометрическим составом и гидросульфат-ионы, а также тиоперренат-ионы, не полностью прореагировавшие с сульфидирующими реагентами.
Отсутствие сигнала ЭПР у синтезированных образцов и данные РФЭС позволяют утверждать, что рений в Re2S7 имеет степень окисления 5+.
Причину структурных различий Re2S7 следует искать в окислительно-восстановительных свойствах соединений, участвующих в синтезе, и условиях его проведения.
Список литературы
Ряшенцева М.А. Ренийсодержащие катализаторы в реакциях органических соединений // Успехи химии. 1998. Т. 66. № 2. С. 175–196.
Manuilov B.M., Ermakov A.V. Preparation and Properties of Nanocolloidal Rhenium Sulfide Solution for Lymphoscintigraphic Methods of Micrometastase Examination // Appl. Biochem. Microbiol. 2017. V. 53. № 8. P. 823–826. https://doi.org/10.1134/S000368381708004X
Палант А.А., Трошкина И.Д., Чекмарев А.М. Металлургия рения. М.: Наука, 2007. 298 с.
Борисова Л.В., Ермаков А.Н. Аналитическая химия рения. М.: Наука, 1974. 319 с.
Брауэр Г. Руководство по неорганическому синтезу. Т 5. М.: Мир, 1985. 360 с.
Антипкин Н.Р., Богородская М.А. О кинетических характеристиках обменной реакции перрената с тиосульфатом // Успехи в химии и химической технологии. 2011. Т. 25. № 6. С. 105–110.
Юденич Д.М. К вопросу определения рения в растворах // Тр. II Всесоюз. Совещ. по проблеме рения. М.: Наука, 1964. С. 236–238.
Роде Е.Я., Лебедев Б.А. Физико-химическое изучение сульфидов рения // Журн. неорган. химии. 1961. Т. 6. № 5. С. 1198–1203.
Билялова Г.А., Кузнеченкова Н.С., Богородская М.А. Оптимизация синтеза и очистки золя Re2S7 в качестве носителя для первого отечественного наноколлоида 99mTc // Успехи в химии и химической технологии. 2007. Т. 21. № 8. С. 9–13.
Pawlak D.W., Parus J.L., Skwarek E., Janusz W. A Study of Selected Properties of Rhenium Sulphide Dispersion // Physicochem. Probl. Miner. Process. 2014. V. 50. № 1. P. 387–397.
Пальчевская Т.А., Богуцкая Л.В., Белоусов В.М. Влияние способа приготовления гептасульфида рения на каталитические свойства в гидрировании нитробензола и м-нитробензойной кислоты// Укр. хим. журн. 1989. Т. 55. № 3. С. 240–243.
Чернов В.И., Медведева А.А., Синилкин И.Г., Зельчан Р.В., Брагина О.Д., Скуридин В.С. Опыт разработки инновационных радиофармпрепаратов в Томском НИИ Онкологии // Сибирский онкологический журн. 2015. Приложение № 2. С. 45–47.
Богородская М.А. Радиометрический анализ рения при синтезе наночастиц // Вестн. технологического ун-та. 2020. Т. 23. № 8. С. 5–10.
Ряшенцева М.А., Миначев Х.М. Рений и его соединения в гетерогенном катализе. М.: Наука, 1983. 248 с.
Нефедов В.И., Сергушин Н.П., Ряшенцева М.А. Рентгеноэлектронное исследование катализаторов – сульфидов рения // Докл. АН СССР. 1973. Т. 213. № 3. С. 600–602.
Ряшенцева М.А., Нефедов В.И. Исследование сульфидов рения методом рентгеноэлектронной спектроскопии // Изв. АН СССР. Сер. хим. 1973. № 7. С. 1642–1644.
Бреусов О.Н., Лаврентьева В.Г. Рений семисернистый // Методы получения химических реактивов и препаратов. М.: ИРЕА, 1967. С. 180–181.
Таратанов Н.А., Юрков Г.Ю., Кокшаров Ю.А., Бузник В.М. Получение и свойства композиционных материалов на основе ренийсодержащих наночастиц и микрогранул политетрафторэтилена // Перспективные материалы. 2010. № 5. С. 24–30.
Traore K., Brenet J.P. Sur la structure cristalline de Re2S7 // Bull. Soc. Fr. Mineral. Cristallogr. 1959. V. 82. № 7–9. P. 323.
Traore K., Brenet J.P. Preparation et quelques proprietes physicochimiques de l’heptasulfure de rhenium // C. R. Acad. Sci. 1959. V. 249. № 2. P. 280–282.
Черняк А.С., Ясько Т.Н., Карнаухова В.К., Шепотько М.Л., Рожкова Е.А. Синтез и изучение сульфатов цезия-тантала // Журн. неорган. химии. 1982. Т. 27. № 10. С. 2503–2509.
Baran J., Ilczyszyn M.M., Marchewka M.K., Ratajczak H. Vibrational Studies of Different Modifications of the Sodium Hydrogen Sulphate Crystals // Spectrosc Lett. 1999. V. 32. № 1. P. 83–102. https://doi.org/10.1080/00387019909349969
Müller A., Schmidt K.H., Ahlborn E. Schwingungsspektrum und normalkoordinatenanalyse von CrO3Br− zur zuordnung der schwingungsspektren von molekülen und ionen des typs MO3Xn− (M = Cr, Mn, Tc, Re; X = F, Cl, Br, S; n = 0.1) // Spectrochim Acta. Part. A. 1973. V. 29. P. 1773–1788. https://doi.org/10.1016/0584-8539(73)80164-3
Krebs B., Müller A., Beyer H. Darstellung, Struktur und Eigenschaften von Alkali-monothioperrhenaten // Z. Anorg Allg. Chem. 1968. V. 362. № 1–2. P. 44–50. https://doi.org/10.1002/zaac.19683620108
Moulder J.F., Stickle W.F., Sobol P.E., Bomben K.D. Handbook of X-ray Photoelectron Spectroscopy. Eden Prairie: Perkin-Elmer, 1992. 261p.
Wagner C.D., Naumkin A.V., Kraut-Vass A., Allison J.W., Powell C.J., Rumble J.R.Jr. NIST Standard Reference Database 20, Version 3.4 (web version), 2003. http://srdata.nist.gov/xps/
Davis S.M. Photoemission Studies of Rhenium Disulfide Oxidation: Altered Core-Level Structure and Reactivity of Defect Sites // Catal. Lett. 1989. V. 2. P. 1–8. https://doi.org/10.1007/BF00765324
Зигбан К., Нордлинг К., Фальман А., Нордберг Р., Хамрин К., Хедман Я., Йохансон Г., Бергмарк Т., Карлсон С., Линдгрен И., Линдберг Б. Электронная спектроскопия. М.: Мир, 1971. 493 c.
Muller A., Krickemeyer E., Bogge H., Ratajczak H., Armatage A. A building Principle of Amorphous Chalcogenides of Transition Metals: The “Extrusion” of the Electron-Rich Cluster [Re4S2(SO2)4(CN)10]8− from a-Re2S7 // Angew. Chem. Int. Ed. Engl. 1994. V. 106. № 7. P. 800–803. https://doi.org/10.1002/anie.199407701
Hibble S.J., Walton R.I. X-Ray Absorption Studies of Amorphous Re2S7 // Chem. Commun. 1996. № 18. P. 2135–2136. https://doi.org/10.1039/CC9960002135
Hibble S.J., Walton R.I., Feaviour M.R., Smith A.D. Sulfur–Sulfur Bonding in the Amorphous Sulfides WS3, WS5, and Re2S7 from Sulfur K-edge EXAFS Studies // J. Chem. Soc. Dalton Trans. 1999. № 16. P. 2877–2883. https://doi.org/10.1039/A903918J
Schwarz D., Frenkel A., Nuzzo R., Rauchfuss T., Vairavamurthy A. Electrosynthesis of ReS4. XAS Analysis of ReS2, Re2S7, and ReS4 // Chem. Mater. 2004. V. 16. № 1. P. 151–158. https://doi.org/10.1021/cm034467v
Cai X., Kong L., Hu X., Peng X. Recovery of Re(VII) from strongly Acidic Wastewater using Sulphide: Acceleration by UV Irradiation and the Underlying Mechanism // J. Hazard. Mater. 2021. V. 416. 126233. https://doi.org/10.1016/j.jhazmat.2021.126233
German K.E., Shiryaev A.A., Safonov A.V., Obruchnikova Y.A., Ilin V.A., Tregubova V.E. Technetium Sulfide – Formation Kinetics, Structure and Particle Speciation // Radiochim. Acta. 2015. V. 103. № 3. P. 199–203. https://doi.org/10.1515/ract-2014-2369
Герман К.Э., Обручникова Я.А., Сафонов А.В., Трегубова В.Е., Афанасьев А.В., Копытин А.В., Крыжовец О.С., Пуано Ф., Абхалимов Е.В., Ширяев А.А. Кинетика образования осадков и физико-химические свойства сульфидов технеция-99 и рения по данным методов малоуглового рассеяния и ультрамикроцентрифугирования // Журн. неорган. химии. 2016. Т. 61. № 11. С. 1500–1505.
Lukens W.W., Bucher J.J., Shuh D.K., Edelstein N.M. Evolution of Technetium Speciation in Reducing Grout // Environ. Sci. Technol. 2005. V. 39. P. 8064–8070. https://doi.org/10.1021/es050155c
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы