Журнал неорганической химии, 2019, T. 64, № 1, стр. 3-8
Синтез, кристаллохимические и термические свойства твердого раствора Zn2 – 2xCu2xSiO4 со структурой виллемитаН. А. Зайцева, И. В. Иванова, Р. Ф. Самигуллина, М. В. Ротермель, Т. И. Красненко
Н. А. Зайцева 1, 2, *, И. В. Иванова 1, Р. Ф. Самигуллина 1, М. В. Ротермель 1, Т. И. Красненко 1
1 Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
2 Уральский государственный горный университет
620144 Екатеринбург, ул. Куйбышева, 30, Россия
* E-mail: natalzay@yandex.ru
Поступила в редакцию 22.03.2018
После доработки 04.07.2018
Принята к публикации 19.04.2018
Аннотация
Разработана методика твердофазного синтеза Zn2 – 2xCu2xSiO4 со структурой виллемита. Показано, что максимально возможная температура отжига составляет 1030 ± 1°С, что обусловлено температурой разложения CuO. Обнаружено, что протяженность твердого раствора Zn2 – 2xCu2xSiO4 составляет 7.5 ат. % Cu. Кристаллохимические параметры элементарных ячеек и коэффициенты термического линейного и объемного расширения не зависят от концентрации Cu2+. Температуры плавления образцов Zn2 – 2xCu2xSiO4 в области гомогенности также не зависят от количества допанта х и близки к значениям для недопированного Zn2SiO4 (1512 ± 1°С). Впервые установлено наличие деформационного фазового перехода в Zn2SiO4 и Zn2 – 2xCu2xSiO4 на 10 ± 2°С ниже температуры плавления. Совокупность полученных кристаллохимических и термических данных позволила осуществить триангуляцию диаграммы системы ZnO–SiO2–CuO, которая линиями двухфазных равновесий разбивается на пять вторичных треугольников.
ВВЕДЕНИЕ
Твердые растворы на основе Zn2SiO4 находят применение как составляющие композиционных материалов для изготовления конденсаторов [1], керамик для микроволновых устройств [2], антикоррозионных покрытий [3] благодаря таким свойствам, как высокая диэлектрическая проницаемость, химическая инертность, термостойкость. Кроме того, в результате замещения цинка ионами кобальта и марганца были получены активно используемые оптические материалы: синий пигмент Zn2 – 2xCo2xSiO4 [4] и неорганический кристаллофосфор зеленого свечения Zn2SiO4 : Mn [5, 6], что определило перспективу дальнейших исследований твердых растворов на основе виллемита с участием других переходных металлов, введение которых обусловливает появление новых пигментных или люминесцентных свойств [7–12]. В связи с этим весьма интересным представляется получение и исследование медьзамещенного силиката цинка [9–12]. Однако в литературе до сих пор остаются открытыми вопросы изоморфной емкости и кристаллохимических свойств твердого раствора Zn2 – 2xCu2xSiO4. Особого внимания, на наш взгляд, требует обсуждение способа его получения, поскольку термическое поведение исходных соединений меди (CuCl2 и CuO) имеет ряд особенностей, которые необходимо учитывать при выборе метода и параметров синтеза.
Для получения допированных силикатов цинка в настоящее время используют различные подходы: гидротермальный синтез [8], традиционную керамическую технологию, основанную на твердофазных высокотемпературных взаимодействиях стехиометрических смесей исходных оксидов, нитратов или карбонатов [6, 12], а также золь-гель метод [9, 10]. Синтез твердого раствора Zn2 – 2xCu2xSiO4 золь-гель методом выполняют с использованием хлорида меди(II) в качестве одного из исходных веществ [9, 10]. Однако в этом случае часть ионов меди может быть потеряна вследствие летучести CuCl2 при высоких температурах финального отжига [13]. Кроме того, ионы хлора могут войти в состав соединения, что изменит его физико-химические свойства. В работах [11, 12] описано получение Zn2 – 2xCu2xSiO4 по керамической технологии из соответствующих оксидов, но итоговые образцы, как отмечают авторы, были неоднофазными. По нашему мнению, это может быть связано с неверно выбранным температурным режимом синтеза, основанным на эмпирическом правиле Таммана, согласно которому температура активного взаимодействия реагентов составляет более 60% от температуры плавления продукта реакции. Так, например, твердофазный синтез твердого раствора Zn2 – 2хMn2xSiО4 необходимо проводить при 1200–1400°С [6], поскольку Zn2SiО4 плавится при 1512°С [14]. Однако этот температурный интервал не подходит для синтеза твердого раствора Zn2 – 2xCu2xSiO4 из-за термической неустойчивости CuO. Данные о температуре его разложения разноречивы: в работах [15–17] указано, что оксид меди(II) разлагается при температурах выше 800°С, в более ранних публикациях [18, 19] приведена температура разложения 1026°С. Поскольку выбор температурного режима синтеза однофазных образцов зависит от устойчивости исходных соединений, мы сочли необходимым на первом этапе настоящей работы исследовать термическое поведение CuO на воздухе. Полученная информация может быть использована и в других работах, где особенности термического поведения диоксида меди накладывают отпечаток на режим синтеза и свойства соединений (высокотемпературные сверхпроводники [20], модифицированная ионами меди алюмосиликатная керамика [21], проводящая оксидная керамика [22] и т.д.).
Цель работы – разработка методики твердофазного синтеза медьзамещенного силиката цинка, установление изоморфной емкости твердого раствора, концентрационной и температурной зависимости параметров элементарной ячейки, температуры плавления однофазных образцов Zn2 – 2xCu2xSiO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза твердого раствора Zn2 – 2xCu2xSiO4 в качестве реактивов использовали оксиды ZnO, CuO, SiO2 (ч. д. а.). Твердофазный синтез Zn2 – 2xCu2xSiO4 проводили из стехиометрической смеси исходных оксидов, которую гомогенизировали перетиранием в агатовой ступке в среде этанола и отжигали ступенчато.
Фазовый состав образцов контролировали рентгенографически, сопоставляя данные РФА с рентгенометрическими характеристиками исходных оксидов и силикатов цинка (база порошковых стандартов PDF2, ICDD USA, Release 2009). Дифрактограммы образцов получали на дифрактометре Shimadzu (CuKα-излучение, 2θ = 10°–60°, шаг сканирования 0.02°), в том числе с помощью высокотемпературной приставки УВД-2000 (скорость нагрева 10 град/мин). Расчет кристаллохимических параметров элементарных ячеек осуществляли методом Ритвельда по программе Fullprof 2010. Дифференциальный термический (ДТА) и термогравиметрический (ТГ) анализ проводили на термоанализаторе Setsys Evolution (Setaram) на воздухе при скорости изменения температуры 10 град/мин, эталон – оксид алюминия.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
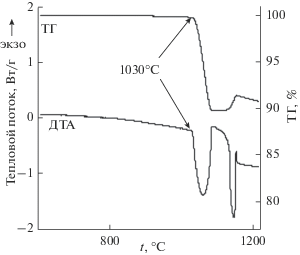
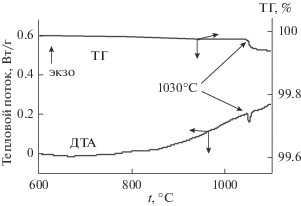
Для выбора оптимальной температуры синтеза твердых растворов Zn2 – 2xCu2xSiO4 были выполнены ДТА и ТГ-исследование исходного оксида CuO при нагревании (рис. 1).
Согласно полученным данным, при 1030°С наблюдается убыль массы CuO на 10.06%, сопровождаемая эндотермическим эффектом 21.57 кДж/моль, обусловленная процессом разложения оксида меди:
(1)
${\text{CuO}} \to {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{\text{C}}{{{\text{u}}}_{2}}{\text{O}} + {1 \mathord{\left/ {\vphantom {1 4}} \right. \kern-0em} 4}{{{\text{O}}}_{2}} \uparrow ,$(2)
$2{\text{C}}{{{\text{u}}}_{2}}{\text{O}} \leftrightarrow 4{\text{Cu}} + {{{\text{O}}}_{2}} \uparrow ,$Таким образом, данные термического анализа показывают, что температура отжига стехиометрической смеси оксидов при твердофазном синтезе Zn2 – 2xCu2xSiO4 не должна превышать 1030°С. Поэтому была разработана следующая методика керамической технологии получения медьзамещенного виллемита: навески оксидов SiO2, ZnO и CuO в необходимых пропорциях последовательно отжигали при 800, 900, 1000 и 1020°С в течение 20 ч на каждой ступени с промежуточным перетиранием. Контроль фазового состава осуществляли методом РФА.
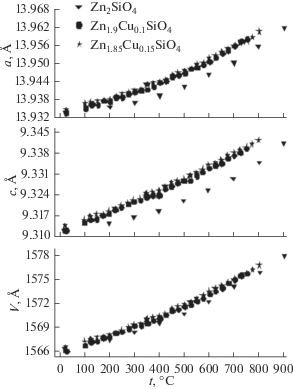
Для определения протяженности твердого раствора Zn2 – 2xCu2xSiO4 были синтезированы составы с содержанием меди х = 0, 0.025, 0.050, 0.075, 0.090, 0.125, 0.150, 0.200. На рис. 2 представлены рентгенограммы образцов Zn2SiO4, Zn1.9Cu0.1SiO4, Zn1.85Cu0.15SiO4 и Zn1.82Cu0.18SiO4. Протяженность твердого раствора Zn2 – 2xCu2xSiO4 со структурой виллемита составляет 7.5 ат. %, поскольку для х > 0.075 фиксируются не только дифракционные максимумы, относящиеся к структуре виллемита [24], но и рефлексы, соответствующие оксиду меди(II). Допированные однофазные образцы имеют слабую сиренево-голубую окраску, которая усиливается с ростом х. Параметры элементарной ячейки Zn2 – 2xCu2xSiO4 при комнатной температуре остаются практически неизменными с увеличением концентрации допанта (табл. 1). При нагревании кристаллическая решетка ортосиликата цинка монотонно расширяется (рис. 3), наибольшие трансформации происходят вдоль оси с (αс = 3.47 × 10–6 1/град). Кристаллическая решетка твердых растворов Zn2 – 2xCu2xSiO4 становится более подвижной по сравнению с таковой для исходного ортосиликата цинка, о чем свидетельствуют растущие значения линейных и объемных коэффициентов термического расширения (табл. 1).
Рис. 2.
Рентгенограммы образцов Zn2 – 2xCu2xSiO4 (1 – Zn2SiO4, 2 –Zn1.9Cu0.1SiO4, 3 – Zn1.85Cu0.15SiO4, 4 – Zn1.82Cu0.18SiO4).
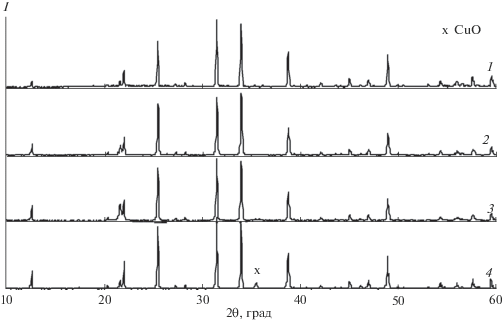
Таблица 1.
Кристаллохимические параметры элементарных ячеек (a, c, V, ρрентг) при комнатной температуре, коэффициенты линейного и объемного термического расширения (αa, αc, αV), температуры плавления (tпл) и фазового перехода (tф. п.) твердого раствора Zn2 – 2xCu2xSiO4
| Состав образцов | Zn2SiO4 | Zn1.95Cu0.05SiO4 | Zn1.9Cu0.1SiO4 | Zn1.85Cu0.15SiO4 |
|---|---|---|---|---|
| a, Å | 13.92(8) | 13.92(2) | 13.92(7) | 13.92(8) |
| c, Å | 9.30(2) | 9.31(3) | 9.30(5) | 9.30(3) |
| V, Å3 | 1562.(9) | 1563.(3) | 1562.(9) | 1563.(0) |
| ρрентг, г/см3 | 4.256 | 4.253 | 4.253 | 4.251 |
| αa, 1/град | 2.29 × 10–6 | 2.44 × 10–6 | 2.40 × 10–6 | |
| αc, 1/град | 3.47 × 10–6 | 3.95 × 10–6 | 3.88 × 10–6 | |
| αV, 1/град | 8.05 × 10–6 | 8.81 × 10–6 | 8.65 × 10–6 | |
| tпл, °С | 1512 ± 2 | 1514 ± 2 | 1513 ± 2 | |
| tф. п., °С | 1500 ± 2 | 1503 ± 2 |
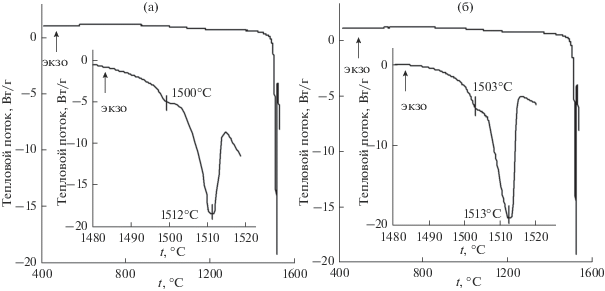
Для установления влияния допирования на температуру плавления Zn2 – 2xCu2xSiO4 были исследованы образцы Zn2SiO4 и Zn1.85Cu0.15SiO4 (рис. 4). На кривой нагревания ДТА Zn2SiO4 наблюдаются два эндотермических эффекта при 1500 (0.13 кДж/моль) и 1512°С (106.44 кДж/моль). Аналогичное термическое поведение демонстрирует Zn1.85Cu0.15SiO4 – эндоэффекты при 1503°С (0.24 кДж/моль) и 1513°С (131.86 кДж/моль). Более энергоемкий эндоэффект для обоих образцов свидетельствует об их плавлении [14]. Поскольку силикат Zn2SiO4 кристаллизуется в двух модификациях: низкотемпературной α-Zn2SiO4 со структурой виллемита и высокотемпературной β-Zn2SiO4 [25, 26], можно утверждать, что эндоэффект при 1500°С (рис. 4а) обусловлен фазовым переходом α → β, а незначительная величина теплового эффекта указывает на деформационный характер фазового перехода [27]. Для допированного образца температура фазового перехода α → β равна 1503°С (рис. 4б). Полученные результаты термического анализа свидетельствуют о том, что замещение ионов цинка на ионы меди в Zn2SiO4 практически не влияет на температуру и характер фазовых превращений (табл. 1).
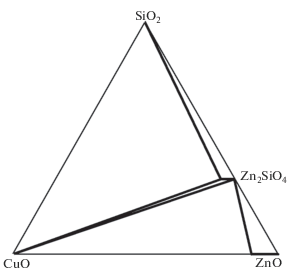
Полученные данные о наличии протяженного твердого раствора Zn2 – 2xCu2xSiO4 в совокупности с литературной информацией о фазовых соотношениях в бинарных системах ZnO–SiO2, CuO–SiO2 и CuO–ZnO позволяют провести триангуляцию трехкомпонентной системе ZnO–SiO2–CuO. Относительно фазовых равновесий в бинарных системах известно следующее: в системе ZnO–SiO2 образуется соединение Zn2SiO4 [14], в бинарных системах CuO–SiO2 [28] и CuO–ZnO [29–32] соединения отсутствуют, на основе оксида цинка образуется твердый раствор Zn1– xCuxO с максимальным содержанием меди 10 ат. % (рис. 5). Альтернативным является выбор коннод внутри треугольника. Осуществить триангуляцию тройной диаграммы можно, путем исследования фазового состава одной из отожженных смесей: Zn1.85Cu0.15SiO4 + Zn0.9Cu0.1О либо Zn2SiO4 + CuO. Однозначно установить фазовый состав продуктов методом РФА не представляется возможным, поскольку дифракционные максимумы оксидов меди и цинка близки, а дифрактограммы Zn2SiO4 и Zn2 – 2xCu2xSiO4 идентичны. Аттестация продуктов отжига возможна методом ДТА, так как наличие оксида меди(II) однозначно регистрируется, как было показано выше, эндоэффектом на кривой нагревания при 1030°С. Для анализа полученного продукта нами был выбран состав 6Zn1.85Cu0.15SiO4 + Zn0.9Cu0.1О. На кривых нагревания этой смеси, отожженной при 900°С в течение 30 ч, был зарегистрирован эндоэффект, сопровождающий потерю массы образца (рис. 6), что соответствует процессу разложения оксида меди(II). Эти факты указывают на присутствие в смеси CuO и, следовательно, на наличие равновесия между CuO и Zn2SiO4. Таким образом, полученные данные позволили осуществить триангуляцию диаграммы системы ZnO–SiO2–CuO, которая линиями двухфазных равновесий разбивается на пять вторичных треугольников (рис. 5).
ЗАКЛЮЧЕНИЕ
Показано, что максимальная температура отжига смесей оксидов для получения однофазных образцов Zn2 – 2xCu2xSiO4 лимитирована термической устойчивостью оксида меди(II), который разлагается при 1030°С. Установлено, что твердый раствор ограничен составом Zn1.85Cu0.15SiO4 (x = 0.075). Параметры элементарной ячейки в области гомогенности твердого раствора практически не зависят от концентрации ионов меди. Кристаллическая решетка твердых растворов Zn2 – 2xCu2xSiO4 становится более подвижной по сравнению с таковой для исходного ортосиликата цинка, о чем свидетельствуют растущие значения линейных и объемных коэффициентов термического расширения. Температуры плавления Zn2 – 2xCu2xSiO4 не зависят от величины х, остаются практически неизменными и составляют 1512 ± 1°С. При температурах, близких к температуре плавления, зафиксирован фазовый переход α-Zn2 – 2xCu2xSiO4 → β-Zn2 – 2xCu2xSiO4. Триангуляция фазовой диаграммы системы ZnO–SiO2–CuO показала, что линиями двухфазных равновесий она разбивается на пять вторичных треугольников.
Список литературы
Ротенберг Б.А. Керамические конденсаторные диэлектрики. СПб.: Гириконд, 2000. 246 с.
Gang D., Dongxiang Z., Mei G., Shuping G. // J. Alloys Compd. 2012. V. 513. P. 466. https://doi.org/ 10.1016/j.jallcom.2011.10.089.
Курбанов М.М. // Коррозия ТНГ. 2013. Т. 26. № 3. С. 50.
Ozel E., Yurdakul H., Turan S. et al. // J. Eur. Ceram. Soc. 2010. V. 30. № 16. P. 3319. https://doi.org/ 10.1016/j.jeurceramsoc.2010.08.013.
Takesue M., Hayashi H., Smith Jr.R.L. // Prog. Cryst. Growth Charact. Mater. 2009. V. 55. № 3–4. P. 98. https://doi.org/10.1016/j.pcrysgrow.2009.09.001.
Onufrieva T.A., Krasnenko T.I., Zaitseva N.A. et al. // Mater. Res. Bull. 2018. V. 97. P. 182. https://doi.org/ 10.1016/j.materresbull.2017.09.008.
Pappalardo R.G., Miniscalco W.J., Peters T.E., Lee K. // J. Lumin. 1993. V. 55. P. 87. https://doi.org/10.1016/0022-2313(93)90013-D.
Зайцева Н.А., Красненко Т.И., Онуфриева Т.А., Самигуллина Р.Ф. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 173. https://doi 10.7868/S0044457X17020222. [Zaitseva N.A., Krasnenko T.I., Onufrieva T.A., Samigullina R.F. // Russ. J. Inorg. Chem. 2017. V. 62. № 2. P. 168. doi 10.1134/S0036023617020218].
Babu B.Ch., Buddhudu S. // Ind. J. Phys. 2014. V. 88. № 6. P. 631. https://doi.org/10.1007/s12648-014-0455-0.
Babu B.Ch., Kumar K.N., Rudramadevia B.H., Buddhudu S. // Ferroelectr. Lett. Sect. V. 38. № 2. P. 28. https://doi.org/10.1080/07315171.2014.908682.
Lavat A.E., Gayo G.X. // Ceram. Intern. 2014. V. 40. № 8А. P. 11947. https://doi.org/10.1016/j.ceramint.2014.04.031.
Туманов С.Г. // Стекло и керамика. 1967. № 6. С. 33 [Tumanov S.G. // Glass Ceram. 1967. V. 24 № 6. P. 330. https://org/10.1007/BF00675893].
Краткая химическая энциклопедия. 1961. Т. 3. 66 с.
Bunting E.N. // J. Am. Ceram. Soc. 1930. V. 13. № 1. P. 5. https://doi.org/10.1111/j.1151-2916.1930.tb16797.x.
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. Ч. 3. Пер. с англ. М.: Мир, 1969. 592 с.
Реми Г. Курс неорганической химии. Т. 2. Пер. с нем. М.: Мир, 1966. 838 с.
Ефимов А.И., Белорукова Л.П., Василькова И.В., Чечев В.П. Свойства неорганических соединений. Справочник. Л.: Химия, 1983. 392 с.
Gadalla A.M.M., Ford W.F., White J. // Trans. Brit. Ceram. Soc. 1963. V. 62. № 1. P. 45.
Gadalla A.M.M., White J. // Trans. Brit. Ceram. Soc. 1964. V. 63. P. 57.
Мацкевич Н.И., Наумов В.Н., Трофименко Е.А. и др. // Химия в интересах устойчивого развития. 2001. Т. 9. № 4. С. 567.
Салычиц О.И., Орехова С.Е. // Огнеупоры и техническая керамика. 2009. № 6. С. 12.
Кузанян А.С., Пашаян С.Т., Татоян В.Т. // Изв. НАН РА. Физика. 2014. Т. 49. № 1. С. 44.
Коршунов А.В., Ильин А.П. // Изв. ТПУ. Химия. Физика. 2008. Т. 313. № 3. С. 5.
Klaska K.H., Eck J.C. // Acta Crystallogr. 1978. V. B34. P. 3324. https://doi.org/10.1107/S0567740878010778.
Omri K., Mir El.L., Dahman H., Barthou C. // Sens. Transducers J. 2014. V. 27. P. 295.
Ghoul El.J., Mir El.L. // Superlattices Microstruct. 2015. V. 82. P. 551. https://doi.org/10.1016/j.spmi.2015.05.029.
Третьяков Ю.Д. Твердофазные реакции. М.: Химия, 1978. 360 с.
Торопов Н.А., Борзаковский В.П. Диаграммы состояния силикатных систем. М.-Л.: Наука, 1965. Т. 2. 372 с.
Мелкозерова М.А., Красильников В.Н., Гырдасова О.И. и др. // Физика тв. тела. 2013. Т. 55. № 12. С. 2340 [Melkozerova M.A., Krasil’nikov V.N., Gyrdasova O.I. et al. // J. Phys. Sol. State. 2013. V. 55. № 12. P. 2459. 10.1134/S106378341312024X].
Singhal S., Kaur J., Namgyal T., Sharm R. // Phys. B: Cond. Matt. 2012. V. 407. P. 1223. doi 10.1016/j.physb.2012.01.103
Muthukumaran S., Gopalakrishnan R. // Opt. Mater. 2012. V. 34. № 11. P. 1946. http://doi.org/10.1016/ j.optmat.2012.06.004.
Gyrdasova O.I., Melkozerova M.A., Baklanova I.V. et al. // Mendeleev Commun. 2017. V. 27. P. 410. doi 10.1016/j.mencom.2017.07.032
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии