Журнал неорганической химии, 2019, T. 64, № 10, стр. 1111-1115
Синтез твердого раствора Li(Ni,Mn,Co,Fe)O2 методом сжигания геля
Г. Д. Нипан 1, М. Н. Смирнова 1, *, М. А. Копьева 1, Г. Е. Никифорова 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: smirnova_macha1989@mail.ru
Поступила в редакцию 15.02.2019
После доработки 01.04.2019
Принята к публикации 15.04.2019
Аннотация
Изучена возможность гомогенного замещения кобальта, никеля и марганца на железо в твердом растворе со слоистой структурой типа α-NaFeO2, образующемся в системе Li–Ni–Mn–Co–O. Методом сжигания гелей на основе крахмала или сахарозы синтезированы и с помощью рентгенофазового анализа исследованы две серии образцов: Li(Ni0.33Mn0.33Co0.33)1 – xFexO2 и Li(Ni0.60Mn0.20Co0.20)1 – xFexO2 (0 ≤ х ≤ 1). Впервые получены однофазные образцы Li(Ni,Mn,Co,Fe)O2, содержащие 15–20% Fe от общего числа катионов. В рамках изобарно-изотермического тетраэдра LiNiO2–LiMnO2–LiCoO2–LiFeO2 определено положение метастабильной области твердого раствора Li(Ni,Mn,Co,Fe)O2 по отношению к сечению LiNiO2–LiMn0.5Co0.5O2–LiFeO2.
ВВЕДЕНИЕ
Попытки замещения кобальта, никеля и марганца на железо в твердом растворе Li(Ni,Mn,Co)O2 со слоистой структурой типа α-NaFeO2 (R$\bar {3}$m) связаны с поиском более дешевых и экологически безопасных материалов для литий-ионных аккумуляторов (ЛИА) [1]. Получение и сохранение высокотемпературной полиморфной модификации Li(Ni,Mn,Co)O2 (R$\bar {3}$m) во многом зависят от условий синтеза. Один и тот же состав, например Li(Ni0.33Mn0.33Co0.33)O2, может отвечать как гомогенному твердому раствору со структурой α-NaFeO2, так и многофазной смеси с участием галита (Fm3m) – Li(Ni,Mn,Co)O, шпинели (Fd3m) – Li(Ni,Mn,Co)2O4 или твердого раствора на основе Li2MnO3 (C2/m) [2]. Концентрационный объем однофазного Li(Ni,Mn,Co)O2 в условном изобарно-изотермическом тетраэдре состава Li2O–(Ni2O3)–Mn2O3–(Co2O3) трансформируется в зависимости от температуры и парциального давления кислорода, находясь между плоскостями Li0.35(Ni,Mn,Co)O2 – δ и Li1.2(Ni,Mn,Co)O2 + δ [3].
При введении еще одного элемента – Fe – ситуация с сохранением гомогенности высокотемпературной модификации Li(Ni,Mn,Co)O2 усложняется и образуется концентрационный объем Li(Ni,Mn,Co,Fe)O2 cо своими границами гомогенности по катионам. Предельному содержанию железа (50% от суммы катионов) соответствует стехиометрический LiFeO2, однако слоистая модификация феррита лития (R3m) существует метастабильно и образуется, например, при ионном обмене α-NaFeO2 с раствором LiCl в органических растворителях при 160–200°C, но переходит в кубическую модификацию (Fd3m) уже во время первой электрохимической деинтеркаляции лития [4]. Близость размеров катионов Li+ и Fe3+ позволяет последним входить в литиевые слои, что приводит к разупорядочению структуры R3m и снижению электрохимической активности [4]. В синтезированных в ряде работ образцах Li(Ni,Mn,Co,Fe)O2 доля железа не превышает 10%. В классическом составе LiNi0.33Mn0.33Co0.33O2 [5] частично замещены кобальт до LiNi0.33Mn0.33Co0.17Fe0.17O2 (золь-гель синтез с использованием лимонной кислоты, отжиг при 750, 800 и 850°C в течение 16 ч) [6], LiNi0.33Mn0.33Co0.23Fe0.1O2 (спекание оксидов или цитратов, отжиг при 950°C, 15 ч) [7] и LiNi0.33Mn0.33Co0.25Fe0.08O2 (сжигание геля с глицином, механоактивация, 800°C, 4 ч) [8], а также никель и марганец до LiNi0.3Mn03Co0.3Fe0.1O2 (твердофазный [7] и золь–гель синтез, винная кислота, 800 и 900°C, 24, 48 и 72 ч [9] или ацетаты, 1000°C, 10 ч [10]). Кроме того, проведено допирование железом с получением составов LiNi0.6Mn0.2Co0.15Fe0.05O2 (сжигание геля с сахарозой, 900°C, 1 ч) [11] и LiNi0.4Mn0.4Co0.15Fe0.05O2 (сжигание геля с глицином, механоактивация, 800°C, 4 ч) [12].
Увеличение содержания железа в Li(Ni,Mn,Co,Fe)O2 предполагает определение концентрационной области гомогенности твердого раствора при выбранных температуре и парциальном давлении кислорода. Наряду с этим практическую значимость представляет сохранение однофазности Li(Ni,Mn,Co,Fe)O2 при изменении изобарно-изотермических условий.
Цель настоящей работы – оценка предельного содержания Fe в гомогенных кристаллитах Li(Ni,Mn,Co,Fe)O2 при фиксированном отношении Ni : Mn : Co. Для анализа были выбраны составы на нодах LiNi0.33Mn0.33Co0.33O2–LiFeO2 и LiNi0.60Mn0.20Co0.20O20–LiFeO2, принадлежащих сечению LiNiO2–LiMn0.5Co0.5O2–LiFeO2 в тетраэдре LiNiO2–LiMnO2–LiCoO2–LiFeO2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы получены методом сжигания геля [13], основываясь на том, что успешный синтез Li(Ni,Mn,Co,Fe)O2 был проведен с использованием гелей [6–12]. Выбор восстановителя оказался немаловажной проблемой. Для серии Li(Ni0.33Mn0.33Co0.33)1 – xFexO2 (0 ≤ х ≤ 1) применялся крахмал, так как при использовании лимонной кислоты и глицина образовывались многофазные смеси. В случае Li(Ni0.60Mn0.20Co0.20)1 – xFexO2 (0 ≤ х ≤ ≤ 1) выбрана сахароза, для которой отработана методика получения твердого раствора состава LiNi0.60Mn0.20Co0.20O2.
Для приготовления реакционных смесей использовали нитраты соответствующих металлов, крахмал и сахарозу с содержанием основных веществ >99.9% (х. ч.). Содержание катионов в нитратах определяли гравиметрическим методом. Сначала готовили растворы нитратов металлов для получения 10 г LiM1 –xFexO2 c шагом х = 0.1. Растворы переносили в мерные колбы на 200 мл и доводили дистиллированной водой до метки. Для синтеза 2 г каждого образца соответствующего состава 40 мл раствора переносили в керамическую чашу, добавляли раствор рассчитанного количества восстановителя (крахмал, сахароза) в 10 мл воды и упаривали при 90–120°С до образования геля. Затем повышали температуру до ~150°С, что приводило к интенсивному выделению газообразных продуктов и образованию черных губчатых хлопьев, которые перетирали и отжигали в три этапа: 300 (5 ч), 500 (5 ч) и 800°С (5 ч), а затем охлаждали с печью.
Применение крахмала и сахарозы в качестве оптимальных восстановителей основано на результатах предварительных экспериментов. При выборе учитывались такие физико-химические свойства, как гидрофильность, комплексообразование с катионами металлов и теплотворная способность. Для прекурсоров системы Li–Ni–Mn–Co–Fe–O характеристические особенности крахмала и сахарозы способствовали образованию устойчивых гелей, горение которых происходило в самоподдерживающем режиме с образованием мелкодисперсных порошков.
Рентгенофазовый анализ (РФА) порошков выполняли на дифрактометре Bruker Advance D8 (излучение CuKα) в интервале углов 2θ = 10°–70° с шагом сканирования 0.0133°. Обработку результатов проводили с помощью программного пакета DIFFRAC.EVA на оборудовании ЦКП ФМИ ИОНХ РАН.
Соотношение Ni : Mn : Co : Fe в гомогенном образце Li(Ni,Mn,Co,Fe)O2 анализировали методом рентгеноспектрального микроанализа (РСМА) с помощью микроскопа Carl Zeiss NVision 40, оснащенного анализатором Oxford Instruments X-Max, при ускоряющих напряжениях 3–20 кВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлены данные РФА и результаты расшифровки для образцов Li(Ni0.33Mn0.33Co0.33)1 – xFexO2. При номинальном составе LiNi0.33Mn0.33Co0.33O2 (LNMC1, рис. 1) наряду со слоистой фазой образуется примесь шпинели, которая сохраняется в образцах LiNi0.30Mn0.30Co0.30Fe0.10O2 и LiNi0.25Mn0.25Co0.25Fe0.25O2 (рис. 1, кривые 1 и 2).
Рис. 1.
Дифрактограммы образцов номинального состава Li(Ni0.33Mn0.33Co0.33)1 – xFexO2: LNMC1 – LiNi0.33Mn0.33Co0.33O2, 1 – LiNi0.30Mn0.30Co0.30Fe0.10O2, 2 – LiNi0.25Mn0.25Co0.25Fe0.25O2, 3 – LiNi0.20Mn0.20Co0.20Fe0.40O2, 4 – LiNi0.17Mn0.17Co0.17Fe0.50O2, 5 – LiNi0.13Mn0.13Co0.13Fe0.60O2, 6 – LiNi0.10Mn0.10Co0.10Fe0.70O2, 7 – LiNi0.07Mn0.07Co0.07Fe0.80O2, 8 – LiNi0.03Mn0.03Co0.03Fe0.90O2.
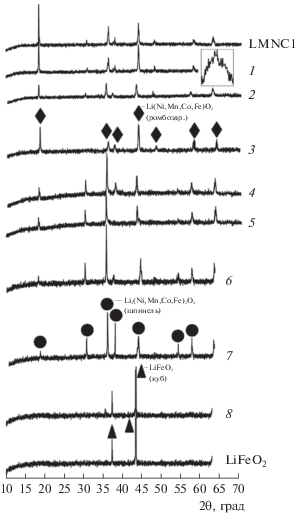
Как показали исследования фазовых равновесий в системе Li–Ni–Mn–Co–O (температура 800°C, давление кислорода 100 кПа), в рамках изоконцентрационных сечений тетраэдра Li–Ni–Mn–Co при 10, 20 и 30 мол. % Co [2] область гомогенности Li(Ni,Mn,Co)O2 смещается при изменении скорости охлаждения образцов с 10 град/с на 10 град/мин в направлении Li [2]. Состав LiNi0.33Mn0.33Co0.33O2 не принадлежит сечениям, но для Li0.96Ni0.32Mn0.32Co0.40O2 можно отметить, что наряду со слоистым Li(Ni,Mn,Co)O2 образуется шпинель Li(Ni,Mn,Co)2O4, а медленно охлажденный состав LiNi0.60Mn0.20Co0.20O2, как видно на сечениях тетраэдра Li–Ni–Mn–Co, из-за смещения области гомогенности Li(Ni,Mn,Co)O2 оказывается граничным [2].
Однофазность, обнаруженная для образца LiNi0.20Mn0.20Co0.20Fe0.40O2 (рис. 1, кривая 3), нарушается при увеличении содержания железа до LiNi0.17Mn0.17Co0.17Fe0.50O2 (рис. 1, кривая 4) и LiNi0.13Mn0.13Co0.13Fe0.60O2 (рис. 1, кривая 5), о чем свидетельствует появление (~30° и ~36°) и расщепление (~18° и ~44°) пиков. При наличии Li номинальное соотношение Li : (Ni,Mn,Co,Fe) = 1 : 1 не является препятствием к образованию шпинели, подобной Li2NiFe2O4 (a = 8.34 Å) [14]. Составы LiNi0.10Mn0.10Co0.10Fe0.70O2 (рис. 1, кривая 6) и LiNi0.07Mn0.07Co0.07Fe0.80O2 (рис. 1, кривая 7) попадают в область гомогенности шпинели Li2(Ni,Mn,Co,Fe)2O4 (a = 8.335 Å). В образце LiNi0.03Mn0.03Co0.03Fe0.90O2 (рис. 1, кривая 8) шпинель сохраняется в виде примеси при кубической модификации LiFeO2 (рис. 1). Хотя одна из возможных причин образования шпинели при исходном соотношении Li : (Ni,Mn,Co,Fe) = 1 : 1 связана с потерей лития, синтез гомогенного LiFeO2 это опровергает.
Фазовые составы Li(Ni0.33Mn0.33Co0.33)1 –xFexO2 (рис. 1) и Li(Ni0.60Mn0.20Co0.20)1 –xFexO2 (рис. 2) заметно отличаются. В материаловедении ЛИА расщепление пиков (006)/(102) и (108)/(110) при 38° и 65°, а также соотношение интенсивностей I003(~18°)/I104(~44°) являются индикатором существования ромбоэдрической фазы. Для LiNi0.33Mn0.33Co0.33O2 и LiNi0.60Mn0.20Co0.20O2, полученных методом соосаждения с отжигом (15 ч) при 950 и 900°C, значения I003/I104 составили 1.35 и 1.26 [15], однако в случае синтеза LiNi0.60Mn0.20Co0.20O2 по золь-гель методике с использованием лимонной кислоты и после отжига (12 ч) при 800°C двойные пики не проявились и значение I003/I104 уменьшилось до 1.16, а расщепление после 900oC сопровождалось снижением I003/I104 до 1.01 [16].
Рис. 2.
Дифрактограммы образцов номинального состава Li(Ni0.60Mn0.20Co0.20)1 – xFexO2: LNMC2 – LiNi0.60Mn0.20Co0.20O2, 1 – LiNi0.54Mn0.18Co0.18Fe0.10O2, 2 – LiNi0.48Mn0.16Co0.16Fe0.20O2, 3 – LiNi0.42Mn0.14Co0.14Fe0.30O2, 4 – LiNi0.36Mn0.12Co0.12Fe0.40O2, 5 – LiNi0.30Mn0.10Co0.10Fe0.50O2, 6 – LiNi0.24Mn0.08Co0.08Fe0.60O2, 7 – LiNi0.18Mn0.06Co0.06Fe0.70O2, 8 – LiNi0.12Mn0.04Co0.04Fe0.80O2, 9 – LiNi0.06Mn0.02Co0.02Fe0.90O2.
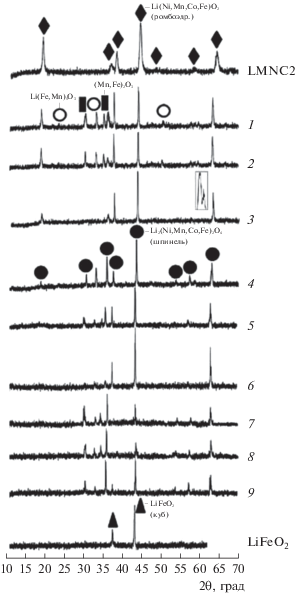
На рис. 2 для LiNi0.6Mn0.2Co0.2O2 (LNMC2) явное расщепление пиков отсутствует и I003/I104 < 1. Подобную картину наблюдали для слоистых твердых растворов, обогащенных никелем, в системе Li–Mn–Ni–O [17].
В образцах LiNi0.54Mn0.18Co0.18Fe0.1O2 и LiNi0.48Mn0.16Co0.16Fe0.2O2 (рис. 2, кривые 1 и 2), кроме шпинели, как в случае LiNi0.3Mn0.3Co0.3Fe0.1O2 и LiNi0.25Mn0.25Co0.25Fe0.25O2 (рис. 1, кривые 1 и 2), дополнительно выделяются фазы со структурой биксбиита – (Mn,Fe)2O3 и α-Li(Fe,Mn)5O8. Это свидетельствует о том, что при таких соотношениях катионов и таких условиях синтеза оксид железа не встраивается в слоистую структуру Li(Ni,Mn,Co)O2, но составу LiNi0.42Mn0.14Co0.14Fe0.3O2 отвечает гомогенный твердый раствор, для которого наблюдается расщепление пиков (108)/(110) (рис. 2, кривая 3). Анализ химического состава образца, проведенный с помощью РСМА, подтвердил его тождественность исходно заданному соотношению Ni : Mn : Co : Fe.
Подобное растворение Fe наблюдается для LiNi0.2Mn0.2Co0.2Fe0.4O2 (рис. 1, кривая 3) и не противоречит тому, что для твердых растворов LiNi1 – yFeyO2 со слоистой структурой гомогенность сохраняется до y = 0.3 [18].
Дальнейшее увеличение доли катионов железа в образцах Li(Ni0.60Mn0.20Co0.20)1 –xFexO2 приводит вначале к появлению (Mn,Fe)2O3 и шпинели (LiNi0.36Mn0.12Co0.12Fe0.40O2, a = 8.329 Å; рис. 2, кривая 4), а затем и α-Li(Fe,Mn)5O8 (LiNi0.30Mn0.10Co0.10Fe0.50O2; рис. 2, кривая 5). Следующему составу LiNi0.24Mn0.08Co0.08Fe0.6O2 (рис. 2, кривая 6) соответствует шпинель с примесью (Mn,Fe)2O3, а далее (LiNi0.18Mn0.06Co0.06Fe0.7O2, рис. 2, кривая 7) опять образуется α-Li(Fe,Mn)5O8. В образцах LiNi0.12Mn0.04Co0.04Fe0.8O2 и LiNi0.06Mn0.02Co0.02Fe0.9O2, кроме шпинели, (Mn,Fe)2O3 и α-Li(Fe,Mn)5O8, проявляется кубический феррит лития LiFeO2 (рис. 2, кривые 8 и 9).
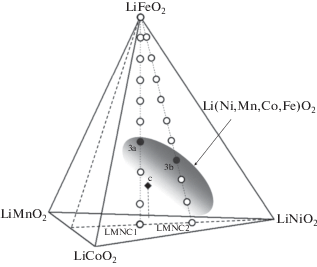
Тетраэдр составов псевдочетырехкомпонентной системы LiNiO2–LiMnO2–LiCoO2–LiFeO2 (рис. 3) не позволяет представить многофазные равновесия с участием шпинели Li(Ni,Mn,Co,Fe)2O4, галита Li(Ni,Mn,Co,Fe)O, биксбиита (Mn,Fe)2O3 и α-Li(Fe,Mn)5O8. Однако с помощью тетраэдра можно оценить положение концентрационного полиэдра Li(Ni,Mn,Co,Fe)O2, который смещен к LiNiO2, согласно исследованиям в тройной системе LiNiO2–LiMnO2–LiCoO2 [19–21]. Ноды (рис. 3), соединяющие LiNi0.33Mn0.33Co0.33O2 и LiNi0.60Mn0.20Co0.20O2 (точки LNMC1 и LNMC2 на основании тетраэдра) с LiFeO2 (вершина тетраэдра), касаются объема гомогенности Li(Ni,Mn,Co,Fe)O2 вблизи составов LiNi0.20Mn0.20Co0.20Fe0.40O2 и LiNi0.42Mn0.14Co0.14Fe0.30O2 (точки 3а и 3b). Однофазный LiNi0.33Mn0.33Co0.17Fe0.17O2, синтезированный в [6], оказывается внутри объема гомогенности (рис. 3). Параметры элементарной гексагональной ячейки для исходных образцов LiNi0.33Mn0.33Co0.33O2 и LiNi0.60Mn0.20Co0.20O2 составляют: a = 2.892, c = 14.302 Å и a = 2.896, c = 14.245 Å, а для беспримесных образцов LiNi0.20Mn0.20Co0.20Fe0.40O2 и LiNi0.42Mn0.14Co0.14Fe0.3O2a = 2.88, c =14.34 Å и a = 2.938, c =14.376 Å. Для LiNi0.33Mn0.33Co0.17Fe0.17O2 [6] получены величины: a = 2.8854, c =14.3690 Å (синтез при 750°С) и a = 2.864, c =14.247 Å (900°С).
Рис. 3.
Поверхность гомогенности твердого раствора Li(Ni,Mn,Co,Fe)O2 в тетраэдре LiNiO2–LiMnO2– LiCoO2–LiFeO2. Отмечены точки: 3a – LiNi0.20Mn0.20Co0.20Fe0.40O2, 3b – LiNi0.42Mn0.14Co0.14Fe0.30O2, c – LiNi0.33Mn0.33Co0.17Fe0.17O2 [6].
Предельное содержание Fe в твердом растворе Li(Ni,Mn,Co,Fe)O2 изменяется в зависимости от соотношения Li : Ni : Mn : Co, температуры и парциального давления кислорода. Систематические исследования системы Li–Ni–Mn–Co–Fe–O проводятся в рамках изоконцентрат, изобар, изотерм и их комбинаций, но даже при таких ограничениях стабильность или метастабильность фазовых состояний экспериментально изучаемых материалов определяется методикой синтеза.
В нашем случае при использовании метода сжигания геля и последующего отжига до температуры 800°C на воздухе получены однофазные образцы составов LiNi0.2Mn0.2Co0.2Fe0.4O2 и LiNi0.42Mn0.14Co0.14Fe0.3O2. Хотя сжигание геля не является оптимальным методом синтеза твердых растворов Li(Ni,Mn,Co,Fe)O2 [22], из-за неустойчивой воспроизводимости фазового состава образцов это обстоятельство не опровергает возможности введения 15–20% Fe в слоистую структуру Li(Ni,Mn,Co,Fe)O2.
Допирование Li(Ni,Mn,Co)O2 алюминием [23], титаном [24] или цирконием [25] в пределах 1.5–4% от общего числа катионов не решает проблему принципиального улучшения материалов ЛИА. В то же время обнаруженная растворимость 15–20% железа в кристаллитах Li(Ni,Mn,Co,Fe)O2 позволяет рассчитывать на создание более дешевых и безопасных материалов, а также на введение бóльших количеств других элементов в Li(Ni,Mn,Co)O2 с целью последующего установления их влияния на электрохимические характеристики ЛИА.
ЗАКЛЮЧЕНИЕ
Методом сжигания геля на основе крахмала и сахарозы впервые получены гомогенные кристаллиты LiNi0.20Mn0.20Co0.20Fe0.40O2 и LiNi0.42Mn0.14Co0.14Fe0.3O2 со структурой α-NaFeO2.
Методом рентгенофазового анализа исследованы образцы брутто-составов Li(Ni0.33Mn0.33Co0.33)1 – x FexO2 и Li(Ni0.60Mn0.20Co0.20)1 – xFexO2 (0 ≤ х ≤1) и определено положение метастабильной области твердого раствора Li(Ni,Mn,Co,Fe)O2 в рамках изобарно-изотермической диаграммы квазичетверной системы LiNiO2–LiMnO2–LiCoO2–LiFeO2.
Список литературы
Xie Y., Jin Y., Xiang L. // Crystals. 2017. V. 7. № 7. 221. P. 1. https://doi.org/10.3390/cryst7070221
Brown C.R., McCalla E., Watson C. et al. // ASC Comb. Sci. 2015. V. 17. P. 381. https://doi.org/10.1021/acscombsci.5b00048
Нипан Г.Д., Клындюк А.И. // Неорган. материалы. 2019. Т. 55. № 2. С. 154. [Nipan G.D., Klyndyuk A.I. // Inorg. Mater. 2019. V. 55. № 2. P. 135. https://doi.org/10.1134/S0020168519020080]https://doi.org/10.1134/S0002337X19020088
Hirayama M., Tomita H., Kubota K. et al. // Mater. Res. Bull. 2012. V. 47. № 1. P. 79. https://doi.org/10.1016/j.materresbull.2011.09.024
Ohzuku T., Makimura Y. // Chem. Lett. 2001. V. 30. № 7. P. 642. https://doi.org/10.1246/cl.2001.642
Meng Y.S., Wu Y.W., Hwang B.J. et al. // J. Electrochem. Soc. 2004. V. 151. № 8. P. A1134. https://doi.org/10.1149/1.1765032
Idemoto Y., Matsui T. // Electrochemistry (Japan). 2007. V. 75. № 10. P. 791.
Wilcox J., Patoux S., Doeff M. // J. Electrochem. Soc. 2009. V. 156. № 3. P. A192. https://doi.org/10.1149/1.3056109
Mohd Hilmi J., Nor Sabirin Mohamed, Yahya R. // Adv. Mater. Res. 2012. V. 501. P. 56. https://doi.org/10.4028/www.scientific.net/AMR.501.56
Son J.-T., Cairns E. // Korean J. Chem. Eng. 2007. V. 24. № 5. P. 888. https://doi.org/10.1007/s11814-007-0060-4
El Mofid W. // Dissertation. Synthesis and characterization of novel cathode material with improved specific capacity and safety for lithium ion batteries. Techniscen Universität Ilmenau. 2016. 121 p. urn:nbn:de:gbv:ilm1-2016000524
Wilcox J.D., Rodrigues E.E., Doeff M.M. // J. Electrochem. Soc. 2009. V. 156. № 12. P. A1011. https://doi.org/10.1149/1.3237100
Смирнова М.Е., Копьева М.А., Береснев Э.Н. и др. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1257. [Smirnova M.N., Kop’eva M.A., Beresnev E.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1257. https://doi.org/10.1134/S0036023618100182]https://doi.org/10.1134/S0044457X18100185
Ding K., Zhao J., Zhou J. et al. // Mater. Chem. Phys. 2016. V. 177. P. 31. https://doi.org/10.1016/j.matchemphys.2016.03.030
Noh H.-J., Youn S., Youn C.S. et al. // J. Power Sources. 2013. V. 233. P. 121. https://doi.org/10.1016/j.jpowsour.2013.01.063
Lee S.-W., Kim H., Kim M.-S. et al. // J. Power Sources. 2016. V. 315. P. 261. https://doi.org/10.1016/j.jpowsour.2016.03.020
McCalla E., Rowe A.W., Shunmugasundaram R. et al. // Chem. Mater. 2013. V. 25. P. 989. https://doi.org/10.1021/cm304002b
Prado G., Suard E., Fournes L. et al. // J. Mater. Chem. 2000. V. 10. P. 2553. https://doi.org/10.1039/B002975K
Kan W.H., Huq A., Mathiram A. // Chem. Mater. 2016. V. 28. № 6. P. 1832. https://doi.org/10.1021/acs.chemmater.5b04994
Wei Y., Zheng J., Cui S. et al. // J. Am. Chem. Soc. 2015. V. 137. № 26. P. 8364. https://doi.org/10.1021/jacs.5b04040
Zheng J., Liu T., Hu Z. et al. // J. Am. Chem. Soc. 2016. V. 138. № 40. P. 13 326. https://doi.org/10.1021/jacs.6b07771
Xu L., Zhou F., Liu B. et al. // Int. J. Electrochem. 2018. V. 2018. P. 1. https://doi.org/10.1155/2018/6930386
Yi T.-F., Han X., Yang S.-Y. et al. // Sci. China Mater. 2016. V. 59. № 8. P. 618. https://doi.org/10.1007/s40843-016-5097-7
Kam K.C., Doeff M.M. // J. Mater. Chem. 2011. V. 21. P. 9991. https://doi.org/10.1039/c0jm04193a
Lu Y., Pang M., Shi S. et al. // Sci. Reports. 2018. V. 8. № 1. P. 2981. https://doi.org/10.1038/s41598-018-21345-6
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


