Журнал неорганической химии, 2019, T. 64, № 10, стр. 1051-1056
Синтез и строение 3,3,3-трифторпропанатов три- и тетрафенилсурьмы
В. В. Шарутин 1, *, О. К. Шарутина 1, А. Н. Ефремов 1, Е. В. Артемьева 1
1 Южно-Уральский государственный университет
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: vvsharutin@rambler.ru
Поступила в редакцию 08.10.2018
После доработки 31.10.2018
Принята к публикации 15.04.2019
Аннотация
Взаимодействием трифенилсурьмы с 3,3,3-трифторпропановой кислотой (HL) в присутствии трет-бутилгидропероксида получен бис(3,3,3-трифторпропанат) трифенилсурьмы (I), превращающийся при обработке пентафенилсурьмой в 3,3,3-трифторпропанат тетрафенилсурьмы (II). Гидролиз соединения I приводит к образованию µ2-оксо-бис(3,3,3-трифторпропанатотрифенилсурьмы) (III). Соединение II синтезировано также из HL и пентафенилсурьмы. При избытке кислоты (2 : 1 мол.) из реакционной смеси выделен сольват Ph4SbOC(O)CH2CF3 ⋅ HOC(O)CH2CF3 (IV). По данным рентгеноструктурного анализа, в соединениях II−IV атомы Sb имеют координацию в разной степени искаженной тригональной бипирамиды. Аксиальные углы СSbO в II и IV равны 173.29(7)° и 178.06(11)° соответственно. В центросимметричной молекуле III (центр инверсии – мостиковый атом кислорода) углы OSbO составляют 175.64(6)°. Длины связей Sb−O и Sb−С равны 2.255(2) и 2.109(2)−2.167(2) Å в II; 1.8169(3), 2.045(2) и 2.065(2)−2.403(3) Å в III; 2.319(3) и 2.110(4)−2.168(3) Å в IV. Внутримолекулярные расстояния Sb⋅⋅⋅O с карбонильным атомом кислорода (3.414(3) Å (II), 3.232(4) Å (III), 3.233(4) Å (IV)) меньше суммы ван-дер-ваальсовых радиусов Sb и O на ∼0.3−0.5 Å.
ВВЕДЕНИЕ
Хорошо изученными сурьмаорганическими соединениями являются дикарбоксилаты триарилсурьмы и карбоксилаты тетраарилсурьмы [1], биологическая активность которых зависит от типа арильного радикала при атоме металла и природы заместителей в карбоксилатных лигандах [2, 3]. Расширение ряда подобных соединений, содержащих различные заместители при атоме сурьмы, является актуальной задачей, поскольку даже небольшие изменения в строении молекулы могут привести к изменению спектра их биологического действия.
К настоящему времени известны многочисленные дикарбоксилаты триарилсурьмы, которые получали по реакции окислительного присоединения из триарилсурьмы и карбоновых кислот в присутствии пероксида [4–8] или из дигалогенидов триарилсурьмы по реакции замещения [9–14]. Менее изучены карбоксилаты тетраарилсурьмы, которые синтезировали либо деарилированием пентаарилсурьмы карбоновыми кислотами, либо по реакции перераспределения лигандов из пентаарилсурьмы и дикарбоксилатов триарилсурьмы [5]. О получении и особенностях строения дикарбоксилатов триарилсурьмы с атомами фтора в карбоксилатных лигандах ранее сообщалось только в работах [15, 16], фторсодержащие карбоксилаты тетраарилсурьмы к настоящему времени не известны.
В продолжение исследований особенностей синтеза и строения дикарбоксилатов триарилсурьмы нами получены бис(3,3,3-трифторпропанат) трифенилсурьмы (I), 3,3,3-трифторпропанат тетрафенилсурьмы (II), µ2-оксо-бис(3,3,3-трифторпропанатотрифенилсурьма) (III) и сольват (1 : 1) 3,3,3-трифторпропаната тетрафенилсурьмы с HL (IV).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Ph3Sb[OC(O)CH2CF3]2 (I). Смесь 100 мг (0.28 ммоль) трифенилсурьмы, 72 мг (0.566 ммоль) HL и 36 мг (0.28 ммоль) 70%-ного водного раствора трет-бутилгидропероксида в 30 мл диэтилового эфира выдерживали при 20°C в течение 24 ч. Получили бесцветные кристаллы, выход 150 мг (87%), tпл = 163°С. ИК-спектр (ν, см−1): 3059, 1714, 1480, 1437, 1333, 1142, 1128, 1070, 1022, 997, 943, 814, 785, 733, 711, 689, 604, 555, 459, 435, 426, 411.
Ph4SbOC(O)CH2CF3 (II). a) Смесь 100 мг (0.20 ммоль) пентафенилсурьмы и 25 мг (0.20 ммоль) HL в 30 мл смеси бензол–октан (5 : 1) выдерживали при 20°C до полного испарения растворителей. Получили бесцветные кристаллы, выход 103 мг, (94%), tразл = 128°С. ИК-спектр (ν, см−1): 3076, 3061, 3045, 3020, 2987, 1662, 1577, 1479, 1456, 1436, 1429, 1355, 1328, 1307, 1261, 1238, 1190, 1161, 1124, 1080, 1066, 1020, 997, 937, 927, 858, 767, 738, 729, 692, 673, 653, 594, 530, 455, 445, 418.
б) Смесь 100 мг (0.20 ммоль) пентафенилсурьмы, 120 мг (0.20 ммоль) соединения I и 30 мл смеси бензол–октан (5 : 1) нагревали при 100°С в течение 1 ч, удаляли растворитель. Получили бесцветные кристаллы, выход 215 мг (98%), tразл = 128°С.
Синтез [Ph3SbOC(O)CH2CF3]2O (III). a) Смесь 100 мг (0.28 ммоль) трифенилсурьмы, 36 мг (0.28 ммоль) HL и 36 мг (0.28 ммоль) 70%-ного водного раствора трет-бутилгидропероксида в 30 мл диэтилового эфира выдерживали при 20°C в течение 24 ч. Твердый остаток перекристаллизовывали из смеси растворителей бензол–гептан (2 : 1). Получили бесцветные кристаллы, выход 133 мг (96%), tразл = 160°С. ИК-спектр (ν, см−1): 3147, 3064, 3018, 2991, 2935, 1961, 1888, 1816, 1764, 1653, 1614, 1577, 1535, 1481, 1436, 1415, 1346, 1307, 1284, 1249, 1184, 1159, 1109, 1074, 1022, 997, 970, 935, 927, 854, 777, 746, 738, 692, 671, 665, 607, 532, 460, 453, 418.
б) Соединение I (100 мг) растворяли в 30 мл водного этанола, удаляли растворитель, остаток перекристаллизовывали из смеси бензол–гептан (2 : 1). Выход 78 мг (98%), tразл = 160°С.
Синтез Ph4Sb[OC(O)CH2CF3]2 ⋅ HOOCCH2CF3 (IV). а) Смесь 100 мг (0.18 ммоль) II и 23 мг (0.18 ммоль) HL в 30 мл смеси бензол–октан (5 : 1) выдерживали при 20°C в течение 24 ч. При медленном испарении растворителя происходило образование бесцветных кристаллов, которые сушили и взвешивали. Выход 117 мг (95%), tразл = 120°С. ИК-спектр (ν, см−1): 3076, 3062, 3045, 3018, 2987, 1751, 1662, 1616, 1577, 1508, 1481, 1436, 1429, 1388, 1355, 1307, 1261, 1238, 1190, 1124, 1080, 1066, 1020, 997, 937, 927, 856, 767, 738, 729, 694, 673, 653, 638, 594, 530, 455, 445.
б) Смесь 100 мг (0.20 ммоль) пентафенилсурьмы и 50 мг (0.40 ммоль) HL в 30 мл смеси бензол–октан (5 : 1) выдерживали при 20°C в течение 24 ч. Получили бесцветные кристаллы, выход 121 мг (90%), tразл = 120°С.
ИК-спектры соединений I–IV записывали на ИК-спектрометре Shimadzu IRAffinity-1S в области 4000–400 см–1 (таблетки KBr).
РСА кристаллов II−IV проведен на дифрактометре D8 QUEST фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор) при 296(2) K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [17]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [18] , OLEX2 [19]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положения атомов водорода определены геометрически по модели “наездника”. Кристаллографические данные и результаты уточнения структуры приведены в табл. 1, основные длины связей и валентные углы – в табл. 2. Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1 851 769 (II), 1 851 768 (III), 1 851 770 (IV); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур II–IV
| Параметр | II | III | IV |
|---|---|---|---|
| М | 557.20 | 976.19 | 685.25 |
| Сингония | Моноклинная | Моноклинная | Моноклинная |
| Пр. гр. | P21/c | P21/c | P21/c |
| Параметры решетки: | |||
| a, Å | 13.130(4) | 9.408(2) | 15.689(7) |
| b, Å | 10.818(5) | 19.399(6) | 10.552(5) |
| c, Å | 17.515(6) | 11.184(3) | 17.974(9) |
| α, град | 90.00 | 90.00 | 90.00 |
| β, град | 101.037(12) | 92.584(11) | 96.316(19) |
| γ, град | 90.00 | 90.00 | 90.00 |
| V, Å3 | 2441.7(16) | 2039.1(9) | 2957(2) |
| Z | 4 | 2 | 4 |
| ρвыч, г/см3 | 1.516 | 1.590 | 1.539 |
| μMo, мм−1 | 1.174 | 1.394 | 1.003 |
| F(000) | 1112.0 | 964.0 | 1368.0 |
| Размер кристалла, мм | 0.67 × 0.4 × 0.15 | 0.55 × 0.26 × 0.09 | 0.41 × 0.23 × 0.09 |
| 2θ, град | 5.72−2.68 | 5.56−92.94 | 5.98–53.64 |
| Интервалы индексов отражений | −24 ≤ h ≤ 24, −20 ≤ k ≤ 20, −32 ≤ l ≤ 32 |
−19 ≤ h ≤ 18, −33 ≤ k ≤ 33, −16 ≤ l ≤ 16 |
−19 ≤ h ≤ 19, −13 ≤ k ≤ 13, −22 ≤ l ≤ 22 |
| Всего отражений | 98 337 | 84 422 | 34 278 |
| Независимых отражений | 16 349 (Rint = 0.0452) |
10 997 (Rint = 0.0406) |
6303 (Rint = 0.0314) |
| Число отражений с F 2 > 2σ(F 2) | 9822 | 7555 | 4972 |
| Число уточняемых параметров | 299 | 251 | 370 |
| GOOF | 1.011 | 1.058 | 1.043 |
| R-факторы по F 2 > 2σ(F 2) | R1 = 0.0487, wR2 = 0.0988 | R1 = 0.0435, wR2 = 0.1053 | R1 = 0.0381, wR2 = 0.0997 |
| R-факторы по всем отражениям | R1 = 0.0990, wR2 = 0.1190 | R1 = 0.0798, wR2 = 0.1212 | R1 = 0.0530, wR2 = 0.1129 |
| Остаточная электронная плотность (max/min), e/Å3 | 1.29/−1.14 | 1.41/−1.28 | 0.51/−0.84 |
Таблица 2.
Некоторые межатомные расстояния и валентные углы в структурах II–IV
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| II | |||
| Sb(1)−O(1) | 2.2552(16) | C(1)Sb(1)O(1) | 79.47(7) |
| Sb(1)−C(1) | 2.1172(19) | C(31)Sb(1)O(1) | 173.29(7) |
| Sb(1)−C(31) | 2.167(2) | C(21)Sb(1)O(1) | 87.73(7) |
| Sb(1)−C(21) | 2.111(2) | C(21)Sb(1)C(1) | 121.50(8) |
| Sb(1)−C(11) | 2.109(2) | C(21)Sb(1)C(31) | 95.85(8) |
| O(1)−C(7) | 1.277(3) | C(11)Sb(1)C(1) | 116.83(8) |
| O(2)−C(7) | 1.222(3) | C(11)Sb(1)C(31) | 97.37(9) |
| F(1)−C(9) | 1.324(4) | C(11)Sb(1)C(21) | 118.78(8) |
| III | |||
| Sb(1)−O(1) | 1.8169(3) | O(1)Sb(1)O(2) | 175.64(6) |
| Sb(1)−O(2) | 2.0450(16) | O(1)Sb(1)C(11) | 104.98(6) |
| Sb(1)−C(11) | 2.065(2) | O(1)Sb(1)C(21) | 92.28(6) |
| Sb(1)−C(21) | 2.218(3) | O(2)Sb(1)C(1) | 101.14(8) |
| Sb(1)−C(1) | 2.403(3) | C(11)Sb(1)C(21) | 105.68(11) |
| O(1)−Sb(1а) | 1.8169(3) | C(11)Sb(1)C(1) | 127.47(9) |
| O(2)−C(7) | 1.313(3) | C(21)Sb(1)C(1) | 126.23(9) |
| O(3)−C(7) | 1.282(3) | Sb(11)O(1)Sb(1) | 180.0 |
| Преобразования симметрии: а1 – x, 1 – y, 1 – z. | |||
| IV | |||
| Sb(1)−O(1) | 2.319(3) | C(11)Sb(1)C(1) | 114.11(14) |
| Sb(1)−C(11) | 2.110(4) | C(11)Sb(1)C(31) | 95.34(13) |
| Sb(1)−C(1) | 2.116(3) | C(11)Sb(1)C(21) | 126.41(13) |
| Sb(1)−C(31) | 2.168(3) | C(1)Sb(1)O(1) | 81.92(12) |
| Sb(1)−C(21) | 2.114(4) | C(31)Sb(1)O(1) | 178.06(11) |
| O(1)−C(7) | 1.268(5) | C(21)Sb(1)C(1) | 115.54(14) |
| O(2)−C(7) | 1.230(5) | C(21)Sb(1)C(31) | 96.46(13) |
| O(4)−C(17) | 1.199(6) | O(4)C(17)O(3) | 126.6(5) |
| O(3)−C(17) | 1.245(6) | O(1)C(7)O(2) | 125.9(2) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что окисление трифенилсурьмы пероксидом водорода в присутствии уксусной кислоты приводит к получению диацетата трифенилсурьмы [4], проведение аналогичной реакции в присутствии трет-бутилгидропероксида и карбоновой кислоты сопровождается образованием дикарбоксилата триарилсурьмы [6, 7, 20].
Нами установлено, что реакция трифенилсурьмы с HL в эфире в присутствии трет-бутилгидропероксида (мольное соотношение 1 : 2 : 1) протекает с образованием бис(3,3,3-трифторпропаната) трифенилсурьмы, выделенного из реакционной смеси с выходом 87%, строение которого доказано на основании результатов элементного анализа, ИК-спектроскопии, а также предварительных данных РСА (пр. гр. P21/c, a = 9.095(2), b = 22.704(6), c = 12.487(4) Å, β = 106.229(12)°, R = = 0.759).
(I)
$\begin{gathered} {\text{P}}{{{\text{h}}}_{3}}{\text{Sb}} + 2{\text{HOC}}({\text{O}}){\text{C}}{{{\text{H}}}_{2}}{\text{C}}{{{\text{F}}}_{3}} + t{\text{ - BuOOH}} \to \\ \to {\text{P}}{{{\text{h}}}_{3}}{\text{Sb}}{{[{\text{OC(O)C}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{F}}}_{3}}]}_{2}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + t{\text{ - BuOH}}. \\ \end{gathered} $(II)
$\begin{gathered} {\text{I}} + {\text{P}}{{{\text{h}}}_{5}}{\text{Sb}} \to {\text{P}}{{{\text{h}}}_{{\text{4}}}}{\text{SbOC}}\left( {\text{O}} \right){\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{F}}}_{3}} \leftarrow \\ \leftarrow {\text{P}}{{{\text{h}}}_{{\text{5}}}}{\text{Sb}} + {\text{HOC}}\left( {\text{O}} \right){\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{F}}}_{3}}. \\ \end{gathered} $(III)
$\begin{gathered} {\text{I}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {{\left[ {{\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{SbOC}}\left( {\text{O}} \right){\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{F}}}_{3}}} \right]}_{2}}{\text{O}} \leftarrow \hfill \\ \leftarrow {\text{P}}{{{\text{h}}}_{{\text{3}}}}{\text{Sb}} + {\text{HOC}}\left( {\text{O}} \right){\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{C}}{{{\text{F}}}_{3}} + t{\text{ - BuOOH}}. \hfill \\ \end{gathered} $Установлено, что при смешении эквимолярных количеств соединения II с 3,3,3-трифторпропановой кислотой в смеси бензол–октан (5 : 1) образуется сольват Ph4SbOC(O)CH2CF3 ⋅ HOC(O)CH2CF3 (IV), который можно получить непосредственно взаимодействием пентафенилсурьмы с избытком HL (мольное соотношение 1 : 2) в бензоле. О выделении подобных сольватов с уксусной и азотной кислотами сообщалось в [22, 23].
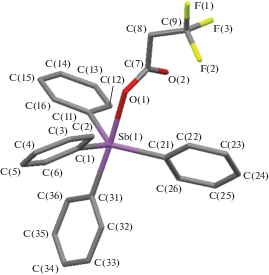
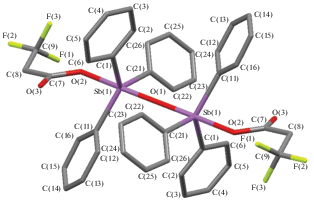
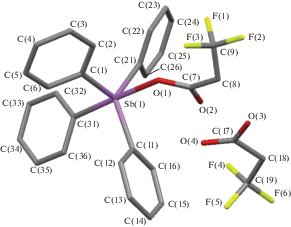
По данным РСА, в соединениях II−IV атомы Sb имеют искаженную в разной степени тригонально-бипирамидальную координацию с электроотрицательными карбоксилатными лигандами в аксиальных позициях (рис. 1–3). Аксиальные углы СSbO в II и IV равны 173.29(7)° и 178.06(11)° соответственно. В центросимметричной молекуле III (центр инверсии – мостиковый атом кислорода) угол OSbO равен 175.64(6)°. Угол при мостиковом атоме кислорода линейный. Суммы углов СSbС в экваториальной плоскости в молекулах II, III и IV составляют 357.11(8)°, 359.38(9)° и 356.06(14)° соответственно. В соединениях II и IV атом Sb выходит из плоскости [C3] в сторону аксиального атома углерода на 0.209 и 0.243 Å соответственно, в III – в сторону мостикового атома кислорода на 0.100 Å. Плоские фенильные кольца в структурах II−IV развернуты вокруг связей Sb−C таким образом, чтобы свести к минимуму внутри- и межмолекулярные контакты. В молекуле III длина экваториальных связей Sb−C значительно различается: 2.065(2), 2.218(3), 2.403(3) Å, при этом самая короткая связь наблюдается с кольцом, образующим максимальный угол с плоскостью [C3]. Связь Sb−O с мостиковым атомом кислорода (1.8169(3) Å) короче аналогичной связи с карбоксилатным лигандом (2.0450(16) Å). Внутримолекулярное расстояние Sb⋅⋅⋅O с карбонильным атомом кислорода равно 3.232(4) Å.
Отметим, что в молекулах µ2-оксо-бис(трифторацетатотрифенилсурьмы) [24], µ2-оксо-бис(2-хлорникотинатотрифенилсурьмы) [25] с угловым строением фрагмента Sb−O−Sb и в молекуле µ2-оксо-бис(хлорацетатотрифенилсурьмы) с линейным строением этого фрагмента [26] средние значения длин связей Sb−O заметно больше: 1.974(5), 2.239(5) Å, 1.955(5), 2.219(5) Å и 1.950(4), 2.197(4) Å соответственно.
В молекулах II и IV экваториальные связи Sb−C (2.110(4)−2.116(3) Å и 2.109(2)−2.117(2) Å) короче аксиальных связей (2.168(3) и 2.167(2) Å) и имеют близкие значения, а связи Sb−O значительно различаются (2.255(2) и 2.319(3) Å соответственно). Меньшей длине связи Sb−O соответствует большее расстояние Sb⋅⋅⋅O (3.414(3) и 3.233(4) Å в II и IV соответственно). В молекуле II связи С−О (1.277(3) Å) и С=О (1.222(3) Å) в карбоксильной группе различаются на 0.055 Å, в то время как в IV разность составляет 0.038 Å (1.268(5) и 1.230(5) Å). Наблюдаемые различия в межъядерных расстояниях, очевидно, обусловлены наличием межмолекулярной водородной связи в аддукте IV между карбонильным атомом кислорода карбоксилатного лиганда и гидроксильной группой молекулы кислоты. Отметим, что геометрические параметры молекулы ацетата тетрафенилсурьмы в свободном виде и в аддукте с уксусной кислотой различаются еще заметнее [27].
Список литературы
Шарутина О.К., Шарутин В.В. Молекулярные структуры органических соединений сурьмы(V). Челябинск: Издательский центр ЮУрГУ, 2012. 395 с.
Hadjikakou S.K., Ozturk I.I., Banti C.N. et al. // J. Inorg. Biochem. 2015. V. 153. P. 293. https://doi.org/10.1016/j.jinorgbio.2015.06.006
Ali M.I., Rauf M.K., Badshah A. et al. // Dalton Trans. 2013. V. 42. P. 16733. https://doi.org/10.1039/C3DT51382C
Thepe T.C., Garascia R.J., Selvoski M.A. et al. // Ohio J. Sci. 1977. V. 77. № 3. P. 134.
Шарутин В.В., Сенчурин В.С. Именные реакции в химии элементоорганических соединений. Челябинск, 2011. 427 с.
Sharutin V.V., Sharutina O.K. // Russ. Chem. Bul. 2017. № 4. P. 707. [Шарутин В.В., Шарутина О.К. // Изв. РАН. Сер. хим. 2017. № 4. С. 707.]https://doi.org/10.1007/s11172-017-1796-6
Sharutin V.V., Sharutina O.K. // Russ. J. Gen. Chem. 2016. V. 86. № 8. P. 1902. [Шарутин В.В., Шарутина О.К. // Журн. общ. химии. 2016. Т. 86. № 8. С. 1366.]https://doi.org/10.1134/S107036321608020X
Sharutin V.V., Sharutina O.K., Efremov A.N. // Russ. J. Inorg. Chem. 2016. V. 61. № 1. P. 43. [Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. неорган. химии. 2016. Т. 61. № 1. С. 46.]https://doi.org/10.1134/S003602361601023X
Yu L., Ma Y.-Q., Wang G.-C. et al. // Heteroatom. Chem. 2004. V. 15. P. 32. https://doi.org/10.1002/hc.10208
Yu L., Ma Y.-Q., Liu R.-C. et al. // Polyhedron. 2004. V. 23. P. 823. https://doi.org/10.1016/j.poly.2003.12.002
Iftikhar T., Rauf M.K., Sarwar S. et al. // J. Organomet. Chem. 2017. V. 851. № 15. P. 89. https://doi.org/10.1016/j.jorganchem.2017.09.002
Hong M., Yin H-D., Li W-K. et al. // Inorg. Chem. Comm. 2011. V. 14. № 10. P. 1616. https://doi.org/10.1016/j.inoche.2011.06.023
Yu L., Ma Y.-Q., Liu R.-C. et al. // Polyhedron. 2004. V. 23. № 5. P. 823. https://doi.org/10.1016/j.poly.2003.12.002
Islam A., Rodrigues B.L., Marzano I.M. et al. // Eur. J. Med. Chem. 2016. V. 109. № 15. P. 254. https://doi.org/10.1016/j.ejmech.2016.01.003
Ferguson G., Kaither B., Glidewell C. et al. // J. Organomet. Chem. 1991. V. 419. № 3. P. 283. https://doi.org/10.1016/0022-328X(91)80241-B
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2012. V. 82. № 1. P. 95. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 2012. Т. 82. № 1. С. 99.]https://doi.org/10.1134/S1070363212010161
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Гущин А.В. Получение органических производных сурьмы, висмута(V) и применение их в органическом синтезе: Дис.… д-ра хим. наук. Нижний Новгород, 1998. 282 с.
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Gen. Chem. 1996. V. 66. № 10. P. 1750. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 1996. Т. 66. № 10. С. 1755.]
Schmidbaur H., Mitschke K.H. // Angew. Chem. 1971. № 83. P. 149. https://doi.org/10.1002/zaac.19713860204
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Inorg. Chem. 2008. V. 53. № 7. P. 1110. [Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. неорган. химии. 2008. Т. 53. № 7. С. 1194.]https://doi.org/10.1134/S0036023608070206
Gibbons M.N., Sowerby D.B. // J. Organomet. Chem. 1998. V. 555. № 2. P. 271.https://doi.org/10.1016/S0022-328X(97)00759-6
Quan L., Yin H., Wang D. // Acta Crystallogr. 2009. V. 65E. № 1. P. m99. https://doi.org/10.1107/S1600536808042335
Quan L., Yin H., Wang D. // Acta Crystallogr. 2008. V. 64E. № 2. P. m349. https://doi.org/10.1107/S1600536808000676
Bone S.P., Sowerby D.B. // Phosphorus, Sulfur and Silicon and the Related Elements. 1989. V. 45. P. 23. https://doi.org/10.1080/10426508908046072
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии