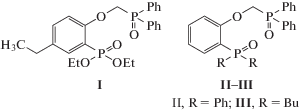
Журнал неорганической химии, 2019, T. 64, № 10, стр. 1104-1110
Экстракция РЗЭ(III) из азотнокислых растворов диэтил(2-((дифенилфосфорил)метокси)-5-этилфенил)фосфонатом
А. Н. Туранов 1, *, В. К. Карандашев 2, 3, В. Е. Баулин 4, 5, Д. В. Баулин 5, В. А. Хвостиков 2
1 Институт физики твердого тела РАН
142432 Черноголовка, Московской обл., ул. Академика Осипьяна, 2, Россия
2 Институт проблем технологии микроэлектроники и особо чистых материалов РАН
142432 Черноголовка, Московской обл., ул. Академика Осипьяна, 6, Россия
3 Национальный исследовательский технологический университет “МИСиС”
119991 Москва, Ленинский пр-т, 4, Россия
4 Институт физиологически активных веществ РАН
142432 Черноголовка, Московской обл., Северный пр-д, 1, Россия
5 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, корп. 4, Россия
* E-mail: turanov@issp.ac.ru
Поступила в редакцию 05.03.2019
После доработки 23.03.2019
Принята к публикации 13.05.2019
Аннотация
Изучена экстракция микроколичеств РЗЭ(III) из азотнокислых растворов растворами диэтил(2-((дифенилфосфорил)метокси)-5-этилфенил)фосфоната (I) в дихлорэтане и ионной жидкости – бис[(трифторметил)сульфонил]имиде 1-бутил-3-метилимидазолия. Определена стехиометрия экстрагируемых комплексов, рассмотрено влияние концентрации HNO3 в водной фазе на эффективность извлечения ионов металлов в органическую фазу. Установлено, что соединение I в дихлорэтане экстрагирует РЗЭ(III) менее эффективно, чем его структурные аналоги с фенильными или бутильными заместителями при атоме фосфора. Показано, что эффективность экстракции РЗЭ(III) соединением I из азотнокислых растворов значительно увеличивается в присутствии ионной жидкости в органической фазе.
ВВЕДЕНИЕ
Экстракционные методы широко используются для извлечения, концентрирования и разделения редкоземельных элементов (РЗЭ) [1]. Изучение экстракционных свойств новых полифункциональных фосфорорганических соединений представляет интерес в связи с перспективами использования их в радиохимической и аналитической практике. Высокой экстракционной способностью по отношению к РЗЭ(III) обладают полидентатные нейтральные фосфорорганические соединения [2, 3], среди которых наиболее детально изучены замещенные диоксиды метилендифосфинов [4], оксиды (диалкилкарбамоилметил)диарилфосфинов (КМФО) [5] и их производные [6], N-дифенилфосфорил-N'-алкилмочевины [7], фосфорилированные каликсарены [8–12 ], фосфорилированные пиридин N-оксиды [13, 14], а также ациклические аналоги краун-эфиров – поданды с амидными [15–20] или фосфорильными [21–23] концевыми группами.
Экстракционная способность и селективность фосфорилсодержащих подандов (ФП) существенно зависят от длины полиэфирной цепи, структуры мостика между эфирным атомом кислорода и РО-группой, а также от природы заместителя при атомах фосфора [21–23]. В ряде случаев замена алкиленового мостика в молекулах диоксидов тетрафенилалкилендифосфинов на этиленгликолевые фрагменты приводит к повышению экстракционной способности соответствующих ФП по отношению к РЗЭ(III) [23]. Среди этих соединений диоксиды тетраарилзамещенных (о-фениленоксиметилен)дифосфинов обладают наиболее высокой экстракционной способностью по отношению к ионам актинидов и РЗЭ(III) [23], превосходя таковую для КМФО. Замена в молекулах этих соединений арильных заместителей при атомах фосфора на алкильные приводит к резкому снижению экстракционной способности ФП по отношению к актинидам и РЗЭ в азотнокислых средах, что связано с проявлением эффекта аномального арильного упрочнения (ЭААУ) экстрагируемых комплексов [24]. Экстракционные свойства ФП с алкоксигруппами при атомах фосфора изучены в значительно меньшей степени [25].
В последнее время вырос интерес к использованию ионных жидкостей (ИЖ) в процессах экстракционного концентрирования и разделения органических и неорганических соединений [26–29]. Экстракция РЗЭ(III) бидентатными нейтральными фосфорорганическими соединениями [30–32] и замещенными дигликольамидами [33–35] значительно возрастает в присутствии ИЖ – бис[(трифторметил)сульфонил]имидов 1-алкил-3-метилимидазолиев. В таких системах для количественного извлечения РЗЭ(III) не требуется значительного избытка ионов NO3– в водной фазе, что является условием экстракции этими экстрагентами в традиционных органических растворителях. Сведения о влиянии ИЖ на экстракцию ионов металлов ФП в литературе отсутствуют.
Цель настоящей работы – исследование влияния ИЖ на эффективность экстракции РЗЭ(III) из азотнокислых растворов соединением I. Для этого рассмотрены некоторые закономерности распределения РЗЭ(III) между водными растворами HNO3 и растворами I в 1.2-дихлорэтане и ИЖ – бис[(трифторметил)сульфонил]имиде 1-бутил-3-метилимидазолия. Сопоставлены данные по экстракции РЗЭ(III) соединением I и его структурными аналогами с фенильными (II) и бутильными (III) заместителями при фосфорильной группе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Диэтил(2-((дифенилфосфорил)метокси)-5-этилфенил)фосфонат (I) получен алкилированием диэтил(2-окси-5-этилфенил)фосфоната (дифенилфосфорил)-метилбензолсульфонатом в присутствии гидрида натрия в кипящем диоксане по описанной ранее методике [36]. Выход соединения I составил 69%, tпл = 89–91°С (бензол–гексан).
| C | H | Р | |
| Найдено, %: | 63.49, 63.15; | 6.05, 6.32; | 16.41, 16.67. |
| Для С25Н30О5Р2 | |||
| вычислено, %: | 63.56; | 6.40; | 16.93. |
Спектр ЯМР 1Н (CDCl3, δ, м. д.): 2.18 м (9H, 2CH3CH2O + Ar–CH2CH3), 3.65 кв (2H, Ar–CH2CH3), 5.01 м (4Н, 2CH3CH2O), 5.82 д (2Н, 2Jн-p = = 16 Гц, OCH2P(O)Ph2), 7.96 т (1Н, 3Jн-н = 7.3 Гц, Ar–H), 8.30 т (1Н, 3Jн-н = 4.6 Гц, Ar–H), 8.52м (6Н, Ar–H), 8.76 д (1Н, 2Jн-p = 32 Гц, Р(О)Ar–H), 9.04 м (4Н, Ar–H). Спектр ЯМР 31Р (CDCl3, δ, м. д.): 18.55, 27.96.
В качестве органических разбавителей использовали 1,2-дихлорэтан марки “х. ч.” без дополнительной очистки и бис[(трифторметил)сульфонил]имид 1-бутил-3-метилимидазолия (C4mimTf2N), синтезированный и очищенный по известной методике [37]. Растворы экстрагента готовили по точной навеске.
Исходные водные растворы РЗЭ(III) готовили растворением соответствующих нитратов в воде с последующим добавлением HNO3. Исходная концентрация ионов металлов составляла 2 × × 10–6 моль/л. Контакт фаз осуществляли при комнатной температуре на роторном аппарате для перемешивания со скоростью 60 об./мин в течение 1 ч. Предварительно установлено, что этого времени достаточно для установления постоянных значений коэффициентов распределения элементов (DLn) в экстракционных системах.
Концентрацию РЗЭ(III) в исходных и равновесных водных растворах определяли методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС) с использованием масс-спектрометра X-7 (Thermo Elemental, США). Содержание элементов в органической фазе определяли после реэкстракции 0.1 М раствором оксиэтилидендифосфоновой кислоты. Коэффициенты распределения элементов рассчитывали как отношение их концентраций в равновесных органической и водной фазах. Погрешность определения коэффициентов распределения не превышала 5%.
Концентрацию ионов Tf2N– в равновесных водных фазах определяли атомно-эмиссионным методом с ионизацией пробы в индуктивно-связанной плазме с использованием спектрометра ICAP-61 (Thermo Jarrel Ash, США).
Концентрацию HNO3 в равновесной водной фазе определяли потенциометрическим титрованием раствором NaOH, в органической – таким же образом после реэкстракции HNO3 водой. Параллельно определяли содержание HNO3 в органической фазе при экстракции кислоты чистым дихлорэтаном (холостой опыт). Результаты холостого опыта учитывали при расчете общей концентрации комплексов HNO3 с экстрагентом в органической фазе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
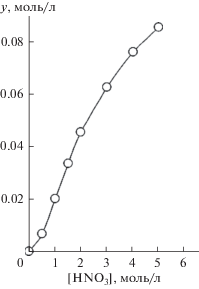
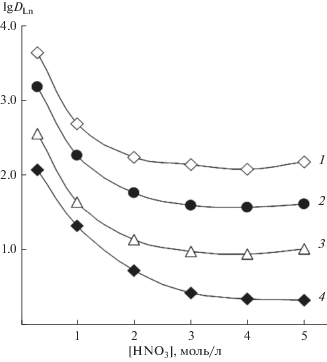
Процесс экстракции ионов металлов из азотнокислых растворов нейтральными фосфорорганическими соединениями сопровождается взаимодействием HNO3 с экстрагентом. Поэтому предварительно была исследована экстракция HNO3 раствором соединения I. Данные по распределению HNO3 между ее водными растворами и раствором соединения I в дихлорэтане (рис. 1) указывают на то, что при [HNO3] > 2.5 моль/л отношение концентрации HNO3, связанной в комплексы с экстрагентом, к исходной концентрации экстрагента в органической фазе превышает 1. Полагая, что в органическую фазу переходят комплексы экстрагента (L) с одной и двумя молекулами азотной кислоты, процесс экстракции HNO3 может быть описан уравнением:
(1)
$i\left( {{{{\text{H}}}^{ + }} + {\text{NO}}_{3}^{--}} \right) + {{{\text{L}}}_{{({\text{o}})}}} \rightleftarrows {{\left( {{\text{HN}}{{{\text{O}}}_{3}}} \right)}_{i}}{{{\text{L}}}_{{{\text{(o)}}}}},$(2)
${{K}_{i}} = {{\left[ {{{{\left( {{\text{HN}}{{{\text{O}}}_{3}}} \right)}}_{i}}{\text{L}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{{{\left( {{\text{HN}}{{{\text{O}}}_{3}}} \right)}}_{i}}{\text{L}}} \right]} {\left( {\left[ L \right]{{a}^{i}}} \right)}}} \right. \kern-0em} {\left( {\left[ L \right]{{a}^{i}}} \right)}},$(3)
${y \mathord{\left/ {\vphantom {y {{{{\left[ {\text{L}} \right]}}_{{{\text{исх}}}}}}}} \right. \kern-0em} {{{{\left[ {\text{L}} \right]}}_{{{\text{исх}}}}}}} = {{\left( {{{K}_{1}}a + 2{{K}_{2}}{{a}^{2}}} \right)} \mathord{\left/ {\vphantom {{\left( {{{K}_{1}}a + 2{{K}_{2}}{{a}^{2}}} \right)} {\left( {1 + {{K}_{1}}a + {{K}_{2}}{{a}^{2}}} \right)}}} \right. \kern-0em} {\left( {1 + {{K}_{1}}a + {{K}_{2}}{{a}^{2}}} \right)}},$Рассмотрено влияние концентрации HNO3 в равновесной водной фазе на изменение коэффициентов распределения РЗЭ(III) при экстракции раствором соединения I в дихлорэтане (рис. 2). Экстракция Ho(III)–Lu(III) возрастает с ростом [HNO3], а при экстракции La(III)–Tb(III) получены зависимости lg DLn–[HNO3] с максимумом, что связано с высаливающим действием ионов ${\text{NO}}_{3}^{--}$ и связыванием экстрагента азотной кислотой, а также с изменением коэффициентов активности нитратов РЗЭ(III) в зависимости от [HNO3]. Положение максимума смещается в область более высокой кислотности водной фазы по мере увеличения атомного номера (Z) РЗЭ, что связано с увеличением энергии гидратации ионов Ln3+ вследствие уменьшения их ионных радиусов с возрастанием Z. Это приводит к увеличению коэффициента разделения Lu/La (βLu/La = DLu/DLa) с ростом концентрации HNO3 (рис. 2). Аналогичный характер зависимостей DLn–[HNO3] отмечался при экстракции РЗЭ(III) растворами соединений II и III в виде координационно-сольватированных нитратов [23].
Рис. 2.
Зависимости коэффициентов распределения Lu(III) (1), Ho(III) (2), Tb(III) (3), Eu(III) (4), Nd(III) (5) и La(III) (6) от концентрации HNO3 в равновесной водной фазе при экстракции 0.1 М растворами соединения I в дихлорэтане.
Стехиометрическое соотношение металл : экстрагент в экстрагируемых комплексах определено методом сдвига равновесия. Полученные данные (рис. 3) показали, что РЗЭ(III) экстрагируются этим соединением в виде смеси моно- и дисольватов. В виде комплексов такой же стехиометрии РЗЭ(III) экстрагируются растворами соединений II и III в дихлорэтане [21]. Полученные данные указывают на то, что природа заместителя при атоме фосфора в соединениях I–III не приводит к существенному изменению стехиометрии экстрагируемых комплексов РЗЭ(III). Исходя из полученных данных, процесс экстракции ионов РЗЭ(III) из растворов HNO3 умеренной концентрации соединением I может быть описан уравнениями:
(3)
${\text{L}}{{{\text{n}}}^{{3 + }}} + 3{\text{NO}}_{3}^{--} + {{{\text{L}}}_{{{\text{(о)}}}}} \rightleftarrows {\text{LnL}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{3({\text{о}})}}},K_{1}^{{{\text{Ln}}}},$(4)
${\text{L}}{{{\text{n}}}^{{3 + }}} + 3{\text{NO}}_{3}^{--} + 2{{{\text{L}}}_{{{\text{(о)}}}}} \rightleftarrows {\text{Ln}}{{{\text{L}}}_{2}}{{\left( {{\text{N}}{{{\text{O}}}_{3}}} \right)}_{{3({\text{о}})}}},K_{2}^{{{\text{Ln}}}}.$(5)
${{D}_{{{\text{Ln}}}}} = {{\left[ {{\text{NO}}_{3}^{--}} \right]}^{{3~}}}\gamma _{ \pm }^{4}\left( {K_{1}^{{{\text{Ln}}}}{{{\left[ L \right]}}_{{{\text{исх}}}}}{{f}^{{--1}}} + K_{2}^{{{\text{Ln}}}}\left[ L \right]_{{{\text{исх}}}}^{2}{{f}^{{--2}}}} \right),$Рис. 3.
Зависимости коэффициентов распределения Lu(III) (1), Tb(III) (2), Eu(III) (3), Nd(III) (4) и La(III) от концентрации соединения I в дихлорэтане при экстракции из 3 М растворов HNO3.
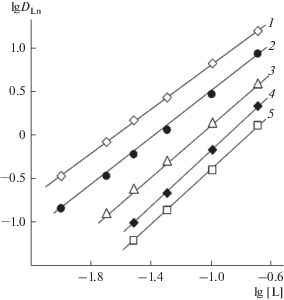
Таблица 2.
Эффективные константы экстракции РЗЭ(III) из растворов HNO3 растворами соединений I–III в дихлорэтане
| Ln(III) | $K_{1}^{{{\text{Ln}}}}$ (I) | $K_{2}^{{{\text{Ln}}}}$ (I) | $K_{2}^{{{\text{Ln}}}}$ (II) [22] | $K_{2}^{{{\text{Ln}}}}$ (III) [22] |
|---|---|---|---|---|
| La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu |
2.02 2.12 2.18 2.21 2.46 2.53 2.51 2.89 2.93 2.92 2.87 2.86 2.87 2.88 |
4.40 4.52 4.62 4.67 4.83 4.92 4.94 5.07 5.06 5.01 4.94 4.92 4.91 4.90 |
6.96 7.16 7.40 7.68 7.86 8.01 7.98 8.38 8.49 8.58 8.66 8.64 8.62 8.62 |
5.01 5.10 5.25 5.49 5.66 5.76 5.56 5.80 5.84 5.84 5.91 5.86 5.81 5.68 |
При экстракции РЗЭ(III) соединениями I–III из растворов с умеренной концентрацией HNO3 наблюдается тенденция уменьшения эффективности экстракции РЗЭ(III) с увеличением Z. Это связано с увеличением устойчивости комплексов РЗЭ(III) с “жесткими” (по Пирсону) лигандами по мере увеличения плотности заряда ионов Ln3+ вследствие уменьшения их ионных радиусов c возрастанием Z [40].
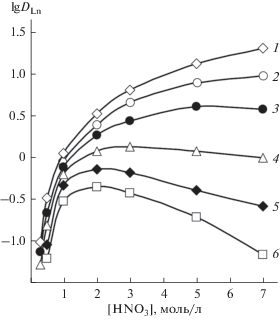
Эффективность экстракции РЗЭ(III) раствором соединения I из азотнокислых растворов значительно возрастает в присутствии ИЖ. Это может быть связано с увеличением гидрофобности экстрагируемых комплексов вследствие замещения ионов ${\text{NO}}_{3}^{ - }$ более гидрофобными Tf2N– [41]. В присутствии ИЖ в органической фазе изменяется характер зависимости lgDLn–[HNO3] (рис. 4). Снижение DLn с ростом [HNO3] до 3 моль/л связано с уменьшением концентрации свободного экстрагента в органической фазе вследствие взаимодействия соединения I как с HNO3, так и с HTf2N, присутствующей в системе вследствие заметного перехода ионов C4mim+ и Tf2N– в водную фазу [42]. Экстракция HTf2N соединением I может быть описана уравнением:
(6)
${{{\text{H}}}^{ + }} + {\text{T}}{{{\text{f}}}_{{\text{2}}}}{{{\text{N}}}^{--}} + {{{\text{L}}}_{{{\text{(o)}}}}} \rightleftarrows {\text{HT}}{{{\text{f}}}_{{\text{2}}}}{\text{N}}{{{\text{L}}}_{{{\text{(o)}}}}},$(7)
${{K}_{{{\text{HTf2N}}}}} = {{\left[ {{\text{HT}}{{{\text{f}}}_{{\text{2}}}}{\text{NL}}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{HT}}{{{\text{f}}}_{{\text{2}}}}{\text{NL}}} \right]} {\left( {\left[ {\text{L}} \right]\left[ {{{{\text{H}}}^{ + }}} \right]\left[ {{\text{T}}{{{\text{f}}}_{{\text{2}}}}{{{\text{N}}}^{--}}} \right]} \right)}}} \right. \kern-0em} {\left( {\left[ {\text{L}} \right]\left[ {{{{\text{H}}}^{ + }}} \right]\left[ {{\text{T}}{{{\text{f}}}_{{\text{2}}}}{{{\text{N}}}^{--}}} \right]} \right)}}.$Рис. 4.
Зависимости коэффициентов распределения Lu(III) (1), Tm(III) (2), Ho(III) (3) и La(III) (4) от концентрации HNO3 в равновесной водной фазе при экстракции 0.1 М растворами соединения I в ИЖ.
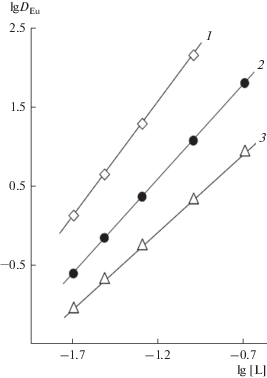
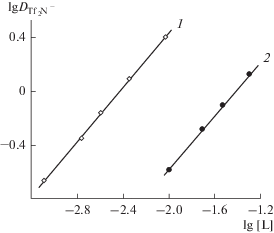
Концентрационная константа экстракции HTf2N соединением I в дихлорэтане рассчитана исходя из данных по зависимости коэффициента распределения иона Tf2N– от концентрации соединения I в органической фазе и ионов Tf2N– и H+ в водной фазе (рис. 5). Предварительно установлено, что в условиях эксперимента ионы Li+ и Cl– не переходят в органическую фазу. Величина ${{K}_{{{\text{HT}}{{{\text{f}}}_{{\text{2}}}}{\text{N}}}}}$ = = 2690 ± 80 значительно превышает константу экстракции HNO3 этим соединением (табл. 1), что связано со значительно большей гидрофобностью аниона Tf2N– по сравнению с ${\text{NO}}_{3}^{ - }.$
Рис. 5.
Зависимости коэффициента распределения иона Tf2N– от концентрации соединения I в дихлорэтане при экстракции из 0.001 М растворов LiTf2N, содержащих 0.1 (1) или 0.01 (2) моль/л HCl.
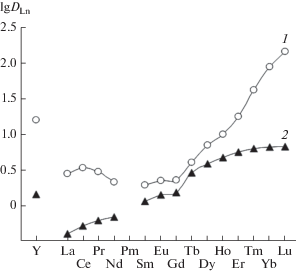
Величина синергетического эффекта S = D/D0 (D и D0 – коэффициенты распределения РЗЭ(III) в присутствии и в отсутствие ИЖ в органической фазе) уменьшается с увеличением [HNO3]. Так, при экстракции Eu(III) величина S уменьшается от 2150 до 2.2 с ростом [HNO3] от 0.3 до 3 моль/л. Характер зависимости DLn–Z при экстракции РЗЭ(III) из азотнокислых растворов растворами I в ИЖ и дихлорэтане существенно различается (рис. 6). Можно видеть, что селективность экстракции тяжелых РЗЭ(III) в системе с ИЖ выше, чем при использовании дихлорэтана в качестве растворителя: величины βLu/Sm в этих системах равны 70.5 и 6.0.
Рис. 6.
Коэффициенты распределения РЗЭ(III) при их экстракции из 3 М растворов HNO3 0.1 М растворами соединения I в ИЖ (1) и дихлорэтане (2).
Стехиометрическое соотношение РЗЭ(III) : I в комплексах, экстрагируемых в присутствии ИЖ, изменяется от 1 : 3 до 1 : 2 по мере увеличения концентрации HNO3 в водной фазе (рис. 7), т.е. в системе с ИЖ наблюдается увеличение сольватных чисел в экстрагируемых комплексах по сравнению с экстракцией растворами соединения I в дихлорэтане (рис. 3). Это связано со слабой координирующей способностью ионов Tf2N– [43], которые находятся, по-видимому, во внешней координационной сфере экстрагируемого комплекса, тогда как в отсутствие ИЖ ионы РЗЭ(III) экстрагируются соединениями I–III в виде координационно-сольватированных нитратов LnLs(NO3)3 (s = = 1, 2), в которых ионы ${\text{NO}}_{3}^{ - }$ участвуют в координации ионов Ln3+ [36].
ЗАКЛЮЧЕНИЕ
Представленные данные показали, что экстракционная способность ФП по отношению к РЗЭ(III) возрастает в ряду соединений I < III < II. Эффективность и селективность экстракции РЗЭ(III) диэтил(2-((дифенилфосфорил)метокси)-5-этилфенил)фосфонатом из азотнокислых растворов значительно увеличивается в присутствии ионной жидкости – бис[(трифторметил)сульфонил]имида 1-бутил-3-метилимидазолия в органической фазе.
Список литературы
Михайличенко А.И., Михлин Е.Б., Патрикеев Ю.Б. Редкоземельные металлы. М.: Металлургия, 1987. 323 с.
Alyapychev M.Yu., Babain V.A., Ustynyuk Yu.A. // Russ. Chem. Rev. 2016. V. 85. № 9. P. 943. https://doi.org/10.1070/RCR4588
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev. 2017. V. 46. P. 7229. https://doi.org/10.1039/C7CS00574A
Розен А.М., Николотова З.И., Карташева Н.А. // Радиохимия. 1986. Т. 28. № 3. С. 407.
Чмутова М.К., Литвина М.Н., Прибылова Г.А. и др. // Радиохимия. 1999. Т. 41. № 4. С. 331.
Sartain H.T., McGraw S.N., Lawrence C.L. // Inorg. Chim. Acta. 2015. V. 426. P. 126. https://doi.org/10.1016/j.ica.2014.11.032
Горюнов Е.И., Горюнова И.Б., Баулина Т.В. и др. // Рос. хим. журн. 2010. Т. 54. № 3. С. 45.
Arnaud-New F., Bohmer V., Dozol J.-F. et al. // J. Chem. Soc., Perkin Trans. 1996. V. 2. P. 1175. https://doi.org/10.1039/P29960001175
Smirnov I., Karavan M., Babain V. et al. // Radiochimica Acta. 2007. V. 95. P. 97. doi:10.1524/ract.2007.95.2.97
Yaftian M.R., Burgard M., Wieser C. et al. // Solvent Extr. Ion Exch. 1998. V. 16. P. 1131. https://doi.org/10.1080/07360299808934572
Смирнов И.В., Караван М.Д., Ефремова Т.И. и др. // Радиохимия. 2007. Т. 49. № 5. С. 423. [Smirnov I.V., Karavan M.D., Efremova T.I. et al. // Radiochemistry. 2007. V. 49. № 5. P. 482. https://doi.org/10.1134/S106636220705007]
Kamenik J., Sebesta F., John J. et al. // J. Radioanal. Nucl. Chem. 2015. V. 304. P. 313. https://doi.org/10.1007/s10967-014-3543-x
Bond E.M., Engelhardt U., Deere T.P. et al. // Solvent Extr. Ion Exch. 1997. V. 15. P. 381. https://doi.org/10.1080/07366299708934484
Ouizem S., Rosrio-Amorin D., Dickie D.A. et al. // Dalton Trans. 2014. V. 43. P. 8368. https://doi.org/10.1039/C3DT53611D
Narita H., Yaita T., Tamura K., Tachimori S. // Radiochim. Acta. 1998. V. 81. P. 223. https://doi.org/10.1524/ract.1998.81.4.223
Sasaki Y., Sugo Y., Suzuki S., Tachimori S. // Solvent Extr. Ion Exch. 2001. V. 19. P. 91. https://doi.org/10.1081/SEI-100001376
Zhui Z.-X., Sasaki Y., Suzuki S., Kimura T. // Analyt. Chim. Acta. 2004. V. 527. P. 163. https://doi.org/10.1016/j.aca.2004.09.023
Sasaki Y., Sugo Y., Morita K., Nash K.L. // Solvent Extr. Ion Exch. 2015. V. 33. P. 625. https://doi.org/10.1080/07366299.2015.1087209
Campbell E., Holfeltz V.E., Hall G.B. et al. // Solvent Extr. Ion Exch. 2018. V. 36. P. 331. https://doi.org/10.2172/1488863
Ansari S.A., Mohapatra P.K., Leoncini A. et al. // Dalton Trans. 2017. V. 46. P. 11 355. https://doi.org/10.1039/C7DT03831C
Туранов А.Н., Карандашев В.К., Евсеева Н.К. и др. // Радиохимия. 1999. Т. 41. № 3. С. 219.
Turanov A.N., Karandashev V.K., Baulin V.E. // Solv. Extr. Ion Exch. 1999. V. 17. P. 1423. https://doi.org/10.1080/07366299908934656
Turanov A.N., Karandashev V.K., Baulin V.E. et al. // Solv. Extr. Ion Exch. 2009. V. 27. P. 551. https://doi.org/10.1080/07366290903044683
Розен А.М., Николотова З.И., Карташева Н.А., Юдина К.С. // ДАН СССР. 1975. Т. 222. № 5. С. 1151.
Сафиуллина А.М., Синегрибова О.А., Баулин В.Е. и др. // Цветные металлы. 2012. № 3. С. 43.
Koel M. // Crit. Rev. Anal. Chem. 2005. V. 35. P. 177. https://doi.org/10.1080/10408340500304016
Kolarik Z. // Solvent Extr. Ion Exch. 2013. V. 31. P. 24. https://doi.org/10.1080/07366299.2012.700589
Billard I. // Handbook on the Physics and Chemistry of Rare Earths. 2013. V. 43. Chapter 256. P. 213.
Mohapatra P.K. // Chem. Prod. Proc. Model. 2015. V. 10. P. 135.
Nakashima K., Kubota F., Maruyama T., Goto M. // Anal. Sci. 2003. V. 19. P. 1097. https://doi.org/10.2116/analsci.19.1097
Туранов А.Н., Карандашев В.К., Баулин В.Е. // Журн. неорган. химии. 2008. Т. 53. № 6. С. 1045. [Turanov A.N., Karandashev V.K., Baulin V.E // Russ. J. Inorg. Chem. 2008. Т. 53. № 6. С. 970. https://doi.org/10.1134/S0036023608060272]
Туранов А.Н., Карандашев В.К., Баулин В.Е. // Радиохимия. 2008. Т. 50. № 3. С. 229. [Turanov A.N., Karandashev V.K., Baulin V.E. // Radiochemistry. 2008. Т. 50. № 3. С. 266. https://doi.org/10.1134/S1066362208030090]
Shimojo K., Kurahashi K., Naganava H. // Dalton Trans. 2008. V. 37. P. 5083. https://doi.org/10.1039/B810277P
Turanov A.N., Karandashev V.K., Baulin V.E. // Solv. Extr. Ion Exch. 2008. V. 26. P. 77. https://doi.org/10.1080/07366290801904871
Panja S., Mohapatra P.K., Tripathi S.C. et al. // Sep. Purif. Technol. 2012. V. 96. P. 289. https://doi.org/10.1016/j.seppur.2012.06.015
Демин С.В., Жилов В.И., Нефедов С.Е. и др. // Журн. неорган. химии. 2012. Т. 57. № 6. С. 970. [Demin S.V., Nefedov S.E., Zhilov V.I. et al. // Russ. J. Inorg. Chem. 2012. V. 57. № 6. P. 897. https://doi.org/10.1134/S0036023612060095]
Bonhote P., Dias A.P., Papageorgiou N. et al. // Inorg. Chem. 1996. V. 35. P. 1168. https://doi.org/10.1021/ic951325x
Rozen A.M., Krupnov B.V. // Russ. Chem. Rev. 1996. V. 65. № 11. P. 973. https://doi.org/10.1070/RC1996v065n11ABEH000241
Власов В.С., Розен А.М. // Радиохимия. 1988. Т. 30. № 1. С. 146.
Яцимирский К.Б., Костромина Н.А., Шека З.А. и др. Химия комплексных соединений редкоземельных металлов. Киев: Наук. думка, 1966. 494 с.
Turanov A.N., Karandashev V.K., Yarkevich A.N. // Radiochemistry. 2018. V. 60. № 2. P. 170. https://doi.org/10.1134/S1066362218020078
Gaillard C., Boltoeva M., Billard I. et al. // Chem. Phys. Chem. 2015. V. 16. P. 2653. https://doi.org/10.1002/cphc.201500283
Binnemans K. // Chem. Rev. 2007. V. 107. P. 2593. https://doi.org/10.1021/cr050979c
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии