Журнал неорганической химии, 2019, T. 64, № 11, стр. 1154-1165
Сложные танталаты РЗЭ с пирохлороподобной структурой: синтез, структура и термические свойства
А. В. Егорышева 1, *, Е. Ф. Попова 1, 2, А. В. Тюрин 1, А. В. Хорошилов 1, О. М. Гайтко 1, Р. Д. Светогоров 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
3 Национальный исследовательский центр “Курчатовский институт”
123182 Москва, пл. Академика Курчатова, 1, Россия
* E-mail: anna_egorysheva@rambler.ru
Поступила в редакцию 16.04.2019
После доработки 23.04.2019
Принята к публикации 13.05.2019
Аннотация
Показано существование широкого ряда пирохлороподобных (PL) соединений Ln2FeTaO7 (Ln = Pr–Yb, включая Y) с гексагональной структурой (пр. гр. R3). Разработаны две новые низкотемпературные методики синтеза Ln2FeTaO7 – с помощью соосаждения с последующим отжигом и синтезом в расплаве солей NaCl/KCl, что позволило снизить температуру и время их получения. Установлено, что синтез PL-фаз протекает через образование нанокристаллической метастабильной фазы флюорита, которая необратимо переходит в PL-фазу при увеличении времени или температуры кристаллизации. Других переходов вплоть до температуры плавления 1320–1450°C (в зависимости от состава соединения Ln2FeTaO7) методом ДСК не зафиксировано. На примере Y2FeTaO7 измерена изобарная теплоемкость Cp(T) и проведен расчет термодинамических функций (энтропии, инкремента энтальпии и приведенной энергии Гиббса) в температурном интервале 5–1300 K. В области низких температур (2–25 K) обнаружено аномальное поведение Cp(T), связанное, по-видимому, с магнитным переходом Y2FeTaO7.
ВВЕДЕНИЕ
Высокотемпературные сложные оксиды представляют особый интерес как материалы для различных функциональных тугоплавких керамик, термобарьерных покрытий, огнеупоров и топливных ячеек. Одним из наиболее известных тугоплавких материалов в настоящий момент является стабилизированный иттрием оксид циркония, так называемый YSZ [1, 2]. Однако из-за наличия высокотемпературных полиморфных переходов и связанных с ними изменений объема верхняя рабочая температура для использования YSZ ограничена 1200°C [1]. Перспективными материалами, которые успешно могли бы заменить YSZ, являются соединения со структурой типа пирохлора с общей формулой A2B2O7. В частности, соединения со структурой пирохлора на основе гафнатов и цирконатов уже зарекомендовали себя как эффективные окислительно-стойкие термобарьерные покрытия с широким интервалом рабочих температур свыше 1300°C [3–7]. К преимуществам данных материалов следует отнести невысокую теплопроводность, обусловленную структурными особенностями данных соединений, а также химическую устойчивость, термическую стабильность и отсутствие фазовых переходов. Недавно было показано [6], что не только пирохлор, но и соединение с пирохлороподобной структурой Sm2FeTaO7 проявляет более высокие характеристики, чем YSZ. Установлено, что соединение Sm2FeTaO7 по сравнению с YSZ обладает в 2 раза меньшей теплопроводностью в интервале температур 25–1000°C, меньшим значением модуля Юнга, лучшим показателем вязкости разрушения и фазовой стабильностью при более высоких температурах. По мнению авторов [8], перечисленные преимущества дают основание полагать, что Sm2FeTaO7 является перспективным материалом для термобарьерных покрытий, и свидетельствуют о необходимости дальнейшего исследования соединений этого структурного типа. В то же время информация о других соединениях ряда Ln2FeTaO7 ограничивается единственной статьей [9], а также диссертацией [10], которые посвящены изучению структуры этих фаз, их магнитных свойств и теплоемкости в низкотемпературном диапазоне (2–300 K). Высокотемпературная область, наиболее важная для практического использования этих соединений, осталась не исследованной. Не существует единого мнения о структурной принадлежности этих пирохлороподобных (PL) соединений. Согласно исследованиям [9], соединения, содержащие Y, Dy, Gd, Eu, имеют ромбоэдрическую решетку (пр. гр. R$\bar {3}$). Sm2FeTaO7 авторы [11, 12] относят к моноклинной сингонии (пр. гр. C2/c), хотя в [10] это соединение также относят к ромбоэдрически искаженному пирохлору. В предшествующих работах синтез Ln2FeTaO7 проводили путем механоактивации смеси исходных оксидов с последующим высокотемпературным отжигом (1400°С) или золь-гель методом [8–12]. Оба метода синтеза сопряжены с большими технологическими трудностями и внесением в синтезируемые образцы неконтролируемой примеси.
В настоящей работе мы разработали две новые низкотемпературные методики получения Ln2FeTaO7, установили границы существования ряда Ln2FeTaO7 и изучили их структуру и термодинамические свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза Ln2FeTaO7 впервые использовали метод соосаждения с последующим отжигом и синтез в расплаве солей. Оба метода отличаются простотой исполнения и позволяют существенно сократить температуру и время синтеза. В качестве реагентов для синтеза Ln2FeTaO7 использовали: Ln(NO3)3 · xH2O (Ln = La, Ce, Pr, Nd, Sm, Eu, Gd, Dy, Er, Yb, Y; x = 5, 6 в зависимости от РЗЭ, чистотой не ниже 99.99%), Fe(NO3)3 · 9H2O (х. ч.), TaCl5 (х. ч.), NH4OHконц (ос. ч.), C2H5OH (х. ч.), KCl (х. ч.) и NaCl (х. ч.). Предварительно все реактивы проверяли на соответствие заявленному составу.
При использовании метода соосаждения все компоненты брали в стехиометрическом соотношении из расчета на 0.5 г конечного продукта состава Ln2FeTaO7. Навески твердых компонентов взвешивали с точностью до четвертого знака. Смесь нитратов РЗЭ и железа растворяли в этиловом спирте и оставляли перемешиваться на магнитной мешалке до полного растворения (~10 мин). Объем этилового спирта брали в 5 раз меньше, чем объем осадителя. После этого добавляли спиртовой раствор TaCl5 (${{C}_{{{\text{T}}{{{\text{a}}}_{2}}{{{\text{O}}}_{5}}}}}$ = 108.9 г/л) и перемешивали еще ~10 мин. В качестве осадителя использовали водный раствор аммиака (25%). Количество аммиака варьировали от 2- до 25-кратного избытка по отношению к количеству, необходимому для полного осаждения растворенных в спирте компонентов, которое определяли заранее путем прямого осаждения (2 мл). Подготовленный спиртовой раствор медленно прикапывали к раствору аммиака и вымешивали в течение не менее 3 ч. Полученный осадок центрифугировали, многократно промывали дистиллированной водой и сушили при t = 50°С. Остаточное содержание катионов РЗЭ, железа и тантала в маточном растворе контролировали с помощью соответствующих качественных реакций. Отжиг проводили в печах резистивного нагрева на воздухе при температурах 750–1180°С в платиновых, а при температурах 1200–1400°С – в алундовых тиглях. Продолжительность синтеза в зависимости от температуры составляла от 12 до 48 ч. Степень прохождения реакции оценивали методом РФА. Равновесие считалось достигнутым, если рентгенограммы после двух последующих отжигов не различались. Элементный состав образцов был подтвержден методом EDX.
Для синтеза Ln2FeTaO7 в расплаве солей в качестве растворителя была выбрана эвтектическая смесь солей NaCl/KCl (мольное соотношение 1 : 1). Осадок, полученный методом обратного осаждения, смешивали с солью в весовом соотношении (шихта : соль) 2 : 1, 1 : 1, 1 : 2 и 1 : 5 и перетирали в агатовой ступке в течение 30 мин. После этого смесь помещали в платиновый тигель и отжигали при различных температурах (700–900°С) в течение 0.5–12 ч. Отожженную смесь многократно промывали дистиллированной водой до нейтрального значения pH, центрифугировали и сушили при 50°С.
РФА проводили с использованием дифрактометра Bruker D8 Advance (CuKα-излучение, Ni-фильтр, детектор LYNXEYE). Данные дифракции регистрировали в диапазоне углов 2θ от 10° до 65° с шагом 0.01°, время накопления 0.3 с/шаг. Идентификацию известных фаз проводили с помощью базы данных JCPDS Research Associateship. Уточнение структур Ln2FeTaO7 осуществляли на основе данных рентгеновской дифракции синхротронного излучения методом Ритвельда с использованием программного обеспечения Jana2006 в предположении пр. гр. R$\bar {3}$ и С2/с. Измерения выполнены на экспериментальной станции РСА УНУ “Курчатовский источник синхротронного излучения”, оснащенной 2D‑детектором Rayonix SX165, в диапазоне углов 2θ от 2° до 56° на длине волны λ = 0.78465 Å. Поликристаллический LaB6 (NIST SRM 660a) использовали в качестве углового стандарта.
Морфологию синтезированных образцов изучали методом растровой электронной микроскопии на трехлучевой рабочей станции Carl Zeiss NVision40 (увеличение до 9 × 105, ускоряющее напряжение 1 кВ) с функцией EDX.
Для изучения температурной зависимости теплоемкости Y2FeTaO7 в интервале температур 22.47–348.23 K использовали адиабатический вакуумный калориметр БКТ-3, сконструированный и изготовленный в АОЗТ “Термис” (г. Менделеево Московской обл.). Теплоемкость Y2FeTaO7 измеряли методом адиабатической калориметрии с шагом 1.0–4.0 K в области температур 80–200 K и с шагом 4.0–7.0 K выше 200 K. Кривая температурной зависимости теплоемкости определена в 118 экспериментальных точках (табл. 1S). Все измерения теплоемкости на установке проводили в автоматическом режиме и контролировали компьютерно-измерительной системой. Калориметрическая ампула представляла собой тонкостенный цилиндрический титановый сосуд (внутренний объем 1 см3, масса ∼1.6 г), завинчивающийся бронзовой крышкой с индиевым уплотнением для герметизации. Температуру регистрировали железородиевым термометром сопротивления (R ≈ 100 Ом). Чувствительность термометрической схемы составляла 1 × 10–3 K, абсолютная погрешность измерений температуры ±5 × 10–3 K в соответствии с МТШ-90. Конструкция калориметра и принцип его работы аналогичны приведенным в работах [13, 14]. Надежность измерительной процедуры была проверена путем измерения теплоемкости меди марки “ос. ч.”, стандартных синтетического корунда и бензойной кислоты марки К-2. Навеска вещества равнялась m = 2.71546 г. Молекулярную массу принимали равной теоретической: М = 526.60036 г/моль [15].
Таблица 1.
Результаты уточнения структур соединений Ln2FeTaO7 методом Ритвельда для модели пр. гр. R$\bar {3}$
| Образец | Y2FeTaO7 | Nd2FeTaO7 | Sm2FeTaO7 | Eu2FeTaO7 | Gd2FeTaO7 | Tb2FeTaO7 | Dy2FeTaO7 | Ho2FeTaO7 | Er2FeTaO7 | Yb2FeTaO7 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| a, Å | 7.44548(12) | 7.64223(15) | 7.58336(8) | 7.55251(9) | 7.53389(10) | 7.49149(11) | 7.47399(8) | 7.44428(10) | 7.42734(10) | 7.37657(7) | |
| c, Å | 16.9752(4) | 17.2292(5) | 17.1483(3) | 17.1615(3) | 17.0884(4) | 17.0560(4) | 17.0215(3) | 17.0345(5) | 16.9505(4) | 16.9298(3) | |
| V, Å3 | 814.95(3) | 871.43(4) | 854.031(19) | 847.75(2) | 839.98(2) | 828.98(3) | 823.444(19) | 817.53(3) | 809.80(2) | 797.793(19) | |
| ОКР, нм | 198.2 | 55.4 | 304.5 | 483.9 | 322.2 | 100.0 | 561.2 | 301.4 | 5461.3 | 491.5 | |
| Микродеформация, % | 0.044 | 0.101 | 0.030 | 0.264 | 0.071 | 0.163 | 0.105 | 0.203 | 0.092 | 0.163 | |
| Ln1 | Uiso | 0.024(2) | 0.0027(18) | 0.0026(16) | 0.0221(18) | 0.026(2) | 0.0130(17) | 0.0048(15) | 0.014(2) | 0.0020(19) | 0.0271(19) |
| Ln2 | Uiso | 0.0164(6) | 0.0047(5) | 0.0086(4) | 0.0223(7) | 0.0041(7) | 0.0028(5) | 0.0057(4) | 0.0074(6) | 0.0059(5) | 0.0012(5) |
| Ta1/Fe1 | Occ, Ta | 0.539(3) | 0.655(3) | 0.429(7) | 0.707(5) | 0.374(8) | 0.449(5) | 0.468(2) | 0.454(8) | 0.495(3) | 0.462(6) |
| Occ, Fe | 0.461(3) | 0.345(3) | 0.571(7) | 0.293(5) | 0.626(8) | 0.550(5) | 0.532(2) | 0.546(8) | 0.505(3) | 0.538(6) | |
| Uiso | 0.0036(12) | 0.013(2) | 0.004(3) | 0.008(3) | 0.0011(6) | 0.011(2) | 0.002(2) | 0.007(3) | 0.010(3) | 0.007(2) | |
| Ta2/Fe2 | Occ, Ta | 0.432(6) | 0.530(11) | 0.521(9) | 0.526(15) | 0.501(9) | 0.479(8) | 0.504(7) | 0.494(8) | 0.470(9) | 0.498(7) |
| Occ, Fe | 0.568(6) | 0.470(11) | 0.479(9) | 0.474(15) | 0.499(9) | 0.521(8) | 0.496(7) | 0.506(8) | 0.530(9) | 0.502(7) | |
| Uiso | 0.0037(6) | 0.0011(7) | 0.0031(8) | 0.0168(10) | 0.0020(9) | 0.0041(7) | 0.0049(5) | 0.0072(8) | 0.0039(8) | 0.0010(8) | |
| O1 | x | 0.318(5) | 0.328(2) | 0.315(8) | 0.3109(11) | 0.293(5) | 0.323(5) | 0.316(6) | 0.305(6) | 0.331(3) | 0.330(4) |
| y | 0.186(5) | 0.2146(15) | 0.195(8) | 0.1983(11) | 0.174(6) | 0.204(5) | 0.199(6) | 0.185(6) | 0.2017(18) | 0.202(3) | |
| z | 0.7813(4) | 0.7803(7) | 0.7823(6) | 0.7803(6) | 0.7828(7) | 0.7814(5) | 0.7826(5) | 0.7772(5) | 0.7790(7) | 0.7790(4) | |
| Uiso | 0.006(3) | 0.026(4) | 0.015(5) | 0.077(3) | 0.016(6) | 0.023(4) | 0.030(4) | 0.051(3) | 0.037(4) | 0.045(3) | |
| O2 | x | 0.7228(19) | 0.6997(18) | 0.693(2) | 0.690(2) | 0.698(2) | 0.689(2) | 0.688(3) | 0.675(5) | 0.679(7) | 0.675(4) |
| y | 0.823(2) | 0.7966(18) | 0.804(2) | 0.801(2) | 0.802(2) | 0.801(2) | 0.797(2) | 0.815(4) | 0.810(6) | 0.810(3) | |
| z | 0.9797(4) | 0.9940(8) | 0.9841(8) | 0.9846(9) | 0.9820(8) | 0.9824(7) | 0.9816(8) | 0.9828(8) | 0.9786(12) | 0.9841(7) | |
| Uiso | 0.012(3) | 0.017(4) | 0.008(5) | 0.044(5) | 0.011(5) | 0.017(5) | 0.019(5) | 0.030(4) | 0.050(8) | 0.035(4) | |
| O3 | z | 0.8959(9) | 0.8931(13) | 0.8968(10) | 0.8966(12) | 0.8933(12) | 0.8932(9) | 0.8930(10) | 0.8862(14) | 0.872(3) | 0.8871(13) |
| Uiso | 0.016(4) | 0.034(5) | 0.051(3) | 0.077(4) | 0.035(5) | 0.048(4) | 0.049(3) | 0.031(6) | 0.051(19) | 0.010(7) | |
| Rp | 3.94 | 4.73 | 4.68 | 5.93 | 4.45 | 3.79 | 3.89 | 4.24 | 5.15 | 3.13 | |
| wRp | 5.18 | 5.88 | 6.15 | 7.43 | 5.97 | 4.88 | 5.02 | 5.38 | 6.77 | 3.93 | |
| GOOF | 2.78 | 2.11 | 1.90 | 2.31 | 1.73 | 2.05 | 2.06 | 1.78 | 2.77 | 1.94 | |
Измерения теплоемкости Ln2FeTaO7 в диапазоне температур 305–1305 K проводили на установке синхронного термического анализа Netzsch STA 449 F1 Jupiter. Измерения теплоемкости Y2FeTaO7 проводили на образце массой 69.04 мг в атмосфере газообразного аргона 5.5 (99.9995 об. %) в Pt-тиглях с крышкой, имеющей небольшое отверстие. Общий расход газа в процессе эксперимента составлял 50 мл/мин, нагревание образца производили со скоростью 20 град/мин. В качестве файла коррекции применяли данные, полученные для пустого тигля, зарегистрированные в идентичных условиях. Обработку полученных данных проводили с использованием программного обеспечения Netzsch Ploteus.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
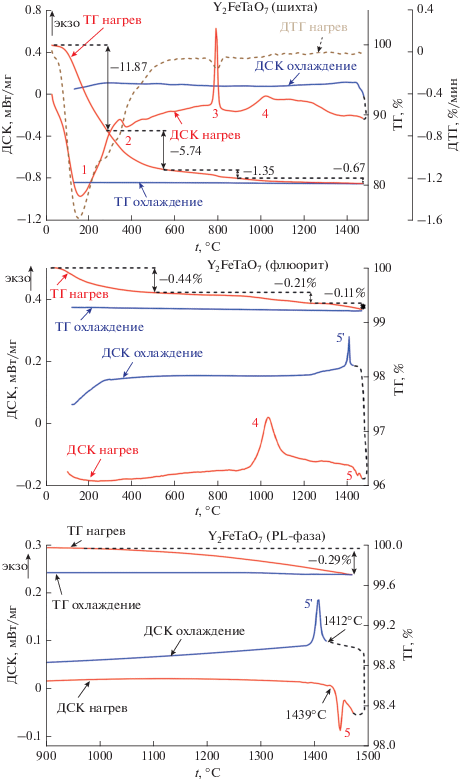
Для изучения влияния условий соосаждения на реакционную способность полученных осадков и установления зависимости температуры и продолжительности отжига от фазового состава продукта реакции на первом этапе исследования на примере сложного оксида Y2FeTaO7 были изучены фазовые превращения, происходящие в процессе его синтеза. С помощью методов ДСК/ТГ и РФА было показано, что при отжиге осадка в температурном интервале 0–340°C происходит разложение нитратов, карбонатов и гидроксисоединений, чему на кривой ДСК соответствуют пики 1 и 2 (рис. 1). Оказалось, что синтез пирохлороподобной (PL) фазы Y2FeTaO7 протекает через образование метастабильной фазы флюорита (рис. 2). Этому процессу отвечает экзотермический пик 3 с началом при 700°С. При дальнейшем нагревании наблюдается второй экзотермический эффект с началом при 930°С (пик 4), связанный с формированием PL-фазы. Особенно отчетливо этот эффект (4) проявляется на термограмме флюорита. Как и следовало ожидать, эффекты 1–3 на этой термограмме отсутствуют. Необходимо отметить, что при охлаждении или повторном отжиге при низких температурах переход PL-фазы во флюорит не наблюдается. По данным ТГ, переход флюорита в PL-фазу сопровождается незначительной потерей массы. Исследование температурных зависимостей теплоемкости PL Y2FeTaO7 показало, что вплоть до температуры плавления (1439°С) на кривой ДСК отсутствуют тепловые эффекты.
Рис. 2.
Типичные дифрактограммы флюорита и PL-фазы состава Y2FeTaO7, синтезированных методом соосаждения (а) и в расплаве солей NaCl/KCl (б).
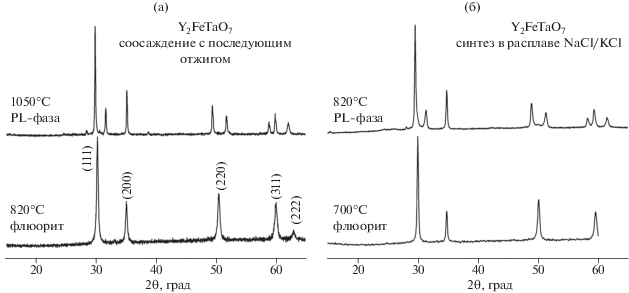
Было показано, что независимо от количества осадителя в процессе синтеза происходило образование метастабильной фазы флюорита и его последующий переход в PL-фазу. Образование флюорита как промежуточной фазы наблюдалось ранее [16] в нанокристаллических образцах при синтезе пирохлора Sm2Zr2O7. При увеличении размера частиц, как и в нашем случае, происходил необратимый переход в стабильную фазу. При больших избытках осадителя наблюдалось незначительное уменьшение размера частиц флюорита. ОКР образцов, отожженных при 820°С (24 ч) изменялся от 25 нм для 2-кратного избытка до 20 нм для 25-кратного. По-видимому, с этим связано появление незначительного количества PL-фазы в образце, синтезированном с меньшим количеством аммиака, по сравнению с однофазным образцом флюорита, полученным с 25-кратным избытком. Следует также отметить, что однофазный PL-образец был получен уже при 950°C (48 ч) для 2-кратного избытка и при 1050°С (48 ч) для 25-кратного избытка аммиака.
Для образцов, полученных методом синтеза в расплаве солей, наблюдались те же закономерности. Однако благодаря присутствию жидкой фазы нам удалось снизить температуру синтеза на 100°C как для флюорита, так и для PL-фазы (рис. 2). Вопреки ожиданиям, заметного эффекта при изменении соотношения шихта : соль мы не наблюдали. Использование этого метода позволило существенно сократить время синтеза. Так, для формирования фазы флюорита потребовалось всего 30 мин.
Изучение морфологии образцов флюорита, синтезированных методом соосаждения с последующим отжигом, показало, что они состоят из кристаллитов размером 25 ± 5 нм, агрегированных в сложные ячеистые структуры (рис. 3). Микроструктура образцов PL-фазы, унаследованная от флюорита, имела вид сетки из сросшихся ограненных частиц с размерами 75–200 нм. Метод синтеза солей в расплаве позволил получить образцы, состоящие из менее агломерированных частиц. Однако благодаря лучшему массопереносу в жидкой фазе размер частиц при использовании этого метода оказался больше (50–100 нм флюорит и 100–200 нм PL-фаза), несмотря на меньшие температуры синтеза.
Рис. 3.
Микрофотографии образцов Y2FeTaO7, полученных методом соосаждения и отожженных при 820°С (фаза флюорита) (а) и 1050°С (PL-фаза) (в), а также методом синтеза в расплаве NaCl/KCl при 700°С (фаза флюорита) (б) и 820°С (PL-фаза) (г).

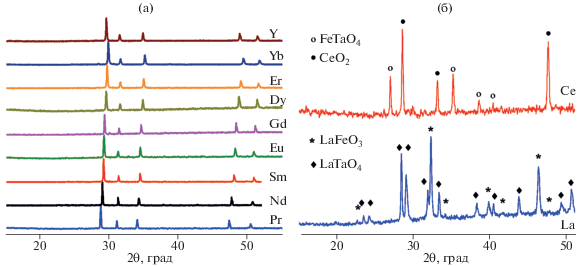
В ходе исследования было подтверждено, что соединения Ln2FeTaO7 с PL-структурой реализуются в широком ряду Ln = Pr–Yb, включая Y (рис. 4а). Сравнение дифрактограмм синтезированных соединений ряда Ln2FeTaO7 показало, что, не учитывая незначительные изменения положения рефлексов, обусловленные изменениями параметров решетки, все соединения имеют одну и ту же кристаллическую структуру, отличную от структуры пирохлора (пр. гр. Fd$\bar {3}$m). Попытки получить аналогичные соединения с лантаном и церием не имели успеха (рис. 4б). Существует критерий образования соединений со структурой типа пирохлора, связанный с величиной отношения радиусов катионов, занимающих две разные кристаллографические позиции: 1.46 < rA/rB < 1.61 [17, 18]. Этому условию удовлетворяют не все синтезированные нами соединения ряда Ln2FeTaO7. Например, для PL-соединений с Ln = Gd–Pr отношение rA/rB составляет 1.65–1.77. Для гипотетических лантан- и церийсодержащих фаз эта величина равна 1.84 и 1.78 соответственно. Таким образом, можно сделать вывод, что искажение структуры пирохлора приводит к расширению границ допустимых значений критерия существования, т.е. rA/rB ≤ 1.77.
Рис. 4.
Дифрактограммы синтезированных образцов PL-соединений Ln2FeTaO7 (а) и равновесной смеси фаз, полученной из шихты состава La2FeTaO7 и Ce2FeTaO7 (б).
Зарегистрированные дифрактограммы Ln2FeTaO7 могут быть описаны в моноклинной или гексагональной симметрии. Поэтому для описания структуры этих соединений нами были выбраны две возможные пр. гр.: C2/c и R$\bar {3}.$ Наилучшее согласие экспериментальных результатов и данных, рассчитанных по методу Ритвельда, было получено для модели пр. гр. R$\bar {3}$ (табл. 1, рис. 5а). Это совпадает с приведенными ранее данными для Ln2FeTaO7 (Ln = Y, Dy, Gd, Eu) [9], но противоречит результатам работ [11, 12] для Sm2FeTaO7.
Рис. 5.
Экспериментальная и теоретическая (для модели пр. гр. R$\bar {3}$) дифрактограммы Sm2FeTaO7 и разность между ними (а); экспериментально полученная дифрактограмма с высоким разрешением в сравнении с модельными кривыми для пр. гр. R$\bar {3}$ и C2/c в диапазоне углов 2θ = 34.5°–39.5° (б).
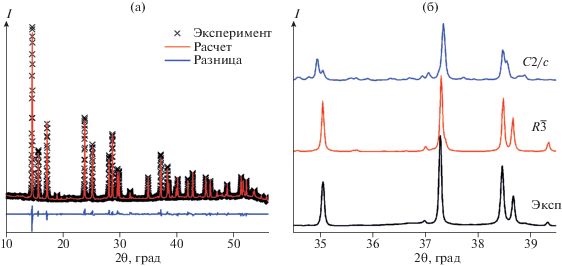
Для точного определения пространственной группы было проведено дополнительное дифракционное измерение образца Sm2FeTaO7 с увеличенным расстоянием образец–детектор (380 мм) и углом поворота детектора 2θ = 29.5°. Использование такой геометрии позволило существенно улучшить угловое разрешение за счет уменьшения аппаратного уширения дифракционных линий. На рис. 5б показана экспериментально полученная дифрактограмма в сравнении с модельными кривыми для пр. гр. R$\bar {3}$ и C2/c в диапазоне углов 2θ = 34.5°–39.5°. Хорошо видно расщепление дифракционных рефлексов на модельной кривой для группы C2/c на углах 35° и 38.5°, которого нет на экспериментальной дифрактограмме и на модели для группы R$\bar {3}.$ Отсутствие расщепления наблюдается и для других рефлексов (рис. 1S). Этот факт наряду с соотношением дифракционных интенсивностей позволяет сделать однозначный вывод о принадлежности Sm2FeTaO7 пр. гр. R$\bar {3}.$ Следует отметить, что для PL-соединений Ln2FeTaO7 полученные величины параметров решетки a и c приблизительно равны (~7.5 Å) и $2\sqrt 3 {{a}_{f}}$ (~17 Å), где af – параметр кубической решетки исходного флюорита.
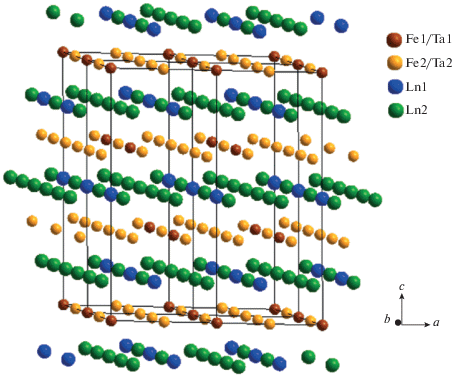
В отличие от пирохлора, в структуре PL-фазы ионы Ln3+ занимают кристаллографические позиции 3b и 9d в центрах искаженного октаэдра и искаженного куба, а ионы тантала и железа статистически распределены по двум позициям – 3a и 9e, в которых координированы шестью и восемью атомами кислорода соответственно. Соединенные друг с другом по углу октаэдры и восьмивершинники Fe/Ta образуют слои из шести- и трехчленных колец, параллельные плоскости (001). Аналогичные слои, сформированные LnO-полиэдрами, чередуются с Fe/Ta-слоями и сдвинуты относительно последних на 001/2 (рис. 6).
Для всех синтезированных нами PL-соединений температурные зависимости теплоемкости аналогичны таковым для Y2FeTaO7, т.е. отсутствуют эффекты вплоть до 1320–1450°С, а в интервале температур 1390–1450°C на их термограммах наблюдается один или два обратимых эндотермических эффекта (табл. 2), связанных, по-видимому, с различным характером плавления соединений разного состава. Изучение морфологии PL Ln2FeTaO7 показало, что размеры частиц не зависят от состава соединения. Как и в случае Y2FeTaO7, образцы Ln2FeTaO7, синтезированные методом соосаждения, после отжига при 1050°С имели размеры 100–180 нм, а полученные из расплава солей – ~40–75 нм.
На примере Y2FeTaO7 была измерена температурная зависимость теплоемкости и рассчитаны термодинамические функции в диапазоне 15–1300 K. Сглаживание теплоемкости проводилось с использованием данных работы [10], где приведены результаты измерения Cp для Y2FeTaO7 в области T < 20 K. Отметим, что при этих температурах релаксационная калориметрия (измерения на приборе PPMS фирмы Quantum Design) дает существенно меньшую погрешность, чем адиабатическая калориметрия, в отличие от более высокотемпературных диапазонов, в которых результаты адиабатической калориметрии дают существенно более точный результат. Причиной высокой погрешности измерений методом адиабатической калориметрии ниже 20 K является возможное завышение теплоемкости из-за сорбции гелия на поверхности частиц вещества [19].
Экспериментальная зависимость теплоемкости Y2FeTaO7 в интервале 2–348 K (табл. 1S) была сглажена методом наименьших квадратов с помощью аппроксимирующего полинома, описанного в работе [20]:
(1)
${{C}_{p}}\left( T \right) = \sum\limits_0^{19} {{{A}_{j}}{{U}^{j}}} ,\,\,\,\,где\,\,\,\,U = \ln \left( {\frac{T}{{400}}} \right),$Таблица 3.
Коэффициенты уравнения (1) для Y2FeTaO7
| j | Aj, Дж/(K моль) |
|---|---|
| 0 | 0.2376958635437960 × 103 |
| 1 | 0.4577617200116699 × 102 |
| 2 | –0.2619829792213309 × 103 |
| 3 | –0.1639067195728861 × 104 |
| 4 | –0.7391226206248694 × 104 |
| 5 | –0.2122968517504985 × 105 |
| 6 | –0.4129998456477113 × 105 |
| 7 | –0.5687482050525794 × 105 |
| 8 | –0.5710118839143726 × 105 |
| 9 | –0.4268816374051629 × 105 |
| 10 | –0.2412132036331164 × 105 |
| 11 | –0.1039997040667554 × 105 |
| 12 | –0.3435269749651777 × 104 |
| 13 | –0.8678109149398026 × 103 |
| 14 | –0.1662111664317769 × 103 |
| 15 | –0.2370773696245508 × 102 |
| 16 | –0.2439153729017246 × 101 |
| 17 | –0.1710129884311020 × 100 |
| 18 | –0.7312035194566760 × 10–2 |
| 19 | –0.1438490554137650 × 10–3 |
Таблица 4.
Термодинамические функции Y2FeTaO7, рассчитанные по сглаженным значениям теплоемкости
| Т, K | Ср°(T), | S°(T), | H°(T ) – – H°(0), | Ф°(T) – – Ф°(0),* | Т, K | Ср°(T), | S°(T), | H°(T ) – – H°(0), | Ф°(T) – – Ф°(0),* |
|---|---|---|---|---|---|---|---|---|---|
| Дж/(K моль) | Дж/(K моль) | Дж/моль | Дж/(K моль) | Дж/(K моль) | Дж/(K моль) | Дж/моль | Дж/(K моль) | ||
| 5* | 2.000 | 0.880 | 3.48 | 0.184 | 260 | 203.1 | 201.2 | 28 660 | 90.99 |
| 10* | 2.754 | 2.503 | 15.37 | 0.9666 | 270 | 206.9 | 209.0 | 30 710 | 95.21 |
| 15* | 3.981 | 3.829 | 31.92 | 1.701 | 280 | 210.4 | 216.5 | 32 800 | 99.41 |
| 20* | 6.415 | 5.274 | 57.32 | 2.408 | 290 | 213.7 | 224.0 | 34 920 | 103.6 |
| 25 | 9.976 | 7.074 | 98.01 | 3.154 | 298.15 | 216.2 | 229.9 | 36 670 | 106.9 |
| 30 | 13.95 | 9.241 | 157.8 | 3.983 | 300 | 216.8 | 231.3 | 37 070 | 107.7 |
| 35 | 18.07 | 11.70 | 237.7 | 4.906 | 310 | 220.2 | 238.4 | 39 250 | 111.8 |
| 40 | 22.41 | 14.39 | 338.8 | 5.921 | 320 | 223.4 | 245.4 | 41 470 | 115.9 |
| 45 | 27.11 | 17.30 | 462.5 | 7.021 | 330 | 226.4 | 252.4 | 43 720 | 119.9 |
| 50 | 32.23 | 20.42 | 610.7 | 8.203 | 340 | 229.2 | 259.2 | 46 000 | 123.9 |
| 60 | 43.54 | 27.27 | 988.5 | 10.80 | 350 | 231.8 | 265.8 | 48 300 | 127.8 |
| 70 | 55.61 | 34.89 | 1484 | 13.69 | 400 | 242.3 | 297.5 | 60 170 | 147.1 |
| 80 | 67.71 | 43.11 | 2101 | 16.85 | 450 | 250.2 | 326.5 | 72 490 | 165.5 |
| 90 | 79.39 | 51.76 | 2837 | 20.24 | 500 | 256.5 | 353.2 | 85 160 | 182.9 |
| 100 | 90.52 | 60.71 | 3687 | 23.84 | 550 | 261.7 | 377.9 | 98 120 | 199.5 |
| 110 | 101.1 | 69.83 | 4645 | 27.60 | 600 | 266.2 | 400.9 | 111 300 | 215.4 |
| 120 | 111.1 | 79.06 | 5706 | 31.51 | 650 | 270.1 | 422.4 | 124 700 | 230.5 |
| 130 | 120.5 | 88.32 | 6864 | 35.52 | 700 | 273.7 | 442.5 | 138 300 | 244.9 |
| 140 | 129.5 | 97.59 | 8115 | 39.62 | 750 | 277.0 | 461.5 | 152 100 | 258.7 |
| 150 | 138.1 | 106.8 | 9453 | 43.80 | 800 | 280.1 | 479.5 | 166 000 | 272.0 |
| 160 | 146.1 | 116.0 | 10 880 | 48.02 | 850 | 283.1 | 496.6 | 180 100 | 284.7 |
| 170 | 153.7 | 125.1 | 12 370 | 52.29 | 900 | 285.9 | 512.8 | 194 300 | 296.9 |
| 180 | 160.8 | 134.1 | 13 950 | 56.58 | 950 | 288.6 | 528.4 | 208 700 | 308.7 |
| 190 | 167.5 | 142.9 | 15 590 | 60.89 | 1000 | 291.3 | 543.2 | 223 200 | 320.0 |
| 200 | 173.7 | 151.7 | 17 300 | 65.22 | 1050 | 293.9 | 557.5 | 237 800 | 331.0 |
| 210 | 179.5 | 160.3 | 19 060 | 69.54 | 1100 | 296.4 | 571.2 | 252 600 | 341.6 |
| 220 | 184.9 | 168.8 | 20 880 | 73.85 | 1150 | 298.9 | 584.5 | 267 500 | 351.9 |
| 230 | 189.9 | 177.1 | 22 760 | 78.16 | 1200 | 301.3 | 597.2 | 282 500 | 361.8 |
| 240 | 194.6 | 185.3 | 24 680 | 82.46 | 1250 | 303.7 | 609.6 | 297 600 | 371.5 |
| 250 | 199.0 | 193.3 | 26 650 | 86.73 | 1300 | 306.1 | 621.5 | 312 800 | 380.9 |
* Данные, полученные с учетом результатов работы [10].
Величину удельной теплоемкости в интервале 348–1300 K определяли методом отношений по формуле:
(2)
${{C}_{p}} = \frac{{{{m}_{{{\text{standard}}}}}}}{{{{m}_{{{\text{sample}}}}}}}\frac{{DS{{C}_{{{\text{sample}}}}} - DS{{C}_{{{\text{bas}}}}}}}{{DS{{C}_{{{\text{standard}}}}} - DS{{C}_{{{\text{bas}}}}}}}{{C}_{{p,{\text{standard}}}}},$Полученные экспериментальные значения теплоемкости (табл. 2S) были сглажены с помощью уравнения Майера–Келли [22] со следующими коэффициентами:
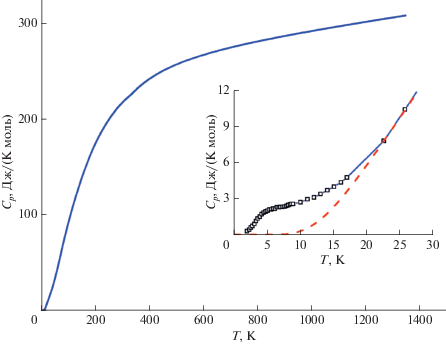
Как видно из рис. 7, температурная зависимость теплоемкости Y2FeTaO7 не имеет каких-либо особенностей вплоть до 1300 K, за исключением области температур 2–25 K, в которой обнаружена аномалия. Из сопоставления измеренных величин теплоемкости и ее регулярной части можно оценить энтропию аномального вклада как 3.7 Дж/(K моль). Природа этой аномалии, вероятно, связана с магнитными свойствами Y2FeTaO7, как это наблюдалось ранее для пирохлора R2Mo2O7 (R = Y, Sm и Gd) [24].
Рис. 7.
Температурная зависимость теплоемкости Y2FeTaO7. На вкладке приведена низкотемпературная область, рассчитанная с учетом данных [10] (точки отмечены квадратами), пунктиром показана регулярная часть теплоемкости.
Известно [23], что в структуре пирохлора A2B2O7, производной которой является кристаллическая решетка Y2FeTaO7, катионы А и B находятся в анионоцентрированных, соединенных вершинами тетраэдрах. В случае, если А или B являются магнитными катионами, структура представляет собой трехмерный аналог геометрически фрустрированной двумерной магнитной решетки типа кагоме. Для таких структур характерны антиферромагнитные взаимодействия ближнего порядка и возможен переход в состояние спинового стекла при низких температурах. В пирохлороподобной решетке Ln2FeTaO7 присутствуют две параллельные друг другу двумерные решетки кагоме, одна из которых образована Ln3+, а другая – катионами Fe3+/Ta5+. Поэтому в этих соединениях также может наблюдаться магнитный переход в состояние спинового стекла. Проведенное ранее исследование [9] магнитных свойств Y2FeTaO7 показало присутствие в нем сильных антиферромагнитных взаимодействий ближнего порядка и отсутствие какого-либо магнитного упорядочения дальнего порядка во всем интервале температур вплоть до 2 K. Также установлено, что Y2FeTaO7 имеет сильно фрустрированную магнитную систему, однако наблюдать переход в состояние спинового стекла авторам [9] не удалось. Причиной этого может быть большая величина приложенного магнитного поля – 1 Тл. Обычно для наблюдения данного эффекта используют поля 0.1–0.5 Тл [25–27]. Кроме того, необходимо учесть, что В-позицию в Y2FeTaO7 наряду с Fe3+ занимают статистически распределенные ионы Ta5+. Это должно приводить к смещению перехода в область самых низких температур. Например, в пирохлоре Bi1.8Fe1.2 – xGaxSbO7 [27] температура перехода в состояние спинового стекла в зависимости от содержания Fe3+ изменялась от 13 до 4 K с ростом х. Необходимо отметить, что выявление перехода в этой области температур является сложной задачей.
Таким образом, опираясь на ранее полученные факты, можно предположить, что при температурах Т < 25 K в Y2FeTaO7 происходит магнитный переход в состояние спинового стекла, который наблюдается на температурной зависимости теплоемкости этого соединения (рис. 7).
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования нами показано, что пирохлороподобные соединения Ln2FeTaO7 реализуются в широком ряду лантаноидов (Ln = Pr–Yb, включая Y) и имеют гексагональную структуру (пр. гр. R$\bar {3}$). Разработка новых методик получения Ln2FeTaO7 позволила снизить температуру синтеза (на 500°С в случае метода соосаждения и на 700°С при использовании расплава солей) по сравнению с твердофазным методом. Это сделало процесс получения соединений более технологичным, что немаловажно для материалов, перспективных для дальнейшего использования. В зависимости от условий синтеза были получены образцы с размером кристаллитов от 75 до 200 нм. Изучение процесса кристаллизации показало, что синтез PL-фазы протекает через образование нанокристаллической метастабильной фазы флюорита, который необратимо переходит в PL-фазу при увеличении времени или температуры кристаллизации. На примере Y2FeTaO7 показано, что температурная зависимость теплоемкости не имеет особенностей вплоть до температуры 1300 K. Исключение составляет область 2–25 K, в которой обнаружена аномалия, с наибольшей вероятностью связанная с магнитным переходом в состояние спинового стекла. Рассчитаны термодинамические функции Y2FeTaO7 в диапазоне 15–1300 K.
Список литературы
Cao X.Q., Vasser R., Stoever D. // J. Eur. Ceram. Soc. 2004. V. 24. № 1. P. 1. https://doi.org/10.1016/S0955-2219(03)00129-8
Popov V.V., Menushenkov A.P., Yastrebtsev A.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 9. P. 1147. https://doi.org/10.1134/S003602361709011X
Vasser R., Cao X.Q., Tietz F. et al. // J. Am. Ceram. Soc. 2000. V. 83. № 8. P. 2023. https://doi.org/10.1111/j.1151-2916.2000.tb01506.x
Wu J., Wei X., Padture N.P. et al. // J. Am. Ceram. Soc. 2002. V. 85. № 12. P. 3031. https://doi.org/10.1111/j.1151-2916.2002.tb00574.x
Xiang J., Chen S., Huang J. et al. // Ceram. Intern. 2012. V. 38. № 5. P. 3607. https://doi.org/10.1016/j.ceramint.2011.12.077
Simonenko N.P., Sakharov K.A., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 12. P. 1452. https://doi.org/10.1134/S0036023615120232
Popov V.V., Menushenkov A.P., Khubbutdinov R.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 4. P. 503. https://doi.org/10.1134/S0036023618040150
Yang J., Han Y., Shahid M. et al. // Scr. Mater. 2018. V. 149. P. 49. https://doi.org/10.1016/j.scriptamat.2018.02.005
Kimie Matsuda C., Ivashita F.F., Paesano Jr.A. et al. // Phys. Rev. B. 2010. V. 81. P. 014417. https://doi.org/10.1103/PhysRevB.81.014417
Berndt G. Análise estruturial e magnética de pirochloros A2(BFe)O7 (B = Sb, Ta). Tesas. dis. Doct. physics. Universidade Estadual de Maringá, Maringá-Paraná. Brasil, 2012.
Torres-Martíneza L.M., Ruiz-Gómeza M.A., Figueroa-Torres M.Z. // Mater. Chem. Phys. 2012. V. 133. P. 839. https://doi.org/10.1016/j.matchemphys.2012.01.104
Torres-Martíneza L.M., Ruiz-Gómeza M.A., Moctezuma E. // Ceram. Inter. 2017. V. 43. P. 3981. https://doi.org/10.1016/j.ceramint.2016.11.098
Косов В.И., Малышев В.В., Мильнер Г.А. и др. // Приборы и техника эксперимента. 1985. Т. 6. С. 195.
Varushchenko R.M., Druzhinina A.I., Sorkin E.L. // J. Chem Thermodyn. 1997. V. 29. № 6. P. 623. https://doi.org/10.1006/jcht.1996.0173
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. № 11. P. 2051. https://doi.org/10.1351/pac2006781112051
Gagarin P.G., Tyurin A.V., Guskov V.N. et al. // Inorg. Mater. 2017. V. 53. № 6. P. 619. https://doi.org/10.1134/S0020168517060048
Subramanian M.A., Aravamudan G., Subba Rao G.V. // Prog. Solid State Chem. 1983. V. 15. P. 55. https://doi.org/10.1016/0079-6786(83)90001-8
Knop O., Brisse F., Meads R.E., Brainbridge J. // Can. J. Chem. 1968. V. 46. P. 3829. https://doi.org/10.1139/v68-635
Bryukhanova K.I., Nikiforova G.E., Tyurin A.V. et al. // J. Therm. Anal. Calorim. 2018. V. 132. P. 337. https://doi.org/10.1007/s10973-017-6593-9
Гуревич В.М., Хлюстов В.Г. // Геохимия. 1979. № 6. С. 829.
Voskov A.L., Kutsenok I.B., Voronin G.F. // Calphad. 2018. V. 61. P. 50. https://doi.org/10.1016/j.calphad.2018.02.001
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. P. 3243. https://doi.org/10.1021/ja01347a029
Greedan J.E. // J. Mater. Chem. 2001. V. 11. № 1. P. 37. https://doi.org/10.1039/B003682J
Raju N.P., Gmelin E., Kremer R.K. // Phys. Rev. B. 1992. V. 46. № 9. P. 5405. https://doi.org/10.1103/PhysRevB.46.5405
Egorysheva A.V., Ellert O.G., Maksimov Yu.V. et al. // J. Alloys Compd. 2013. V. 579. P. 311. https://doi.org/10.1016/j.jallcom.2013.06.096
Whitaker M.J., Marco J.F., Berry F.J. et al. // J. Solid State Chem. 2013. V. 198. P. 316. https://doi.org/10.1016/j.jssc.2012.10.021
Ellert O.G., Egorysheva A.V., Maksimov Yu.V. et al. // J. Alloys Compd. 2016. V. 688. P. 1. https://doi.org/10.1016/j.jallcom.2016.06.283
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии