Журнал неорганической химии, 2019, T. 64, № 11, стр. 1136-1145
Синтез и физико-химические свойства бинарных боридов кобальта(II). Термическое восстановление комплексов-прекурсоров [CoLn][B10H10] (L = H2O, n = 6; N2H4, n = 3)
Е. А. Малинина 1, Л. В. Гоева 1, Г. А. Бузанов 1, В. В. Авдеева 1, *, Н. Н. Ефимов 1, И. В. Козерожец 1, Н. Т. Кузнецов 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119071 Москва, Ленинский пр-т, 31, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 05.04.2019
После доработки 05.04.2019
Принята к публикации 08.05.2019
Аннотация
Синтезированы и охарактеризованы комплексы состава [CoLn][B10H10], где L = H2O, n = 6; N2H4, n = 3. Показана возможность их использования в качестве прекурсоров в синтезе бинарных боридов кобальта(II), которые получали термическим восстановлением комплексов-прекурсоров в инертной атмосфере при 650 и 900°С. Чистоту и однородность прекурсоров и продуктов их восстановления устанавливали методами элементного анализа, РФА и ИК-спектроскопии. Проведены магнетохимические исследования прекурсоров и продуктов их отжига. Определена морфология конечных продуктов. Установлено, что продукты восстановления представляют собой структурированную оксид-боридную и нитрид-боридную фазы. Магнетохимическое исследование фаз показало существенное различие в их магнитном поведении.
ВВЕДЕНИЕ
Бориды металлов [1, 2] образуют самостоятельный класс неорганических соединений, которые применяются во многих областях. Среди наиболее используемых в науке и технике боридов можно отметить диборид титана [3, 4] (применяется для изготовления испарителей для расплавов металлов, как компонент жаропрочных сплавов, для инструментальных материалов и износостойких наплавочных покрытий), диборид циркония [4–8] (для изготовления защитных чехлов и элементов термопар, как нейтронопоглощающий материал для ядерных реакторов и компонент жаропрочных сплавов), диборид хрома [9] (в качестве компонента износостойких наплавочных покрытий), гексаборид кальция [10] (как абразив и нейтронопоглощающий материал). Одним из направлений использования боридов металлов, которое активно развивается в последнее время, является получение высокодисперсных составляющих компонентной базы для создания ультравысокотемпературных керамических композиционных материалов на основе карбида кремния и борида гафния [11–15].
Многообразие боридных фаз обусловлено различным комбинированием связей между компонентами (атомами металла и бора), что обеспечивает возможность направленного изменения их физических, химических и прочностных характеристик. Высокая тугоплавкость, химическая стойкость в различных агрессивных средах, подобие металлам (высокая электро- и теплопроводность, магнитные свойства) обеспечили этому классу соединений успешное использование в различных областях науки и техники.
В литературе известны следующие способы получения боридов металлов: синтез из элементарных металлов и бора, элемент-термическое восстановление (карботермическое, борокарботермическое или магнийтермическое), осаждение из газовой фазы, электролиз расплавленных сред [16].
Многолетние работы в области химии клозо-бороводородных анионов позволили предложить метод получения боридсодержащих фаз термическим окислением комплексных соединений металлов с кластерными анионами бора в качестве противоионов. Установлено, что кластерные анионы бора позволяют синтезировать комплексы металлов(II) с легко уходящими лигандами, такие как [М(solv)6][B10H10], где solv = DMF, DMSO; M = = Co, Ni [17–20], Zn [21], которые образуются в реакционных растворах в отсутствие конкурентоспособных органических лигандов.
Термическое поведение комплексов состава [Co(solv)6][B10H10] (solv = DMF, DMSO) в качестве прекурсоров для низкотемпературного синтеза боридов изучено в работе [17]. Обнаружено, что образование бинарного борида с существенным преобладанием борид-оксидной фазы наблюдается только в продукте термолиза комплекса [Co(DMF)6][B10H10].
В настоящей работе описан синтез комплексов кобальта [Co(H2O)6][B10H10], [Co(N2H4)3][B10H10] и проведено их термическое окисление в сравнении с известным комплексом [Co(DMF)6][B10H10] с целью определения возможности синтеза боридсодержащих фаз. Для комплексов-прекурсоров и продуктов их термолиза выполнены магнетохимические исследования и изучена морфология конечных продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Декагидро-клозо-декаборат триэтиламмония (Et3NH)2[B10H10] синтезировали из декаборана-14 через стадию образования 1,6–бис(триэтиламин)декаборана [22].
Клозо-декабораты щелочных металлов (Li+, K+, Na+, Cs+) получали кипячением (Et3NH)2[B10H10] в водном растворе соответствующего гидроксида металла до полного удаления триэтиламина. Из клозо-боратов щелочных металлов путем катионного обмена на сильнокислотном катионите КУ-2 синтезировали кислоту (H3О)2[B10H10] (20%).
Синтез [Co(H2O)6][B10H10] ⋅ nH2O (I). Реакционную смесь, содержащую 20%-ный водный раствор (H3О)2[B10H10] (50 мл) и гидроксид кобальта(II), перемешивали до полного растворения гидроксида, при этом контролировали рН реакции (pH 7). Затем реакционный раствор упаривали на роторном испарителе при 40°С досуха. Выход конечного продукта составил ∼95%.
Синтез [Co(N2H4)3][B10H10] (II). Соединение I (3 ммоль) растворяли в 65%-ном водном растворе гидразин гидрата (9 ммоль). В результате изотермического упаривания на воздухе из прозрачного реакционного раствора формировался поликристаллический осадок темно-синего цвета.
[Co(DMF)6][B10H10] (III) получали по методике, описанной в [17].
Элементный анализ I–III проводили на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение содержания бора и кобальта методом ICP MS выполнено на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой iCAP 6300 Duo. Перед проведением анализа образцы высушивали до постоянной массы.
| H | N | B | Co | |
| Найдено для I, %: | 8.04; | 30.68; | 39.44; | 21.51. |
| Для H22N6B10Co | ||||
| вычислено, %: | 8.11; | 30.75; | 39.56; | 21.57 |
| C | H | N | B | Co | |
| Найдено для III, %: | 35.08; | 8.44; | 13.57; | 17.48; | 9.49. |
| Для C18H52N6O6B10Co | |||||
| вычислено, %: | 35.11; | 8.51; | 13.65; | 17.56; | 9.57. |
ИК-спектры исходных соединений I–III и продуктов их термолиза записывали на ИК-Фурье-спектрофотометре Инфралюм ФТ-02 (НПФ АП “Люмекс”); образцы готовили в виде суспензии в вазелиновом масле (Aldrich), использовали пластинки NaCl, спектр записывали в области 4000–400 см–1 с разрешением 1 см–1.
Рентгенофазовый анализ образцов проводили на дифрактометре Bruker D8 Advance (CuKα-излучение) в низкофоновых кюветах с подложкой из ориентированного монокристалла кремния в интервале углов 2θ 5°–80° с шагом 0.01125°.
Термогравиметрический анализ образцов I и II проводили методом ДСК-ТГА. Образцы прогревали в алундовых тиглях объемом 40–100 мкл в токе аргона высокой чистоты (расход 100 мл/мин); температурный диапазон 20–400, 20–600 и 20–800°С, скорость нагрева образцов 10 град/мин.
Отжиг образцов I–III проводили в лабораторной трубчатой электропечи “Накал”. Образец помещали в кварцевую трубку в корундовом тигле. Отжиг проводили в токе аргона высокой чистоты марки 5.5, скорость подачи газа 300 мг/мин, максимальная температура нагрева образца 900°С достигалась в результате пошагового нагрева на 100°С каждые 10 мин. Образец выдерживали при максимальной температуре в течение 30 мин.
Измерения магнитной восприимчивости (χ) комплексных соединений II и III, а также намагниченности (M) твердотельных отожженных образцов $II_{{{\text{аргон}}}}^{{900}}$ и $III_{{{\text{аргон}}}}^{{650}}$ проводили с использованием автоматизированного комплекса проведения физических измерений PPMS-9 фирмы Quantum Design с опцией для проведения измерений магнитных свойств. Образцы помещали в герметично запаянную полиэтиленовую пленку. С целью предотвращения ориентирования образца во внешнем магнитном поле образцы смачивали минеральным маслом. Вводили поправку на магнитный вклад масла, полиэтиленовую пленку, прободержатель и на диамагнетизм молекулы, используя аддитивную схему Паскаля.
Измерения температурных зависимостей χ(Т) и М(Т) для образцов ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ и ${\text{III}}_{{{\text{аргон}}}}^{{650}}$ проводили в интервале температур 2–300 K в процессе охлаждения со стабилизацией температуры и выдержкой 60 с для каждой точки. Напряженность приложенного измерительного магнитного поля НDC = 5000 и 100 Э при измерениях χ(Т) и М(Т) соответственно. Эффективный магнитный момент (μ) комплексных соединений определяли по формуле μ = (8χТ)1/2. Зависимости намагниченности от напряженности магнитного поля M(Н) продуктов термолиза измеряли при температуре Т = 300 K в интервале магнитных полей НDC = = ±50 кЭ. Измерение зависимости М(Н) образца III проводили при 2 K в интервале магнитных полей Н = 0–50 кЭ. Измерения частотных зависимостей динамической магнитной восприимчивости комплекса II проводили при температуре 2 K в постоянном внешнем магнитном поле НDC = 2500 и 5000 Э. Амплитуда модуляции была равна HAC = = 5, 3 и 1 Э в интервале частот ν = 10–100, 100–1000 и 1000–10000 Гц соответственно.
Сканирующую электронную микроскопию (СЭМ) продукта отжига ${\text{III}}_{{{\text{аргон}}}}^{{650}}$ осуществляли на приборе SCAN-S2, ускоряющее напряжение 20 кВ, фокусное расстояние 11 мм. Съемку проводили в режиме вторичных электронов. Для исследования образцы наносили на алюминиевый держатель путем приклеивания. Перед съемкой осуществляли ионное напыление алюминиевого держателя золотом или сплавом золота с палладием.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение комплексов [CoLx][B10H10]
К комплексным соединениям металлов с легко уходящими лигандами можно отнести ряд соединений общей формулы [М(solv)6][B10H10], где solv = H2O, CH3CN, DMF, DMSO. Такие соединения образуются в реакционных растворах в отсутствие конкурентоспособных органических лигандов. Наличие последних, как правило, приводит к замещению растворителей-лигандов в комплексах, причем данный процесс наблюдается даже для твердофазных реакций [17, 22].
В настоящем исследовании для получения бинарных боридов из координационных соединений кобальта(II) с легко уходящими лигандами нами были синтезированы и изучены комплексы состава [Co(H2O)6][B10H10] и [Co(N2H4)3][B10H10].
Гексааквакомплекс кобальта(II) [Co(H2O)6][B10H10] ⋅ nH2O (I) был получен при нейтрализации 20%-ного водного раствора (H3О)2[B10H10] гидроксидом кобальта(II):
(I)
$\begin{gathered} {{({{{\text{H}}}_{{\text{3}}}}{\text{О}})}_{2}}[{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}] + {\text{Co}}{{\left( {{\text{OH}}} \right)}_{2}}\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}} \\ \to \,\,[{\text{Co(}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{{{\text{)}}}_{{\text{6}}}}{\text{][}}{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}] \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Координационное соединение [Co(N2H4)3][B10H10] (II) образуется при взаимодействии [Co(H2O)6][B10H10] с 65%-ным раствором гидразин гидрата:
(II)
$\begin{gathered} {{{\text{[}}{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}]}^{{2--}}} + {\text{C}}{{{\text{o}}}^{{2 + }}} + {{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{4}} \cdot n{{{\text{H}}}_{{\text{2}}}}{\text{O}}\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}} \\ \to \left[ {{\text{Co}}{{{\left( {{{{\text{N}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}} \right)}}_{3}}} \right][{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}]. \\ \end{gathered} $Комплекс [Co(DMF)6][B10H10] (III) известного строения получали взаимодействием CoCl2 c (Et3NH)2[B10H10] в растворе DMF по методике, описанной ранее [17]:
(III)
$\begin{gathered} {{[{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}]}^{{2--}}} + {\text{C}}{{{\text{o}}}^{{2 + }}}\xrightarrow{{{\text{DMF}}}} \\ \to \,\,\left[ {{\text{Co}}{{{\left( {{\text{DMF}}} \right]}}_{6}}} \right]\left[ {{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}} \right]. \\ \end{gathered} $Данные физико-химических методов анализа соединения III (элементный анализ, ИК-спектр, РФА) совпали с результатами, описанными в [17].
Полученные соединения-прекурсоры I и II были идентифицированы методами элементного анализа, ИК-спектроскопии и РФА, записаны и изучены термограммы прекурсоров на воздухе и в инертной атмосфере в диапазоне температур 25–800°С, проведены магнетохимические исследования исходных комплексов и продуктов отжига, изучена морфология конечных продуктов.
Согласно данным ИК-спектров комплексов I и II, координационная сфера атома металла сформирована бидентатно-координированными молекулами гидразина (II) либо молекулами воды (I). В спектре I присутствует интенсивная широкая полоса валентных колебаний ν(OH) молекул воды в интервале 3600–3100 см–1 и полоса деформационных колебаний δ(HOH), расщепленная на два максимума при 1648 и 1597 см–1, что указывает на наличие в соединении ассоциированных и координированных молекул H2O. В спектре II полосы валентных колебаний связей N–H аминогрупп лежат в области ниже 3300 см–1, что характерно для бидентатно-циклической координации молекул гидразина. Наличие в спектре II полосы средней интенсивности валентных колебаний ν(NN) около 960 см–1, отсутствующей в спектре некоординированной или мостиковой молекулы гидразина, также свидетельствует в пользу высказанного предположения.
В комплексах I–III анион [B10H10]2– находится во внешней сфере, однако заметно влияние координированных молекул лиганда L на его состояние, поскольку в спектрах наблюдается одна уширенная полоса валентных колебаний ν(ВН) в интервале 2480–2450 см–1.
Для проведения дальнейших исследований образец I высушивали при 110°С в течение 1 ч. Анализ ИК-спектра полученного образца обнаружил заметные изменения в области валентных колебаний как молекул воды, так и аниона [B10H10]2–. В частности, наблюдается уменьшение интенсивности полосы ν(OH); в спектре можно выделить две полосы колебаний ν(OH) в интервале 3600–3300 и около 3209 см–1, соответствующие колебаниям ассоциированных и координированных молекул воды. Указанные изменения в спектре соответствуют частичному удалению ассоциированной воды при 110°С с сохранением клозо-декаборатного аниона. Следует отметить, что частичное удаление воды из прогретого образца изменяет состояние аниона [B10H10]2– – в спектре появляется интенсивная полоса валентных колебаний связей бор–водород с четкими максимумами ν(BH)ап при 2525 см–1 и ν(BH)экв при 2463 см–1, что свидетельствует о перераспределении межмолекулярных контактов между молекулами воды без участия клозо-декаборатного аниона.
Термические свойства синтезированных соединений
Характер термического разложения соединения I близок к таковому для соединения III [17]. Следует отметить, что сохранение и постепенное удаление молекул воды при термолизе I вплоть до 400°С при отжиге образца, вероятно, будет препятствовать образованию боридной фазы в чистом виде; в ходе отжига образца в инертной атмосфере следует ожидать формирование бинарных борид-оксидных фаз, близких по составу изученной ранее и образующейся при отжиге в инертной атмосфере комплекса III.
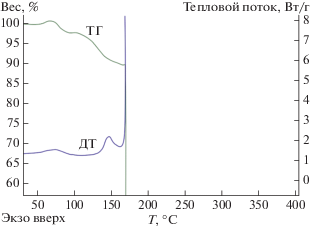
Термическое разложение комплекса II на воздухе происходит следующим образом. При 120°С на термограмме наблюдается небольшая потеря массы образца, сопровождаемая эндотермическим эффектом и соответствующая удалению ассоциированных молекул воды. Нагревание образца выше 160°С приводит к неконтролируемому выбросу образца в газовую фазу (рис. 1).
На основании данных термогравиметрического анализа образцов I и II с целью получения низкотемпературных бинарных боридов с возможным содержанием в них оксидной или нитридной фазы были определены условия отжига комплексов-прекурсоров I и II. Отжиг образцов проводили в лабораторной трубчатой электропечи при 650 (${\text{I}}_{{{\text{аргон}}}}^{{650}}$) и 900°С (${\text{II}}_{{{\text{аргон}}}}^{{900}}$) соответственно в атмосфере аргона. В дальнейшем отожженные образцы были исследованы методами ИК-спектроскопии и РФА. Отжиг соединения III проводили по методике, описанной в [17], с получением образца ${\text{III}}_{{{\text{аргон}}}}^{{650}}.$
Отжиг I при 650°С, τ = 30 мин, аргон
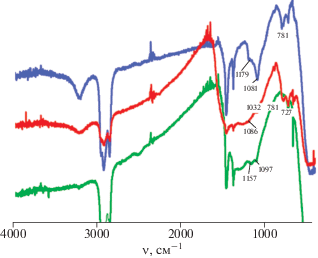
Продукт термолиза ${\text{I}}_{{{\text{аргон}}}}^{{650}}$ представляет собой оксид-боридную фазу; можно отметить ее структурирование. В спектре ${\text{I}}_{{{\text{аргон}}}}^{{650}}$ в интервале 1000–1350 см–1 уширенная интенсивная полоса, характерная для боратов и боридов металлов, расщеплена на три максимума: 1282 (ν(BO)) и 1157, 1097 см–1 (ν(BВ)). По данным РФА, образец ${\text{I}}_{{{\text{аргон}}}}^{{650}}$ является рентгеноаморфным. Следует отметить, что, согласно данным ИК-спектроскопии (рис. 2) и РФА, образец ${\text{I}}_{{{\text{аргон}}}}^{{650}}$ идентичен образцу ${\text{III}}_{{{\text{аргон}}}}^{{650}},$ содержащему оксид-боридную фазу и полученному из прекурсора [Со(DMF)6][B10H10] [17].
Отжиг II при 900°С, τ = 30 мин, аргон
Согласно данным ИК-спектроскопии и РФА, отжиг образца в указанных условиях приводит к конверсии комплекса II в бинарную фазу. ИК-спектр образца ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ существенно отличается от спектра исходного комплекса II. В спектре ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ присутствует интенсивная уширенная полоса с двумя максимумами при 1086 и 1032 см–1, которые можно отнести к валентным колебаниям ν(BN), что соответствует образованию в указанных условиях борид-нитридной фазы. Полоса при 781 см–1 относится к колебаниям ν(CoB), аналогично полосе в том же интервале, которая наблюдается в спектре борида гафния. Кроме того, в спектре присутствует широкая интенсивная полоса при 1500–1150 см–1, которую следует отнести к колебаниям ν(BО). Наличие данной полосы свидетельствует о частичном гидролизе образующегося в результате отжига нитрида бора на воздухе. Аналогичные полосы в указанном интервале проявляются в спектрах борида гафния и композиций, содержащих борид кобальта(II) [17] (рис. 2).
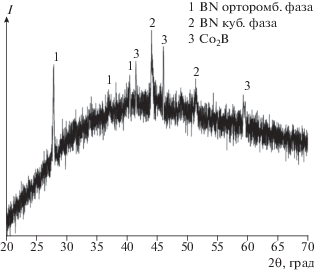
В пользу формирования бинарной борид-нитридной фазы свидетельствуют данные РФА. На рис. 3 приведена дифрактограмма твердого продукта, полученного при отжиге комплексного соединения II в атмосфере аргона. По данным РФА, твердый продукт пиролиза представляет собой слабоокристализованную трехфазную смесь. На дифрактограмме присутствуют рефлексы нитрида бора BN в двух модификациях – кубической и орторомбической с преобладанием последней, а также твердого раствора борида дикобальта Co2B (тетрагональная модификация). Фаза Co2B окристаллизована слабо, что может быть вызвано, во-первых, малой диффузионной подвижностью самих компонентов, а во-вторых, присутствием в смеси других веществ (BN), пространственно затрудняющих консолидацию кристаллитов.
Ранее в качестве координационных соединений с легко уходящими лигандами нами были рассмотрены комплексы кобальта(II) состава [Co(solv)6][B10H10] (solv = DMF (III), DMSO (IV)), которые образуются при взаимодействии солей клозо-декаборатного аниона и CoCl2 в DMF или DMSO [17]:
На основании результатов термического анализа с целью изучения процесса формирования бинарных боридов в [17] были выбраны условия отжига комплексов III и IV. Отжиг образцов проводили на воздухе при 600°С, в вакууме (10–3 мм рт. ст.) при 100 и 600°С и в токе аргона (ос. ч.) при 50, 150, 300 и 650°С. На основании анализа ИК-спектров продуктов термолиза образцов III и IV определено [17], что образование фазы борида кобальта наблюдается только для соединения III.
В продолжение этих исследований для полученного ранее продукта термолиза ${\text{III}}_{{{\text{аргон}}}}^{{650}},$ представляющего собой структурированную оксид-боридную фазу, а также для синтезированного в настоящей работе продукта термолиза ${\text{II}}_{{{\text{аргон}}}}^{{900}},$ представляющего собой структурированную нитрид-боридную фазу, выполнены магнетохимические исследования в сравнении с исходными комплексами II и III.
Магнетохимическое исследование комплексов-прекурсоров II, III и продуктов их термолиза
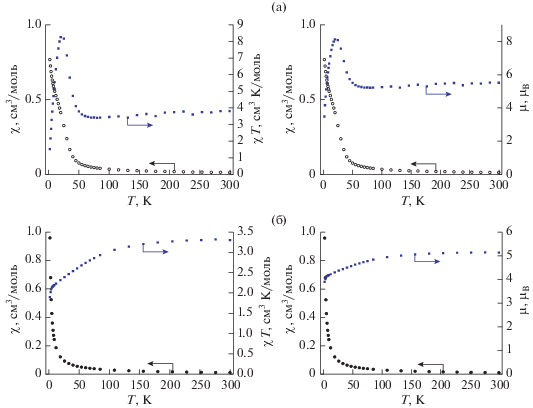
Температурные зависимости магнитной восприимчивости и эффективного магнитного момента комплексов II и III представлены на рис. 4. Значение эффективного магнитного момента II при температуре 300 K, равное 5.52 μB, заметно превышает теоретическую величину 5.20 μB, характерную для невзаимодействующих ионов Co2+ (4F9/2). При охлаждении до T ~ 50 K наблюдается заметный рост эффективного магнитного момента с максимумом μ = 8.1μB при Т = 20 K. При дальнейшем понижении температуры происходит снижение магнитного момента до значения μ = = 3.5μB при 2 K. Такое понижение может быть связано с влиянием эффекта Зеемана (насыщения) и/или наличия антиферромагнитных межмолекулярных взаимодействий. Завышение значения μ при 300 K наряду с видом зависимости μ(Т) (рост значения эффективного магнитного момента при Т < 50 K) может быть связано с большим значением расщепления в нулевом поле D. Расщепление в нулевом поле при отрицательных значениях параметра D < 0 может приводить к наличию в комплексах кобальта свойств молекулярных магнетиков, обусловленных медленной релаксацией намагниченности молекулы.
Рис. 4.
Температурные зависимости магнитной восприимчивости и χТ/магнитного момента образца II (а) и III (б) (Н = 5000 Э).
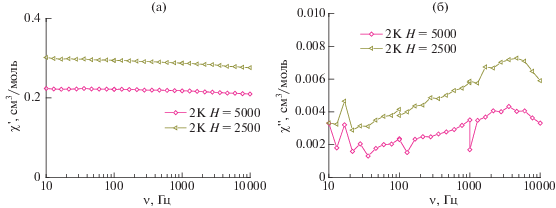
С целью проверки возможного наличия медленной магнитной релаксации в комплексе II для него были проведены измерения динамической магнитной восприимчивости (AC-susceptibility). Для понижения вероятности квантового туннелирования измерения проводили в постоянных магнитных полях 2500 и 5000 Э. Результаты проведенных измерений приведены на рис. 5 и 6. Как видно из рисунков, абсолютные значения величины мнимой компоненты динамической магнитной восприимчивости χ'' во всех проводимых экспериментах более чем на порядок меньше таковых для действительной компоненты χ'. Эти данные свидетельствуют о факте отсутствия медленной магнитной релаксации в исследуемом комплексе, который может быть связан с наличием релаксационных механизмов, ускоряющих релаксацию, или с положительным значением параметра D.
Рис. 5.
Температурные зависимости действительной (а) и мнимой (б) компоненты динамической магнитной восприимчивости образца II во внешнем магнитном поле Н = 5000 Э (частота ν = 1000 Гц (черный) и 10000 Гц (красный)).
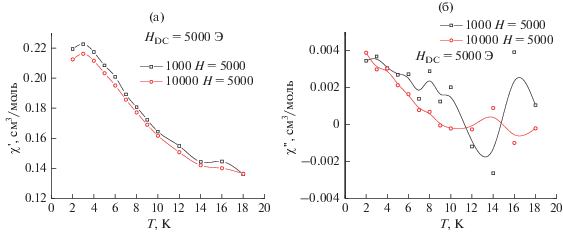
Рис. 6.
Частотные зависимости действительной (а) и мнимой (б) компоненты динамической магнитной восприимчивости образца II во внешних магнитных полях Н = 2500 и 5000 Э (Т = 2 K).
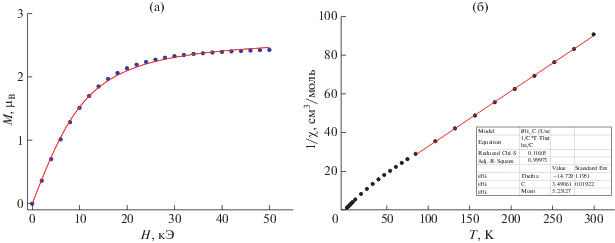
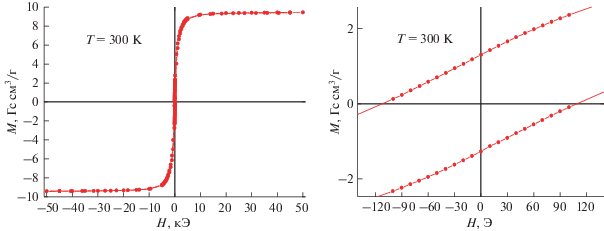
Измерение магнитных свойств комплекса III выявило существенное отличие его магнитного поведения от комплекса II. Так, магнитный момент соединения III при Т = 300 K равен 5.14μB, что существенно меньше аналогичного значения для II и, соответственно, ближе к теоретическому значению для невзаимодействующих ионов Co2+. Вид зависимости μ(Т) носит монотонный характер и до Т = 100 K значения μ остаются практически неизменными (μ = 4.95μB при Т = 108 K). При снижении температуры <100 K наблюдается заметное уменьшение величины магнитного момента с более резким спадом при 4 K и минимальным значением 3.90μB при Т = 2 K. Результаты измерений полевой зависимости намагниченности III при 2 K приведены на рис. 7. Видно, что экспериментальные данные хорошо описываются функцией Бриллюэна с g = 2.56 ± 0.01 и J = 5.69 ± ± 0.10.
Рис. 7.
Полевая зависимость намагниченности III (T = 2 K; линия – аппроксимация функцией Бриллюэна) (а) и температурная зависимость обратной магнитной восприимчивости III (Н = 5000 Э) (б).
Как известно, внешнее магнитное поле может сдвигать или сглаживать магнитные переходы. Поэтому с целью нивелирования влияния магнитного поля измерения зависимостей намагниченности от температуры М(Т) продуктов термолиза ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ и ${\text{III}}_{{{\text{аргон}}}}^{{650}}$ проводили в слабом магнитном поле напряженностью 100 Э (рис. 8 и 9 соответственно). Из графиков зависимости М(Т) видно отсутствие каких-либо магнитных переходов в интервале температур 2–300 K для обоих соединений.
Рис. 8.
Температурная зависимость намагниченности ZFC (синий) и FC (красный) образца ${\text{III}}_{{{\text{аргон}}}}^{{650}}$ (Н = 100 Э).
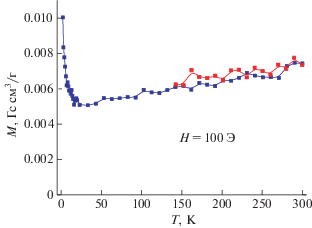
Рис. 9.
Температурная зависимость магнитной восприимчивости (белый) и намагниченности (синий) образца ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ (Н = 100 Э).
Для соединения ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ удельная намагниченность остается практически постоянной во всем температурном диапазоне и лишь немного возрастает от 2.38 Гс см3/г при 300 K до 2.53 Гс см3/г при 2 K. Такое поведение зависимости М(Т) указывает на тот факт, что вещество находится в ферромагнитном состоянии в данном интервале температур. При этом фазовый переход из парамагнитного в ферромагнитное состояние наблюдается при Т > 300 K. Факт ферромагнитного состояния ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ подтверждается результатами измерений полевой зависимости намагниченности при 300 K (рис. 10). Из рис. 10 видно, что намагниченность образца ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ достигает насыщения при Н ~ 10 кЭ, наблюдается гистерезис намагниченности с величиной коэрцитивной силы Нс = 110 Э.
Рис. 10.
Полевая зависимость намагниченности образца ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ при 300 K. Слева область малых магнитных полей.
В то же время измерения магнитных свойств соединения ${\text{III}}_{{{\text{аргон}}}}^{{650}}$ показало отсутствие магнитных фазовых переходов в интервале 2–300 K. Абсолютные величины намагниченности образца в интервале Т = 20–300 K, равные ~0.006 Гс см3/г, по сравнению с ~2.45 Гс см3/г для ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ свидетельствуют о нахождении ионов кобальта в диамагнитном и/или частично низкоспиновом состоянии. Этот факт подтверждает рост удельной намагниченности образца ${\text{III}}_{{{\text{аргон}}}}^{{650}}$ при температурах ниже ~20 K, обусловленный наличием небольшого количества (<1%) парамагнитной примеси в образце (предположительно – высокоспиновый Co2+), температурный ход зависимости M(T) которого подчиняется закону Кюри–Вейса. Результаты измерения полевой зависимости соединения ${\text{III}}_{{{\text{аргон}}}}^{{650}}$ представлены на рис. S1 в приложении. Видно, что в поле ~0.5 Э происходит насыщение ферромагнитной составляющей образца. При увеличении напряженности поля наблюдаются отрицательные значения тангенса угла наклона касательной М(Н). Уменьшение М(Н) при повышении Н однозначно свидетельствует об относительно большом диамагнитном вкладе в общую намагниченность образца.
Морфология продукта термолиза ${\text{II}}_{{{\text{аргон}}}}^{{900}}$
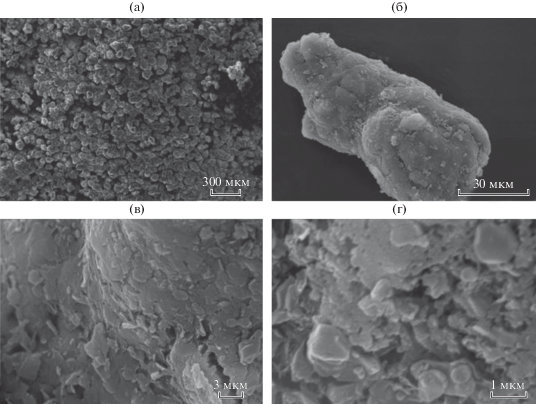
Согласно результатам СЭМ (рис. 11), образец ${\text{II}}_{{{\text{аргон}}}}^{{900}}$ представлен агломератами со средним размером порядка 80–100 мкм, которые состоят из двух фаз: крупных частиц со средним размером ∼1 мкм и частиц со средним размером ∼100 нм. Полученные данные находятся в соответствии с результатами РФА, согласно которым образец представляет собой смесь фаз.
ЗАКЛЮЧЕНИЕ
Показана возможность синтеза бинарных боридов методом термического восстановления комплексов-прекурсоров состава [CoLn][B10H10], где L = H2O, n = 6; L = N2H4 или DMF, n = 3. Продукты восстановления представляют собой структурированную оксид-боридную и нитрид-боридную фазы. Магнетохимическое поведение образцов различно: оксид-боридная фаза характеризуется существенным ферромагнитным вкладом в общую намагниченность образца, нитрид-боридная – диамагнитным.
Список литературы
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth-Heinemann, 1997.
Cotton F.A., Wilkinson G., Murillo C.A., Bochmann M. Advanced Inorganic Chemistry. N.Y.: Wiley-Interscience, 1999.
Lepakova O.K., Raskolenko L.G., Maksimov Y.M. // Inorg. Mater. 2000. V. 36. P. 568. https://doi.org/10.1007/BF02757955
Kravchenko S.E., Burlakova A.G., Korobov I.I. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 429. https://doi.org/10.1134/S0036023616040112
Poilov V.Z., Pryamilova E.N. // Russ. J. Inorg. Chem. 2016. V. 61. P. 55. https://doi.org/10.1134/S0036023616010198
Kravchenko S.E., Torbov V.I., Shilkin S.P. // Russ. J. Inorg. Chem. 2011. V. 56. P. 506. https://doi.org/10.1134/S0036023611040164
Sulyaeva V.S., Shestakov V.A., Rumyantsev Y.M. et al. // Inorg. Mater. 2018. V. 54. P. 133. https://doi.org/10.1134/S0020168518020152
Kravchenko S.E., Burlakova A.G., Domashnev I.A. et al. // Inorg. Mater. 2017. V. 53. P. 804. https://doi.org/10.1134/S002016851708009X
Audronis M., Kelly P.J., Arnell R.D. et al. // Surf. Coat. Technol. 2005. V. 200. P. 1366.https://doi.org/10.1016/j.surfcoat.2005.08.022
Otani S. // J. Cryst. Growth. 1998. V. 192. P. 346. https://doi.org/10.1016/S0022-0248(98)00444-8
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 4. P. 421. [Симоненко Е.П., Симоненко Н.П., Гордеев А.Н. и др. // Журн. неорган. химии. 2018. Т. 63. № 4. С. 393.]https://doi.org/10.1134/S0036023618040186
Simonenko E.P., Simonenko N.P., Papynov E.K. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 1. P. 1. [Симоненко Е.П., Симоненко Н.П., Папинов Е.К. и др. // Журн. неорган. химии. 2018. Т. 63. № 1. С. 3.]https://doi.org/10.1134/S0036023618010187
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 1. P. 1484. [Симоненко Е.П., Симоненко Н.П., Гордеев А.Н. и др. // Журн. неорган. химии. 2018. Т. 63. № 1. С. 1465.]https://doi.org/10.1134/S0036023618110177
Kosyakov V.I., Shestakov V.A., Kosinova M.L. // Russ. J. Inorg. Chem. 2018. V. 63. № 6. P. 822. [Косяков В.И., Шестаков В.А., Косинова М.Л. // Журн. неорган. химии. 2018. Т. 63. № 6. С. 777.]https://doi.org/10.1134/S0036023618060153
Simonenko E.P., Simonenko N.P., Gordeev A.N. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1345. [Симоненко Е.П., Симоненко Н.П., Гордеев А.Н. и др. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1329.]https://doi.org/10.1134/S0036023618100170
Matkovich V.I. Boron and Refractory Borides. Berlin–Heidelberg– N.Y.: Springer Verlag, 1977.
Avdeeva V.V., Polyakova I.N., Vologzhanina A.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 9. P. 1125. [Авдеева В.В., Полякова И.Н., Вологжанина А.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 9. С. 1182].https://doi.org/10.1134/S0036023616090023
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Inorg. Chim. Acta. 2016. V. 451. P. 129. https://doi.org/10.1016/j.ica.2016.07.016
Goeva L.V., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1050. [Гоева Л.В., Авдеева В.В., Малинина Е.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 1015.]https://doi.org/10.1134/S0036023618080089
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. P. 1673. https://doi.org/10.1134/S0036023617130022
Malinina E.A., Korolenko S.E., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1552. [Малинина Е.А., Короленко С.Е., Гоева Л.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1543.]https://doi.org/10.1134/S0036023618120148
Knoth W.H., Miller H.C., Sauer J.C. et al. // Inorg. Chem. 1964. V. 3. P. 159.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии