Журнал неорганической химии, 2019, T. 64, № 12, стр. 1304-1311
Синтез и строение дицианоаргентатов органилтрифенилфосфония [Ph3PCH2СH=CHCH2PPh3]2+[Ag(CN)2$]_{2}^{ - }$ и [Ph3PR]+[Ag(CN)2]–(R = Et, CH=CMe2)
В. В. Шарутин 1, О. К. Шарутина 1, М. А. Попкова 1, Н. М. Тарасова 1, *, В. В. Полозова 1
1 Национальный исследовательский Южно-Уральский государственный университет
454080 Челябинск, пр-т им. В.И. Ленина, 76, Россия
* E-mail: tarasovanm@susu.ru
Поступила в редакцию 14.01.2019
После доработки 18.02.2019
Принята к публикации 17.06.2019
Аннотация
Взаимодействием дицианоаргентата калия с хлоридами алкилтрифенилфосфония в водном растворе синтезированы ионные комплексы Ag(I) [Ph3PCH2СH=CHCH2PPh3]2+[Ag(CN)2]$_{2}^{ - }$ (I) и [Ph3PR]+[Ag(CN)2]–, где R = Et (II), CHCMe2 (III). ИК-спектры соединений I–III характеризуются наличием полос поглощения CN-групп в области 2131–2137 см–1. В ходе рентгеноструктурных исследований установлено, что катионы алкилтрифенилфосфония имеют искаженную тетраэдрическую конфигурацию: углы CPC составляют 105.6(3)°−112.8(3)° (I), 108.0(3)°−110.6(4)° (II), 106.77(11)°−113.74(11)° (III), связи P−С равны 1.790(6)−1.810(6) (I), 1.774(8)−1.806(7) (II) и 1.745(3)−1.806(2) Å (III). В анионах [Ag(CN)2]− углам СAgC соответствуют значения 168.4(3)° (I), 175.5(3)° (II), 180.000(2)° (III), расстояния Ag−C составляют 2.039(10)−2.093(10) Å. Формирование кристаллов I–III обусловлено в основном слабыми водородными связями между атомами водорода катионов и азота анионов N⋅⋅⋅Н−С (2.37–2.74 Å).
ВВЕДЕНИЕ
Комплексы дицианидов металлов вызывают интерес исследователей в связи с их использованием при получении полупроводниковых и оптически активных материалов, которые приобретают при этом разнообразные свойства [1–6]. В частности, специфическое строение дицианоаргентатных анионов, способствующее образованию олигомеров, приводит к проявлению магнитной активности [7]. Кроме того, комплексы с анионами [Ag(CN)2]− перспективны в плане создания новых нано- и жидкокристаллических систем [8, 9]. С точки зрения поиска структур, обладающих ценными физико-химическими свойствами, перспективным является варьирование катионной части дицианоаргентатных комплексов [10]. В зависимости от строения катиона дицианоаргентатные анионы в кристаллах могут быть мономерными [2, 11, 12], полимерными с разветвленным строением [13–15], выполнять мостиковую функцию, связывая катионы и анионы [16], образовывать “димеры” с короткими расстояниями Ag⋅⋅⋅Ag [17–19]. Следует отметить, что комплексы [Ag(CN)2]− с органическими и элементоорганическими катионами мало изучены. В литературе представлены немногочисленные примеры подобных систем с катионами имидазолия [11, 20], пиримидиния [21], бис(трифенилфосфан)иминия [22, 23] и трифенилтеллурия [24]. Данные о синтезе и особенностях строения дицианоаргентатов тетраорганилфосфония в литературе отсутствуют.
В настоящей работе впервые синтезированы и структурно охарактеризованы дицианоаргентатные комплексы органилтрифенилфосфония [Ph3PCH2CH=CHCH2PPh3]2+[Ag(CN)2]$_{2}^{ - }$ (I) и [Ph3PR]+[Ag(CN)2]–, где R = CH2CH3 (II), R = = CH=CMe2 (III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез бис(дицианоаргентата) бут-2-ен-1,4-диил-бис(трифенилфосфония) [Ph3PCH2CH=CHCH2PPh3]2+ [Ag(CN)2]$_{2}^{ - }$ (I). К водному раствору 326 мг (0.502 ммоль) дихлорида бутен-2-ен-1,4-бис(трифенилфосфония) добавляли раствор 200 мг (1.004 ммоль) дицианоаргентата калия в 5 мл воды. Воду удаляли, остаток экстрагировали ацетонитрилом (3 × 5 мл). Медленное испарение растворителя приводило к образованию бледно-желтых кристаллов, пригодных для проведения рентгеноструктурного анализа. Выделили 383 мг (85%) комплекса I с tпл = 218.5°С.
ИК-спектр (ν, см−1): 3415, 3055, 3043, 3020, 2964, 2933, 2893, 2862, 2792, 2131, 1631, 1585, 1496, 1481, 1458, 1435, 1408, 1315, 1247, 1186, 1157, 1112, 1072, 1026, 975, 844, 756, 744, 723, 705, 690, 613, 543, 516, 503, 493, 457, 443, 435, 422, 416.
Соединения II и III синтезировали по аналогичной методике.
Дицианоаргентат трифенилэтилфосфония (II). Выделено 85% комплекса II с tпл = 104.1°С.
ИК-спектр (ν, см–1): 3167, 3080, 3043, 3024, 3008, 2989, 2981, 2931, 2900, 2881, 2216, 2140, 2129, 2088, 1986, 1905, 1834, 1784, 1687, 1612, 1583, 1479, 1456, 1436, 1406, 1336, 1315, 1269, 1244, 1182, 1161, 1114, 1105, 1070, 1033, 1014, 997, 931, 856, 846, 748, 734, 721, 690, 661, 530, 503, 489, 451, 441, 418.
Дицианоаргентат (2-метилпроп-1-ен-1-ил)трифенилфосфония (III). Выделено 87% комплекса III с tпл = 195.8°С.
ИК-спектр (ν, см–1): 3091, 3064, 3051, 3022, 3001, 2956, 2914, 2164, 2137, 1973, 1905, 1826, 1778, 1631, 1587, 1573, 1481, 1436, 1409, 1363, 1338, 1307, 1273, 1193, 1172, 1163, 1141, 1111, 1074, 1028, 997, 966, 931, 854, 846, 765, 754, 721, 694, 684, 642, 615, 599, 542, 518, 486, 455, 416.
Дифференциальную сканирующую калориметрию (ДСК) соединений I−III проводили с помощью комплекса синхронного термического анализа Netzsch 449C Jupiter.
ИК-спектры комплексов I−III записывали на ИК-Фурье-спектрометре Shimadzu IR Affinity-1S в таблетках KBr.
РСА кристаллов I−III проводили на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0.71073 Å, графитовый монохроматор). Для сбора, редактирования данных и уточнения параметров элементарной ячейки, а также учета поглощения использовали программное обеспечение SMART и SAINT-Plus [25]. Все расчеты по определению и уточнению структур выполнены по программам SHELXL/PC [26] и OLEX2 [27]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур I−III приведены в табл. 1, избранные длины связей и валентные углы – в табл. 2.
Таблица 1.
Кристаллографические данные, параметры эксперимента и уточнения структур I–III
| Параметр | I | II | III |
|---|---|---|---|
| М | 898.45 | 451.24 | 792.63 |
| Сингония | Триклинная | Моноклинная | Триклинная |
| Пр. гр. | Р1 | P21/c | Р |
| a, Å | 9.57(2) | 9.648(11) | 8.997(5) |
| b, Å | 9.624(19) | 29.71(4) | 10.579(5) |
| c, Å | 12.698(18) | 7.490(8) | 10.647(8) |
| α, град | 70.34(7) | 90.00 | 101.11(3) |
| β, град | 68.18(9) | 106.61(3) | 100.26(3) |
| γ, град | 84.45(17) | 90.00 | 92.80(2) |
| V, Å3 | 1022(3) | 2057(4) | 974.8(10) |
| Z | 2 | 4 | 1 |
| ρвыч, г/см3 | 1.459 | 1.457 | 1.350 |
| μ, мм−1 | 1.071 | 1.065 | 0.633 |
| F(000) | 452.0 | 912.0 | 409.0 |
| Размер кристалла, мм | 0.36 × 0.12 × 0.07 | 0.21 × 0.15 × 0.08 | 0.42 × 0.37 × 0.3 |
| Область сбора данных по 2θ, град | 6.32−39.7 | 5.84−46.78 | 6.14−58.38 |
| Интервалы индексов отражений | −9 ≤ h ≤ 9, −9 ≤ k ≤ 9, −12 ≤ l ≤ 12 |
−10 ≤ h ≤ 10, −32 ≤ k ≤ 32, −8 ≤ l ≤ 8 |
−12 ≤ h ≤ 12, −14 ≤ k ≤ 14, −14 ≤ l ≤ 14 |
| Измерено отражений | 7807 | 19 859 | 40 651 |
| Независимых отражений | 1839 (Rint = 0.0345) | 2948 (Rint = 0.0425) | 5267 (Rint = 0.0276) |
| Отражений с I > 2σ(I) | 1454 | 2244 | 4282 |
| Переменных уточнения | 235 | 236 | 233 |
| GOOF | 1.069 | 1.103 | 1.062 |
| R-факторы по F2 > 2σ(F2) | R1 = 0.0371, wR2 = 0.0842 | R1 = 0.0570, wR2 = 0.1111 | R1 = 0.0519, wR2 = 0.1629 |
| R-факторы по всем отражениям | R1 = 0.0541, wR2 = 0.0934 | R1 = 0.0785, wR2 = 0.1226 | R1 = 0.0632, wR2 = 0.1743 |
| Остаточная электронная плотность (min/max), e/Å3 | 0.28/−0.38 | 0.48/−0.69 | 1.38/−0.72 |
Таблица 2.
Основные длины связей и валентные углы в структурах I−III
| Связь | Длина, Å | Угол | ω, град |
|---|---|---|---|
| I | |||
| Ag(1)−C(9) | 2.039(10) | C(9)Ag(1)C(10) | 168.4(3) |
| Ag(1)−C(10) | 2.059(10) | C(21)P(1)C(7) | 109.5(3) |
| P(1)−C(21) | 1.798(7) | C(21)P(1)C(11) | 108.6(3) |
| P(1)−C(1) | 1.790(6) | C(1)P(1)C(21) | 110.5(3) |
| P(1)−C(7) | 1.810(6) | C(1)P(1)C(7) | 105.6(3) |
| P(1)−C(11) | 1.799(7) | C(1)P(1)C(11) | 109.8(3) |
| N(1)−C(9) | 1.101(9) | C(11)P(1)C(7) | 112.8(3) |
| N(2)−C(10) | 1.104(9) | N(2)C(10)Ag(1) | 174.1(9) |
| C(1)−C(2) | 1.403(8) | N(1)C(9)Ag(1) | 171.7(8) |
| Преобразования симметрии: 1–x, 1 – y, 1 – z. | |||
| II | |||
| Ag(1)−C(9) | 2.093(10) | C(10)Ag(1)C(9) | 175.5(3) |
| Ag(1)−C(10) | 2.068(11) | C(21)P(1)C(1) | 110.6(3) |
| P(1)−C(21) | 1.774(8) | C(21)P(1)C(11) | 108.4(3) |
| P(1)−C(1) | 1.806(7) | C(21)P(1)C(7) | 110.6(6) |
| P(1)−C(11) | 1.791(6) | C(11)P(1)C(1) | 108.0(3) |
| P(1)−C(7) | 1.787(8) | C(7)P(1)C(1) | 110.6(4) |
| N(1)−C(9) | 1.089(9) | C(7)P(1)C(11) | 108.5(4) |
| N(2)−C(10) | 1.121(11) | N(1)C(9)Ag(1) | 177.1(8) |
| III | |||
| Ag(1)−C(271) | 2.059(5) | C(271)Ag(1)C(27) | 180.000(2) |
| Ag(1)−C(27) | 2.059(5) | C(1)P(1)C(11) | 107.46(10) |
| P(1)−C(1) | 1.794(2) | C(1)P(1)C(21) | 108.22(11) |
| P(1)−C(11) | 1.806(2) | C(21)P(1)C(11) | 107.12(10) |
| P(1)−C(21) | 1.802(2) | C(7)P(1)C(1) | 113.25(12) |
| P(1)−C(7) | 1.745(3) | C(7)P(1)C(11) | 113.74(11) |
| P(1)−C(27) | 1.113(6) | C(7)P(1)C(21) | 106.77(11) |
| Преобразования симметрии: 1 –x, 2 – y, 1 – z. | |||
Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 1878005 (I), 1878008 (II), 1878006 (III); deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексы I–III получали взаимодействием дицианоаргентата калия и хлоридов алкилтрифенилфосфония в водном растворе:
После испарения воды сухой остаток перекристаллизовывали из ацетонитрила для получения монокристаллов. Соединения I–III устойчивы на воздухе.
Согласно данным ДСК, кристаллы I, II, III плавятся при температурах 218.5, 104.1, 195.8°С соответственно и не претерпевают разложения при нагревании до 200°С.
Известно, что поглощение C≡N-групп в ИК-спектрах соединений независимо от их природы (органические, неорганические, элементоорганические) наблюдается в нешироком интервале частот: 2200−2000 см−1, т.е. колебания связей C≡N не чувствительны к влиянию окружения [28]. В связи с этим соединения с цианогруппами легко обнаружить по поглощению в указанной области. В ИК-спектрах соединений I, II, III колебаниям C≡N-групп соответствуют полосы при 2131, 2129, 2137 см−1. Колебания связей P−Ph в катионах находятся в интервале частот 1450−1435 см−1 [28]. В спектрах соединений I, II и III имеет место поглощение при 1435, 1436 и 1436 см−1, относящееся к колебаниям связи фосфор–углерод фенильных колец. В спектрах I и III с непредельными алкильными радикалами наблюдаются полосы при 1585 и 1631 см−1, характерные для колебаний кратных связей С=С.
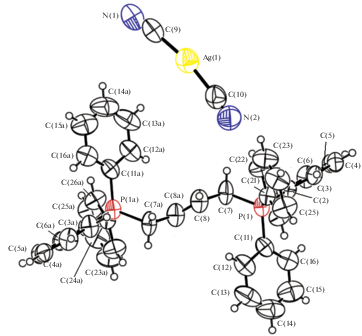
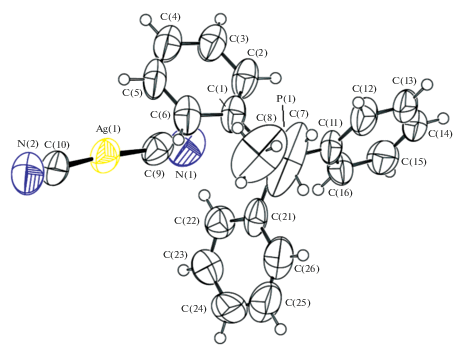
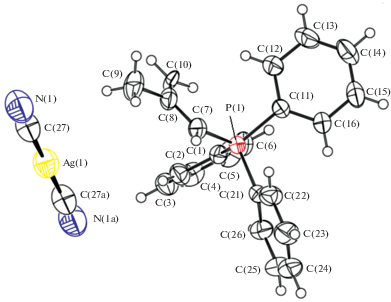
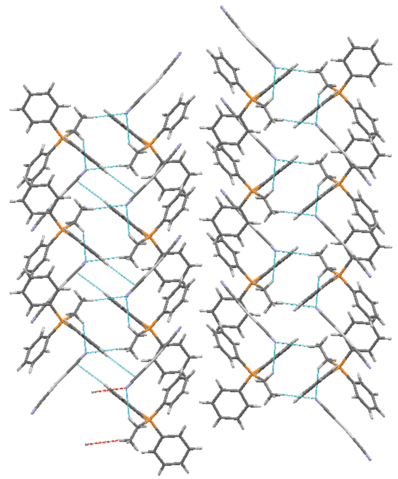
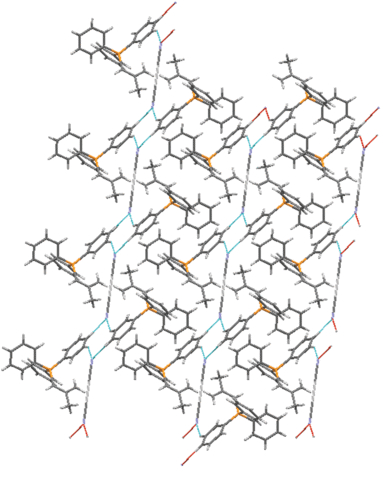
Рентгеноструктурные исследования показали, что кристаллы I−III сформированы из катионов органилтрифенилфосфония и мономерных дицианоаргентатных анионов (рис. 1−3). Расстояния Ag⋅⋅⋅Ag между анионами для всех структур значительно превышают суммы ван-дер-ваальсовых радиусов атомов серебра (3.40(3) Å) [11].
В кристалле I катионы центросимметричны с центром инверсии, совпадающим с серединой двойной связи фрагмента СH2CH=CHСH2. Тетраэдрическая конфигурация катионов несколько искажена, углы при атоме фосфора отличаются от теоретического значения и составляют: 105.6(3)°−112.8(3)° (I), 108.0(3)°−110.6(4)° (II), 106.77(11)°−113.74(11)° (III), длины связей P−СPh (1.790(6)−1.799(7) Å (I), 1.774(8)−1.806(7) Å (II) и 1.794(2)−1.806(2) Å (III)) близки между собой, как и расстояния Р−Саlk (1.810(6), 1.787(7), 1.745(3) Å). Отметим, что в структурно исследованных комплексах рутения и палладия катионы [Ph3PCH2СH=CHCH2PPh3]2+ также центросимметричны и имеют очень близкие значения валентных углов СРС и расстояний Р−С [29, 30]. В анионах [Ag(CN)2]− углы СAgC равны 168.4(3)° (I), 175.5(3)° (II), 180.000(2)° (III), расстояния Ag−C (2.039(10)−2.093(10) Å) близки к сумме ковалентных радиусов указанных атомов (2.03 Å [31]). Тройные связи C≡N в цианидных лигандах комплексов I, II и III равны 1.101(9), 1.104(9) Å; 1.089(9), 1.121(11) Å и 1.113(6), 1.113(6) Å соответственно. Структурная организация кристаллов соединений I–III обусловлена в основном образованием слабых водородных связей между атомом водорода катионов и атомом азота анионов N⋅⋅⋅Н−С (2.37−2.74 Å).
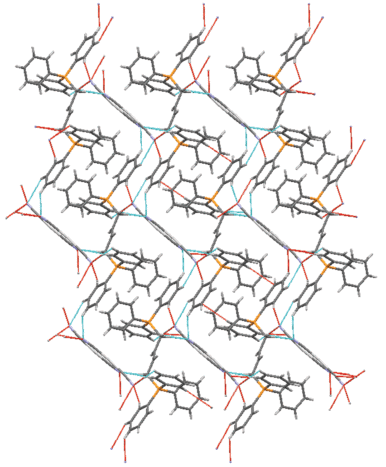
На рис. 4−6 изображено относительное расположение катионов и анионов в кристаллах дицианоаргентатов тетраорганилфосфония I, II и III.
ЗАКЛЮЧЕНИЕ
Осуществлен синтез и проведены структурные исследования бис(дицианоаргентата) бут-2-ен-1,4-диил-бис(трифенилфосфония), а также дицианоаргентатов трифенилэтилфосфония и (2-метилпроп-1-ен-1-ил)трифенилфосфония. Кристаллы комплексов состоят из катионов органилтрифенилфосфония, имеющих искаженную тетраэдрическую конфигурацию, и мономерных дицианоаргентатных анионов. Соединения термически стабильны до 200°С.
Список литературы
Xiaobo L., Patterson H. // Materials. 2013. V. 6. P. 2595. https://doi.org/10.3390/ma6072595
Dechambenoit P., Ferlay S., Kyritsakas N. et al. // Cryst. Eng. Commun. 2011. V. 13. P. 1922. https://doi.org/10.1039/C0CE00607F
Hill J.A., Thompson A.L., Goodwin A.L. // J. Am. Chem. Soc. 2018. V. 138. P. 5886. https://doi.org/10.1021/jacs.5b13446
Assefaa Z., Haire R.G., Sykora R.E. // J. Solid State Chem. 2008. V. 181. P. 382. https://doi.org/10.1016/j.jssc.2007.11.036
Brown M.L., Ovens J.S., Leznoff D.B. // Dalton Trans. 2017. V. 46. P. 7169. https://doi.org/10.1039/C7DT00942A
Chorazy S., Wyczesany M., Sieklucka B. // Molecules. 2017. V. 22. P. 1902. https://doi.org/10.3390/molecules22111902
Agust G., Bele’n Gaspar A., Muñoz M.C. et al. // Inorg. Chem. 2007. V. 46. P. 9646. https://doi.org/10.1021/ic060247i
Dobbs W., Suisse J.-M., Douce L. et al. // Angew. Chem. Int. Ed. 2006. V. 45. P. 4179. https://doi.org/10.1002/anie.200600929
Al Abbas A., Heinrich B., L’Her M. et al. // New J. Chem. 2016. V. 41. P. 2604. https://doi.org/10.1039/C6NJ03590F
Ahern J.C., Shilabin A., Henline K.M. et al. // Dalton Trans. 2014. V. 43. P. 12044. https://doi.org/10.1039/c4dt01110d
Mallah E., Abu-Salem Q., Sweidan K. et al. // Z. Naturforsch. 2011. V. 66b. P. 545.
Tsujimoto K., Ogasawara R., Kishi Y. et al. // New J. Chem. 2014. V. 38. P. 406. https://doi.org/10.1039/C3NJ00979C
Urban V., Pretsch T., Hart H. // Angew. Chem. Int. Ed. 2005. V. 44. P. 2794. https://doi.org/10.1002/anie.200462793
Liu X., Guo G.-C., Fu M.-L. et al. // Inorg. Chem. 2006. V. 45. P. 3679. https://doi.org/10.1021/ic0601539
Geiser U., Wang H.H., Gerdom L.E. et al. // J. Am. Chem. Soc. 1985. V. 107. P. 8305. https://doi.org/10.1021/ja00312a106
Hill J.A., Thompson A.L., Goodwin A.L. // J. Am. Chem. Soc. 2016. V. 138. P. 5886. https://doi.org/10.1021/jacs.5b13446
Korkmaz N., Aydin A., Karadag A. et al. // Spectrochim. Acta, Part A. 2017. V. 173. P. 1007. https://doi.org/10.1016/j.saa.2016.10.035
Stender M., White-Morris R.L., Olmstead M.M. et al. // Inorg. Chem. V. 42. P. 4504. https://doi.org/10.1021/ic034383o
Zhang H.-X., Kang B.-S., Deng L.-R. et al. // Inorg. Chem. Commun. 2001. V. 4. P. 41. https://doi.org/10.1016/S1387-7003(00)00191-X
Yoshida Y., Muroi K., Otsuka A. et al. // Inorg. Chem. 2004. V. 43. P. 1458. https://doi.org/10.1021/ic035045q
Jiang Z.-Y., Dong H.-Z., Zhang G. et al. // Acta Crystallogr. 2008. V. E64. P. m858. https://doi.org/10.1107/S1600536808015791
Carcelli M., Ferrari C., Peliui C. et al. // J. Chem. Soc., Dalton Trans. 1992. P. 2127. https://doi.org/10.1039/DT9920002127
Jaafar M., Liu X., Dielmann F. et al. // Inorg. Chim. Acta. 2016. V. 45. P. 443. https://doi.org/10.1016/j.ica.2015.12.018
Klapötke T.M., Krumm B., Mayer P. et al. // Eur. J. Inorg. Chem. 2002. P. 2701. https://doi.org/10.1002/1099-0682(200210)2002:10< 2701::AID-EJIC2701>3.0.CO;2-G
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. М.: Мир, 2006. 440 с.
Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1178. [Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. неорган. химии. 2018. Т. 63. С. 1153. https://doi.org/10.1134/S0044457X18090180].https://doi.org/10.1134/S0036023618090188
Sharutin V.V., Sharutina O.K., Senchurin V.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 747. [Шарутин В.В., Шарутина О.К., Сенчурин В.С. и др. // Журн. неорган. химии. 2018. Т. 63. С. 712.]https://doi.org/10.1134/S0036023618060220
Batsanov S.S. // Russ. J. Inorg. Chem. 1991. V. 36. № 12. P. 2015. [Бацанов С.С. // Журн. неорган. химии. 1991. Т. 36. № 12. С. 3015.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии