Журнал неорганической химии, 2019, T. 64, № 2, стр. 117-124
Структура и транспортные свойства ниобатов висмута Bi3Nb1 – хErxO7 – δ
Ю. В. Емельянова 1, *, А. А. Крылов 1, А. Д. Казанцева 1, Е. С. Буянова 1, С. А. Петрова 2, И. В. Николаенко 1, 3
1 Уральский федеральный университет
620002 Екатеринбург, ул. Мира, 19, Россия
2 Институт металлургии УрО РАН
620016 Екатеринбург, ул. Амундсена, 101, Россия
3 Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: J.V.Emelianova@urfu.ru
Поступила в редакцию 05.04.2018
После доработки 06.07.2018
Принята к публикации 05.04.2018
Аннотация
Представлены результаты исследования структурных и электрофизических характеристик замещенных ниобатов висмута состава Bi3Nb1 – хErxO7 – δ, являющихся перспективными кислородно-ионными проводниками. С помощью рентгенофазового анализа, электронной микроскопии с рентгеновским микроанализом установлены области гомогенности твердых растворов, рассчитаны кристаллохимические параметры. Методами дифференциальной сканирующей калориметрии и дилатометрического анализа определена устойчивость твердых растворов и наличие фазовых переходов. Электропроводность спеченных образцов исследована методом импедансной спектроскопии.
ВВЕДЕНИЕ
Оксид висмута δ-Bi2O3 со структурой флюорита (структура CaF2, пр. гр. Fm3m) имеет наибольшую величину ионной проводимости среди всего класса кислородно-ионных проводников. Она на два порядка выше, чем у 8YSZ, который в настоящее время используется в качестве электролита в ТОТЭ. Высокая электропроводность δ-Bi2O3 обусловлена большим количеством вакансий кислорода в структуре и слабой связью Bi–O, что, в свою очередь, приводит к высокой подвижности иона кислорода. Однако данная модификация стабильна лишь в узком интервале температур 1000–1100 K [1]. Изо- или гетеровалентное замещение висмута может способствовать стабилизации флюоритоподобной модификации и изменению концентрации кислородных вакансий [2, 3]. Ниобат висмута Bi3NbO7 является представителем такого вида замещения и, по мнению авторов [4–6], также является кислородно-ионным проводником, величина электропроводности которого составляет 5 × 10–4 См см–1 при 873 K. Атомы висмута и ниобия в Bi3NbO7 статистически распределены в одной системе кристаллографических позиций в мольном соотношении 3 : 1. Координационный полиэдр ниобия представляет собой искаженный октаэдр, висмут же окружен восемью атомами кислорода. Возможно дальнейшее замещение позиций катионов, например, в [7] ниобий замещен на эрбий с образованием Bi3Nb1 − xErxO7 – δ. Электропроводность в данной системе была исследована методом импедансной спектроскопии. Из результатов измерений на переменном токе построены температурные зависимости электропроводности, на которых авторы [7–9] выделяют два линейных участка с различными значениями энергии активации. Значения обеих величин возрастают с увеличением количества допанта. Это может быть связано с повышением числа вакансий при замещении Nb5+ на Er3+. Кроме того, на аррениусовских зависимостях видно резкое повышение значений электропроводности между определенными составами. Например, первый скачок между х = 0.2 и 0.4 соответствует переходу от псевдокубической структуры (согласно работе [10], это тип II структуры ниобатов в системе Bi2O3–Nb2O5 – псевдокубическая структура с несоразмерной модуляцией во всех трех измерениях) к другому типу, характеризующемуся бóльшим содержанием позиций кислорода О(1) – 8с и меньшим содержанием позиций О(2) – 32f. Второй скачок между составами с х = 0.8 и 1.0 связан с удалением из системы пятивалентного ниобия. Энергия активации низкотемпературной области (ELT) возрастает с увеличением содержания эрбия в системе. Это связано с уменьшением количества позиций ионов кислорода в положении 32f, которые обеспечивают бóльшую подвижность ионов, чем 8с. Для энергии активации высокотемпературной области (EHT), кроме перехода от х = 0.0 к 0.2, характерно уменьшение величины с повышением содержания допанта в связи со снижением взаимодействия вакансия–допант при замещении пятивалентного ниобия трехвалентным эрбием.
Авторами [7] уточнена структура Bi3Nb1 −xErxO7 – δ и установлено, что атомы металлов располагаются на идеальной позиции 4а (0, 0, 0), а атомы кислорода распределены по трем позициям: О(1) – 8c (0.25, 0.25, 0.25), O(2) – 32f (0.3, 0.3, 0.3) и О(3) – 48i (0.5,0.2,0.2). Следует отметить, что в чистом δ-Bi2O3 вообще отсутствует позиция О(3). Следовательно, можно предположить, что ион кислорода в этой позиции должен быть связан с элементами-заместителями Nb и/или Er. Окружение атомов Nb и/или Er атомами О(3) представляет разупорядоченный октаэдр. Кроме того, авторами показано, что число позиций О(1) значительно увеличивается с повышением содержания эрбия, а число О(2), соответственно, уменьшается. Количество позиций О(3) не зависит от состава. По результатам нейтронографических исследований, при х < 0.6 на дифрактограммах появляются дополнительные линии, характерные для сверхструктурного упорядочения. При большом содержании замещающего компонента эти дополнительные линии не удается отследить из-за высокого фона. Авторы [7] считают, что происходит локальное упорядочение дефектов в структуре. Однако при описании структур они учли не все имеющиеся на нейтронограммах рефлексы, и, по-видимому, в этой системе также необходимо учитывать возможность сосуществования фаз.
Основной целью настоящей работы является исследование влияния замещения ниобия эрбием на структурные и транспортные характеристики ниобатов висмута.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза изучаемых соединений Bi3Nb1 – хErxO7 – δ, где x изменяется от 0.1 до 1.0 с шагом 0.1, в работе использовали Bi2O3 (ос. ч. ≥99.5%), Er2O3 (ос. ч. ≥99.5%), Nb2O5 (ос. ч.). Исходные оксиды предварительно прокаливали для удаления влаги и получения устойчивых модификаций. Синтез проводили по стандартной керамической технологии в брикетированных образцах в интервале температур 773–1123 K с шагом 50 K и выдержкой на каждой стадии около 24 ч.
Фазовый состав контролировали рентгенографически (дифрактометр ДРОН-3, CuKα-излучение, монохроматор из пиролитического графита на отраженном пучке, интервал углов 2θ = 20°–60°). Для расчета параметров элементарной ячейки и уточнения кристаллической структуры использовали программный пакет Celref [11]. Высокотемпературное исследование образцов проводили на дифрактометре D8 ADVANCE (CuKα-излучение, позиционно-чувствительный детектор Våntec-1, β-фильтр) в камере HTK1200N в диапазонах температур 303–1123 K (x = 0.2, 0.5, 0.8) и 303–1083 K (x = 0.4) на воздухе в алундовых тиглях. При нагревании съемку проводили через каждые 10 (x = = 0.2, 0.5, 0.8) или 20 (x = 0.4) градусов, при охлаждении – через каждые 50 K. Выдержка перед съемкой при заданной температуре – 60 с, скорость нагрева и охлаждения – 0.5 град/с. Результаты экспериментов были обработаны с использованием программного пакета Diffracplus EVA [12] и базы данных международного центра дифракционных данных PDF4+ ICDD [13]. Полнопрофильный анализ дифрактограмм в двухфазной области проводили с использованием программного пакета DiffracplusTOPAS [14].
Для уточнения структуры по методу Ритвельда съемку образцов проводили при комнатной температуре (298 K) на дифрактометре D8 Advance. Данные записывали в интервале углов 7°–130° с шагом 0.021° по 2θ и экспозицией в точке 1664 с. Полнопрофильное уточнение структуры по методу Ритвельда [15] проводили для пр. гр. 225 (PDF 04–011–2233) [15] с использованием программы TOPAS [14].
Размеры частиц порошков определяли с помощью анализатора дисперсности SALD-7101 Shimadzu. Для электрохимических и термических измерений порошки прессовали в виде таблеток диаметром 10 мм и прямоугольных столбиков высотой 25 мм, далее отжигали при температуре 1123 K. В качестве критерия оценки плотности полученной керамики использовали отношение объемной плотности, полученной гидростатическим взвешиванием, и рентгеновской плотности образцов. Анализ микроструктуры образцов выполняли с использованием растрового электронного микроскопа JEOL JSM 6390LA, оснащенного рентгеновским энергодисперсионным микроанализатором JED 2300. Элементный состав образцов определяли методом атомно-эмиссионной спектроскопии (АЭС) с индуктивно-связанной плазмой на спектрометре iCAP 6500 Thermo Scientific. Дилатометрический анализ спеченных брикетов проводили на дилатометре DIL 402 C Netzsch при скорости нагрева 2 град/мин в интервале температур 293–1023 K. Дифференциальный термический анализ выполняли в температурном интервале 293–973 K на термоанализаторе STA 409 PC Luxx Netzsch. В качестве стандарта использовали оксид алюминия.
Электропроводность образцов исследовали методом импедансной спектроскопии (импедансметр Elins Z-3000) в интервале температур 1073–573 K. Эквивалентную схему ячейки подбирали с использованием программы Zview software (Version 2.6b, Scribner Associates, Inc.).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В нашей предыдущей работе [16] было установлено, что в исследуемой системе существует область твердых растворов со стороны ниобата висмута Bi3NbO7 при x = 0–0.4 и область твердых растворов на основе сложного оксида висмута-эрбия Bi3ErO6 при x > 0.70. В настоящем исследовании проведено уточнение структурных особенностей и областей существования твердых растворов серии Bi3Nb1 – хErxO7 – δ, особенно при большой концентрации эрбия. Установлено, что при x = 0 происходит формирование двух фаз: Bi3NbO7 и фазы, состав которой можно описать формулой Bi47Nb16O111, имеющей тетрагональную структуру (пр. гр. I4m2) с параметрами элементарной ячейки: а = 11.533, с = 38.525 Å. Эту структуру можно рассматривать как смесь структурных типов флюорита и пирохлора [17]. В диапазоне 0 < < x < 0.6 формируются твердые растворы на основе ниобата висмута Bi3NbO7 (несоразмерная структура), а при x = 0.2–0.9 дополнительно появляются твердые растворы на основе оксида висмута и эрбия состава Bi3ErO6. Однофазные образцы в серии Bi3Nb1 – xErxO7 – δ получены только при х = 0.1 и х ≥ 0.7. Однофазные образцы имеют кубическую структуру, расчет параметров элементарной ячейки проводили в кубической установке (пр. гр. Fm3m). Значения параметров элементарных ячеек приведены в табл. 1.
Таблица 1.
Рентгенографические характеристики Bi3Nb1 – xErxO7 – δ
| Значение x для номинального состава Bi3Nb1 – xErxO7 – δ | Параметры элементарной ячейки | |||
|---|---|---|---|---|
| твердый раствор на основе | Bi47Nb16O111 | |||
| Bi3NbO7 | Bi3ErO6 | |||
| a ± 0.001, Å | c ± 0.001, Å | |||
| 0 | 5.466 | – | 11.533 | 38.525 |
| 0.1 | 5.466 | – | – | – |
| 0.2 | 5.473 | 5.458 | – | – |
| 0.3 | 5.476 | 5.456 | – | – |
| 0.4 | 5.475 | 5.458 | – | – |
| 0.5 | 5.476 | 5.466 | – | – |
| 0.6 | 5.466 | 5.476 | – | – |
| 0.7 | – | 5.477 | – | – |
| 0.8 | – | 5.480 | – | – |
| 0.9 | – | 5.481 | – | – |
Для ряда составов Bi3Nb1 –xErxO7 – δ (х = 0.1, 0.7) проведено полнопрофильное уточнение структуры по методу Ритвельда, данные представлены на рис. 1, 2 и в табл. 2. Состав Bi3Nb0.9Er0.1O6.9 кристаллизуется в псевдокубической структуре [18], о чем свидетельствует наличие сверхструктурных отражений (показаны стрелками на рис. 1). Для состава с х = 0.7 сверхструктурных рефлексов не обнаружено.
Рис. 1.
Экспериментальная (точки) и расчетная (сплошная линия) дифрактограммы, а также разностная кривая образца Bi3Nb0.9Er0.1O6.9.
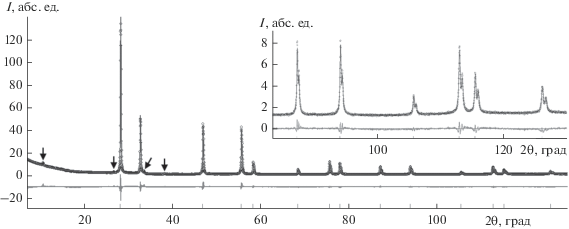
Рис. 2.
Экспериментальная (точки) и расчетная (сплошная линия) дифрактограммы, а также разностная кривая образца Bi3Nb0.3Er0.7O6.3.
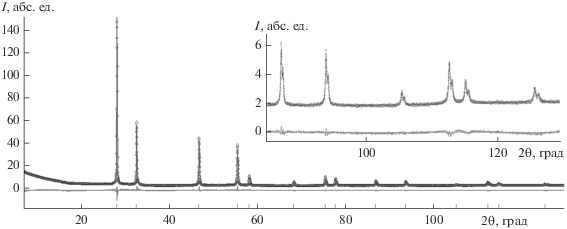
Таблица 2.
Структурные параметры соединений Bi3Nb0.9Er0.1O6.9 и Bi3Nb0.3Er0.7O6.3
| Позиция | Кратность | x | y | z | Атом | Заселенность | Bэкв |
|---|---|---|---|---|---|---|---|
| Bi3Nb0.9Er0.1O6.9. Пр. гр. Fm3m, a = 5.4661(1) Å, V = 163.317(5) Å3 | |||||||
| Bi | 4a | 0 | 0 | 0 | Bi+3 | 0.7490(18) | 0.92(2) |
| Nb | 4a | 0 | 0 | 0 | Nb+5 | 0.2247(21) | 0.92(2) |
| Er | 4a | 0 | 0 | 0 | Er+3 | 0.0253(22) | 0.92(2) |
| O | 48g | 0.142(6) | 0.25 | 0.25 | O–2 | 0.141(16) | 2.6(1) |
| Rэксп = 1.84%, Rwp = 7.95%, Rp = 6.06%, GOF = 4.3%, RB = 1.27% | |||||||
| Bi3Nb0.3Er0.7O6.3. Пр. гр. Fm3m, a = 5.4787(1) Å, V = 164.450(12) Å3 | |||||||
| Bi | 4a | 0 | 0 | 0 | Bi+3 | 0.7495(14) | 1.81(3) |
| Nb | 4a | 0 | 0 | 0 | Nb+5 | 0.0748(21) | 1.81(3) |
| Er | 4a | 0 | 0 | 0 | Er+3 | 0.1752(18) | 1.81(3) |
| O(1) | 8c | 0.25 | 0.25 | 0.25 | O–2 | 0.325(9) | 2.9(1) |
| O(2) | 32f | 0.330(3) | 0.330(3) | 0.330(3) | O–2 | 0.092(10) | 2.3(1) |
| O(3) | 48i | 0.5 | 0.133(5) | 0.133(5) | O–2 | 0.016(11) | 2.8(1) |
| Rэксп = 1.74%, Rwp = 7.07%, Rp = 5.38%, GOF = 4.07%, RB = 0.84% | |||||||
Установлено, что атомы металлов в Bi3Nb0.3Er0.7O6.3 располагаются на идеальной позиции 4а (0, 0, 0), а атомы кислорода распределены по трем позициям: О(1) – 8c (0.25, 0.25, 0.25), O(2) – 32f (0.330, 0.330, 0.330) и О(3) – 48i (0.5,0.133,0.133). Для Bi3Nb0.9Er0.1O6.9 наблюдается другая картина, где все металлические атомы связаны с атомом кислорода, находящимся в позиции 48g (0.142, 0.25, 0.25).
Элементный состав твердых растворов, установленный двумя методами (рентгеноэлектронной микроскопии (РЭМ) и АЭС), неплохо согласуется между собой и совпадает с номинальной композицией, заложенной при синтезе в пределах ошибки эксперимента (табл. 3).
Таблица 3.
Соотношение по металлическим компонентам для ряда Bi3Nb1 –хErxO7 – δ
| Метод анализа | Содержание атомов, ± 0.5 ат. % | ||
|---|---|---|---|
| Bi | Nb | Er | |
| Bi3Nb0.7Er0.3O7 – δ | |||
| РЭМ | 74.4 | 18.0 | 7.6 |
| АЭС | 74.3 | 18.1 | 7.6 |
| Истинное значение | 75.0 | 17.5 | 7.5 |
| Bi3Nb0.2Er0.8O7 – δ | |||
| РЭМ | 78.1 | 4.7 | 17.3 |
| АЭС | 78.0 | 4.7 | 17.2 |
| Истинное значение | 75.0 | 5.0 | 20.0 |
В качестве дополнительного метода оценки фазового и элементного состава твердых растворов Bi3Nb1 – хErxO7 – δ была использована РЭМ с возможностью энергодисперсионного микроанализа. На рис. 3 для примера представлен общий вид поверхности и скола таблетированного образца Bi3Nb0.2Er0.8O7 – δ. Поверхность и скол образца достаточно ровные, пористые, межзеренная область чистая, примесных фаз не наблюдается. Содержание эрбия в разных точках поверхности колеблется от ~16 до 24 ат. % для данного твердого раствора. Средний размер частиц порошков, определенный методом лазерной дифракции, лежит в интервале 0.5–20 мкм. Пористость спеченной из порошков керамики составляет в среднем 4–7%.
Рис. 3.
Микроизображение скола спеченного брикета Bi3Nb0.2Er0.8O7 – δ. Изображение получено в отраженных электронах.

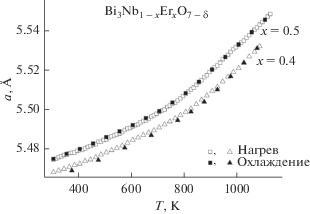
Для изучения температурных интервалов существования присутствующих совместно фаз проведены высокотемпературные рентгенографические исследования в интервале 303–1123 K. В качестве примера на рис. 4 приведены температурные зависимости параметров элементарных ячеек сосуществующих фаз для образца номинального состава Bi3Nb0.5Er0.5O7 – δ, зависимости аппроксимированы полиномами 2-го порядка. На рис. 5 показано изменение параметров элементарных ячеек двух сосуществующих кубических фаз в Bi3Nb1 – хErхO7 – δ при нагревании и охлаждении.
Рис. 4.
Температурная зависимость параметров элементарной ячейки для двух сосуществующих кубических фаз (твердых растворов на основе Bi3NbO7 и Bi3ErO6) для образца номинального состава Bi3Nb0.5Er0.5O7 – δ.
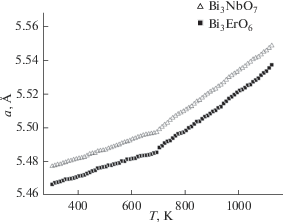
Можно заметить, что при охлаждении фазовый состав образцов сохраняется до комнатной температуры и каких-либо отклонений в поведении параметров элементарных ячеек не наблюдается, а во всем исследованном температурном интервале две фазы присутствуют совместно. Однако при температуре ~693 K на обоих графиках наблюдается перегиб, связанный, скорее всего, с переходом от псевдокубической структуры (тип II) к другому типу, который характеризуется большим содержанием позиций кислорода и обеспечивается изменением координационного окружения катионов. Полученные данные по полнопрофильному уточнению структуры методом Ритвельда (табл. 2) показывают, что при малом содержании допанта в структуре отсутствуют позиции О(2) и О(3), тогда как при большом содержании замещающего компонента эти позиции заняты. Следовательно, можно предположить, что ион кислорода в этих позициях должен быть связан с допирующим элементом.
Для установления возможных фазовых переходов и определения линейного коэффициента термического расширения (ЛКТР) керамики использовали дилатометрический анализ. На рис. 6 видно, что при изменении температуры также наблюдаются перегибы, которые связаны с перестройками в кислородной подрешетке и обеспечиваются изменением координационного окружения катионов. Несовпадение линий нагрева и охлаждения для образцов может быть связано со спеканием брикетов в процессе длительной выдержки при температуре 1123 K. Рассчитанные значения ЛКТР твердых растворов составляют (17–18) × 10–6 K–1.
Рис. 6.
Результаты дилатометрического анализа, показывающие изменение КТР для образца Bi3Nb0.1Er0.9O7 – δ с температурой.
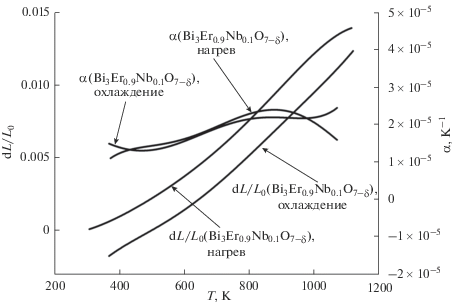
Для образца Bi3Nb0.6Er0.4O7 – δ была сделана попытка провести дилатометрические измерения с выдержкой при конечной температуре (1023 K) и сменой атмосферы на восстановительную (50% H2 + 50% Ar, общее давление 1 атм). Однако при выдержке при 1023 K в атмосфере смеси газов H2 и Ar образец изменял форму и цвет. После эксперимента образец представлял собой столбик желто-зеленого цвета, покрытый серыми каплями, которые легко отделялись. Для данного образца провели РФА (отдельно для каждой составляющей). Результаты РФА представлены в табл. 4.
Таблица 4.
Фазовый состав желто-зеленого образца и серых капель
| Формула | Сингония | Пр. гр. | Параметры элементарной ячейки | |||
|---|---|---|---|---|---|---|
| a ± 0.005, Å | b ± 0.005, Å | c ± 0.005, Å | β ± 0.005, град | |||
| Желто-зеленый образец | ||||||
| Bi2O3 | Тетрагональная | C42b | 10.950 | 10.950 | 5.630 | 90.000 |
| Bi | Ромбоэдрическая | R3m | 4.547 | 4.547 | 11.861 | 90.000 |
| Bi1.9Er0.1O3 | Тетрагональная | I4/mmm | 3.879 | 3.879 | 5.658 | 90.000 |
| Bi2O3 | Моноклинная | P21/c | 5.844 | 8.157 | 7.503 | 112.970 |
| Серые капели | ||||||
| Bi | Ромбоэдрическая | R3m | 4.548 | 11.852 | ||
Таким образом, при смене атмосферы на восстановительную (Ar + H2) произошло разложение образца на металлический Bi, Bi2O3 и твердый раствор на основе эрбата висмута. Полученные результаты свидетельствуют о нестабильности образца в восстановительной атмосфере, что может в дальнейшем привести к невозможности использования данного твердого раствора в качестве электролита ТОТЭ.
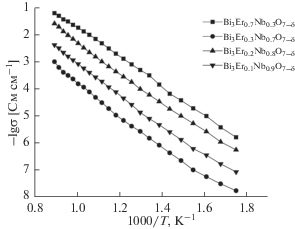
Общая электропроводность твердых растворов Bi3Nb1 –xErxO7 – δ при 0.1 ≤ x ≤ 1.0 исследована методом импедансной спектроскопии в интервале температур 1073–573 K в режиме охлаждения. Импедансные диаграммы для исследуемых ячеек и их изменение с температурой соответствуют наблюдаемым закономерностям для других замещенных ниобатов висмута и могут быть описаны аналогичными эквивалентными схемами [19]. Общую проводимость поликристаллического образца рассчитывали, ориентируясь на сопротивление R, отвечающее объемной и/или зернограничной составляющей проводимости с учетом величин элементов постоянной фазы [20]. Разделение общей проводимости на объемную и зернограничную компоненты не проводилось из-за небольшого температурного интервала.
По результатам измерений импеданса построены температурные зависимости общей электропроводности, на которых можно выделить два линейных участка с различными значениями энергии активации. Проводимость при 673 и 1073 K для таких линейных участков может характеризовать низкую и высокотемпературную области. Ее величина меняется немонотонно, что может быть связано, с одной стороны, с переходом от псевдокубической структуры (тип II) к другому типу, характеризующемуся большим содержанием позиций кислорода, а с другой – с удалением из системы пятивалентного ниобия. Полученные данные представлены в виде графика температурной зависимости электропроводности в аррениусовских координатах (рис. 7) для ряда составов. Общий вид температурных зависимостей электропроводности для изучаемых твердых растворов является типичным для Bi3NbO7. Из однофазных твердых растворов наибольшей проводимостью обладают составы Bi3Nb1 –xErxO7 – δ с х = 0.2, 0.7.
ЗАКЛЮЧЕНИЕ
Показана возможность образования в системе Bi2O3–Nb2O5–Er2O3 твердых растворов, кристаллизующихся в кубической структуре флюорита (пр. гр. Fm3m). Такой прием приводит к стабилизации кубической структуры ниобата висмута в определенных концентрационных диапазонах замещающих элементов и улучшению электропроводящих характеристик твердых растворов. Однако при смене атмосферы на восстановительную (Ar + H2) происходит разложение образца на металлический Bi, Bi2O3 и твердый раствор на основе эрбата висмута. Полученные результаты свидетельствуют о невозможности использования данного твердого раствора в качестве электролита ТОТЭ.
Список литературы
Samoukina P., Kamba S. // J. Eur. Ceram. Soc. 2005. V. 25. № 12. P. 3085. doi 10.1016/j.jeurceramsoc.2005.03.194
Krok F., Abrahams I. // Solid State Ionics. 2004. V. 175. № 1–4. P. 335. doi 10.1016/j.ssi.2003.12.031
Chezhina N.V., Zhuk N.A., Korolev D.A. // J. Solid State Chem. 2016. V. 233. P. 205. doi 10.1016/j.jssc.2015.10.026
Borowska-Centkowska A., Kario A., Krok F. et al. // Solid State Ionics. 2010. V. 181. № 39–40. P. 1750. doi 10.1016/j.ssi.2010.09.055
Castro A., AguadoE., Rojoet J.M. et al. // Mater. Res. Bull. 1998. V. 33 № 1. P. 31. doi 10.1016/S0025-5408(97)00190-6
Ling C.D. // J. Solid State Chem. 2004. V. 177. P. 1838.
Leszczynska M., Holdynski M., Krok F. et al. // Solid State Ionics. 2010. V. 181. № 8–9. P. 796. doi 10.1016/ j.ssi.2010.04.012
Tung Chou, Li-Der Liu, Wen-Cheng J. Wei // J. Eur. Ceram. Soc. 2011. V. 31. № 16. P. 3087. doi 10.1016/ j.jeurceramsoc.2011.04.016
Sadykov V.A., Koroleva M.S., Piir I.V. et al. // Solid State Ionics. 2018. V. 315. P. 33. doi 10.1016/ j.ssi.2017.12.008
Withers R.L., Ling C.D., Schmid S. // Z. Kristallogr. 1999. V. 214. № 5. P. 296.
Laugier J., Bochu B. CELREF V3. Developed at the Laboratoire des Matériaux et du Génie Physique, Ecole Nationale Supérieure de Physique de Grenoble (INPG), 2003.
DiffracPlus: Eva Bruker AXS GmbH, Ostliche. Rheinbruckenstraße 50, D-76187, Karlsruhe, Germany. 2008.
Powder Diffraction File PDF4 + ICDD Release 2015.
DiffracPlus: TOPAS Bruker AXS GmbH, Ostliche. Rheinbruckenstraße 50, D-76187, Karlsruhe, Germany, 2008.
Rietveld H.M. // J. Appl. Crystallogr. 1969. V. 2. P. 65.
Emel’yanova Yu.V., Mikhailovskaya Z.A., Buyanova E.S., Petrova S.A. // Russ. J. Appl. Chem. 2017. V. 90. Iss. 3. Р. 354. doi 10.1134/ S1070427217030053 [Емельянова Ю.В., Михайловская З.А., Буянова Е.С., Петрова С.А. // Журн. прикл. химии. 2017. Т. 90. № 3. С. 292.]
Roth R.S., Waring J.L. // J. Res. Nat. Bur. Stand. A. 1962. V. 66A. № 6. P. 451.
Valant M., Suvorov D. // J. Am. Ceram. Soc. 2003. V. 86. № 6. P. 939.
Kaymieva O.S., Tarasova O.A., Shatokhina A.N. et al. // Russ. J. Electrochem. 2013. V. 49. № 7. P. 652. doi 10.1134/ S1023193513070057 [Каймиева О.С., Тарасова О.А., Шатохина А.Н. и др. // Электрохимия. 2013. Т. 49. № 7. С. 732.]
Irvine J.T.S., Sinclair D.C., West A.R. // Adv. Mater. 1990. V. 2. № 3. P. 132. doi 10.1002/adma.19900020304
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии