Журнал неорганической химии, 2019, T. 64, № 2, стр. 218-226
Фазообразование в системе TiO2–H2SO4–HF–Nd(NO3)3–H2O при 20°C
М. М. Годнева 1, *, М. П. Рыськина 1, Н. Л. Михайлова 1, В. Я. Кузнецов 1
1 Институт химии и технологии редких элементов и минерального сырья КНЦ РАН
184209 Апатиты, Академгородок, 26а, Россия
* E-mail: motov@chemy.kolasc.net.ru
Поступила в редакцию 05.04.2018
После доработки 06.07.2018
Принята к публикации 20.05.2018
Аннотация
Выделены фазы NdF3 (I), X (II), NdTi2O4.75F0.5(SO4)0.5 · 3H2O (III), NdTiF3(SO4)2 · 6H2O (NdTiOF(SO4)2 · 6H2O) (IV), Nd2(SO4)3 · 8H2O (V) и Nd2(SO4)3 · 4H2O (VI), образующиеся в сернокислых и фторсодержащих растворах при получении материалов из сырья, при очистке и разделении металлов. Схематично представлены области их существования. Отмечены частицы со структурой “ядро–оболочка”. Соединения изучены методами элементного, кристаллооптического, рентгенофазового и термического анализа. Определен состав фазы III (по данным ТГ) и сферолитоподобных частиц H6NdF7.8(SO4)0.5 · 3.75H2O (VII) (методом рентгеновского микроанализа). Свежеполученные частицы выделяют HF. Фаза IV, соответствующая (по данным ТГ) NdTiF3(SO4)2 · 6H2O, при выстаивании приобретает состав и вид известной фазы NdTiOF(SO4)2 · 6H2O.
ВВЕДЕНИЕ
Недостаточная изученность индивидуальных свойств соединений неодима тормозит их применение на практике. Ранее были исследованы системы Nd2O3–TiO2–HNO3–HF–H2O в интервале концентраций 25–50% HNO3, 0.5–6.0% HF при мольном отношении (м. о.) Nd/Ti = 0.4 при 50 и 75°С [1] и TiO2–H2SO4–HF–Nd(NO3)3–H2O при содержании в растворах 6–7 мас. % TiO2, м. о. H2SO4/Ti = 3–8, Nd/Ti = 0.3–0.4 и F/Ti = 0–5 при 75°C [2]. Установлены области кристаллизации твердых фаз: NdF3, Nd2(SO4)3 · 8H2O, Nd2(SO4)3 · · 4H2O, NdTiOF(SO4)2 · 6H2O, Nd4Ti3F15(SO4)4.5· · nH2O, NdFSO4 · nH2O, TiOSO4 · 2H2O, TiO2 · xH2O и фторида титана. Кристаллизацией из кипящих сернокислых растворов при 150–170°С выделен также двойной сульфат Nd2(SO4)3 · 4Ti(SO4)3 [3].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения образцов в качестве исходных компонентов использовали TiOSO4 · 2H2O, Nd(NO3)3 · 6H2O (х. ч.), H2SO4 и HF квалификации ”ос. ч.”. Исследования проводили по разрезам системы TiO2–H2SO4–HF–Nd(NO3)3–H2O при м. о. H2SO4/Ti = 2 и 5, Nd/Ti = 0.2 и 0.5, F/Ti = = 1–6 и при содержании в растворе 2–15 мас. % TiO2. Концентрацию TiO2 рассчитывали с учетом разбавления водой, содержащейся в растворе фтористоводородной кислоты и гидрате неодима. Смеси выдерживали в течение 7–30 сут при 20°С, затем образовавшиеся осадки отфильтровывали, промывали ледяной водой, спиртом с водой, спиртом. Кристаллооптические измерения проводили с использованием иммерсионных жидкостей на микроскопе Leica DM 2500 P. Рентгенограммы полученных образцов записывали на приборе ДРФ-2 (графитовый монохроматор, CuKα-излучение). Состав некоторых частиц определяли методом рентгеновского микроанализа (РМА) на энергодисперсионном спектрометре INCA Energy фирмы Oxford Instrument. Запись кривых ДТА и ТГ осуществляли с помощью термоанализатора STA 409 фирмы NETZSCH в Pt–Rh-тиглях с крышками в токе воздуха с расходом 30 мл/мин при скорости нагрева 10 град/мин с Pt–Pt/Rh-термопарой.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
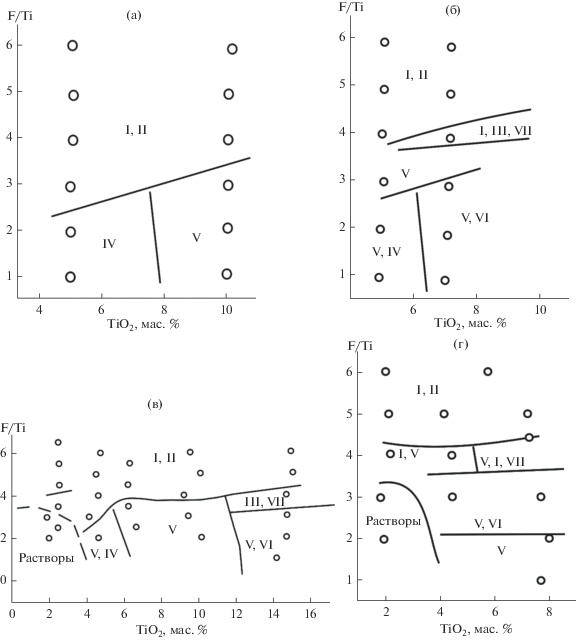
На рис. 1 схематично представлены поля образования фаз NdF3 (I), X (II), NdTi2O4.75F0.5(SO4)0.5 · · 3H2O (III), NdTiOF(SO4)2 · 6H2O (IV), Nd2(SO4)3 · · 8H2O (V) и Nd2(SO4)3 · 4H2O (VI). При низком содержании неодима (Nd/Ti = 0.2) и серной кислоты (H2SO4/Ti = 2) (рис. 1а) выделены фазы I, II, IV и V. В поле I, II в широкой области концентраций по TiO2 при м. о. F/Ti > 4 образуются аморфизованные осадки, которые состоят из смеси NdF3 и изотропной фазы (II). Повышение кислотности исходного раствора (H2SO4/Ti = 5) приводит к образованию двухфазных полей фаз IV, V и V, VI, т.е. помимо оксофторосульфатотитаната неодима образуется октагидрат сульфата неодима, а при увеличении содержания титана имеет место также образование тетрагидрата (фаза VI) (рис. 1б). Кроме того, появляется поле фазы V. Увеличение содержания неодима, по-видимому, смещает границу образования фазы VI вправо (рис. 1г). Повышение содержания неодима от м. о. Nd/Ti = 0.2 до 0.5 (рис. 1в) не приводит к существенным изменениям в образовании фаз при тех же условиях, что на рис. 1а. Однако при низком содержании титана в исходном растворе и незначительном содержании фтора отмечена область ненасыщенных растворов, а при высоком – с фазой V кристаллизуется сульфат VI (рис. 1в). Как было отмечено ранее, при осаждении фторида из растворов образуются гелеобразные осадки, плохо фильтрующиеся и плохо отмывающиеся от анионов [3].
Рис. 1.
Области образования фаз. Разрезы: м. о. Nd/Ti, H2SO4/Ti: а – 0.2, 2; б – 0.2, 5; в – 0.5, 2; г – 0.5, 5 соответственно. Кружками отмечены экспериментальные точки.
Фаза I мелкозернистая, белого цвета отобрана механически под бинокуляром из осадка, содержащего в незначительном количестве фазу II. Для осадка с фазой I , полученного при м. о. F/Ti = 6:
| Nd | TiO2 | F– | ${\text{SO}}_{4}^{{2 - }}$ | |
| Найдено, мас. %: | 69.0; | 0.06; | 28.3; | 2.65. |
| Для NdF3 | ||||
| вычислено, мас. %: | 71.7; | 0.00; | 28.3; | 0.00. |
Фаза I при 20°С более аморфизована, чем при 75°С.
Фаза II аморфная, существующая вместе с фазой I, отдельно не выделена. Количество SO4-групп в ней уменьшается по мере увеличения м. о. F/Ti в исходной смеси и увеличивается с ростом содержания титана в исходном растворе. SO4-группа не отмывается при обильной промывке холодной водой (550 мл H2O/г осадка). Осадок остается слабо-розовым.
Осадки c фазами I и II содержат капсулы (рис. 2а), состоящие из розовых ядра и оболочки (рис. 2б). Ядро представляет собой изометричные округлые немонофазные образования c белым с голубоватым оттенком анизотропным материалом (рис. 3б, 3в) и изотропными зернами NdF3 (рис. 2в, 2г). Рентгенограммы оболочки и ядра идентичны (табл. 1). Они содержат только интенсивные линии NdF3 [1].
Рис. 2.
Микрофотографии формирования ядер в капсуле в исходном растворе (а,б, в – м. о. F/Ti = 6; г – м. о. F/Ti = 4): а – общий вид капсулы, б – часть оболочки отсутствует, в – ядро удалено, г – внутренняя сторона капсулы; увеличение ×(32–56).
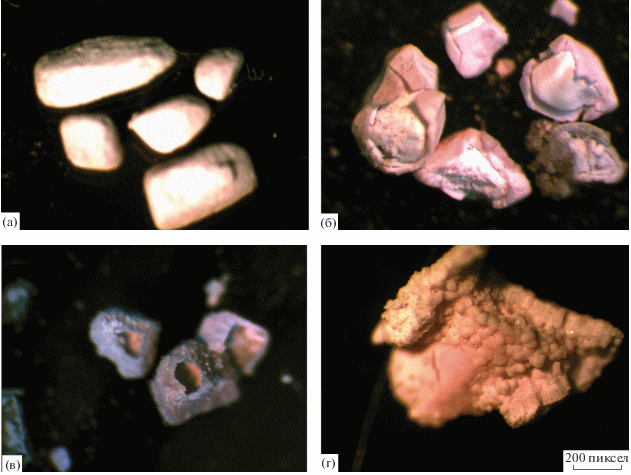
Рис. 3.
Микрофотографии ядер, образовавшихся в растворе с м. о. F/Ti = 4: а – общий вид (увеличение ~60); б, в – фрагменты ядра (увеличение ×600); в – при скрещенных николях.
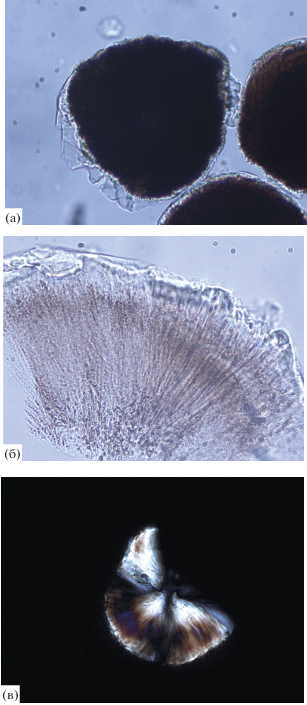
Таблица 1.
Рентгенометрические характеристики фаз
| I | III | IV | VII | VIII | |||||
|---|---|---|---|---|---|---|---|---|---|
| d, Å | Iотн | d, Å | Iотн | d, Å | Iотн | d, Å | Iотн | d, Å | Iотн |
| 3.58 | 49 | 14.0 | 83 | 8.0 | 28 | 6.75 | 83 | 12.8 | 12 |
| 3.50 | 44 | 6.50 | 37 | 7.0 | 60 | 6.4 | 53 | 6.753 | 4 |
| 3.13 | 100 | 6.30 | 37 | 6.401 | 14 | 5.75 | 60 | 6.003 | 100 |
| 2.51 | 17 | 5.10 | 22 | 5.801 | 49 | 5.15 | 27 | 4.853 | 6 |
| 2.04 | 55 | 3.50 | 100 | 5.401 | 29 | 4.62 | 100 | 4.67 | 13 |
| 2.01 | 65 | 3.29 | 70 | 4.70 | 67 | 4.27 | 63 | 4.52 | 5 |
| 1.975 | 42 | 2.98 | 57 | 4.32 | 55 | 3.93 | 40 | 4.203 | 4 |
| 1.780 | 52 | 2.76 | 30 | 4.00 | 41 | 3.79 | 43 | 3.813 | 9 |
| 1.767 | 47 | 2.16 | 38 | 3.811 | 100 | 3.70 | 57 | 3.753 | 16 |
| 1.710 | 16 | 2.07 | 62 | 3.701 | 56 | 3.512 | 53 | 3.54 | 7 |
| 1.990 | 47 | 3.56 | 40 | 3.40 | 93 | 3.423 | 13 | ||
| 1.863 | 40 | 3.44 | 96 | 3.152 | 67 | 3.203 | 9 | ||
| 1.783 | 28 | 3.261 | 19 | 2.99 | 60 | 3.08 | 17 | ||
| 1.770 | 28 | 3.161 | 12 | 2.87 | 37 | 3.033 | 17 | ||
| 1.673 | 30 | 3.10 | 14 | 2.60 | 67 | 3.013 | 13 | ||
| 1.648 | 25 | 3.021 | 43 | 2.55 | 67 | 2.743 | 4 | ||
| 2. 90 | 16 | 2.36 | 43 | 2.663 | 5 | ||||
| 2.78 | 11 | 2.33 | 50 | 2.603 | 4 | ||||
| 2.71 | 7 | 2.26 | 37 | 2.533 | 11 | ||||
| 2.61 | 43 | 2.15 | 57 | 2.423 | 3 | ||||
| 2.59 | 73 | 2.07 | 37 | 2.263 | 8 | ||||
| 2.52 | 16 | 2.0252 | 77 | 2.203 | |||||
| 2.46 | 13 | 1.9772 | 57 | 2.153 | |||||
| 2.37 | 16 | 2.10 | |||||||
| 2.34 | 16 | 2.01 | |||||||
| 2.30 | 27 | 1.926 | |||||||
| 2.26 | 16 | 1.878 | |||||||
| 2.21 | 5 | 1.870 | |||||||
| 2.16 | 29 | ||||||||
| 2.101 | 37 | ||||||||
| 2.06 | 16 | ||||||||
| 2.031 | 17 | ||||||||
| 1.9841 | 38 | ||||||||
| 1.956 | 34 | ||||||||
| 1.906 | 27 | ||||||||
| 1.884 | 14 | ||||||||
Примечание. 1 NdFSO4 · nH2O [1], 2 NdF3, 3 Nd2(SO4)3 · 8H2O.
Оболочка, как и ядро, немонофазна и содержит, кроме прозрачных со слабым голубоватым оттенком частиц, в меньшем количестве примесь (табл. 2). При длительном выдерживании (~10 лет) оболочка становится черно-серой (рис. 2в). Установлено, что NdF3 неустойчив и при хранении на воздухе подвергается медленному гидролизу. Черный цвет образующейся твердой фазы подтверждает образование оксида неодима. Между ядром и оболочкой имеется полый промежуточный слой.
Таблица 2.
Кристаллооптические характеристики соединений
| Соединение (по данным РФА) | Габитус | Окраска | Показатели преломления | |
|---|---|---|---|---|
| Ng | Np | |||
| I | Изотропные зерна без определенного облика | Белая со слабой голубизной | 1.580 ± 0.005 | |
| II | Мелкозернистая стеклоподобная масса | Розовая | 1.554–1.570 | |
| Zr(NO3)4 · 5H2O (примесь в ядре) | Изометричные округлые образования | 1.515–1.528 | ||
| Примесь в оболочке | Мелкозернистая масса с волнистым погасанием | 1.536 ± 0.005 | 1.524 ± 0.005 | |
| III (14 Å + белая фаза) | Мелкозернистая масса | >1.562 | ||
| IV | Радиально-лучистые сростки. Игольчатый | Розовая | 1.554 | 1.536 |
| V | Неопределенный | Розовая | 1.562 | 1.541 |
| VI | Неопределенный | Розовая | 1.634 | 1.602 |
В ИК-спектре ядра содержатся полосы при 841, 1400 и 1523 см–1, отвечающие Zr(NO3)4 · · 5H2O11 [4]. Полагаем, что при значительном содержании нитрат-ионов в исходном растворе сначала осаждаются NdF3 и Zr(NO3)4 · 5H2O, образуя ядра. Затем, когда содержание нитрат-иона в растворе уменьшается, кристаллизуется фторид неодима, создающий оболочку.
При м. о. F/Ti = 6 в исходном растворе капсулы имеют сравнительно тонкую оболочку и большое легко рассыпающееся ядро (рис. 1б), после удаления которого в розовой оболочке остается пустота (рис. 1в). Такие структуры называют погремушечными или структурами “ядро–оболочка” [5]. При м. о. F/Ti = 4 капсулы имеют более толстую оболочку, чем при м. о. F/Ti = 6, но состав оболочек одинаковый. На внутренней поверхности оболочки формируется множество мелких сферолитоподобных частиц (шариков) (рис. 2а, 2б), состоящих в основном из анизотропного материала белого (голубоватого) цвета (рис. 3б, 3в) (табл. 2).
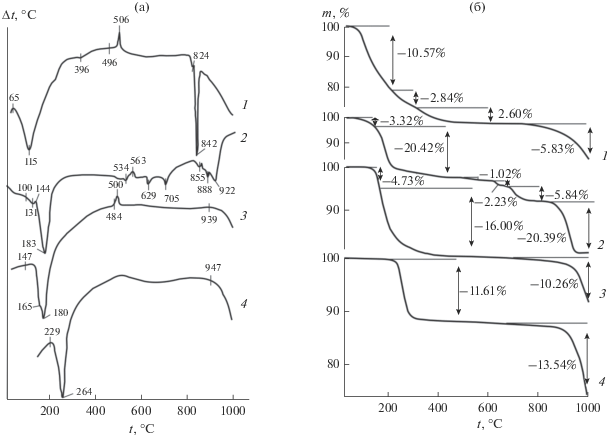
Фаза III белого цвета отобрана под бинокуляром из осадков, содержащих другие фазы, при высоком содержании титана в исходной смеси, причем во всех случаях м. о. F/Ti = 4–5 (рис. 1). Отдельного поля ее образования не имеется. Слабо раскристаллизованная фаза III неустойчива. Из нее выделяется газообразный продукт, разъедающий стекло, вероятно, HF. Рентгенограммы этой фазы и двойного сульфата титана с неодимом Nd2(SO4)3 · 4Ti(SO4)2 сходны, но не идентичны (табл. 1) [3, 6]. В табл. 1 представлены данные для свежеполученного образца. При более поздних записях отсутствует линия при 14 Å. Полагаем, что соотношение неодима к титану в фазе III соответствует найденному в фазе Nd2(SO4)3 · · 4Ti(SO4)2. По данным ТГ расcчитан состав фазы III c учетом конечных продуктов прокаливания при 1000°C. Известно, что термическая диссоциация безводных сульфатов РЗЭ протекает в две стадии: с образованием R2O2SO4 и далее R2O3. Исключением является сульфат церия, для которого сразу образуется оксид [7]. Для фаз V и VI конечными продуктами являются (NdO)2SO4 и Nd2(SO4)3. Такие продукты должны быть и для фазы III. Однако при этом велика разница между вычисленными и экспериментальными значениями для остатка после прокаливания. Если конечными продуктами прокаливания являются оксиды Nd2O3 и 4TiO2, то эти значения близки и формульный состав фазы III – NdTi2O4.75(SO4)0.31 · 3H2O. Учитывая, что при нагревании до 1000°С часть SO3 (~0.2 моля) и фтора (tпл(NdF3) = 1377°C [8]) не удаляется из сульфатоцирконатов калия [9], формулу соединения, по данным ТГ, можно записать как NdTi2O4.75F0.5(SO4)0.5 · 3H2O (табл. 3).
Таблица 3.
Данные термического анализа
| Исходная фаза | t, оС | Эффект | Убыль массы, % | Остаток, % | ||||
|---|---|---|---|---|---|---|---|---|
| найдено | вычис-лено | отне-сение | найдено | вычис-лено | состав | |||
| Состав исходной фазы III по данным ТГ NdTi2O4.75F0.5(SO4)0.5 · 3H2O | ||||||||
| III | 65–220 | Эндо | 10.57 | H2O | ||||
| 220–310 | Эндо | 2.84 | H2O | |||||
| ∑13.41 | 13.20 | H2O | ||||||
| 310–496 | 2.60 | 2.44 | HF | |||||
| 496–506 | Экзо | – | – | Кр | ||||
| 610–1000 | 5.83 | 6.06 | SO3 | |||||
| 824–842 | Эндо | – | – | Пл | ||||
| 65–1000 | 78.16 | 76.71 | Nd2O3, 4TiO2 | |||||
| 65–1000 | 78.16 | 85.57 | ¼[(NdO)2SO4, Nd2(SO4)3 · 8TiO2 | |||||
| Состав исходной фазы IV NdTiF3(SO4)2 · 6H2O | ||||||||
| IV | 100–130 сл | Эндо | 3.32 | H2O | ||||
| 144–183 у. с | Эндо | 20.42 | H2O | |||||
| ∑23.74 | 20.50 | H2O | ||||||
| 525–534 | Эндо | 1.02 | SO3 | |||||
| 534–562 | Экзо | Кр | ||||||
| 620–629 | Эндо | 2.53 | SO3 | |||||
| 694–705 | Эндо | 5.84 | SO3 | |||||
| 834–855 | Эндо | Пл | ||||||
| 880–888 | Эндо | |||||||
| 897–922 | Эндо | 20.39 | SO3, F | |||||
| 1000 | ∑ 29.96 | 30.36 | SO3, F | 46.47 | 47.05 | 1/2Nd2O3, TiO2 | ||
| 1000 | 46.47 | 62.23 | ¼[4TiO2, (NdO)2SO4, Nd2(SO4)3] | |||||
| Состав исходной фазы V Nd2(SO4)3 · 8.3H2O | ||||||||
| V | 147–165 | Эндо | 4.73 | H2O | ||||
| 165–180 | Эндо | 16.00 | H2O | Nd2(SO4)3 | ||||
| ∑20.73 | 20.02 | H2O | ||||||
| 484–500 | Экзо | – | – | Кр | ||||
| 535–1000 | – | 10.26 | 33.32 | М. о. SO3/Nd = 0.92 | 69.01 | 68.90 | [(NdO)2SO4, Nd2(SO4)3] | |
| 1000 | 69.01 | 46.68 | Nd2O3 | |||||
| Состав исходной фазы VI Nd2(SO4)3 · 4.28H2O | ||||||||
| VI | 229–264 | Эндо | 11.61 | 11.11 | H2O | Nd2(SO4)3 | ||
| 600–1000 | – | 13.54 | 44.42 | SO3 | 74.85 | 76.55 | (NdO)2SO4, Nd2(SO4)3 | |
Фаза IV светло-розового цвета образует радиально-лучистые сростки игольчатых кристаллов длиной ~10 мкм (рис. 4). Рентгенограмма этой фазы в основном соответствует представленной ранее [1], но имеется небольшой сдвиг в сторону увеличения межплоскостных расстояний (табл. 1).
| Nd | Ti | ∑(SO3 + F) (по ТГ) | H2O (по ТГ) | |
| Найдено, мас. %: | – | – | 29.96; | 23.74. |
| Для фазы IV | ||||
| вычислено, мас. %: | 27.35; | 9.08; | 30.36, 3.60; | 20.50. |
Фаза V образует ярко-розовые (красные) крупные кристаллы, структура которых определена методом РСА [10, 11]. Соединение содержит два типа SO4-групп: бидентатно-мостиковую и тридентатно-мостиковую.
Фаза VI состоит из кристаллов игольчатого облика длиной 5–15 мкм и шириной ~1 мкм. Данные по структуре этой фазы отсутствуют, но ее рентгенограмма сходна с таковой для Ce2(SO4)3 · · 4H2O [6, карта 73-195, 2].
Фаза VII. Ее содержание в смеси с фазами I, III и V незначительно. Она состоит из сферолитоподобных образований (шариков), которые были отобраны под бинокуляром (табл. 1, рис. 2а). Их состав, по данным РМА, H6.2NdF7.8(SO4)0.5 · · 3.75H2O22. Свежеполученные частицы выделяют летучий компонент, разъедающий стекло, вероятно, HF. После длительного выдерживания фтор в составе фазы не обнаружен. В меньшем количестве в сферолитоподобных частицах (шариках) присутствуют изотропные зерна NdF3. Шарики покрыты тончайшей оболочкой (рис. 3а). Состав оболочки шариков и анизотропного материала не установлен.
Фаза VIII (табл. 1). Содержание кристаллической фазы VIII в осадках также незначительно. Она отмечена в кислых растворах при м. о. H2SO4/Ti = 5, Nd/Ti = 0.5, HF/Ti = 4 и 4.5–7.4 мас. % TiO2 в смесях с фазами III, V и VII. Ее состав не установлен.
Помимо кристаллических фаз с неодимом отмечены аморфные фазы, вероятно, содержащие титан. В системе обнаружены в единичных точках не имеющие своих полей образования фазы, состав которых не установлен или требует уточнения. К ним относятся фазы II, VII, VIII.
Фазы III–VI являются гидратами, о чем свидетельствуют низкотемпературные эндоэффекты на кривых ДТА (рис. 5а). Причем в фазе III вода связана наиболее слабо, а в фазе VI – прочно. За эндоэффектами следуют небольшие экзоэффекты, вызванные, очевидно, кристаллизацией аморфных промежуточных продуктов дегидратации. Высокотемпературные эндоэффекты обусловлены убылью SO3, их температура возрастает в ряду фаз I < < IV < V < VI.
Рис. 5.
Кривые термического анализа: а – ДТА, б – ТГ. 1 – NdTi2O4.75F0.5(SO4)0.5 · 3H2O, 2 – NdTiOF(SO4)2 · 6H2O, 3 – Nd2(SO4)3 · 8H2O, 4 – Nd2(SO4)3 · 4H2O. Скорость нагревания 10 град/мин. Навеска, мг: 1 – 30, 2 – 14, 3 – 36, 4 – 28.
Частицы микро- и наноразмеров помимо пространственных характеристик могут обладать внутренней полой структурой в виде нанотрубок или в форме ядро–оболочки. В целом наноматериалы с многоуровневой внутренней структурой делят на ядро–полая оболочка и многооболочечные и многостенные [5]. Частицы, исследованные в данной работе для соединений с неодимом, не относятся к наноматериалам. Это микрочастицы с внутренней структурой ядро–оболочка, которая ранее для него не была известна. Погремушечные структуры ранее получали несколькими методами: с применением коллоидного раствора и вытравливанием промежуточного слоя SiO2, с использованием разницы в скорости диффузии. Наличие частиц ядро–оболочка приписывают также оствальдовcкому старению, когда молекулы маленьких кристаллов диффундируют и рекристаллизуются на поверхности больших кристаллических частиц [5]. Однако кристалличность NdF3 низкая. Вероятно, образование структуры ядро–оболочка вызвано наличием промежуточного коллоидного титансодержащего раствора, из которого в итоге формируется аморфная фаза.
Полые микроструктуры привлекают большое внимание за счет разнообразной внутренней структуры, гибкого химического состава, большой удельной поверхности и многофазных анизотропных границ разделов. Однако исследования пока в самой начальной точке своего развития [1, 5]. До этой работы авторам было известно только одно соединение титана со структурой ядро–оболочка, в котором ядро TiO2 покрыто оболочкой NiTiO3 [12]. Особого внимания заслуживают наночастицы типа ядро–оболочка, обладающие способностью комбинировать свойства нескольких материалов в одной частице [13].
Многоуровневые сложные структуры обладают огромным потенциалом в энергетике, защите окружающей среды, биоинженерии и многих других областях науки.
ЗАКЛЮЧЕНИЕ
Выделены фазы NdF3, X, NdTi2O4.75F0.5(SO4)0.5 · · 3H2O, NdTiOF(SO4)2 · 6H2O, Nd2(SO4)3 · 8H2O, Nd2(SO4)3 · 4H2O и H6NdF7.8(SO4)0.5 · 3.75H2O. Схематично представлены области их существования. Отмечены частицы со структурой ядро–оболочка и объяснено их образование. Фазы NdTi2O4.75F0.5(SO4)0.5 · 3H2O и H6.2NdF7.8(SO4)0.5 · · 3.75H2O выделены впервые. Свежеполученные частицы теряют HF. После длительного выдерживания (~10 мес.) фтор в них не обнаружен. Показано, что ранее полученная фаза NdTiOF(SO4)2 · 6H2O образуется при выстаивании фазы NdTiF3(SO4)2 · 6H2O.
Список литературы
Панасенко Е.Б., Белокосков В.И., Бегунова Р.Г. // Журн. неорган. химии. 1986. Т. 31. № 10. С. 2669.
Панасенко Е.Б., Загинайченко Н.И., Белокосков В.И. и др. // Журн. неорган. химии. 1988. Т. 33. № 12. С. 3171.
Филатова С.А., Горощенко Я.Г., Янкович В.Н., Антишко А.Н. // Журн. неорган. химии. 1977. Т. 22. № 4. С. 956.
Nyquist R.A., Kogal R.O. Infrared Spectra Inorganic Compounds. New-York–London: Academic Press, 1971. 500 p.
Полые наноматериалы с многоуровневой внутренней структурой // [Реферат подготовлен аспирантом МГУ Сивовым Романом (перевод тематического литературного обзора)] // Сайт нанотехнологического сообщества URL: http://www.nanometer.ru. 2010.07.15.12791485338975_215354.html из кеша Google (дата обращения 28.11. 2017).
The Powder Diffraction File (International Centre for Diffraction Data). Cardes 23-1262, 83-2244, 73-195.
Покровский А.Н., Ковба Л.М. // Журн. неорган. химии. 1976. Т. 21. № 2. C 567.
Химический энциклопедический словарь / Под ред. Кнунянц И.Л. М.: Сов. энцикл., 1983. 792 с.
Годнева М.М., Мотов Д.Л. Химия подгруппы титана: сульфаты, фториды, фторосульфаты из водных сред. М.: Наука, 2006. 302 с. [Motov D.L., Godneva M.M. Fluoric, Sulfatic and Fluorosulfatic Compounds of Group IV Elements. SPB.: Nauka, 2009, 307 p.]
Асланов Л.А., Рыбаков В.Б., Ионов В.М. и др. // Докл. АН СССР. 1972. Т. 204. № 5. С. 1122.
Комиссарова Л.Н., Пушкина Г.Я., Шацкий В.М. и др. Соединения редкоземельных элементов. Сульфаты, селенаты, теллураты, хроматы. М.: Наука, 1986. 366 с.
He Xuanmeng, Wang Fen, Lui Hui et al. // J. Eur. Ceram. Soc. 2017. V. 37. № 8. C. 2965. PЖX 18.01-19M.247.
Рудаковская П.Г., Белоглазкина Е.К., Мажуга А.Г. и др. // Вестн. Моск. ун-та. Сер. 2. Химия. 2015. Т. 56. № 3. С. 181.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии