Журнал неорганической химии, 2019, T. 64, № 2, стр. 132-136
Синтез нанодисперсного анатаза гидролизом тетрабутоксититана при различных значениях рН
Д. А. Жеребцов 1, С. А. Куликовских 2, *, В. В. Викторов 2, Е. А. Белая 3, И. Н. Ковалев 3, Ю. И. Рябков 4
1 Южно-Уральский государственный университет
454080 Челябинск, пр-т им. Ленина, 76, Россия
2 Южно-Уральский государственный гуманитарно-педагогический университет
454080 Челябинск, пр-т им. Ленина, 69, Россия
3 Челябинский государственный университет
454000 Челябинск, ул. Братьев Кашириных, 129, Россия
4 Институт химии Коми НЦ УрО РАН
167982 Сыктывкар, ул. Первомайская, 48, Россия
* E-mail: kulikovskikhsa@gmail.com
Поступила в редакцию 15.03.2017
После доработки 06.07.2018
Принята к публикации 22.06.2018
Аннотация
Гидролизом водно-спиртового раствора тетрабутоксититана в присутствии хелатирующего агента при различных значениях pH среды и 100°C получен нанодисперсный анатаз или оксигидрат титана. Показано, что при осаждении при рН 0.8–8.6 образуется анатаз, размер кристаллитов которого после прокаливания при 400°C составляет 4.8–7.1 нм. После осаждения при рН 10.5–12.7 образуется плохо кристаллизованная оксигидратная фаза, которая после прокаливания при 400°C превращается в смесь не идентифицируемой рентгенофазовым анализом оксидной фазы и анатаза с размером кристаллов 41–42 нм. Методом сканирующей электронной микроскопии подтвержден размер кристаллов, определенный рентгенофазовым анализом. Величина адсорбции бензола полученными оксидными материалами быстро убывает от 10 до 0.5 г/100 г адсорбента при возрастании рН растворов, использованных при синтезе.
ВВЕДЕНИЕ
Материалы на основе диоксида титана широко используются в качестве фотокатализаторов, химических и газовых сенсоров, диэлектрического материала в конденсаторах, при обработке воды для разложения органических загрязняющих примесей [1, 2], в качестве самоочищающихся покрытий окон и антибактериальных агентов [3], цветосенсибилизированных солнечных батарей [4], пигмента в лакокрасочной промышленности [5–7], косметике, пищевой промышленности и фармацевтике [8–10].
В настоящее время большое внимание уделяется созданию высокодисперсных и пористых материалов на основе диоксида титана [11–13] и разработке технологий их синтеза [13–15]. Одним из наиболее перспективных методов получения нанодисперсного диоксида титана является гидролиз алкоксидов титана, в частности тетрабутоксититана (ТБТ), механизм которого до сих пор недостаточно изучен [16, 17].
Цель данной работы – исследование влияния концентрации H2SO4 или NaOH на формирование частиц диоксида титана из ТБТ в водно-спиртовом растворе в присутствии ацетилацетона (асас).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для экспериментов использовали реактивы квалификации “ч. д. а.”: тетрабутоксититан (ТБТ), ацетилацетон (асас), этанол (95 об. %), гидроксид натрия, серную кислоту (98 мас. %) и дистиллированную воду.
Синтез проводили в несколько стадий. Вначале был приготовлен раствор 30 мл ТБТ и 5 мл acac. Такое соотношение было выбрано на основании предварительных экспериментов, подтвердивших, что асас эффективно снижает скорость гидролиза и исключает образование плотного полидисперсного осадка, который формируется в отсутствие асас. Чрезмерное количество асас (20 мл) приводит к полному подавлению гидролиза ТБТ и отсутствию осадка. Затем к аликвотам по 3.5 мл этого раствора добавляли по 50 мл этилового спирта, перемешивали до получения прозрачного раствора и добавляли 20 мл воды, после чего вновь перемешивали. После этого полученный прозрачный раствор вливали в стакан со 100 мл кипящего раствора, содержащего 0.01, 0.1, 1, 10 г серной кислоты (или гидроксида натрия) на 100 мл воды и кипятили 1 ч. Такой выбор концентраций обеспечивал проведение синтеза в широком диапазоне рН растворов (от –0.1 до 12.7). Условия гидролиза и внешний вид продуктов описаны в табл. 1.
Таблица 1.
Условия синтеза образцов
| Образец | Введенный реагент, г/100 мл воды | Время кипячения, мин | Цвет осадка в процессе кипячения | Скорость уплотнения осадка | рН фильтрата |
|---|---|---|---|---|---|
| EAB0 | 10.0 H2SO4 | 60 | Осадка нет, раствор прозрачный | – | –0.11 |
| EAB1 | 1.0 H2SO4 | 60 | Белый | Оседает | 0.83 |
| EAB2 | 0.1 H2SO4 | 90 | » | Медленно оседает | 1.77 |
| EAB3 | 0.01 H2SO4 | 70 | Белый с желтым оттенком | Устойчив к оседанию | 3.29 |
| EAB4 | Вода | 60 | Желтоватый | Быстро оседает | 3.95 |
| EAB5 | 0.01 NaOH | 60 | Белый с желтым оттенком, оптически наиболее плотный | » | 6.60 |
| EAB6 | 0.1 NaOH | 50 | Белый с желтым оттенком | Медленно оседает | 8.58 |
| EAB7 | 1.0 NaOH | 45 | Белый | » | 10.51 |
| EAB8 | 10.0 NaOH | 45 | » | » | 12.66 |
Цвет осадков в процессе кипячения изменялся от белого до желтоватого (табл. 1). Более интенсивная окраска образца EAB4, вероятно, связана с более высоким содержанием бутоксигрупп в оксигидрате титана. Рост концентрации электролитов способствовал более полному гидролизу ТБТ и сопровождался ослаблением окраски осадка вплоть до белой.
Скорость уплотнения осадка изменялась от низкой, при которой формировалась однородная сравнительно устойчивая взвесь, до высокой, которая приводила к образованию плотного осадка (табл. 1). Наиболее быстро оседают и уплотняются осадки EAB4 и EAB5, раствор над которыми имеет рН, близкий к изоэлектрической точке оксигидрата титана: рН 5.2 [18] или 6.5 [19].
Образцы EAB2 и EAB3 кипятили дольше, ожидая просветления раствора и формирования плотного осадка, как в случае с образцом EAB4, но увеличение времени не приводило к коагуляции частиц. Образцы EAB6–EAB8, напротив, быстро образовывали плотный хлопьевидный осадок на дне, из-за чего растворы не могли равномерно кипеть и поэтому были охлаждены несколько раньше во избежание выброса из стакана.
После остывания осадки центрифугировали или фильтровали (в зависимости от наличия устойчивого коллоида) и измеряли рН фильтрата. Далее образцы отмывали от кислоты (или щелочи) 4–5 раз порциями по 100–150 мл дистиллированной воды.
Полученные образцы сушили при комнатной температуре до воздушно-сухого состояния и исследовали с помощью рентгенофазового анализа (РФА, Rigaku Ultima IV) и растровой электронной микроскопии (JeolJSM7001F).
После прокаливания в течение 48 ч при 400°C образцы повторно исследовали методом РФА. Адсорбционную емкость всех образцов определяли по величине адсорбции бензола по ранее описанной методике [20].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
РФА образцов после кипячения при 100°C и последующей сушки при 20°С показал, что при рН 0.83–8.58 (образцы EAB1–EAB6) образуется слабокристаллизованная фаза анатаза, а при более высоких значениях рН – рентгеноаморфный оксигидрат титана (рис. 1, 1а–3а).
Рис. 1.
Рентгенограммы образцов: 1а – EAB1, 2а – EAB4, 3а – EAB7 после кипячения при 100°С; 1б – EAB1, 2б – EAB4, 3б – EAB7 после термообработки при 400°С. Штрих-диаграмма обозначает пики анатаза [22].
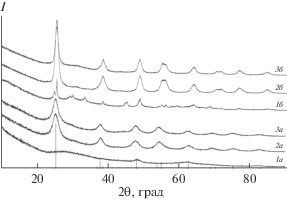
После термообработки при 400°C образцы EAB1–EAB6 оставались однофазными и сохраняли структуру анатаза (рис. 1, 1б–3б). Размер областей когерентного рассеяния (ОКР) после кипячения при 100°С (рис. 2) незначительно уменьшался с ростом рН, становясь неопределенно малым для образцов EAB7, EAB8 из-за их высокой степени аморфности (рис. 1).
Рис. 2.
Зависимость размера ОКР анатаза образцов ЕАВ1–ЕАВ6 от pH после кипячения (1) и после прокаливания при 400°С (2).
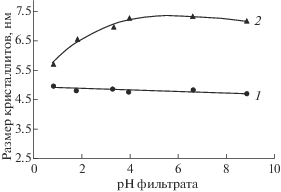
После прокаливания при 400°C размер ОКР, напротив, возрастал от 4.8 до 7.1 нм при увеличении рН от 0.83 до 8.58 (рис. 2), а при рН 10.5–12.7 резко возрастал до 41–42 нм. Аналогичное резкое увеличение скорости рекристаллизации и размера кристаллов анатаза при переходе от рН 1–8.5 к 11.5 сообщалось ранее [18, 21]. Образцы EAB7 и EAB8 трехфазные и содержат кроме анатаза [22] фазу Na2Ti9O19 [23], а также остатки аморфной фазы, существовавшей до прокаливания (широкое гало около 29° 2θ). Такое отличие образцов EAB7 и EAB8 связано со значительной примесью натрия, не удаляемой даже при пятикратной промывке дистиллированной водой. По данным [21], в образце анатаза, полученном при рН 2 гидролизом тетраизопропилата титана водным раствором азотной кислоты при 20°C, присутствует примесь брукита, к которому авторы отнесли один слабый рефлекс. В нашем исследовании ни брукита, ни рутила не обнаружено.
На превращения образцов определенное влияние, по-видимому, оказывает наличие в них не полностью отмытых H2SO4 или NaOH. Так, рентгенофлуоресцентный анализ элементного состава ксерогелей после сушки при 20°C при помощи энергодисперсионного спектрометра Oxford INCA X-max 80 обнаружил примеси серы и натрия в количествах, приблизительно пропорциональных их концентрации в исходных растворах (табл. 2).
Таблица 2.
Содержание примесей в образцах после сушки при 20°С
| Образец | S | Na |
|---|---|---|
| мас. % | ||
| EAB1 | 3.10 | 0 |
| EAB2 | 0.43 | 0 |
| EAB3 | 1.09 | 0 |
| EAB4 | 0 | 0 |
| EAB5 | 0 | 0.01 |
| EAB6 | 0 | 2.83 |
| EAB7 | 0 | 9.74 |
| EAB8 | 0 | 6.73 |
Морфологию образцов на свежих сколах ксерогеля исследовали с помощью растрового электронного микроскопа с предварительным напылением золота. По данным микроскопии, все образцы сформировали плотноупакованные ксерогели из частиц округлой формы диаметром 10–15 нм (рис. 3). Согласно РФА, размер частиц несколько увеличивался с ростом рН. Наблюдение образцов после прокаливания при 400°C не выявило существенного увеличения размеров частиц. Можно лишь отметить появление на поверхности ксерогелей с высоким содержанием натрия небольшого количества игольчатых кристаллов. Дополнительная выдержка нескольких образцов при 400°C в течение 5 сут привела к росту размера ОКР анатаза всего на 10–13%. Из этого можно сделать вывод, что при 400°C в течение 2–7 сут происходит преимущественно не рекристаллизация мелких кристаллов в крупные, а снижение дефектности существующих кристаллов, за счет чего уменьшается полуширина рентгеновских пиков, и размер, по рентгеновским данным, приближается к размеру наблюдаемых в микроскоп частиц.
Механизм гидролиза зависит как от образования устойчивых три-, тетрамеров и более сложных ассоциатов ТБТ в растворе [16, 17], так и от образования ацетилацетоном с алкоксидами титана сравнительно прочных комплексов типа Ti(OBu)3(асас) и [Ti2(µ-OEt)2(OBu)4(асас)2], гидролизующихся при значительно большем количестве воды, чем чистые алкоксиды [17]. Гидролиз Ti(OBu)3(асас) при увеличении концентрации воды включает образование полиядерных комплексов титана с гидроксильными, а затем и с кислородными мостиковыми группами, предположительно [Ti2(µ-OH)2(OBu)4(асас)2] ⇒ ⇒ [Ti2(µ-OH)2(OBu)2(OH)2(асас)2] ⇒ [Ti2(µ-OH)2(OH)4(асас)2]. В этих комплексах часть или все алкоксигруппы замещаются более прочно связываемыми хелатными молекулами асас, которые гидролизуются лишь в более жестких условиях, например гидротермальных. Если в условиях проведенного эксперимента растворы ТБТ с ацетилацетоном, спиртом и водой оставались прозрачными, то при смешении ТБТ с раствором спирт–вода мгновенное образование плотного неоднородного рентгеноаморфного осадка частично гидролизованных алкоксиоксигидратов титана происходит уже при содержании 3 мас. % воды в спирте. Введение асас при синтезе наночастиц анатаза позволяет сохранить однородность продукта, образующегося при вливании в кипящий водный раствор.
Адсорбцию бензола определяли весовым методом в условиях равновесия прокаленных образцов с парами бензола при парциальном давлении бензола 0.69 от насыщенного давления паров бензола [20]. Результаты измерений показали, что величина адсорбции быстро уменьшается с увеличением рН (рис. 4). Наименьшую адсорбцию имеет образец ЕАВ7 с наибольшей примесью натрия. Оценочная удельная площадь поверхности, рассчитываемая пропорционально количеству адсорбированного бензола [20], составила от 14 до 250 м2/г. Не следует также исключать для малых пор между наночастицами TiO2 вероятность капиллярного заполнения их бензолом. Количество бензола, оставшееся в материале после десорбции в течение 2 сут над сухим силикагелем, лишь незначительно меньше количества, присутствовавшего в состоянии насыщения. Это демонстрирует сравнительно прочное связывание бензола и хорошие свойства образцов ЕАВ1–ЕАВ5 как адсорбентов.
ЗАКЛЮЧЕНИЕ
Методом гидролиза тетрабутоксититана в смеси воды, этанола, ацетилацетона при изменяемых значениях pH получен золь нанодисперсного оксигидрата титана или анатаза. Введение ацетилацетона при гидролизе позволяет замедлить скорость гидролиза тетрабутоксититана и получить однородный продукт, состоящий после прокаливания из частиц диаметром 4.8–7.1 нм при рН 0.8–8.6. Изменение pH среды влияет на размер кристаллитов, а также на адсорбционные свойства полученных продуктов. Материалы, полученные при рН 0.8–6.6, имеют меньший размер кристаллитов и более высокую величину адсорбции, что важно для фотохимических, каталитических и других приложений. В более щелочных средах образуются более крупнозернистые, менее чистые и менее пористые ксерогели оксигидрата титана.
Список литературы
Feng G., Liu S., Xiu Z. et al. // J. Phys. Chem. C. 2008. V. 112. № 35. P. 13692.
Gaya U.I., Abdullah A.H. // J. Photochem. Photobiol. C: Photochem. Rev. 2008. V. 9. № 1. P. 1.
Mangiardi J.R. Пат. 20080187457 A 1 US, C 08 F /46, A 61 L 2/10, B 05 D 3/06. Antibacterial Titanium Dioxide Compositions / № US 11/937,102; заявл. 08.11.2007; опубл. 07.08.2008.
Gratzel M. // Curr. Opin. Colloid Interface Sci. 1999. V. 4. № 4. P. 314.
O’regan B., Gratzel M. // Nature. 1991. V. 353. № 24. P. 737.
Pawlewicz W.T., Exarhos G.J., Conaway W.E. // Appl. Opt. 1983. V. 22. № 12. P. 1837.
Ha H.K., Yosimoto M., Koinuma H. et al. // Appl. Phys. Lett. 1996. V. 68. № 21. P. 2965.
Озерин А.Н., Перов Н.С., Зеленский А.Н. и др. // Журн. рос. нанотехнологии. 2009. Т. 4. № 5–6. С. 107.
Juliano R., Alam Md.R., Dixit V. et al. // Nucl. Acids Res. 2008. V. 36. № 12. P. 4158.
Gilmore I.R., Fox S.P., Hollins A.J. et al. // Curr. Drug Deliv. 2006. V. 3. P. 147.
Жеребцов Д.А., Викторов В.В., Куликовских С.А. и др. // Неорган. материалы. 2016. Т. 52. С. 35.
Yuan S., Sheng Q., Zhang J. et al. // Microporous Mesoporous Mater. 2005. V. 79. P. 93.
Hasegawa G., Kanamori K., Nakanishi K. et al. // J. Am. Ceram. Soc. 2010. V. 93. № 10. P. 3110.
Fujishima A., Hashimoto K., Watanabe T. TiO2 photocatalysis: fundamentals and applications. Tokyo: BKC Inc., 1999. 126 p.
Coronado J.M., Fresno F., Hernández-Alonso M.D. et al. Design of Advanced Photocatalytic Materials for Energy and Environmental Applications (Green Energy and Technology). Springer London Ltd, 2013. P. 345.
Bradley D.C., Mehrotra R., Rothwell I. et al. Alkoxo and Aryloxo Derivatives of Metals. San Diego: Academic Press, 2001. 908 p.
Schubert U. // Mater. Chem. 2005. V. 15. P. 3701.
Finnegan M.P., Zhang H., Banfield J.F. // Chem. Mater. 2008. V. 20. P. 3443.
Костин А.С., Кольцова Э.М. // Фундаментальные исследования. 2012. № 6-3. С. 647.
Жеребцов Д.А., Сапожников С.Б., Галимов Д.М. и др. // Журн. физ. химии. 2015. Т. 89. № 5. С. 274.
Агафонов А.В., Редозубов А.А., Козик В.В. и др. // Журн. неорган. химии. 2015. Т. 60. № 8. С. 1001.
Howard C.J., Sabine T.M., Dickson F. // Acta Crystallogr., Sect. B: Struct. Sci. 1991. V. 47. № 4. P. 462.
Theobald F.R., Catlow C.R.A., Cormack A.N. // J. Solid State Chem. 1984. V. 52. P. 80.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии




