Журнал неорганической химии, 2019, T. 64, № 4, стр. 357-364
Влияние метода синтеза гидрокарбоната алюминия и аммония на морфологические свойства оксида алюминия
В. А. Матвеев 1, *, Д. В. Майоров 1
1 Институт химии и технологии редких элементов и минерального сырья им. И.В. Тананаева
Кольского научного центра РАН
184209 Мурманской обл., Апатиты, мкр. Академгородок, 26а, Россия
* E-mail: matveev@chemy.kolasc.net.ru
Поступила в редакцию 28.06.2018
После доработки 11.09.2018
Принята к публикации 21.09.2018
Аннотация
Тремя различными способами синтезированы гидрокарбонаты алюминия и аммония. Полученные образцы и продукты их термической обработки – оксиды алюминия – исследованы методами физико-химического анализа. Показано, что способ синтеза гидрокарбонатов алюминия и аммония оказывает существенное влияние на структуру, пористость и дисперсность получаемых γ- и α-форм оксида алюминия.
ВВЕДЕНИЕ
Оксид алюминия благодаря своим уникальным свойствам находит широкое применение в различных областях современной техники. Оксид алюминия в γ-форме применяют в производстве катализаторов и носителей катализаторов, используют как адсорбент в процессах глубокой осушки газов, для улавливания примесей из различных сред, для создания защитной атмосферы при длительном хранении пищевых продуктов, для консервации аппаратуры и приборов [1–6]. Мелкодисперсный оксид алюминия в α-форме (корунд) широко используют в производстве различных видов алюмооксидной керамики (включая прозрачную, броне- и биокерамику), при изготовлении абразивных материалов, как наполнитель в огнеупорах и для футеровки литейных форм, при изготовлении запорных элементов трубопроводных кранов и др. [7–9]. Особо чистый оксид алюминия может быть использован для выращивания искусственных сапфиров, производства светодиодов и люминофоров [10, 11].
Чаще всего оксид алюминия получают прокаливанием гидроксида алюминия или его солей. В качестве гидроксида алюминия используют технический гидроксид или полученный гидролизом солей алюминия [12, 13]. В качестве солей алюминия используют предпочтительно нитрат или хлорид.
Дисперсность и другие свойства получаемого оксида алюминия зависят в том числе и от природы прекурсора, определяющей ход его термического разложения. С этой точки зрения, для получения оксида алюминия большой интерес представляет гидрокарбонат алюминия и аммония (ГКАА) NH4AlCO3(OH)2. Его отличительной особенностью является то, что термическое разложение ГКАА происходит в одну стадию, при этом одновременное удаление NH3, СО2 и Н2О идет в довольно узком температурном диапазоне (220–260°С) и сопровождается резкой потерей массы (62–63%). Вероятно, именно это и приводит к образованию мелкодисперсного оксида алюминия.
Существуют различные методы синтеза ГКАА. Он может быть получен при сливании в том или ином порядке разбавленных растворов соли алюминия (сульфата, нитрата, хлорида, алюминиевых квасцов) и гидрокарбоната или карбоната аммония. Для последующего отделения осадка ГКАА от раствора фильтрованием с приемлемыми показателями суспензию выдерживают при перемешивании в течение длительного времени (иногда 24 ч и более) с целью кристаллизации образовавшихся частиц [14–17]. В ряде случаев смешение растворов ведут при повышенном давлении [18]. В ИХТРЭМС КНЦ РАН разработан синтез ГКАА методом “solid state reaction”, который заключается в смешении кристаллической соли алюминия с карбонатом аммония с последующей отмывкой ГКАА от растворимых солей аммония [19].
Известно, что свойства соединений существенно зависят от метода получения их прекурсора [20, 21].
Цель настоящей работы – изучение влияния способа синтеза ГКАА на морфологические свойства оксида алюминия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В представленной работе тремя способами синтезированы образцы гидрокарбоната алюминия и аммония. В качестве исходных реагентов использовали AlCl3 ⋅ 6H2O, (NH4)2CO3 и NH4HCO3 марки “ч. д. а.”.
Образец 1 готовили в соответствии с [14]. Для этого к 1 л раствора, содержащего 150 г/л NH4НCO3, в течение 2 ч при перемешивании и температуре ~35°С приливали 0.5 л раствора с содержанием 70 г/л AlCl3. Реакция протекала в соответствии с уравнением:
Полученную суспензию выдерживали при той же температуре в течение 3 ч для обеспечения роста кристаллов гидрокарбоната алюминия и аммония. Осадок отфильтровывали, промывали и высушивали до постоянной массы при 105°С.
Для синтеза образца 2 к 100 г (NH4)2CO3, помещенного в смеситель-измельчитель, порциями в течение 15 мин добавляли 64 г AlCl3 ⋅ 6H2O и продолжали перемешивание еще 15 мин. При этом протекала реакция:
Полученную реакционную массу выщелачивали водой при 40–50°С в течение 20 мин. Осадок отфильтровывали, промывали и сушили при 105°С.
Для получения образца 3 тщательно смешивали 20 г AlCl3 ⋅ 6H2O с 12 г (NH4)2CO3, затем полученную реакционную массу помещали в автоклав, добавляли еще 20 г (NH4)2CO3 и 200 мл воды и вели обработку при 120°С в течение 6 ч. По окончании процесса осадок отфильтровывали, промывали и сушили при 105°С.
Образцы ГКАА подвергали термической обработке при 600°С в течение 2 ч (образцы 4–6 соответственно), далее оксиды алюминия прокаливали при 1200оС в течение 1.5 ч (образцы 7–9 соответственно).
Рентгенофазовый анализ (РФА) образцов 1–6 определяли на рентгеновском дифрактометре ДРОН-3, образцов 7–9 – на дифрактометре ДРОН-4 (CuKα-излучение). Идентификацию фаз проводили в соответствии с базой данных ICDD.
Кристаллооптический анализ проводили с помощью петрографического микроскопа со специализированной цифровой камерой Leica DM 2500P.
ИК-спектроскопические исследования выполняли на приборе Nicolet 6700 (образцы таблетировали с KBr).
Анализ ДСК-ТГ образцов ГКАА проводили на синхронном термоанализаторе STA 409 фирмы Netzsch.
Удельную поверхность и пористость образцов 4–6 определяли методами BET и BJH соответственно с использованием низкотемпературной адсорбции азота на анализаторе удельной поверхности и пористости TriStar 3020.
Морфологию образцов 4–9 фиксировали методом сканирующей электронной микроскопии (СЭМ) с использованием цифрового сканирующего электронного микроскопа SEM LEO-420.
Дисперсность частиц образцов 7–9 анализировали на лазерном гранулометре ANALYSETTE 22 MicroTec plus.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
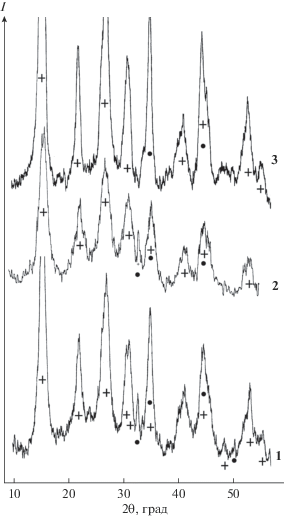
На рис. 1 приведены дифрактограммы образцов 1–3, которые полностью соответствуют дифрактограмме гидрокарбоната алюминия и аммония (база данных JCPDC-ICDD 2002, карта № 79-1923) и хорошо согласуются с данными [14]. В незначительном количестве во всех образцах обнаруживается примесная фаза псевдобемита (карта № 21-1307). Обе фазы обладают орторомбической сингонией кристаллических решеток. Размеры областей когерентного рассеивания, рассчитанные по уравнению Дебая–Шеррера, в образцах 1–3 для ГКАА составили 15.6, 7.6 и 11.5 (±0.2) нм соответственно, а для псевдобемита – 15.7, 13.1 и 14.7 (±0.2) нм.
По данным кристаллооптического анализа, образцы 1 и 2 представляют собой округлые зерна довольно изометричного облика, которые, как правило, агрегированы. Показатель преломления N = 1.605 ± 0.005. Основная масса образца 3 представлена анизотропными иголочками, которые изредка формируются в ориентированные сростки. Показатели преломления Ng = 1.578 ± 0.005 и Np = 1.550 ± 0.005. Во всех образцах отмечено присутствие в небольшом количестве второй фазы.
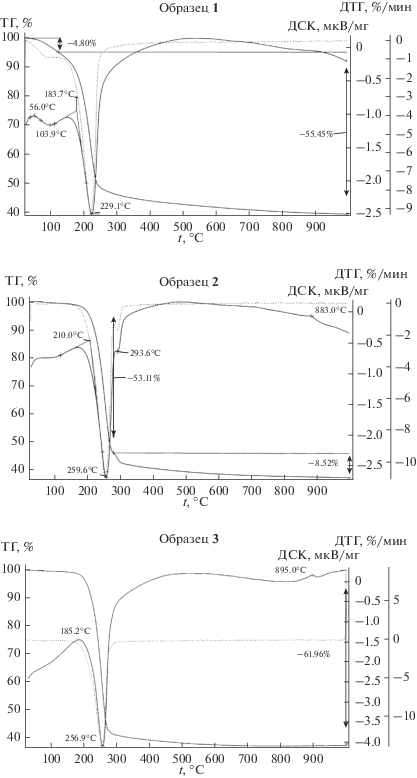
Наличие примесной фазы подтверждается и результатами анализа ДСК-ТГ (рис. 2). Термическое разложение чистого гидрокарбоната алюминия и аммония сопровождается потерей массы 63%. Для образцов 1–3 она составила 60.25, 61.6 и 61.96% соответственно. Исходя из того, что второй фазой является псевдобемит (81% Al2O3, 19% Н2О), содержание ГКАА в образцах 1–3 составило 93.75, 96.8 и 97.6%, что свидетельствует о достаточно высокой степени взаимодействия исходных реагентов при синтезе гидрокарбоната алюминия и аммония. При этом лучший результат достигнут при получении ГКАА в автоклаве. На кривых ДСК всех образцов отмечается глубокий эндоэффект, свидетельствующий об интенсивном одноэтапном полном разложении гидрокарбоната алюминия и аммония. Незначительное различие заключается лишь в величине максимума эндотермического эффекта.
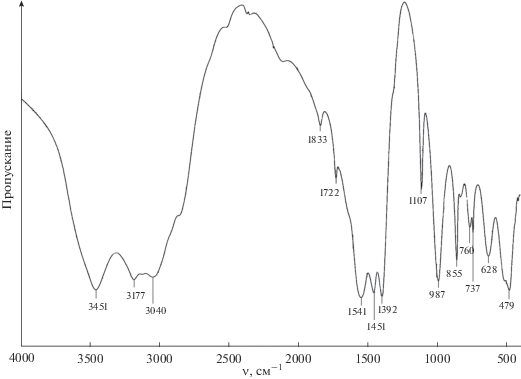
ИК-спектры образцов 1–3 также идентичны, причем на них не обнаруживается полоса поглощения при 970 см–1, характерная для псевдобемита (рис. 3). Полосы поглощения могут быть отнесены к различным видам колебаний связи ОН– (νОН при 3451 см–1, δОН при 987 см–1), ${\text{NH}}_{4}^{ + }$ (νNH при 3177, δNH при 1833 и 1722 см–1), ${\text{С О }}_{3}^{{2 - }}$ (ν3 при 1541, 1451 и 1392 см–1, ν1 при 1107 см–1, ν2 при 855 см–1 и ν4 при 760 см–1) и Al–O (колебания решетки AlO6 при 737, 628, 479 см–1) [14, 15].
Анализ дифрактограмм продуктов термообработки синтезированных ГКАА при 600°С (образцы 4–6) показал, что все они представляют собой оксид алюминия в γ-форме.
Поскольку γ-Al2O3 широко используется в качестве носителя катализаторов, к нему предъявляются весьма высокие требования по таким параметрам, как удельная поверхность, пористость, размер и форма пор. В табл. 1 приведены некоторые структурно-поверхностные свойства исследуемых образцов.
Таблица 1.
Структурно-поверхностные свойства образцов γ-Al2O3
| № образца | Sуд, м2/г | Vуд, см3/г | dпор, нм |
|---|---|---|---|
| 4 | 325 | 0.73 | 5.5 |
| 5 | 298 | 0.99 | 9.7 |
| 6 | 300 | 0.44 | 4.2 |
Как следует из приведенных данных, удельная поверхность всех образцов примерно одинакова, однако пористость и диаметр пор существенно различаются. При этом у образца 4 существенный вклад в величину удельной поверхности вносят микропоры, а у образца 6 – внешняя поверхность мелкодисперсных частиц. В наибольшей степени требованиям, предъявляемым к оксиду алюминия для катализаторов, отвечает образец 5.
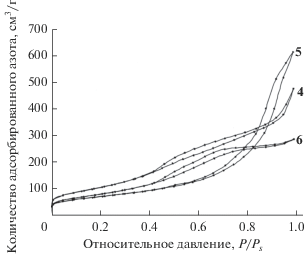
Анализ изотерм сорбции–десорбции показывает (рис. 4), что петли гистерезиса образцов 4 и 6 соответствуют, по классификации де Бура, петлям типа В, которые он относит к щелевидным порам, а образца 5 – к петлям типа А и С, при этом гистерезис типа А относится к порам цилиндрической формы, а гистерезис типа С – к клиновидным порам с открытыми концами. С большой вероятностью такие поры (по сравнению с щелевидными) более доступны для молекул химически активных веществ (реагентов), что должно приводить к повышению адсорбционной и реакционной способности. Это подтверждает высказанное предположение о целесообразности испытания γ-Al2O3, полученного термическим разложением образца 5, в качестве носителя катализаторов.
На рис. 5 приведены СЭМ-изображения γ-Al2O3 (образцы 4–6). Видно, что морфология частиц существенно различается. Образец 4 – это неоднородная масса, представленная агломератами, состоящими из частиц, не имеющих определенной формы. Образец 5 представляет собой агломераты преимущественно округлой формы, сформированные мельчайшими сферическими частицами, и образец 6 имеет равномерную игольчато-стержневую структуру. С учетом кристаллооптического анализа образцов ГКАА можно констатировать, что образцы γ-Al2O3 наследуют структуру своих прекурсоров.
РФА продуктов прокаливания при 1200оС в течение 1.5 ч показал, что все они на 100% состоят из корунда. Фаза θ-Al2O3 во всех образцах обнаружена в следовых количествах.
Анализ СЭМ-изображений α-Al2O3 (образцы 7–9) показал (рис. 5) некоторое увеличение размеров агрегатов у образцов 7 и 8, что, вероятно, объясняется спеканием частиц. У образца 9 это явление не наблюдается.
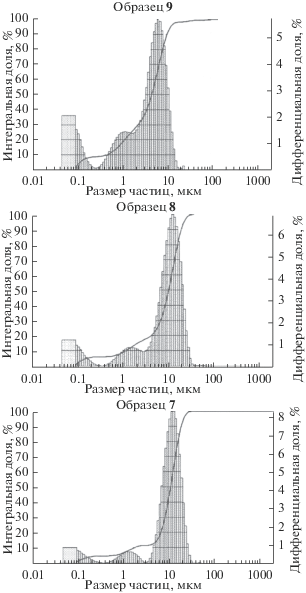
На рис. 6 представлено дифференциальное и интегральное распределение частиц по размерам, а в табл. 2 – основные параметры дисперсности образцов.
Как следует из приведенных данных, лучшие показатели дисперсности имеет образец 9. Такой α-оксид алюминия может быть использован для получения алюмооксидной керамики.
ЗАКЛЮЧЕНИЕ
Выполненные исследования показали, что способ синтеза гидрокарбоната алюминия и аммония оказывает существенное влияние на морфологические свойства оксида алюминия: структуру, пористость, дисперсность. Для получения пористых частиц γ-оксида алюминия предпочтительно синтезировать ГКАА методом “solid state reaction”, а для получения мелкодисперсных частиц – методом, включающим гидротермальную автоклавную обработку.
Список литературы
Стайлз Элвин Б. Носители и нанесенные катализаторы. Теория и практика / Пер. с англ. под ред. Слинкина А.А. М.: Химия, 1991. 240 с.
Иванова А.С. // Промышленный катализ в лекциях. 2009. № 8. С. 7.
Гаврилова Н.Н., Круглая Т.И., Мячина М.А. и др. // Стекло и керамика. 2018. № 1. С. 29.
Hiaofu Hu, Yunqi Liu, Chenguang Liu // Adv. Mater. Res. 2012. V. 415–417. P. 580. doi 10.4028/www.scientific.net/AMR.415-417.580
Савельев Г.Г., Юрмазова Т.А., Галанов А.И. и др. // Изв. Томского политехн. ун-та. 2001. Т. 307. № 1. С. 102.
Чукин Г.Д. Строение оксида алюминия и катализаторов гидрообессеривания. Механизмы реакций. М.: Типография Паладин, ООО “Принта”, 2010. 288 с.
Ханамирова А.А. Глинозем и пути уменьшения содержания в нем примесей. Ереван: Изд-во АН Армянской ССР. 1983. 244 с.
Плетнев П.М., Непочатов Ю.К., Маликова Е.В. и др. // Изв. Томского политехн. ун-та. 2015. Т. 326. № 3. С. 40.
Mikheev V.A., Sulaberidze V.Sh., Mushenko V.D. // J. Instrum. Eng. 2017. V. 60. № 3. P. 275. [Михеев В.А., Сулаберидзе В.Ш., Мушенко В.Д. // Изв. вузов. Приборостроение. 2017. Т. 60. № 3. С. 275.]
Панасюк Г.П., Азарова Л.А., Белан В.Н. и др. // Хим. технология. 2017. № 9. С. 393.
Данчевская М.Н., Ивакин Ю.Д., Багдасаров Х.С. и др. // Перспективные материалы. 2009. № 4. С. 28.
Кузнецова Т.Ф., Соболенко Н.М., Баркатина Е.Н. А.с. 1705237 РФ. МПК C01F 7/02 (2000.01). Способ получения оксида алюминия. ИОНХ АН БССР. № 4779484; заявл. 09.01.90; опубл. 15.01.92 // Бюл. изобр. № 2.
Popov V.V. // Russ. J. Inorg. Chem. 2015. V. 60. № 4. P. 420. [Попов В.В. // Журн. неорган. химии. 2015. Т. 60. № 4. С. 478.]
Kato Sh., Iga T., Hatano Sh., Isawa Yu. Пат. № 4053579 США, МКИ2 H01F 7/02, C01C 1/26, A61K 33/10. Method for manufacture of sintered alumina from ammonium aluminum carbonate hydroxide.
Guang-Gi Li, Yun-Qi Liu, Li-Li Guan et al. // Mater. Res. Bull. 2012. № 47. P. 1073.
Ali A.A., Hasan M.A., Zaki M.I. // Chem. Mater. 2005. № 17. P. 6797.
Xue Hui Li, Zhe Tang, Yong Ming Chai et al. // Proceeding of 2012 International Conference on Mechanical Engineering and Material Sience (MEMS 2012). 2012. P. 601.
Dubert D.C., Perez-Ramirez J., Garcia-Valls R. // Chem. Eng. Transactions. 2011. V. 25. P. 231.
Матвеев В.А., Майоров Д.В. Пат. № 2632437 РФ, МПК C01F 7/30 (2006.01). Способ получения оксида алюминия // Бюл. изобр. № 28.
Matveev V.A., Maiorov D.V., Shulyak D.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 12. P. 1499. [Матвеев В.А., Майоров Д.В., Шуляк Д.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 12. С. 1560.]
Krasnenko T.I., Samigullina R.F., Rotermel M.V. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 3. P. 275. [Красненко Т.И., Самигуллина Р.Ф., Ротермель М.В. и др. // Журн. неорган. химии. 2017. Т. 62. № 3. С. 263.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии