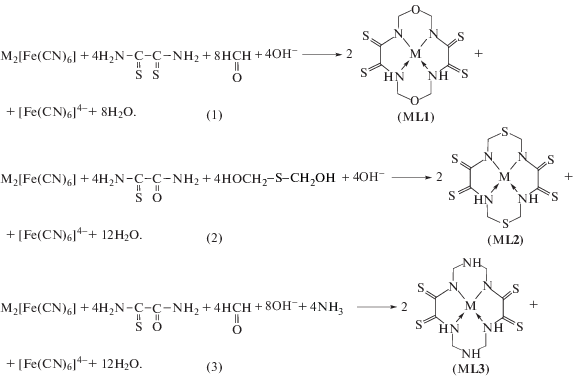
Журнал неорганической химии, 2019, T. 64, № 4, стр. 397-404
Структурные изменения в макроциклах тетратиозамещенных 1,8-диокса-, 1,8-дитиа-3,6,10,13-тетраазациклотетрадекана и 1,3,5,8,10,12-гексаазациклотетрадекана при комплексообразовании с ионами M(II) 3d-элементов по данным метода функционала плотности
О. В. Михайлов 1, *, Д. В. Чачков 2, 3
1 Казанский национальный исследовательский технологический университет
420015 Казань, ул. Карла Маркса, 68, Россия
2 Казанское отделение Межведомственного суперкомпьютерного центра РАН – филиал Федерального государственного учреждения “Федеральный научный центр
Научно-исследовательский институт системных исследований РАН”
420111 Казань, ул. Лобачевского, 2/31, Россия
3 Казанский (Приволжский) Федеральный университет
420111 Казань, ул. Лобачевского, 2/31, Россия
* E-mail: olegmkhlv@gmail.com
Поступила в редакцию 16.03.2018
После доработки 17.09.2018
Принята к публикации 21.09.2018
Аннотация
С использованием квантово-химического метода расчета DFT OPBE/TZVP и программы Gaussian09 осуществлен расчет валентных углов в макроциклах 1,8-диокса-3,6,10,13-тетраазациклотетрадекантетратиона-4,5,11,12, 1,8-дитиа-3,6,10,13-тетраазациклотетрадекантетратиона-4,5,11,12, 1,3,5,8,10,12-гексаазациклотетрадекантетратиона-6,7,13,14 и их координационных соединений с ионами Cr(II), Mn(II), Fe(II), Co(II), Ni(II), Cu(II) и Zn(II) с (NNNN)-координацией донорных центров лиганда, возникающих при комплексообразовании в тройных M(II)–этандитиоамид–формальдегид, M(II)–этандитиоамид–2-тиапропандиол-1,3 и в четверной M(II)–этандитиоамид–формальдегид–аммиак системах в желатин-иммобилизованных матричных имплантатах. Отмечено значительное искажение макроцикла, которое количественно может быть охарактеризовано по степени его отклонения от компланарности, как в макроциклических соединениях, так и в образуемых ими комплексах (более 60о). При этом в зависимости от природы как иона M(II), так и макроциклического лиганда это искажение может ослабляться или усиливаться.
ВВЕДЕНИЕ
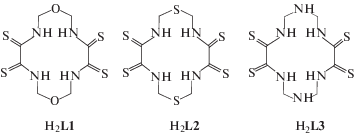
Ранее [1–3] с использованием метода DFT OPBE/TZVP осуществлен квантово-химический расчет молекулярных структур макротетрациклических металлохелатов ряда ионов 3d-элементов M(II) с 1,8-диокса-3,6,10,13-тетраазациклотетрадекантетратионом-4,5,11,12 (ML1), а также его структурными аналогами, получаемыми в результате замены двух находящихся в противоположных концах макроцикла (положения 1 и 8) атомов углерода на атомы серы и азота: 1,8-дитиа-3,6,10,13-тетраазациклотетрадекантетратионом-4,5,11,12 (ML2) и 1,3,5,8,10,12-гексаазациклотетрадекантетратионом-6,7,13,14 (ML3), возникающих в результате темплатного синтеза (“самосборки”) в тройных M(II)–этандитиоамид–формальдегид, M(II)–этандитиоамид–2-тиапропандиол-1,3 и четверной M(II)–этандитиоамид–формальдегид–аммиак системах в металлгексацианоферрат(II)ных желатин-иммобилизованных матричных имплантатах по валовым схемам (1), (2) и (3) соответственно (M = Mn, Fe, Co, Ni, Cu и Zn).
На основании данных этих расчетов выявлены ключевые детали по координации возникающих при этом макроциклических лигандов (хелантов) к соответствующему иону M(II). Отмечалось [1–3], что ни один из хелатов ML1, ML2 и ML3 не является компланарным (плоским); и некомпланарными оказываются все фрагменты, определяющие итоговую молекулярную структуру хелатного комплекса, а именно хелатные узлы MN4, 5- и 6-членные металлоциклы. В связи с этим целесообразно с помощью квантово-химического расчета методом DFT оценить степень некомпланарности макроциклов в металлокомплексах ML1, ML2 и ML3, сопоставить ее с аналогичным параметром для соответствующего хеланта и выяснить, сопровождается ли комплексообразование ионов M(II) 3d-элементов с рассматриваемыми макроциклическими хелантами усилением или ослаблением степени отклонения макроцикла комплекса от компланарности. С другой стороны, стоит проследить, как зависит степень некомпланарности металлокомплексов с одним и тем же M(II) от природы гетероатомов, находящихся в положениях 1 и 8 14-членного макроцикла. Рассмотрению этих вопросов и будет посвящена данная статья.
МЕТОД РАСЧЕТА
Квантово-химический расчет проведен методом функционала плотности (DFT), сочетающим обменно-корреляционный функционал OPBE [4–6] и стандартный расширенный валентно-расщепленный базис TZVP [7, 8], который, согласно данным [5, 9–12], в случае комплексов 3d-элементов дает точное соотношение энергетической стабильности между высоко- и низкоспиновым состояниями и надежно характеризует основные геометрические параметры молекулярных структур соединений данного типа. Расчеты проводили с использованием программного пакета Gaussian09 [13]. Как и в [14–19], соответствие найденных стационарных точек минимумам энергии во всех случаях доказывали расчетом вторых производных энергии по координатам атомов. При этом все равновесные структуры, соответствовавшие точкам минимума на поверхностях потенциальной энергии, имели вещественные положительные значения частот нормальных колебаний. Для комплексов Mn(II) и Co(II) рассматривали мультиплетности 2, 4 и 6, для комплексов Cr(II) и Fe(II) – мультиплетности 1, 3 и 5, для комплексов Ni(II) и Zn(II) – мультиплетности 1 и 3, для комплекса Cu(II) – мультиплетности 2 и 4. Из оптимизированных при указанных мультиплетностях структур выбирали структуру с наименьшей энергией. Расчет параметров молекулярных структур при мультиплетностях, отличных от 1, всегда проводили неограниченным методом UOPBE; при мультиплетности 1 – ограниченным методом ROPBE. При мультиплетности 1 применяли вариант расчета неограниченным методом в сочетании с опцией GUESS = Mix. В этом случае результаты всегда были аналогичны данным, полученным с использованием ограниченного метода.
Количественную оценку степени отклонения макроциклов от компланарности как хелантов, так и образуемых ими металлокомплексов осуществляли по величинам VAS14 – 2160°, где VAS14 – сумма внутренних углов в соответствующем 14-членном макроцикле, 2160° – сумма внутренних углов в плоском 14-угольнике; чем меньше модуль этой величины, тем меньше степень отклонения от компланарности.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Квантово-химический расчет молекулярных структур каждого из хелантов H2L1, H2L2 и H2L3, дважды депротонированные формы которых находятся во внутренней координационной сфере металлохелатов ML1, ML2 и ML3 соответственно, показал, что все они, как и молекулярные структуры образуемых ими металлокомплексов, являются неплоскими. Такой результат не был неожиданным, так как известно, что циклические соединения с числом атомов в цикле, равным 7 и более, как правило, неплоские, но имеются и исключения, например, хелаты d-элементов с фталоцианином [4]. Данные расчета значений VAS14 макроциклических хелантов и образуемых ими металлокомплексов ML1, ML2 и ML3 представлены в табл. 1–3; молекулярные структуры показаны на рис. 1–3 соответственно. Остановимся подробнее на характеристике каждого соединения (хелант + металлокомплекс).
Таблица 1.
Валентные углы 14-членного макроцикла в хеланте H2L1 и образуемых им комплексах типа ML1
| Валентный угол | Комплекс и MS основного состояния | |||||||
|---|---|---|---|---|---|---|---|---|
| H2L1 | CrL1 | MnL1 | FeL1 | CoL1 | NiL1 | CuL1 | ZnL1 | |
| 1 | 5 | 6 | 3 | 2 | 1 | 2 | 1 | |
| C6O1C5 | 117.8 | 118.0 | 117.5 | 116.8 | 117.0 | 116.7 | 117.6 | 117.4 |
| O1C5N1 | 112.7 | 110.9 | 111.3 | 110.3 | 110.0 | 110.2 | 111.0 | 111.0 |
| C5N1C2 | 227.6 | 242.8 | 242.1 | 244.7 | 244.9 | 246.6 | 244.1 | 243.2 |
| N1C2C1 | 120.0 | 112.4 | 112.4 | 111.3 | 110.8 | 110.9 | 112.5 | 112.7 |
| C2C1N4 | 111.8 | 110.5 | 110.1 | 110.9 | 110.7 | 110.9 | 111.5 | 110.5 |
| C1N4C7 | 233.5 | 240.3 | 239.4 | 241.6 | 241.8 | 241.6 | 239.1 | 238.7 |
| N4C7O2 | 111.8 | 111.3 | 110.8 | 111.2 | 111.4 | 111.5 | 111.4 | 111.0 |
| C7O2C8 | 116.6 | 115.3 | 116.2 | 114.4 | 114.1 | 114.0 | 115.7 | 116.6 |
| O2C8N3 | 111.8 | 111.3 | 110.8 | 111.2 | 111.4 | 111.5 | 111.4 | 111.0 |
| C8N3C4 | 233.5 | 240.3 | 239.4 | 241.6 | 241.8 | 241.6 | 239.1 | 238.7 |
| N3C4C3 | 118.8 | 110.5 | 110.1 | 110.9 | 110.6 | 110.9 | 111.5 | 110.5 |
| C4C3N2 | 120.0 | 112.4 | 112.4 | 111.1 | 110.8 | 110.9 | 112.5 | 112.7 |
| C3N2C6 | 227.6 | 242.8 | 242.1 | 244.7 | 244.9 | 246.6 | 244.1 | 243.2 |
| N2C6O1 | 112.7 | 110.9 | 111.3 | 110.3 | 110.0 | 110.2 | 111.0 | 111.0 |
| VAS14 | 2069.2 | 2089.7 | 2085.9 | 2091.0 | 2090.2 | 2094.1 | 2092.5 | 2088.2 |
| VAS14(H2L1)– VAS14(ML1) | 0 | –20.5 | –16.7 | –21.8 | –21.0 | –24.9 | –23.3 | –19.0 |
| VAS14–2160° | –90.8 | –70.3 | –74.1 | –69.0 | –69.8 | –65.9 | –67.5 | –71.8 |
Таблица 2.
Валентные углы 14-членного макроцикла в хеланте H2L2 и образуемых им хелатах типа ML2
| Валентный угол | Комплекс и MS основного состояния | |||||||
|---|---|---|---|---|---|---|---|---|
| H2L2 | CrL2 | MnL2 | FeL2 | CoL2 | NiL2 | CuL2 | ZnL2 | |
| 1 | 5 | 6 | 3 | 2 | 1 | 2 | 1 | |
| C7S6C8 | 103.2 | 100.6 | 103.5 | 98.1 | 97.4 | 97.3 | 100.8 | 102.7 |
| S6C8N3 | 113.4 | 112.5 | 110.9 | 112.4 | 111.4 | 112.8 | 112.5 | 112.1 |
| C8N3C4 | 234.8 | 241.3 | 239.4 | 242.6 | 241.8 | 242.5 | 240.2 | 239.6 |
| N3C4C3 | 111.8 | 110.3 | 109.4 | 110.7 | 109.8 | 110.5 | 111.4 | 110.3 |
| C4C3N2 | 120.2 | 112.1 | 112.7 | 111.0 | 110.4 | 110.2 | 112.4 | 113.7 |
| C3N2C6 | 228.0 | 242.5 | 241.7 | 242.9 | 243.0 | 244.6 | 243.3 | 242.6 |
| N2C6S3 | 115.1 | 112.1 | 113.0 | 111.2 | 111.1 | 111.1 | 112.2 | 112.5 |
| C6S3C5 | 105.0 | 103.7 | 103.2 | 102.5 | 102.4 | 102.1 | 103.0 | 103.0 |
| S3C5N1 | 115.1 | 112.2 | 113.1 | 111.2 | 110.8 | 111.1 | 112.2 | 112.5 |
| C5N1C2 | 228.0 | 242.5 | 241.7 | 242.9 | 242.2 | 244.6 | 243.3 | 242.6 |
| N1C2C1 | 120.2 | 112.1 | 112.7 | 111.0 | 110.6 | 110.2 | 112.4 | 113.7 |
| C2C1N4 | 111.8 | 110.3 | 109.4 | 110.7 | 110.9 | 110.5 | 111.4 | 110.3 |
| C1N4C7 | 234.8 | 241.3 | 239.4 | 242.6 | 244.0 | 242.5 | 240.2 | 239.6 |
| N4C7N6 | 113.4 | 112.5 | 110.9 | 112.4 | 113.9 | 112.8 | 112.5 | 112.1 |
| VAS14 | 2054.8 | 2066.0 | 2061.0 | 2062.2 | 2059.7 | 2062.8 | 2067.8 | 2067.3 |
| VAS14(H2L2)–VAS14(ML2) | 0 | –11.2 | –6.2 | –7.4 | –4.9 | –8.0 | –13.0 | –12.5 |
| VAS14 – 2160о | –105.2 | –94.0 | –99.0 | –97.8 | –100.3 | –97.2 | –92.2 | –92.7 |
Таблица 3.
Валентные углы 14-членного макроцикла в хеланте H2L3 и образуемых им хелатах типа ML3
| Валентный угол | Комплекс и MS основного состояния | |||||||
|---|---|---|---|---|---|---|---|---|
| H2L3 | CrL3 | MnL3 | FeL3 | CoL3 | NiL3 | CuL3 | ZnL3 | |
| 1 | 5 | 6 | 3 | 2 | 1 | 2 | 1 | |
| N6C6N2 | 112.8 | 109.0 | 109.9 | 107.7 | 107.9 | 107.4 | 108.9 | 109.2 |
| C6N2С3 | 227.9 | 242.2 | 241.3 | 243.5 | 245.7 | 245.6 | 243.1 | 242.2 |
| N2C3C4 | 119.8 | 112.4 | 112.7 | 111.3 | 111.2 | 110.9 | 112.5 | 112.8 |
| C3C4N3 | 112.1 | 110.2 | 109.3 | 110.8 | 110.7 | 110.6 | 111.2 | 110.1 |
| C4N3C8 | 234.2 | 240.2 | 238.1 | 241.6 | 241.9 | 241.8 | 239.2 | 238.1 |
| N3C8N5 | 117.2 | 109.4 | 108.5 | 109.2 | 109.6 | 109.8 | 109.7 | 109.1 |
| C8N5C7 | 119.9 | 116.7 | 118.7 | 115.3 | 115.0 | 114.7 | 117.0 | 118.7 |
| N5C7N4 | 117.2 | 109.4 | 108.5 | 109.2 | 109.6 | 109.8 | 109.7 | 109.1 |
| C7N4C1 | 234.2 | 240.2 | 238.1 | 241.6 | 241.9 | 241.8 | 239.2 | 238.1 |
| N4C1C2 | 112.1 | 110.2 | 109.3 | 110.8 | 110.7 | 110.6 | 111.2 | 110.1 |
| C1C2N1 | 119.8 | 112.4 | 112.7 | 111.3 | 111.2 | 110.9 | 112.5 | 112.8 |
| C2N1C5 | 227.9 | 242.3 | 241.3 | 243.5 | 245.7 | 245.6 | 243.1 | 242.2 |
| N1C5N6 | 112.8 | 109.0 | 109.9 | 107.7 | 107.9 | 107.4 | 108.9 | 109.2 |
| C5N6C6 | 119.7 | 119.9 | 119.0 | 118.3 | 118.4 | 118.2 | 119.3 | 118.9 |
| VAS14 | 2087.6 | 2083.5 | 2077.3 | 2081.8 | 2087.4 | 2085.0 | 2085.6 | 2080.6 |
| VAS14(H2L3)– VAS14(ML3) | 0 | +4.1 | +10.3 | +5.8 | +0.2 | +2.6 | +2.0 | +7.0 |
| VAS14 – 2160° | –72.4 | –76.5 | –82.7 | –78.2 | –72.6 | –75.0 | –74.4 | –79.4 |
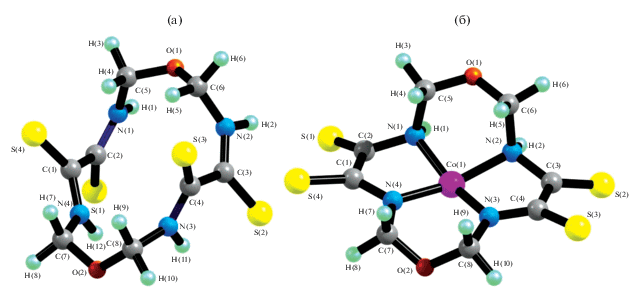
Хелант H2L1 и комплексы ML1. Как видно из данных табл. 1, сумма внутренних углов в 14-членном макроцикле как в самом хеланте H2L1, так и в образуемых им комплексах ML1 (VAS14) намного (как минимум на 65°) меньше, чем сумма внутренних углов в плоском 14-угольнике (2160°). При этом в каждом из указанных в хелатов ML1 отклонение от суммы 2160° существенно меньше, чем в хеланте H2L1, так что комплексообразование каждого из перечисленных M(II) с H2L1 сопровождается уменьшением степени искажения содержащегося в нем макроцикла. Знак величины VAS14(H2L1)–VAS14(ML1) не зависит от природы M(II), однако она незначительно сказывается на модуле вышеуказанного параметра (от 16.7° в случае MnL1 до 24.9° в случае NiL1). В результате комплексообразования резко меняется и внешний вид группировок атомов S1C2C1S4 и S2C3C4S3 (рис. 1), несмотря на то, что ни один из атомов, входящих в состав этих группировок, не образует в результате комплексообразования химических связей с атомом M. Соответственно, изменяются и значения образуемых ими торсионных (диэдрических) углов, которые для всех ML1, за исключением CoL1, совпадают по модулю, различаясь между собой лишь знаком. Например, торсионный угол S1C2C1S4 в H2L1 составляет –130.9°, а в образуемых им комплексах ML1 варьирует от –25.8° (NiL1) до –62.4° (MnL1), т.е. оказывается значительно меньшим.
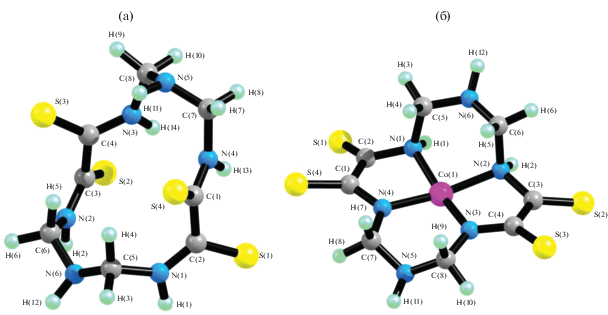
Рис. 1.
Пространственная структура 1,8-диокса-3,6,10,13-тетраазациклотетрадекантетратиона-4,5,11,12 (а) и его комплекса с Co(II) (б).
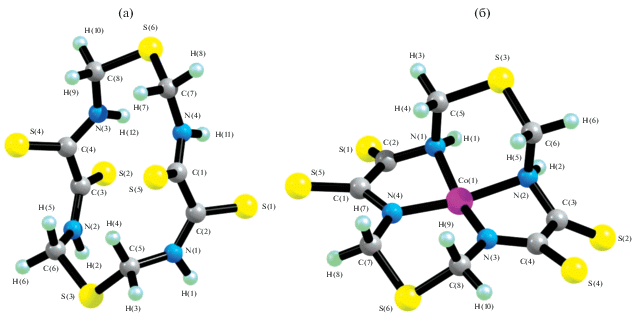
Хелант H2L2 и комплексы ML2. H2L2 отличается от H2L1 наличием в положениях 1 и 8 макроцикла атомов серы вместо атомов кислорода, но для него (табл. 2), как и для H2L1, сумма внутренних углов в его 14-членном макроцикле (VAS14), как и аналогичные суммы в комплексах ML2, существенно меньше, чем сумма внутренних углов в плоском 14-угольнике. При этом, как и в случае H2L1, отклонение от 2160° в каждом из комплексов ML2 меньше, чем в H2L2, и знак величины VAS14(H2L2) – VAS14(ML2) не зависит от природы M(II). Однако модуль этой величины в каждом комплексе ML2, во-первых, меньше, чем в аналогичном ему комплексе ML1, а во-вторых, динамика изменения данного параметра в ряду Cr–Zn несколько иная, чем в случае хелатов ML1 – минимальное значение имеет место в случае CoL2 (4.9°), максимальное – в случае CuL2 (13.0°), и разброс этих значений намного меньше. В результате комплексообразования сильно меняется внешний вид группировок атомов S1C2C1S5 и S2C3C4S4 (рис. 2) и значения соответствующих им торсионных (диэдрических) углов (например, угол S1C2C1S5 в хеланте H2L2 равен –135.1°, в металлохелатах ML2 он варьируется от –34.2° (CoL2) до –61.7° (MnL2)). Комплекс CoL2 оказывается единственным, для которого имеет место неравенство модулей величин углов S1C2C1S5 и S2C3C4S4 (39.0° и 34.2° соответственно).
Рис. 2.
Пространственная структура 1,8-дитиа-3,6,10,13-тетраазациклотетрадекантетратиона-4,5,11,12 (а) и его комплекса с Co(II) (б).
Хелант H2L3 и комплексы ML3. Искажения макроцикла в результате комплексообразования хеланта H2L3 с M(II) с образованием металлохелатов ML3 такое же, как и для хелантов H2L1 и H2L2, т.е. как сам хелант, так и его комплексы обнаруживают весьма значительные отклонения от компланарности – сумма внутренних углов в макроциклах в каждом из них отличается от суммы внутренних углов плоского 14-угольника более чем на 70° (табл. 3). Однако здесь изменяется соотношение между степенью искажения макроцикла в хеланте и образуемых им металлохелатах: если для H2L1 и H2L2 разность VAS14(H2L2) – VAS14(ML2) отрицательна, то для H2L3 она оказывается положительной, но малой по модулю по сравнению с аналогичными параметрами для ML1 и ML2. При этом наибольшее значение модуля величины VAS14(H2L3)–VAS14(ML3) наблюдается в случае MnL3, наименьшее – в CoL3. В результате комплексообразования сильно меняется внешний вид группировок атомов S1C2C1S4 и S2C3C4S3 (рис. 3), и значение соответствующих им торсионных углов (S1C2C1S4) в хеланте H2L3 равно –130.3°, в металлохелатах ML3 – от –28.6° NiL3 до –61.1° MnL3). Стоит отметить, что в комплексе CoL3 в отличие от CoL1 и CoL2 модули значений углов S1C2C1S4 и S2C3C4S3 одинаковы (по 28.8°). Такое же попарное равенство характерно для всех остальных комплексов ML3. Степень отклонения от компланарности у каждого из комплексов ML1 заметно меньше, чем у комплексов ML3. При этом в комплексах ML1, ML2 и ML3 не связанные с M(II) атомы O, S и N соответственно, имеющиеся в их макроциклах, располагаются по разные стороны от плоскости донорных атомов N4.
Рис. 3.
Пространственная структура 1,3,5,8,10,12-гексаазациклотетрадекантетратиона-6,7,13,14 (а) и его комплекса с Co(II) (б).
Из табл. 1–3 видно, что степени отклонения макроцикла хелантов H2L1, H2L2 и H2L3 от компланарности весьма существенно отличаются друг от друга (90.8°, 105.2° и 72.4° соответственно), что свидетельствует и о весьма сильной зависимости данного параметра от природы гетероатомов в макроцикле, наиболее удаленных от атомов M, не связанных с ними химическими связями, и находящихся в положениях (1,8) (в случае H2L1 и H2L2) и в положениях (3,10) (в случае H2L3). В то же время, согласно данным [19], степень отклонения от компланарности хеланта – 1,4,8,11-тетраазациклотетрадекантетратиона-2,3,9,10, который содержит в аналогичном 14-членном макроцикле лишь четыре атома азота, составляет 82.6°. Таким образом, при замене в макроцикле этого хеланта двух атомов углерода, наиболее удаленных от его центра (“периферийных”), на атомы азота степень некомпланарности макроцикла уменьшается, при замене их на атом O или S, напротив, возрастает. Сопоставление величин углов CEC (где E = C, N, O или S) в рассматриваемых соединениях показывает, что при переходе от C к N они в целом увеличиваются, а при переходе от N к O и далее к S – уменьшаются как в хелантах, так и в комплексах. При этом ни в тех, ни в других они попарно не равны друг другу. Но если для комплексов M(II) такое неравенство вполне ожидаемо и объяснимо (поскольку содержащиеся в них 6-членные металлоциклы не полностью идентичны друг другу, так как в одном из них оба атома N связаны с атомами водорода, в другом же – нет), то для хелантов оно остается непонятным. Обращает на себя внимание тот факт, что характер изменения вышеуказанных валентных углов в ряду N–O–S сходен с характером изменения степени искажения макроциклов, однако увеличение величин данных углов связано с уменьшением степени искажения. Возможно, именно здесь причина выраженной зависимости степени искажения макроцикла от природы гетероатомов. Можно предположить, что дело в размерах гетероатома E – чем больше его орбитальный радиус, тем меньшe должен быть образуемый валентный угол CEC. Для атомов C (орбитальный радиус 67 пм), гетероатомов N (56 нм) и гетероатомов S (88 пм) это ожидание оправдывается. В случае гетероатомов O (48 пм) следовало ожидать наибольших значений “периферийных” валентных углов, чего на самом деле не наблюдается. C другой стороны, эти углы должны зависеть и от наличия атомов H, химически связанных с гетероатомами E, и с ростом их числа должны увеличиваться вследствие стерических препятствий, возникающих для сближения соседних с E атомов углерода. Каждый из вышеуказанных “периферийных” атомов C в макроцикле связан с двумя атомами H, тогда как каждый из гетероатомов N – с одним, а гетероатомы O и S связаны лишь с соседними с ними атомами углерода. В случае гетероатома O влияние второго фактора превалирует над первым, так что несмотря на меньший его орбитальный радиус по сравнению с таковым для гетероатома N, углы COC оказываются меньшими, чем углы CNC.
ЗАКЛЮЧЕНИЕ
Согласно данным квантово-химического расчета методом DFT OPBE/TZVP, в комплексах, образуемых макроциклическими лигандами – 1,8-диокса-3,6,10,13-тетраазациклотетрадекантетратионом-4,5,11,12, 1,8-дитиа-3,6,10,13-тетраазациклотетрадекантетратионом-4,5,11,12 и 1,3,5,8,10,12-гексаазациклотетрадекантетратионом-6,7,13,14, как и в самих этих лигандах, имеет место значительное искажение 14-членного макроцикла. При этом в случае 1,8-диокса-3,6,10,13-тетраазациклотетрадекантетратиона-4,5,11,12 и 1,8-дитиа-3,6,10,13-тетраазациклотетрадекантетратиона-4,5,11,12 комплексообразование с Mn(II), Fe(II), Co(II), Ni(II), Cu(II) и Zn(II) сопровождается уменьшением степени искажения макроцикла хеланта, а в случае 1,3,5,8,10,12-гексаазациклотет-радекантетратиона-6,7,13,14, напротив, увеличением. В зависимости от природы как иона M(II), так и макроциклического лиганда эта степень может как ослабляться, так и усиливаться.
БЛАГОДАРНОСТЬ
Работа выполнена при финансовой поддержке Министерства образования и науки РФ (грант № 4.5784.2017/8.9). Все квантово-химические расчеты выполнены в Казанском отделении Межведомственного суперкомпьютерного центра РАН – филиале Федерального государственного учреждения “Федеральный научный центр Научно-исследовательский институт системных исследований РАН” (http://kbjscc.knc.ru), которому авторы также выражают свою искреннюю признательность за оказанную техническую поддержку.
Список литературы
Mikhailov O.V., Chachkov D.V. // Russ. J. Inorg. Chem. 2015. V. 60. № 9. P. 1117. doi 10.1134/ S0036023615090065 [Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2015. Т. 60. № 9. С. 1225. doi 10.7868/ S0044457X15090068]
Mikhailov O.V., Chachkov D.V. // Russ. J. Inorg. Chem. 2015. V. 60. № 11. P. 1354. doi 10.1134/ S003602361511011X [Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2015. Т. 60. № 11. С. 1479. doi 10.7868/S0044457X15110112]
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2014. V. 59. № 3. P. 218. doi 10.1134/ S0036023614030024 [Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2014. Т. 59. № 3. С. 361. doi 10.7868/ S0044457X14030027]
Hoshino A., Takenaka Y., Miyaji H. // Acta Crystallogr. B. 2003. V. 59. № 3. P. 393. doi 10.1107/ S010876810300942X
Hoe W.-M., Cohen A., Handy N.C. // Chem. Phys. Lett. 2001. V. 341. № 3–4. P. 319. doi 10.1016/S0009-2614(01)00581-4
Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev. Lett. 1997. V. 77. № 18. P. 3865. doi 10.1103/PhysRevLett.77.3865
Schaefer A., Horn H., Ahlrichs R. // J. Chem. Phys. 1992. V. 97. № 4. P. 2571. doi 10.1063/1.463096
Schaefer A., Huber C., Ahlrichs R. // J. Chem. Phys. 1994. V. 100. № 8. P. 5829. doi 10.1063/1.467146
Paulsen H., Duelund L., Winkler H., et al. // Inorg. Chem. 2001. V. 40. № 9. P. 2201. doi 10.1021/ic000954q
Swart M., Groenhof A.R., Ehlers A.W., Lammertsma K. // J. Phys. Chem. A. 2004. V. 108. № 25. P. 5479. doi 10.1021/jp049043i
Swart M., Ehlers A.W., Lammertsma K. // Mol. Phys. 2004. V. 102. № 23. P. 2467. doi 10.1080/0026897042000275017
Swart M. // Inorg. Chim. Acta. 2007. V. 360. № 1. P. 179. doi 10.1016/j.ica.2006.07.073
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09, Revision A.01. Gaussian, Inc., Wallingford CT, 2009.
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2012. V. 57. № 7. P. 981. doi 10.1134/S0036023612070078 [Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2012. Т. 57. № 7. С. 1056.]
Chachkov D.V., Mikhailov O.V. // Macroheterocycles. 2009. V. 2. № 3-4. P. 271.
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2010. V. 55. № 8. P. 1243. doi 10.1134/ S0036023610080152 [Чачков Д.В., Михайлов О.В. // Журн. неорган. химии. 2010. Т. 55. № 8. С. 1318.]
Mikhailov O.V., Chachkov D.V. // Inorg. Chim. Acta. 2013. V. 408. № 1. P. 246. doi 10.1016/j.ica.2013.09.003
Chachkov D.V., Mikhailov O.V. // Russ. J. Inorg. Chem. 2013. V. 58. № 2. P. 174. doi 10.1134/ S0036023613020186 [Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2013. Т. 58. № 2. С. 209. doi 10.7868/S0044457X13020189]
Mikhailov O.V., Chachkov D.V. // Russ. J. Inorg. Chem. 2014. V. 59. № 11. P. 1276. doi 10.1134/ S0036023614110138 [Михайлов О.В., Чачков Д.В. // Журн. неорган. химии. 2014. Т. 59. № 11. С. 1521. doi 10.7868/S0044457X14110130]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии