Журнал неорганической химии, 2019, T. 64, № 4, стр. 405-413
Кинетическая и термодинамическая устойчивость промежуточных комплексов в реакциях окисления церием(IV) некоторых гетероциклических соединений
О. О. Воскресенская 1, *, Н. А. Скорик 2, Е. Н. Наприенко 2
1 Объединенный институт ядерных исследований
141980 Дубна, Московской обл., ул. Жолио-Кюри, 6, Россия
2 Томский государственный университет
634050 Томск, пр-т Ленина, 36, Россия
* E-mail: voskr@jinr.ru
Поступила в редакцию 30.05.2018
После доработки 16.07.2018
Принята к публикации 15.08.2018
Аннотация
Кинетические и термодинамические характеристики промежуточных комплексов церия(IV) с 8-оксихинолином, 7-иод-8-гидроксихинолин-5-сульфокислотой и 1-фенил-2,3-диметил-4-диметиламинопиразолоном-5, образующихся на первой стадии окисления данных гетероциклических соединений церием(IV), изучены методами спектрофото-, фото- и рН-метрии при ионной силе $I = 2$ в области pH 0.5–3.0 сернокислой среды и температурах 285.15–297.15 K. Установлены состав комплексов, форма присутствия в них органического лиганда, определены константы устойчивости и константы скорости их внутримолекулярного редокс-распада. Получено общее уравнение скорости наблюдаемого в системах редокс-процесса, предложена соответствующая ему реакционная модель. Рассмотрен тип линейных корреляций между термодинамической и кинетической устойчивостью промежуточных комплексов, который может применяться в координационной химии для количественного описания реакций окисления органических соединений ионами переходных металлов.
ВВЕДЕНИЕ
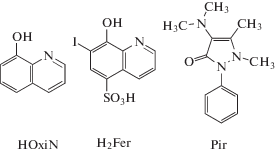
Гетероциклические1 соединения широко распространены в природе и применяются в различных областях медицины, биологии, химии и технологии. Многие из них занимают важное место среди лекарственных препаратов. Активно применяется в фармакологии и медицине 1‑фенил-2,3-диметил-4-диметиламинопиразолон-5 ${{{\text{С }}}_{{17}}}{{{\text{H}}}_{{13}}}{\text{O}}{{{\text{N}}}_{3}}$ (пирамидон, ${\text{Pir}}$), входящий в состав большого числа лекарственных форм. Соединения редкоземельных элементов (РЗЭ) с антипирином и его производными используют в качестве терапевтических препаратов, а также в технологии разделения РЗЭ [1–3]. Антиканцерогенные, нейропротекторные, антивирусные, антиоксидантные и другие биологически активные свойства 8-оксихинолина ${{{\text{С }}}_{9}}{{{\text{H}}}_{7}}{ON\;}({\text{HOxiN}}),$ его производных, соединений с металлами [4–8], а также продуктов его окисления с хиноидной структурой (производных хинолин-5,8-диона) [9–13] обусловливают их применение в медицине, радиобиологии и сельском хозяйстве в качестве селективных антиканцерогенных средств, антидиабетических, противомалярийных, фунгицидных препаратов и антисептиков наружного и амебоцидного действия [4, 5, 9, 14, 15].
Производные 8-оксихинолина и их соединения с РЗЭ и микроэлементами нашли широкое применение в аналитической химии, технологических процессах разделения РЗЭ [3], ингибирования коррозии [16], концентрирования микроэлементов [17]. Люминесцентные свойства комплексов РЗЭ [18], церия(IV) [19] и других элементов [20] c 8-оксихинолином и его производными применяют в люминесцентном анализе, технологии создания материалов с фото- и электролюминесцентными свойствами для оптоэлектроники, фотоники, хемо- и биосенсорики [18, 20]. 8-Оксихинолин используют при экстракционно-колориметрическом определении церия(IV) и, напротив, церий(IV) применяют при оксидиметрическом определении 8-оксихинолина [21–23]. Однако данные о термодинамической устойчивости 8-оксихинолинатного комплекса церия(IV) и его кинетической устойчивости относительно редокс-распада в литературе отсутствуют. Доступны лишь сведения о величине произведения растворимости соли ${\text{Ce}}{{({\text{OxiN}})}_{4}}$ [24], а также о значении редокс-эквивалента церия(IV) по отношению к 8-оксихинолину [23]. Производные 8-оксихинолина с сульфогруппами, например, 7-иод-8-оксихинолин-5-сульфокислота ${{{\text{С }}}_{9}}{{{\text{H}}}_{6}}{{{\text{O}}}_{4}}{\text{NIS}}$ (${{{\text{H}}}_{2}}{\text{Fer}}$, реагент на железо(III)), образуют с катионами металлов растворимые в воде комплексы и применяются для фотометрического определения элементов [22]. Однако, насколько нам известно, сведения о характеристиках 7-иод-8-оксихинолин-5-сульфонатного комплекса церия(IV) в литературе отсутствуют.
В аналитической химии комплексы металлов с производными антипирина активно используются как аналитические реагенты на церий(IV) [25]. Комплексообразующая способность амидопирина (пирамидона) описана в обзоре [26]. Данные об образовании окрашенного интермедиата при окислении амидопирина церием(IV) и о величине редокс-эквивалента церия(IV) по отношению к указанному соединению приведены в работах [27, 28]. Константа устойчивости комплекса ${{[{\text{CeOH}}{{({\text{Pir}})}_{2}}]}^{{3 + }}}$ определена в [29], однако кинетическая устойчивость комплекса не исследована, кинетика редокс-взаимодействия в системе изучена недостаточно. При изучении процессов окисления гетероциклических соединений церием(IV) авторы акцентировали внимание на возможности синтеза органических соединений, не рассматривая их с кинетической точки зрения [30]. Мы полагаем, что изучение кинетики процессов данного типа представляет научный интерес.
В представленной работе обобщенные термодинамические методы изучения образования и внутримолекулярного редокс-распада комплексов металлов переменной валентности, а также кинетические аналоги этих методов [31] применены как для исследования термодинамических и кинетических характеристик промежуточных комплексов церия(IV), образующихся в системах ${\text{C}}{{{\text{e}}}^{{4 + }}}$–${\text{SO}}_{4}^{{2 - }}$–${\text{R}}$ (${\text{R}} = {\text{HOxiN,}}$ ${{{\text{H}}}_{2}}{\text{Fer,}}$ ${\text{Pir}}$) в начальный момент времени, так и для регистрации кинетики и выявления механизма окисления церием(IV) указанных органических молекул (${\text{R}}$):
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все использованные в работе реагенты имели квалификацию “ч. д. а.”. В качестве источника церия(IV) использовали тетрагидрат сульфата церия(IV) ${\text{Ce}}{{({\text{S}}{{{\text{O}}}_{{4{\;}}}})}_{2}} \cdot 4{{{\text{H}}}_{2}}{\text{O}}{\text{.}}$ Содержание церия(IV) в свежеприготовленном растворе сульфата церия(IV) (${{c}_{{{{{\text{H}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}}}} = 0.20$ моль/л) определяли обратным титрованием солью Мора в присутствии ферроина [23] перед началом эксперимента и по его окончании. Исходные растворы 8-оксихинолина, 7-иод-8-оксихинолин-5-сульфокислоты и амидопирина готовили по точной навеске. Определенную величину ионной силы $I = 2$ растворов (${{c}_{{{\text{S}}{{{\text{O}}}_{4}}}}} = 0.67$ моль/л) создавали сульфатом аммония.
Начальную величину оптической плотности реакционной смеси ${{D}^{0}}$ находили путем линейной экстраполяции кинетических кривых в координатах $\lg D$–${\tau }$ к начальному времени ${\tau } = 0,$ так как изменение логарифма оптической плотности во времени $\left( {\lg D} \right)_{{\tau }}^{'}$ подчинялось уравнению прямой $\lg D = \lg {{D}^{0}} - {{k}_{{{{n}_{{{\tau \;}}}} = \quad1}}}{\tau ,}$ где ${{k}_{{{{n}_{\tau }}\quad = \quad1}}},\,\,{{{\text{c}}}^{{ - 1}}},$ – псевдоконстанта скорости первого временнóго порядка (приложение, рис. S1). Начальную скорость наблюдаемого редокс-процесса $ - {{\dot {D}}^{0}} \equiv {{\partial D} \mathord{\left/ {\vphantom {{\partial D} {\partial {\tau }}}} \right. \kern-0em} {\partial {\tau }}}{\text{,}}$ c–1, оценивали графически в тех же координатах по тангенсу угла наклона прямой, $ - {{\dot {D}}^{0}} = ({{D}^{0}} - {{D}^{i}}){\text{/}}({{{\tau }}^{0}} - {{{\tau }}^{i}}) = {\text{const,}}$ а также рассчитывали линейным МНК. Начальную равновесную концентрацию промежуточного $1\quad:n$ комплекса определяли по формулам: $c_{n}^{0}$ = = $({{D}^{0}} - {{D}_{{\text{M}}}}){\text{/}}(D_{\infty }^{0} - {{D}_{{\text{M}}}}){{c}_{{\text{M}}}}$ = ${\alpha }_{n}^{0}{{c}_{{\text{M}}}}$ и $\bar {c}_{1}^{0}$ = = $ - ({{\dot {D}}^{0}} - {{\dot {D}}_{{\text{M}}}}){\text{/}}(\dot {D}_{\infty }^{0} - {{\dot {D}}_{{\text{M}}}}){{c}_{{\text{M}}}}$ = $\bar {\alpha }_{n}^{0}{{c}_{{\text{M}}}}$ (${{c}_{{\text{M}}}} \leqslant \quad{{c}_{{\text{L}}}}$) с использованием термодинамических методов и их кинетических аналогов соответственно. Здесь ${{D}_{{\text{M}}}}$ – оптическая плотность раствора иона металла, ${{\dot {D}}_{{\text{M}}}}$ – скорость ее изменения, ${{c}_{{\text{M}}}}$ и ${{c}_{{\text{L}}}}$ – концентрации исследуемых растворов церия(IV) и органического лиганда, ${\alpha }_{n}^{0}$ (${\bar {\alpha }}_{n}^{0}$) – выход комплекса в момент времени ${\tau } = 0.$ Черта над символом здесь и далее означает величину, определенную кинетическим методом. Максимальные значения оптической плотности реакционной смеси $D_{\infty }^{0}$ и скорости ее изменения $\dot {D}_{\infty }^{0},$ c–1, находили из графиков зависимостей ${{D}^{0}}$ от pH и ${{\dot {D}}^{0}}$ от pH. При использовании метода изомолярных серий (метод ${{D}^{0}}$–${{N}_{{\text{L}}}},$ где ${{N}_{{\text{L}}}}$ – мольная доля лиганда) начальную равновесную концентрацию монокомплекса $c_{1}^{0}$ рассчитывали по уравнению:
(1)
$\begin{gathered} {{\left( {\frac{1}{a}\frac{{{{с }_{{{\text{M}} + {\text{L}}}}}}}{2} - c_{1}^{0}} \right)}^{2}} = \left( {\frac{{{{с }_{{{\text{M}} + {\text{L}}}}}}}{{{{{{N}_{{\text{L}}}}} \mathord{\left/ {\vphantom {{{{N}_{{\text{L}}}}} {\left( {1 + {{N}_{{\text{L}}}}} \right)}}} \right. \kern-0em} {\left( {1 + {{N}_{{\text{L}}}}} \right)}} + 1}} - c_{1}^{0}} \right) \times \\ \times \,\,\left( {\frac{{{{с }_{{{\text{M}} + {\text{L}}}}}}}{{{{\left( {1 - {{N}_{{\text{L}}}}} \right)} \mathord{\left/ {\vphantom {{\left( {1 - {{N}_{{\text{L}}}}} \right)} {{{N}_{{\text{L}}}} + 1}}} \right. \kern-0em} {{{N}_{{\text{L}}}} + 1}}}} - c_{1}^{0}} \right), \\ \end{gathered} $Регистрацию оптической плотности D растворов осуществляли с помощью спектрофотометра SPECORD UV VIS c термостатируемым блоком и фотоэлектроколориметра KF-5 с регистрирующим устройством МЭА-4 и термостатируемой ячейкой. Измерение pH в смеси компонентов проводили прецизионным pH-метром DATA METER.
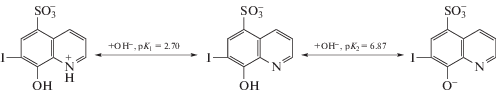
Мольное отношение металл : лиганд (M : R) в комплексе, образующемся в момент смешения компонентов реакционной смеси, определяли с помощью метода ${{D}^{0}}$–${{N}_{{\text{L}}}}$ и его кинетических аналогов ${{\dot {D}}^{0}} - {{N}_{{\text{L}}}},$ $\left( {\lg D} \right)_{{\tau }}^{'} - {{N}_{{\text{L}}}}$ [23]. В расчетах использовали определенные для $I{\;} \approx 2{\;}$ значения логарифмов общих констант протонирования анионов ${{{\text{R}}}^{{m - }}},$ $m$ = 0–2, и отрицательных логарифмов констант диссоциации их протонированных форм: $\lg {{B}_{1}} = {\text{p}}{{K}_{2}} = 9.56,$ $\lg {{B}_{2}} = \lg {{B}_{1}} + {\text{p}}{{K}_{1}} = 14.76,$ ${\text{p}}{{K}_{1}} = 5.20$ (${\text{Oxi}}{{{\text{N}}}^{ - }}$) [32]; $\lg {{B}_{1}} = 6.87,$ $\lg {{B}_{2}} = 9.57,$ ${\text{p}}{{K}_{1}} = 2.{\;}70$ (${\text{Fe}}{{{\text{r}}}^{{2 - }}}$) [33]; $\lg {{B}_{1}} = 6.10$ (Pir) [29]. Отметим, что, согласно [33, 34], значения констант диссоциации ${{K}_{1}},$ ${{K}_{2}},$ полученные в [33] для 7-иод-8-оксихинолин-5-сульфокислоты, характеризуют равновесия:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Положение экстремума на оси состава соответствует образованию в системах ${\text{C}}{{{\text{e}}}^{{4 + }}}$–${\text{SO}}_{4}^{{2 - }}$–${\text{HOxiN,}}$ ${\text{C}}{{{\text{e}}}^{{4 + }}}$–${\text{SO}}_{4}^{{2 - }}$–${{{\text{H}}}_{2}}{\text{Fer}}$ в момент ${\tau } = 0$ комплексов с мольным отношением ${M\;}:{\text{R}} = 1\quad:1$ (приложение, рис. S2). В системе ${\text{C}}{{{\text{e}}}^{{4 + }}}$–${\text{SO}}_{4}^{{2 - }}$–${Pir\;M}:{\text{R}} = 1\quad:2,$ что согласуется с результатами установления состава комплекса церия(IV) с амидопирином в работе [29]. Форму присутствия органического лиганда в комплексе определяли на основе диаграмм свойство–${\text{pH}}$ расширенными кинетическим (${{\dot {D}}^{0}},$$\quad{{D}^{0}}$–${\text{pH}}$) и термодинамическим (${{D}^{0}},$ ${{\dot {D}}^{0}}$–${\text{pH}}$) методами, описанными в [31]. В качестве доминирующей формы церия(IV) в исследуемом интервале pH на сульфатном фоне была принята в соответствии с [31] моногидроксоформа ${\text{CeO}}{{{\text{H}}}^{{3 + }}}.$ Для определения формы присутствия лиганда в комплексе число протонов $z$ ($\bar {z}$), вытесненных ионом ${\text{CeO}}{{{\text{H}}}^{{3 + }}}$ из катионной формы лигандов ${\text{H}}{{{\text{R}}}^{ + }}$ = ${{{\text{H}}}_{2}}{\text{Ox}}{{{\text{N}}}^{ + }},$ ${\text{HPi}}{{{\text{r}}}^{ + }}$ и цвиттер-иона ${{{\text{H}}}_{2}}{\text{Fer}}$ [19] при установлении равновесий
(2)
$\begin{gathered} {\text{CeO}}{{{\text{H}}}^{{3 + }}} + n{\text{H}}{{{\text{R}}}^{ + }}\overset {{{K}_{n}},{{{\bar {K}}}_{n}}} \longleftrightarrow \\ \leftrightarrow {{\left[ {{\text{CeOH}}{{{\left( {{{{\text{H}}}_{{ - z}}}{{{\text{R}}}^{{z{\;} - {\;}1}}}} \right)}}_{n}}} \right]}^{{3 - n(z{\;} - {\;}1)}}} + nz{{{\text{H}}}^{ + }}, \\ {\text{CeO}}{{{\text{H}}}^{{3 + }}} + n{{{\text{H}}}_{2}}{\text{Fer}}\overset {{{K}_{n}},{{{\bar {K}}}_{n}}} \longleftrightarrow \\ \leftrightarrow {{\left[ {{\text{CeOH}}{{{\left( {{{{\text{H}}}_{{2{\;} - {\;}z}}}{{{\text{R}}}^{{ - z}}}} \right)}}_{n}}} \right]}^{{3{\;} - {\;}nz}}} + nz{{{\text{H}}}^{ + }}, \\ {{K}_{n}} = {\beta }_{n}^{{{\text{ef}}}}{{\left[ {{{{\text{H}}}^{ + }}} \right]}^{{nz}}},\,\,\,\,{{{\bar {K}}}_{n}} = \bar {\beta }_{n}^{{{\text{ef}}}}{{\left[ {{{{\text{H}}}^{ + }}} \right]}^{{n\bar {z}}}},\,\,\,\,n = {\text{ }}1,{\text{ }}2, \\ \end{gathered} $(3)
${\;}\lg {\beta }_{n}^{{{\text{ef}}}} = \lg {{K}_{n}} + nz{\text{pH}},\,\,\,\,{\text{lg}}\bar {\beta }_{n}^{{{\text{ef}}}} = \lg {{\bar {K}}_{n}} + n\bar {z}{\text{pH}}{\text{.}}$Эффективные константы устойчивости рассчитывали для каждого из значений pH серий ${{\dot {D}}^{0}},$ ${{D}^{0}}$–${\text{pH}}$ и ${{D}^{0}},$ ${{\dot {D}}^{0}}$–${\text{pH}}$ по формулам:
(4)
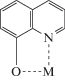
$\begin{gathered} {\beta }_{n}^{{{\text{ef}}}} = \frac{{c_{n}^{0}}}{{\left( {{{c}_{{\text{M}}}} - c_{n}^{0}} \right){{{({{c}_{{\text{L}}}} - c_{n}^{0})}}^{n}}}}, \\ \bar {\beta }_{n}^{{{\text{ef}}}} = \frac{{\bar {c}_{n}^{0}}}{{\left( {{{c}_{{\text{M}}}} - \bar {c}_{n}^{0}} \right){{{({{c}_{{\text{L}}}} - \bar {c}_{n}^{0})}}^{n}}}}. \\ \end{gathered} $Как следует из анализа зависимости (3), ион ${\text{CeO}}{{{\text{H}}}^{{3 + }}}$ при комплексообразовании вытесняет из ${{{\text{H}}}_{2}}{\text{Oxi}}{{{\text{N}}}^{ + }}$ и ${{{\text{H}}}_{2}}{\text{Fer}}$ по два протона (приложение, рис. S3). Пространственная близость третичного атома азота и гидроксильной группы в молекулах 8-оксихинолина и 7-иод-8-оксихинолин-5-сульфокислоты может приводить к замыканию 5-членных циклов
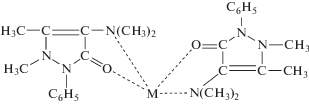
(${\text{M}} = {\text{CeO}}{{{\text{H}}}^{{3 + }}}$) в образующихся комплексах ${{[{\text{CeOHOxiN}}]}^{{2 + }}},$ ${{[{\text{CeOHFer}}]}^{ + }}$ в соответствии с данными [35–38]. Заметим, что анализ ИК-спектров дает прямое доказательство участия атома азота в образовании хелатов РЗЭ с 8-оксихинолин-5-сульфокислотой [3].При образовании амидопиринатного бис-комплекса катион ${\text{CeO}}{{{\text{H}}}^{{3 + }}}$ вытесняет из каждой протонированной молекулы ${\text{HPi}}{{{\text{r}}}^{ + }}$ по одному протону (приложение, рис. S3). Спектроскопические характеристики аналогичных комплексов (например, ${{[{\text{Fe}}{{({\text{Pir}})}_{2}}]}^{{3 + }}}$ [39]) позволяют предположить структуру комплекса ${{[{\text{CeOH}}{{({\text{Pir}})}_{2}}]}^{{3 + }}},$ где каждая молекула ${\text{Pir}}$ координируется катионом металла посредством карбонильной группы и экзоциклического атома азота с образованием пятичленного цикла:
Для равновесий комплексообразования c анионами ${{{\text{R}}}^{{m - }}} = {\text{Oxi}}{{{\text{N}}}^{ - }},$ ${\text{Fe}}{{{\text{r}}}^{{2 - }}}$:
(5)
$\quad{\text{CeO}}{{{\text{H}}}^{{3 + }}} + {{{\text{R}}}^{{m - }}}\overset {{{{\beta }}_{1}},{{{\bar {\beta }}}_{1}}} \longleftrightarrow \,{{[{\text{CeOHR}}]}^{{(3{\;} - {\;}m) + }}},$(6)
${{{\beta }}_{1}} = {\beta }_{1}^{{{\text{ef}}}}{{f}_{2}},\,\,\,\,{{\bar {\beta }}_{1}} = \bar {\beta }_{1}^{{{\text{ef}}}}{{f}_{2}},\,\,\,\,{{f}_{2}} = 1 + \sum\limits_{i = 1}^2 {{{B}_{{\text{i}}}}{{{[H]}}^{i}}} ,$(7)
${\text{CeO}}{{{\text{H}}}^{{3 + }}} + 2{\text{Pir}}\overset {{{{\beta }}_{2}},{{{\bar {\beta }}}_{2}}} \longleftrightarrow \,\,{{[{\text{CeOH}}{{({\text{Pir}})}_{2}}]}^{{3 + }}},$(8)
${{{\beta }}_{2}} = {\beta }_{2}^{{{\text{ef}}}}{{f}_{1}},\,\,\,\,{{\bar {\beta }}_{2}} = \bar {\beta }_{2}^{{{\text{ef}}}}{{f}_{1}},\,\,\,\,{{f}_{1}} = 1 + {{B}_{1}}[H],$Доверительный интервал для усредненных значений констант устойчивости рассчитывали с доверительной вероятностью 0.95 при объеме выборки $N = 16$ с использованием программы СТАТОБРАБОТКА [40]. Усредненные значения ${\text{lg}}{{\bar {\beta }}_{n}}$ (n = = 1, 2), определенные методом ${{\dot {D}}^{0}},$${{D}^{0}}$–${\text{pH,}}$ согласуются со значениями $\lg {{{\beta }}_{n}}$ (n = 1, 2), рассчитанными с использованием метода ${{D}^{0}},$${{\dot {D}}^{0}}$–${\text{pH}}$ (табл. 1–3). Так, например, для комплекса ${{[{\text{CeOHOxiN}}]}^{{2 + }}}$ ${\text{lg}}{{\bar {\beta }}_{1}} = 15.54 \pm 0.13,$ $\lg {{{\beta }}_{1}} = 15.55 \pm 0.55$ (табл. 1). Введение в структуру оксина электроноакцепторных групп (сульфогруппа и атом иода) существенно понижает устойчивость комплекса ${{[{\text{CeOHFer}}]}^{ + }}$ ($\lg {{{\beta }}_{1}}\sim \quad12.43$) по сравнению с ${{[{\text{CeOHOxiN}}]}^{{2 + }}}.$ Устойчивость последних сопоставима с устойчивостью глицинатного комплекса церия(IV) ($\lg {{{\beta }}_{1}}\sim \quad13.70$) [41], имеющего тот же хелатообразующий скелет [19]. Определенная кинетическим методом величина $\lg {{\bar {\beta }}_{2}} = 15.01 \pm 0.13$ комплекса ${{[{\text{CeOH}}{{({\text{Pir}})}_{2}}]}^{{3 + }}}$ близка к $\lg {{{\beta }}_{2}} = 14.91 \pm 0.17,$ найденной термодинамическим методом в [29]. Значения $\lg {{{\beta }}_{1}}$ комплексов катиона ${\text{CeO}}{{{\text{H}}}^{{3 + }}}$ с органическими лигандами, полученные в данной и предшествующих работах [31, 41–43], коррелируют с соответствующими значениями величины $\lg {{{\beta }}_{1}}$ [39, 44, 45], полученными для комплексов железа(III) (рис. 1).
Таблица 1.
Константы устойчивости и константы скорости редокс-распада комплекса ${{[{\text{CeOHOxiN}}]}^{{2 + }}},$ определенные методами ${{\dot {D}}^{0}},{{D}^{0}}$ – pH (1) и ${{\dot {D}}^{0}},{{D}^{0}}$ – pH (2) при cM = 1.56 × 10–4, cL = 4.69 × 10–4 моль/л, $\dot {D}_{\infty }^{0} = 2.03 \times {{10}^{{ - 2}}}\,{{{\text{с }}}^{{ - 1}}},$ $D_{\infty }^{0} = 0.162,$ I = 2, T = 289.15 K, λef = 515 нм, l = 1 см
| 1. Метод ${{\dot {D}}^{0}},{{D}^{0}}$ – pH | |||||||
| ${{\dot {D}}^{0}} \times {{10}^{2}},$ с–1 | pH | $\bar {c}_{1}^{0} \times {{10}^{4}},$ моль/л | $\lg \bar {\beta }_{1}^{{{\text{ef}}}}$ | $\lg {{\bar {\beta }}_{1}}$ | 10ΔD0 | lg ε1 | $\lg {{\bar {k}}_{{n = 1}}}$ |
| –0.16 | 0.60 | 0.12 | 2.27 | 15.83 | 0.13 | 3.01 | –0.91 |
| –0.23 | 0.82 | 0.18 | 2.46 | 15.58 | 0.19 | 3.03 | –0.89 |
| –0.28 | 0.90 | 0.22 | 2.57 | 15.53 | 0.23 | 3.02 | –0.90 |
| –0.39 | 1.05 | 0.31 | 2.75 | 15.41 | 0.31 | 3.03 | –0.89 |
| –0.51 | 1.12 | 0.40 | 2.91 | 15.43 | 0.42 | 3.00 | –0.87 |
| –0.77 | 1.23 | 0.60 | 3.19 | 15.49 | 0.60 | 3.00 | –0.88 |
| –1.28 | 1.43 | 1.00 | 3.68 | 15.58 | 1.03 | 3.03 | –0.89 |
| –1.64 | 1.70 | 1.28 | 4.13 | 15.49 | 1.38 | 3.01 | –0.90 |
| Примечание. Величина $\lg {{\bar {\beta }}_{1}}$ = 15.54 ± 0.13, $\lg {{\bar {k}}_{{n = 1}}}$ = –0.89 ± 0.01. | |||||||
| 2. Метод ${{D}^{0}},{{\dot {D}}^{0}}$ – pH | |||||||
| 10ΔD0 | pH | $c_{1}^{0} \times {{10}^{4}},$ моль/л | $\lg \bar {\beta }_{1}^{{{\text{ef}}}}$ | $\lg {{\bar {\beta }}_{1}}$ | ${{\dot {D}}^{0}} \times {{10}^{2}}$, с–1 | $\lg k_{{n = 1}}^{{{\text{obs}}}}$ | $\lg k_{{n = 1}}^{{}}$ |
| 0.13 | 0.60 | 0.13 | 2.28 | 15.84 | –0.16 | 2.10 | –0.91 |
| 0.19 | 0.82 | 0.19 | 2.45 | 15.57 | –0.23 | 2.11 | –0.90 |
| 0.23 | 0.90 | 0.23 | 2.57 | 15.53 | –0.28 | 2.11 | –0.91 |
| 0.31 | 1.05 | 0.31 | 2.74 | 15.40 | –0.39 | 2.12 | –0.90 |
| 0.42 | 1.12 | 0.42 | 2.91 | 15.43 | –0.51 | 2.10 | –0.91 |
| 0.60 | 1.23 | 0.60 | 3.16 | 15.46 | –0.77 | 2.12 | –0.89 |
| 1.03 | 1.43 | 1.03 | 3.67 | 15.57 | –1.28 | 2.11 | –0.91 |
| 1.38 | 1.70 | 1.38 | 4.24 | 15.60 | –1.64 | 2.09 | –0.92 |
Таблица 2.
Кинетическая и термодинамическая устойчивость комплекса ${{[{\text{CeOHFer}}]}^{ + }},$ определенные методами ${{\dot {D}}^{0}},{{D}^{0}}$ – pH при cM = cL = 4.77 × 10–4 моль/л, $\dot {D}_{\infty }^{0}$ = 6.30 × 10–2 c–1, $D_{\infty }^{0}$ = 0.745 (1) и ${{D}^{0}},{{\dot {D}}^{0}}$–NL при cM + L = 9.53 × × 10–4 моль/л (2), I = 2, T = 289.15 K, λef = 515 нм, l = 1 см
| 1. Метод ${{\dot {D}}^{0}},{{D}^{0}}$–pH | |||||||
| $10{{\dot {D}}^{0}},$ с–1 | pH | $\bar {c}_{1}^{0} \times {{10}^{4}},$ моль/л | $\lg \bar {\beta }_{1}^{{{\text{ef}}}}$ | $\lg {{\bar {\beta }}_{1}}$ | 10ΔD0 | lg ε1 | $\lg {{\bar {k}}_{{n = 1}}}$ |
| –0.38 | 0.50 | 2.86 | 3.90 | 12.47 | 3.46 | 3.08 | –0.96 |
| –0.38 | 0.60 | 2.88 | 3.91 | 12.28 | 4.73 | 3.17 | –0.98 |
| –0.34 | 0.63 | 2.59 | 4.15 | 12.46 | 4.07 | 3.10 | –0.99 |
| –0.50 | 0.90 | 3.79 | 4.46 | 12.23 | 6.20 | 3.20 | –1.08 |
| –0.55 | 1.05 | 4.16 | 5.05 | 12.53 | 6.48 | 3.30 | –1.18 |
| –0.55 | 1.12 | 4.16 | 5.05 | 12.39 | 6.43 | 3.21 | –1.05 |
| –0.56 | 1.23 | 4.25 | 5.21 | 12.33 | 6.63 | 3.17 | –1.07 |
| Примечание. Величина $\lg {{\bar {\beta }}_{1}}$ = 12.38 ± 0.11, $\lg {{\bar {k}}_{{n = 1}}}$ = –1.05 ± 0.07. | |||||||
| 2. Метод ${{D}^{0}},{{\dot {D}}^{0}}$–NL | |||||||
| ΔD0 | NL | $c_{1}^{0} \times {{10}^{4}},$ моль/л | $\lg \bar {\beta }_{1}^{{{\text{ef}}}}$ | $\lg {{\bar {\beta }}_{1}}$ | ${{\dot {D}}^{0}} \times {{10}^{2}}$, с–1 | $\lg k_{{n = 1}}^{{{\text{obs}}}}$ | $\lg k_{{n = 1}}^{{}}$ |
| 0.40 | 0.55 | 5.90 | 4.47 | 12.80 | –7.66 | 2.11 | –1.08 |
| 0.35 | 0.63 | 6.07 | 3.85 | 12.18 | –7.70 | 2.07 | –1.12 |
| 0.36 | 0.65 | 4.92 | 4.06 | 12.39 | –6.25 | 2.06 | –1.13 |
| 0.28 | 0.70 | 1.89 | 3.94 | 12.27 | –2.57 | 2.13 | –1.06 |
| 0.21 | 0.75 | 1.67 | 4.49 | 12.82 | –2.09 | 2.10 | –1.09 |
| 0.15 | 0.80 | 0.95 | 4.05 | 12.38 | –1.29 | 2.13 | –1.06 |
| 0.17 | 0.82 | 1.16 | 4.44 | 12.77 | –1.47 | 2.10 | –1.09 |
| 0.14 | 0.85 | 0.87 | 3.90 | 12.23 | –1.10 | 2.10 | –1.09 |
| 0.11 | 0.90 | 0.53 | 4.22 | 12.55 | –0.70 | 2.12 | –1.07 |
Таблица 3.
Константы скорости редокс-распада комплекса ${{[{\text{CeOH(Pir)2}}]}^{{3 + }}}$ и его константы устойчивости, определенные методами ${{\dot {D}}^{0}},{{D}^{0}}$–pH (1) и ${{D}^{0}},{{\dot {D}}^{0}}$– pH (2) при cM = 4.0 × 10–3 моль/л, cL = 8.0 × 10–3 моль/л, I = 2, T = 289.15 K, $\dot {D}_{\infty }^{0} = 7.5 \times {{10}^{{ - 3}}}\,{{{\text{с }}}^{{ - 1}}},$ $D_{\infty }^{0} = 0.750,$ λef = 540 нм, l = 1 см
| 1. Метод ${{\dot {D}}^{0}},{{D}^{0}}$ – pH | |||||||
| ${{\dot {D}}^{0}} \times {{10}^{2}},$ с–1 | pH | $\bar {c}_{1}^{0} \times {{10}^{3}},$ моль/л | $\lg \bar {\beta }_{2}^{{{\text{ef}}}}$ | $\lg {{\bar {\beta }}_{2}}$ | 10ΔD0 | lg ε2 | $\lg {{\bar {k}}_{{n = 1}}}$ |
| –0.25 | 0.82 | 1.33 | 4.24 | 14.80 | 2.54 | 2.28 | –2.01 |
| –0.29 | 0.85 | 1.55 | 4.42 | 14.92 | 2.76 | 2.25 | –1.98 |
| –0.38 | 0.94 | 2.03 | 4.82 | 15.14 | 3.81 | 2.27 | –2.00 |
| –0.41 | 1.03 | 2.19 | 4.97 | 15.11 | 4.13 | 2.27 | –2.00 |
| –0.43 | 1.08 | 2.35 | 5.12 | 15.16 | 4.23 | 2.25 | –1.98 |
| –0.51 | 1.33 | 2.72 | 5.51 | 15.05 | 5.48 | 2.30 | –2.03 |
| –0.53 | 1.43 | 2.83 | 5.64 | 14.98 | 5.47 | 2.29 | –2.01 |
| –0.65 | 2.02 | 3.47 | 6.72 | 14.93 | 6.48 | 2.27 | –2.00 |
| Примечание. Величина $\lg {{\bar {\beta }}_{2}}$ = 15.01 ± 0.13, $\lg {{\bar {k}}_{{n = 1}}}$ = –2.00 ± 0.02. | |||||||
| 2. Метод ${{D}^{0}},{{\dot {D}}^{0}}$ – pH | |||||||
| 10ΔD0 | pH | $c_{2}^{0} \times {{10}^{4}},$ моль/л | $\lg \beta _{2}^{{{\text{ef}}}}$ | $\lg {{\beta }_{2}}$ | ${{\dot {D}}^{0}} \times {{10}^{2}}$, с–1 | $\lg k_{{n = 1}}^{{{\text{obs}}}}$ | $\lg k_{{n = 1}}^{{}}$ |
| 2.54 | 0.82 | 1.37 | 4.26 | 14.82 | –0.25 | 0.29 | –1.98 |
| 2.76 | 0.85 | 1.49 | 4.36 | 14.86 | –0.29 | 0.27 | –2.00 |
| 3.81 | 0.94 | 2.05 | 4.83 | 15.15 | –0.38 | 0.26 | –2.01 |
| 4.13 | 1.03 | 2.23 | 4.99 | 15.13 | –0.41 | 0.25 | –2.02 |
| 4.23 | 1.08 | 2.28 | 4.72 | 14.76 | –0.43 | 0.28 | –2.00 |
| 5.48 | 1.33 | 2.95 | 5.79 | 15.33 | –0.51 | 0.24 | –2.04 |
| 5.47 | 1.43 | 2.95 | 5.78 | 15.12 | –0.53 | 0.25 | –2.02 |
| 6.48 | 2.02 | 3.49 | 6.79 | 14.95 | –0.65 | 0.27 | –2.00 |
Рис. 1.
Корреляционная зависимость между значениями lg β1 комплексов катионов CeOH3+ (I = 2.0) и Fe3+ (I = 0.1) с анионами: 1 – ${\text{NO}}_{3}^{ - }$, 2 – ${\text{SO}}_{4}^{{2 - }}$, 3 – Acet– (уксусная), 4 – Mal2– (малоновая), 5 – Suc2– (янтарная), 6 – Glut2– (глутаровая) кислоты, 7 – Fer2– (феррон), 8 – Glu– (глицин), 9 – OxiN– (оксихинолин), 10 – Cit2– (лимонная кислота).
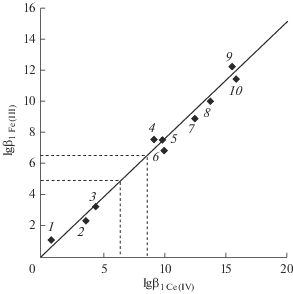
В работе [39] показано, что в системе железо(III)–амидопирин наряду с доминирующим бис-комплексом ${{[{\text{Fe}}{{({\text{Pir}})}_{2}}]}^{{3 + }}}$ образуется до 15% монокомплекса ${{[{\text{FePir}}]}^{{3 + }}}.$ Это позволяет предположить ненулевой выход ${{[{\text{CeOHPir}}]}^{{3 + }}}$ и в системе церий(IV)–амидопирин. Рассмотренная выше корреляция (рис. S4) дает возможность оценить значение константы устойчивости ${{[{\text{CeOHPir}}]}^{{3 + }}}{\text{:}}$ $\lg {{{\beta }}_{1}} \cong 8.63.$ Заметим, что введение в структуру амидопирина сульфогруппы, как и в случае оксина, понижает устойчивость комплексов церия(IV) и железа(III) со структурным аналогом амидопирина – анальгином (${\text{Anal}}$): $\lg {{{\beta }}_{1}} \cong 6.42$ для ${{[{\text{CeOHAnal}}]}^{{3 + }}}.$
Для нахождения констант скоростей внутримолекулярного редокс-распада комплексов, характеризующих их кинетическую устойчивость по отношению к редокс-распаду, анализ нелинейных зависимостей $ - {{\dot {D}}^{0}} = f\left( {{\text{pH}}} \right)\quad$ дополняли анализом зависимостей $ - {{\dot {D}}^{0}} = {\varphi }\left( {c_{n}^{0}} \right)$ вида $ - {{\dot {D}}^{0}} = A + k_{n}^{{{\text{obs}}}}{{\left( {c_{n}^{0}} \right)}^{{{{n}_{c}}}}},$ где ${{n}_{c}}$ – концентрационный порядок редокс-процесса по отношению к комплексу, $\lg k_{{n\quad = \quad1}}^{{{\text{obs}}}} = \lg ( - {{\dot {D}}^{0}}) - \lg c_{n}^{0}$ (приложение, рис. S4, линии 4 и 5). Нулевое значение интерсепта графиков свидетельствует о несущественности вклада бимолекулярного пути в наблюдаемый редокс-процесс. Линейность графиков зависимостей соответствует ${{n}_{c}} = 1$ и является признаком доминирования одного промежуточного комплекса в исследованных системах (${\text{In}}{{{\text{t}}}_{1}} = {\text{M}}{{{\text{R}}}_{n}},$ n = 1, 2). Константы скорости $\lg {{k}_{n}}$ первого концентрационного порядка по комплексу $({{k}_{{{{n}_{c}}\quad = \quad1}}} \equiv \quad{{k}_{{n{\;} = {\;}1}}})$ при использовании расширенных термодинамических (${{D}^{0}},\quad{{\dot {D}}^{0}}$–${\text{pH,}}$ ${{D}^{0}},{{\dot {D}}^{0}}$–${{{\text{N}}}_{{\text{L}}}}$) и кинетических (${{\dot {D}}^{0}},$ ${{D}^{0}}$–${\text{pH}}$) методов рассчитывали по формулам $\lg {{k}_{{n\quad = \quad1}}} = \lg k_{{n\quad = \quad1}}^{{{\text{obs}}}} - \lg (l{\varepsilon }_{n}^{{{\text{ex}}}}),$ $\lg {{\bar {k}}_{{n\quad = \quad1}}} = \lg {{\left( {k_{{n\quad = \quad1}}^{{{\text{obs}}}}} \right)}^{{{\text{ex}}}}} - \lg (l{{\bar {\varepsilon }}_{n}})$ (n = 1, 2), где ${\varepsilon }_{n}^{{{\text{ex}}}} = D_{\infty }^{0}{\text{/}}{{c}_{{\text{M}}}}$ (${{c}_{{\text{M}}}} \leqslant {{c}_{{\text{L}}}}$), ${{{\bar {\varepsilon }}}_{n}} = {{{{D}^{0}}} \mathord{\left/ {\vphantom {{{{D}^{0}}} {\bar {c}_{n}^{0}}}} \right. \kern-0em} {\bar {c}_{n}^{0}}},$ л/(моль см), – коэффициент экстинкции комплекса ${\text{M}}{{{\text{R}}}_{n}}$ (${{\varepsilon }_{{\text{M}}}} \approx {{\varepsilon }_{{\text{L}}}} \approx 0$), l, см, – толщина поглощающего слоя раствора [31]. Как видно из таблиц, $\lg {{k}_{{n\quad = \quad1}}}$ и $\lg {{\bar {k}}_{{n\quad = \quad1}}}$ сохраняют в сериях ${{\dot {D}}^{0}},{{D}^{0}}$–${\text{pH,}}$ ${{D}^{0}},{{\dot {D}}^{0}}$–${\text{pH}}$ постоянное значение. Полученные значения $\lg {{k}_{{n\quad = \quad1}}}$ и $\lg {{\bar {k}}_{{n\quad = \quad1}}}$ хорошо согласуются между собой. Так, например, для $[{\text{CeOH}}{{\left( {{\text{Pir}}{{)}_{2}}} \right]}^{{3 + }}}\quad\lg {{\bar {k}}_{{n\quad = \quad1}}}$ = = $ - 2.00 \pm 0.02,$ $\lg {{k}_{{n\quad = \quad1}}}$ = $ - 2.01 \pm 0.02.$
С использованием (2), (4) уравнение скорости, например в случае ${\text{R}} = {\text{Pir,}}$ может быть записано следующим образом:
(9)
$\begin{gathered} \quad - \frac{{\partial {{c}_{{\text{M}}}}}}{{\partial {\tau }}} \approx {{k}_{2}}\left[ {{\text{CeOH}}\left( {{\text{Pir}}} \right)_{2}^{{3 + }}} \right] = \\ = \,\,{{k}_{2}}{{{\beta }}_{2}}\left[ {{\text{CeO}}{{{\text{H}}}^{{3 + }}}} \right]{{\left[ {{\text{Pir}}} \right]}^{2}}. \\ \end{gathered} $С учетом комплексообразования церия(IV) с анионами фона и ступенчатого комплексообразования в системе ${\text{C}}{{{\text{e}}}^{{4 + }}}$–${\text{SO}}_{4}^{{2 - }}$–Pir уравнение приобретает вид:
(10)
$ - \frac{{\partial {{c}_{{\text{M}}}}}}{{\partial \tau }} = ({{k}_{1}}{{\beta }_{1}} + {{k}_{2}}{{\beta }_{2}}[{\text{Pir}}])[CeOH(S{{O}_{4}})_{3}^{{3 - }}][{\text{Pir}}].$Последнее уравнение может быть представлено в форме:
(11)
$\begin{gathered} - \frac{{\partial {{c}_{{\text{M}}}}}}{{\partial \tau }} = \left( {{{k}_{1}}{{\beta }_{1}} + {{k}_{2}}{{\beta }_{2}}\frac{{\left[ {{\text{HPi}}{{{\text{r}}}^{ + }}} \right]}}{{1 + {{B}_{1}}[H]}}} \right) \times \\ \times \,\,\frac{{{{\kappa }_{{1S{{O}_{4}}}}}{{\kappa }_{{2S{{O}_{4}}}}}{{\kappa }_{{3S{{O}_{4}}}}}{{\beta }_{{1h}}}{{K}_{w}}[{{H}_{2}}O]}}{{(1 + {{B}_{1}}[H])[H]}} \times \\ \times \,\,{{\left( {\frac{{{{c}_{{S{{O}_{4}}}}}}}{{1 + {{B}_{{1S{{O}_{4}}}}}[H]}}} \right)}^{3}}\left[ {C{{e}^{{4 + }}}} \right]\left[ {H{\text{Pi}}{{{\text{r}}}^{ + }}} \right], \\ \end{gathered} $(12)
${{{\text{H}}}_{2}}{\text{O}}\overset {{{K}_{w}}} \longleftrightarrow {{{\text{H}}}^{ + }} + {\text{O}}{{{\text{H}}}^{ - }}{\;},$(13)
${\text{SO}}_{4}^{{2 - }} + {{{\text{H}}}^{ + }}\overset {{{B}_{{1{\text{S}}{{{\text{O}}}_{4}}}}}} \longleftrightarrow {\text{HSO}}_{4}^{ - },{\;}$(14)
${Pir\;} + {\;}{{{\text{H}}}^{{ + {\;}}}}\overset {{{B}_{1}}} \longleftrightarrow {\text{HPi}}{{{\text{r}}}^{ + }},{\;}$(15)
${\text{C}}{{{\text{e}}}^{{4 + }}} + {\text{SO}}_{4}^{{2 - }}\overset {{{\kappa }_{{1{\text{S}}{{{\text{O}}}_{4}}}}}} \longleftrightarrow {\text{CeSO}}_{4}^{{2 + }}{\;},$(16)
${\text{CeSO}}_{4}^{{2 + }} + {\text{SO}}_{4}^{{2 - {\;}}}\overset {{{\kappa }_{{2{\text{S}}{{{\text{O}}}_{4}}}}}} \longleftrightarrow {\text{Ce}}{{({\text{S}}{{{\text{O}}}_{4}})}_{2}},$(17)
${\text{Ce}}{{({\text{S}}{{{\text{O}}}_{4}})}_{2}}{\;} + {\text{SO}}_{4}^{{2 - }}\overset {{{\kappa }_{{3{\text{S}}{{{\text{O}}}_{4}}}}}} \longleftrightarrow {\text{Ce}}({\text{S}}{{{\text{O}}}_{4}})_{3}^{{2 - }},$(18)
${\text{Ce}}({\text{S}}{{{\text{O}}}_{4}})_{3}^{{2 - }} + {\text{O}}{{{\text{H}}}^{ - }}\overset {{{{\beta }}_{{1h}}}} \longleftrightarrow {\text{CeOH}}({\text{S}}{{{\text{O}}}_{4}})_{3}^{{3 - }},$(19)
${\text{CeOH}}({\text{S}}{{{\text{O}}}_{4}})_{3}^{{3 - }}{\;} + {\;Pir}\overset {{{{\beta }}_{1}}} \longleftrightarrow \quad{\text{CeOH}}{{({\text{S}}{{{\text{O}}}_{4}})}_{3}}{\text{Pi}}{{{\text{r}}}^{{3 - }}},$(20)
$\begin{gathered} {\text{CeOH}}{{({\text{S}}{{{\text{O}}}_{4}})}_{3}}{\text{Pi}}{{{\text{r}}}^{{3 - }}}\xrightarrow{{{{k}_{1}}}} \\ \to \,\,{\text{Ce}}({\text{S}}{{{\text{O}}}_{4}})_{2}^{ - }{\;} + {\text{П р о д у к т ы ,}} \\ \end{gathered} $(21)
$\begin{gathered} {\text{CeOH}}({\text{S}}{{{\text{O}}}_{4}})_{3}^{{3 - }} + 2{\text{Pir}}\overset {{{{\beta }}_{2}}} \longleftrightarrow \quad \\ \leftrightarrow \,\,{\text{CeOH}}{{({\text{S}}{{{\text{O}}}_{4}})}_{3}}\left( {{\text{Pir}}} \right)_{2}^{{3 - }}, \\ \end{gathered} $(22)
$\begin{gathered} {\text{CeOH}}{{({\text{S}}{{{\text{O}}}_{4}})}_{3}}\left( {{\text{Pir}}} \right)_{2}^{{3 - }}\xrightarrow{{{{k}_{2}}}} \\ \to \,\,{\text{Ce}}({\text{S}}{{{\text{O}}}_{4}})_{2}^{ - }{\;} + {\text{П р о д у к т ы }}{\text{.}} \\ \end{gathered} $Продуктом окисления амидопирина церием(IV) является диоксиамидопирин, образованию которого соответствует редокс-эквивалент церия(IV) по ${Pir\;}E{{q}_{{{\text{Ce}}({\text{IV}})}}} \approx 4$ [28]. Промежуточным продуктам окисления молекул ${\text{R}} = {{{\text{H}}}_{2}}{\text{Fer}}$ и ${\text{HOxiN}}$ отвечают $E{{q}_{{{\text{Ce}}({\text{IV}})}}} = 2$ (1 – ${{N}_{{\text{L}}}}$ = 0.67) и $E{{q}_{{{\text{Ce}}({\text{IV}})}}} = 4$ (1 – ${{N}_{{\text{L}}}}$ = 0.80) соответственно (приложение, рис. S5, кривые 1, 2). Первым продуктом окисления ${\text{HOxiN}}$ является соединение хиноидной структуры, конечным продуктом – хинолиновая кислота, $E{{q}_{{{\text{Ce}}({\text{IV}})}}} = 13$ (${{c}_{{\text{L}}}} = 1.75 \times {{10}^{{ - 5}}}$ моль/л; рис. S5, кривая 3):
(23)
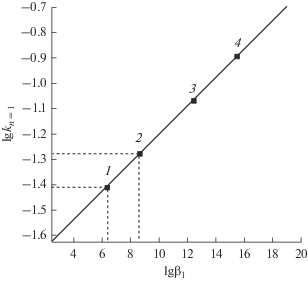
$\begin{gathered} {\text{R}} + 4{\text{C}}{{{\text{e}}}^{{4 + }}}\overset { - 2{\text{e}}} \longleftrightarrow {\text{R**}} + 2{\text{C}}{{{\text{e}}}^{{3 + }}} + \\ + \,\,2{\text{C}}{{{\text{e}}}^{{4 + }}}\overset { - 2{\text{e}}} \longleftrightarrow {\text{R****}} + 4{\text{C}}{{{\text{e}}}^{{3 + }}}{\;} \\ \end{gathered} $Значение $\lg {{k}_{1}}$ для комплекса ${{[{\text{CeOHPir}}]}^{{3 + }}}$ в модели (12)–(22) может быть предварительно оценено по линейной корреляционной зависимости (рис. 2):
(24)
${\text{lg}}\quad{{k}_{{n\quad = \quad1}}} = \quad\lg k_{{n\quad = \quad1}}^{0} + {\rho }\lg {{{\beta }}_{1}}{\text{,}}$Рис. 2.
Зависимость lg kn = 1 от lg β1 для комплексов ${{[{\text{CeOHAnal}}]}^{{3 + }}}$ (1), ${{[{\text{CeOHPir}}]}^{{3 + }}}$ (2), ${{\left[ {{\text{CeOHFer}}} \right]}^{ + }}$ (3), ${{\left[ {{\text{CeOHOxiN}}} \right]}^{{2 + }}}$ (4) при I = 2, T = 289.15 K.
В отличие от комплексов церия(IV) c алифатическими органическими лигандами, координированными через атомы кислорода (дикарбоновыми, оксикарбоновыми кислотами, многоатомными спиртами), для которых характерны преимущественно ионный тип связи и обратная линейная корреляция между ${\text{lg}}\quad{{k}_{{n\quad = \quad1}}}$ и $\lg {{{\beta }}_{1}}$:
(25)
${\text{lg}}\quad{{k}_{{n\quad = \quad1}}} = \quad\lg k_{{n{\;} = {\;}1}}^{0} - {\rho }\lg {{{\beta }}_{1}}{\;}$В координационной химии корреляционные уравнения типа (24), (25) могут быть применены для описания реакций окисления органических соединений ионами переходных металлов. Изучение данных корреляционных зависимостей в координационной химии находится в начальной стадии и заслуживает дальнейших исследований.
Список литературы
Крыльский Д.В., Сливкин А.И. Гетероциклические лекарственные вещества. Воронеж: Изд-во Воронежского гос. ун-та, 2007.
Солодунова Г.Н., Озеров А.А. Фармацевтическая химия. Ч. V. Волгоград: Изд-во ВолгГМУ, 2017.
Яцимирский К.Б., Костромина Н.А., Шека З.А. и др. Химия комплексных соединений редкоземельных элементов. Киев: Наукова думка, 1966.
Oliveri V., Vecchio G. // Eur. J. Med. Chem. 2016. V. 120. P. 252. doi 10.1016/j.ejmech.2016.05.007
Suwanjang W., Prachayasittikul S., Prachayasittikul V. // PeerJ. 2016. V. 4. P. e2389. doi 10.7717/peerj.2389
Dalecki A.G.D., Crawford C.L., Wolschendorf F. // Advances in Microbial Physiology / Ed. Poole R. Elsevier Ltd, 2017. V. 70. P. 193. doi 10.1016/bs.ampbs.2017.01.007
Kuhlmann F.M., Fleckenstein J.M. // Infectious Diseases. V. 2. / Eds. Cohen G., Powderly W.G., Opal S.M. Elsevier Ltd, 2017. P. 1345. doi 10.1016/B978-0-7020-6285-8.00273-2
Kubanik M., Lam N.Y.S., Holtkamp H.U. et al. // Chem. Commun. 2018. V. 54. P. 992. doi 10.1039/ c7cc09478g
Bayrak N. // Chem. Cent. J. 2018. V. 12. P. 21. doi 10.1186/s13065-018-0388-3
Novais J.S., Campos V.R., Silva A.C.J.A. et al. // RSC Adv. 2017. V. 7. № 30. P. 18311. doi 10.1039/ C7RA00825B
Kubanik M., Kandioller W., Kim K. et al. // J. Chem. Soc., Dalton Trans. 2016. V. 45. P. 13091. doi 10.1039/C6DT01110A
Ling Y., Yang Q.-X., Teng Y.-N. et al. // Eur. J. Med. Chem. 2018. In press. doi 10.1016/j.ejmech.2018.05.025
Bayrak N., Yildirim H., Tuyun A.F. et al. // J. Chem. Soc. Pak. 2016. V. 38. № 6. P. 1211.
Gawne P., Man F., Fonslet J. et al. // J. Chem. Soc., Dalton Trans. 2018. In press. doi 10.1039/c8dt00100f
Jensen A.I., Severin G.W., Hansen A.E. et al. // J. Controlled Release. 2018. V. 269. P. 100. doi 10.1016/j.jconrel.2017.11.006
Obot I.B., Ankah N.K., Sorour A.A. et al. // Sustainable Materials and Technologies. 2017. V. 14. P. 1. doi 10.1016/j.susmat.2017.09.001
Антонова Е.В. Дис. … канд. хим. наук. Саранск: Изд-во МордГУ, 2010. 148 с.
Колоколов Ф.А., Панюшкин В.Т., Михайлов И.Е. и др. // Наука Юга России (Вестник Южного Научного Центра). 2016. Т. 12. № 4. С. 25.
Soroka K., Vithanage R.S., Phillips D.A. et al. // Anal. Chem. 1967. V. 59. P. 629.
Petrova O.B., Anurova M. O., Akkuzina A.A. // Opt. Mater. 2017. V. 69. P. 141. http://dx.doi.org/10.1016/ j.optmat.2017.04.014.
Cerium: Molecular Structure, Technological Applications and Health Effects / Eds. Izyumov A., Plaksin G. N.Y.: Nova Science Publishers, Inc., 2013.
Марченко З. Фотометрическое определение элементов. М.: Мир, 1970.
Kolthof I. et al. Volumetric Analysis. N.Y.: Interscience, 1957.
Коренман И.М., Туманов А.А., Сорокина В.М. // Изв. Вузов СССР. 1960. Т. III. С. 580.
Канаев H.A. // Журн. аналит. химии. 1963. Т. 18. № 5. С. 575.
Каткова О.В. Дис. … канд. хим. наук. Кемерово: Изд-во КузГТУ, 2005.
Шемякин Ф.М., Карпов А.Н., Бруснецов А.Н. Аналитическая химия. М.: Высшая школа, 1973.
Черкасов В.М., Петрова В.А. // Журн. аналит. химии. 1950. Т. 5. № 5. С. 305.
Voskresenskaya O.O., Naprienko E.N., Skorik N.A. // Russ. J. Inorg. Chem. 1999. V. 44. № 9. P. 1428. [Воскресенская O.O., Наприенко E.H., Скорик H.A. // Журн. неорган. химии. 1999. Т. 44. № 9. С. 1507.]
Tandon P.K., Khanam S.Z., Singh S.B. // Open Catal. J. 2012. V. 5. P. 1.
Воскресенская O.О., Скорик Н.А. Термодинамические и кинетические аспекты образования и редокс-распада комплексов церия(IV) с рядом гидроксилсодержащих органических соединений. Томск: НТЛ, 2011. 220 с.
Näsänen R., Lumme P., Mukula A.-L. // Acta Chem. Scand. 1951. V. 5. P. 1199.
Näsänen R., Ekman A. // Acta Chem. Scand. 1952. V. 6. P. 1384.
Langmyhr F.G., Storm Å.R. // Acta Chem. Scand. 1961. V. 7. P. 1465.
Мишукова Т.Г., Карева Е.Ю., Кунавина Е.А. // Современные научные исследования и инновации. 2016. № 10. http://web.snauka.ru/issues/2016/10/72821
Amolegbe S.A., Adewuyi Sh., Akinremi C.A. et al. // Arab. J. Chem. 2015. V. 8. P. 542. doi 10.1016/j.arabjc.2014.11.040
Barilli A., Atzeri C., Bassanetti I. et al. // Mol. Pharmacol. 2014. V. 11. № 4. P. 1151. doi 10.1021/mp400592n
Ramos M.L., Justino L.L.G., Barata R. et al. // J. Chem. Soc., Dalton Trans. 2017. V. 46. P. 9358. doi 10.1039/C7DT01324H
Наприенко Е.Н. Дис. … канд. хим. наук. Томск: Изд-во ТГУ, 2001.
Скорик Н.А., Чернов Е.Б. Расчеты с использованием персональных компьютеров в химии комплексных соединений. Томск: Изд-во ТГУ, 2009.
Voskresenskaya O.O., Skorik N.A., Stepanova N.V. // Russ. J. Appl. Chem. 2016. V. 89. № 11. P. 1747. doi 10.1134/S1070427216110033 [Воскресенская O.O., Скорик H.A., Степанова Н.В. // Журн. прикл. химии. 2016. Т. 89. № 11. С. 1375.]
Voskresenskaya O.O., Skorik N.A., Yuzhakova Yu.V. // Russ. J. Phys. Chem. (A) 2017. V. 91. № 4. P. 627. doi 10.1134/S0036024417040318 [Воскресенская O.O., Скорик H.A., Южакова Ю.В. // Журн. физ. химии. 2017. Т. 91. № 4. С. 601.]
Voskresenskaya O.O., Skorik N.A., Yuzhakova Yu.V. // Russ. J. Gen. Chem. 2018. V. 88. № 4. P. 721. doi 10.1134/S1070363218040163 [Воскресенская O.O., Скорик H.A., Южакова Ю.В. // Журн. общ. химии. 2018. Т. 88. № 4. С. 640.]
Sillen L.G., Martell A. Stability Constants of Metal-Ion Complexes. London: Chemical Society, Burlington House, 1964.
Martell A.E., Smith R.M. Critical Stability Constants. V. 4. New York: Springer Science, 1977.
Бусев А.И. Аналитическая химия молибдена. М.: Изд-во АН СССР, 1962.
Агрономов А.Е. Избранные главы органической химии. М.: Химия, 1990.
Андреев В.П., Соболев П.С. Молекулярные комплексы металлопорфиринов как модельная система исследования донорно-акцепторных взаимодействий n,v-типа. Петрозаводск: Изд-во ПетрГУ, 2015.
Координационная химия редкоземельных элементов / Под ред. Спицына В.И., Мартыненко Л.И. М.: Изд-во Моск. ун-та, 1974.
Kiselev Yu.M. // Russ. J. Inorg. Chem. 2002. V. 47. № 4. P. 473. [Киселев Ю.М. // Журн. неорган. химии. 2002. Т. 47. № 4. С. 540.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии