Журнал неорганической химии, 2019, T. 64, № 5, стр. 500-509
Теоретическое моделирование структуры и стабильности комплексов икосаэдрического иона ${\text{Al}}_{{{\text{13}}}}^{ - }$ с молекулами борана и алана
О. П. Чаркин *
Институт проблем химической физики РАН
142432 Черноголовка, Московской обл., пр-т Академика Семенова, 1, Россия
* E-mail: charkin@icp ac.ru
Поступила в редакцию 24.09.2018
После доработки 11.10.2018
Принята к публикации 22.10.2018
Аннотация
В рамках метода функционала плотности (МФП/DFT) выполнены расчеты структурных, энергетических и спектроскопических характеристик комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$ и ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$ с центрированным икосаэдрическим алюминиевым кластером ${\text{Al}}_{3}^{ - }$, последовательно “сольватированным” молекулами борана и алана с n = 1−16. Согласно расчетам, в первой половине борановой серии ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$ молекулы ВН3 координируются к ребрам каркаса Al13 и связываются с ними двумя связями B−Al и водородным мостиком B−Hb−Al. По мере увеличения числа лигандов n в поверхностной области комплексов появляются мостики B−Hb−В' между лигандами с образованием биядерных фрагментов В2Нm c m = 3−5. Предсказана энергетическая стабильность борановых комплексов к распаду с отрывом молекулы диборана и возможность их существования в изолированном состоянии. У начальных членов алановой серии ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$ лиганды также связываются с каркасом двумя связями Al −Al' и водородным мостиком, а с увеличением n для них еще более, чем для боранов, характерно образование Н-мостиков между лигандами и биядерных поверхностных фрагментов Al2Hm. При n > 10 внутренний каркас сильно деформируется и раскрывается, а в конце серии он меняет свой состав за счет перехода нескольких атомов Al в поверхностную область. Алановые комплексы связаны слабее борановых, однако для систем второй половине серии ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$ расчеты предсказывают ощутимую стабильность к распаду с отрывом молекулы диалана. Прослеживаются тенденции в изменениях структурных и энергетических характеристик комплексов при увеличении n. Результаты представляют интерес для моделирования структуры и стабильности более сложных наноразмерных алюмоборогидридов и алюмогидридов с высоким содержанием водорода
ВВЕДЕНИЕ
Поиск новых гидридов алюминия и их производных с высоким содержанием водорода остается важной проблемой современной химии из-за перспектив их возможного использования в качестве эффективных накопителей водорода, источников водорода для топливных элементов, восстанавливающих агентов и т.д. [1–7]. Благодаря развитию методов молекулярных пучков, масс-спектрометрии, фотоэлектронной спектроскопии, колебательной спектроскопии в инертных матрицах и др. [8–15] в сочетании с использованием квантово-химических расчетных методов [16–19] было обнаружено более двухсот новых изолированных кластеров и молекулярных ионов гидридов алюминия различного состава и рассчитаны их молекулярные характеристики. Эти результаты существенно обогащают (и будут далее расширять) представления о структурной химии и стабильности этого класса соединений в газовой фазе.
Одно из перспективных направлений связано с поиском и исследованиями полиатомных алюминиевых кластеров Aln и их “покрытых” производных AlnRm, в которых внутренний каркас Aln выполняет роль “суператома”, а его поверхность покрыта объемными лигандами R-типа, защищающими кластеры от “слипания” и препятствующими их ассоциации в более крупные частицы. “Покрытые” кластеры могут служить строительными блоками для кластерной сборки более сложных систем с различными полезными свойствами, зависящими от размеров каркаса Aln и характера объемных лигандов R [20]. В работах [21, 22] синтезированы и исследованы структуры “покрытых” алюминиевых кластеров AlnRm (n = 7, 12, 14, 18, 20, 69 и 77; R = N(SiMe3)2) и, в частности, показано, что кластерам стехиометрического состава Al22X20 ⋅ 12L (X = Cl и Br; L = THP тетрагидрофуран) отвечает равновесная структура Al12(AlX2THP)10(THP)2 c правильным полым икосаэдром Al12, окруженным десятью замещенными алановыми группами AlX2THP.
В работе [23] в рамках приближения теории функционала плотности (ТФП/DFT) выполнены расчеты двух серий “покрытых” кластеров формального состава ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{{\text{12}}}}^{{{\text{2}}--}}{{({\text{B}}{{{\text{H}}}_{{\text{3}}}})}_{n}}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{{\text{12}}}}^{{{\text{2}}--}}{{({\text{Al}}{{{\text{H}}}_{{\text{3}}}})}_{n}},$ в которых дианион ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{{\text{12}}}}^{{{\text{2}}--}}$ последовательно сольватирован молекулами борана и алана с числом n, варьирующим в интервале от 1 до 12. Согласно расчетам, молекулы ВН3 и AlH3 при координации к ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{{\text{12}}}}^{{{\text{2}}--}}$ трансформируются в бидентатные тетрагидроборатные и монодентатные тетрагидроаланатные группы ВН4 и AlH4, а равновесные структуры этих комплексов адекватно описываются формулами ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{{\text{12}} - n}}^{{}}({\text{B}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{Al}}{{{\text{H}}}_{{\text{4}}}})_{{n{\text{i}}}}^{{{\text{2}}--}}$ соответственно с внутренним полым икосаэдром Al12, частично или полностью закрытым лигандами ВН4 или AlH4. В [23] предсказано, что боратные комплексы ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{B}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$ энергетически стабильны к распаду с отрывом молекул диборана В2Н6 во всем интервале изменения n = 1−12 и могут существовать в условиях обычных или умеренно пониженных температур или в инертных матрицах. Высказано предположение, что координационно-насыщенный анион ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}({\text{B}}{{{\text{H}}}_{{\text{4}}}})_{{{\text{12}}}}^{{{\text{2}}--}}$ в составе его солей с щелочными металлами может представлять интерес в качестве строительного блока для кластерной сборки более крупных наноразмерных частиц. Аланаты ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{Al}}{{{\text{H}}}_{{\text{4}}}})_{{n{\text{i}}}}^{{{\text{2}}--}}$ менее стабильны, чем их боратные аналоги, но несколько начальных членов аланатной серии тоже могут считаться энергетически стабильными к отрыву молекул диалана Al2H6.
Настоящее исследование является продолжением работы [23] и посвящено аналогичным DFT-расчетам двух серий комплексных анионов состава ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ и ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ с центрированным икосаэдрическим анионом ${\text{Al}}_{{{\text{13}}}}^{ - },$ поверхность которого последовательно “сольватирована” молекулами борана и алана с числом n, варьируемым в интервале 1−17. Как и в [23], целью исследования (помимо расчетов равновесных геометрических структур и частот нормальных колебаний этих комплексов; оценки энергий последовательного присоединения молекул BH3 и AlH3 к аниону ${\text{Al}}_{{{\text{13}}}}^{ - };$ оценки энергетической стабильности комплексов к распаду с отщеплением молекул диборана и диалана и возможности их существования в изолированном состоянии) является анализ тенденций поведения структурных и энергетических характеристик при увеличении числа лигандов n. У рассматриваемых систем эти тенденции должны существенно отличаться от тенденций, найденных в [23] для дианионов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{{\text{12}} - n}}^{{{\text{2}}--}}({\text{B}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{Al}}{{{\text{H}}}_{{\text{4}}}})_{{n{\text{i}}}}^{{{\text{2}}--}}.$ У последних комплексов каркас Al12 при всех своих деформациях сохраняет клозо-структуру замкнутого икосаэдра, а лиганды BH4 и AlH4 – тетраэдрическую структуру и способы координации во всем интервале n = 1−12. Как показано ниже, у анионов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ и ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ увеличение n сопровождается образованием водородных мостиков между лигандами и появлением на поверхности каркаса биядерных гидридных фрагментов типа В2Нm и Al2Hm. При больших n каркас Al13 раскрывается и теряет икосаэдрическую форму с одновременным изменением состава за счет выхода нескольких атомов в поверхностную область. Знание этих тенденций может быть полезным при моделировании образования и поведения биядерных алюмогидридных фрагментов типа Al2Hm на поверхности более крупных гидрированных алюминиевых наночастиц.
Как и в [23], оптимизация геометрии изомеров и расчеты частот нормальных колебаний выполнены с использованием программы GAUSSIAN-9 [24] в рамках приближения B3LYP [25, 26] со стандартным базисом 6-31G*, а энергетические характеристики уточнены с расширенным базисом 6-311+G*. Ранее [23, 24] на примере нескольких десятков молекул и ионов боратных и аланатных солей легких металлов было показано, что это приближение неплохо (в пределах нескольких ккал/моль) воспроизводит энергетические характеристики, рассчитанные параллельно в рамках более точного приближения связанных кластеров CCSD(T)/6-311+G*. Как и в предыдущих работах [27, 28], мы фокусируемся не столько на абсолютных значениях рассчитанных характеристик, сколько на их относительных изменениях и тенденциях поведения в рядах родственных соединений. Поскольку все члены каждого ряда рассчитываются в рамках одного и того же приближения, точность расчетов для относительных величин должна быть выше, чем для абсолютных значений.
Каждому из обсуждаемых комплексов, так же как и для комплексов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{B}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{Al}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}},$ рассмотренных в [23], может отвечать большое число альтернативных изомеров с различным расположением внешнесферных лигандов. Систематическое исследование множества перестановочных изомеров выходит за рамки настоящего сообщения, и мы ограничились оптимизацией нескольких (5−6) низколежащих структур для каждого значения n и выборкой из них наиболее предпочтительного изомера, которому отвечает самая низкая полная энергия. На рис. 1 изображены равновесные структуры предпочтительных изомеров борановых комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - },$ а в табл. 1 даны рассчитанные энергии их распада, а также наиболее интересные геометрические и колебательные характеристики. На рис. 2 и в табл. 2 приведены структуры и характеристики предпочтительных изомеров алановых аналогов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }.$ Все структуры на рис. 1 и 2 отвечают локальным минимумам поверхности потенциальной энергии (ППЭ), все их колебательные частоты действительны.
Рис. 1.
Структуры предпочтительных изомеров борановых комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }.$
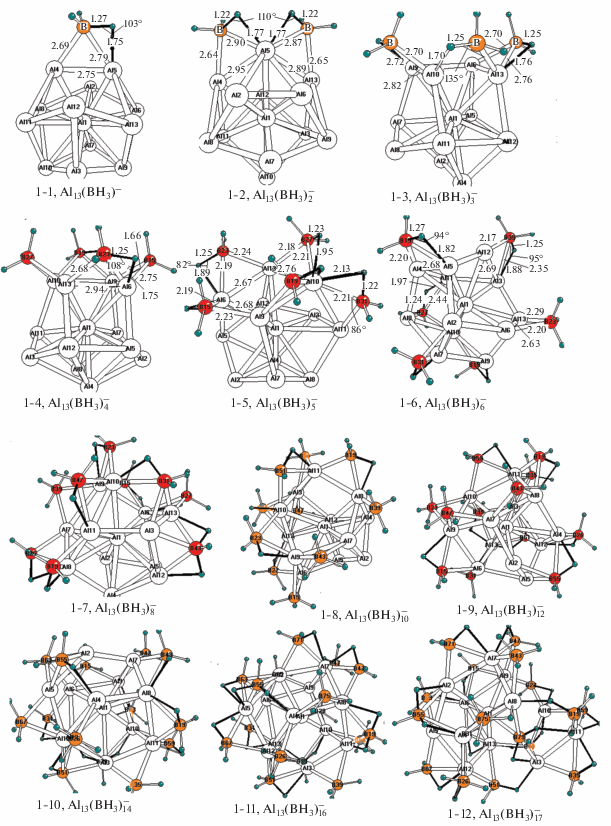
Таблица 1.
Рассчитанные характеристики боратных комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$
| ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{n}^{-}$ | E(nBH3) | E(2BH3) | R1(AlAl) | R2(AlB) | R3(BHb) | R4(AlHb) | φ | ν1(BHb | ν2(AlHb | ν3(B(Ht)2 |
|---|---|---|---|---|---|---|---|---|---|---|
| 1-1, Al13(BH3)− | 17 | 2.58 | 2.30 | 1.26 | 1.93 | 89 | 2132 | 1207 | 434 | |
| 1-2, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{2}^{-}$ | 38 | 38 | 2.62 | 2.25 | 1.25 | 1.91 | 88 | 2185–2251 | 1215–1224 | 409–426 |
| 1-3, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{3}^{-}$ | 61 | 44 | 2.62–2.68 | 2.21–2.27 | 1.24–1.26 | 1.90–1.98 | 73–75 | 2.175–2298 | 1169–1222 | 439–472 |
| 1-4, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{4}^{-}$ | 91 | 53 | 2.70 | 2.20 | 1.21 | 1.94 | 85 | 2171–2296 | 1192–1245 | 432–483 |
| 1-5, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{5}^{-}$ | 112 | 51 | 2.59–2.73 | 2.20–2.35 | 2.24–2.26 | 1.95–1.97 | 73–77 | 2070–2271 | 1204–1256 | 453–484 |
| 1-6, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{6}^{-}$ | 136 | 46 | 2.55–2.95 | 2.15–2.26 | 1.23–1.25 | 1.99–1.98 | 75–85 | 2122–2385 | 1136−1258 | 451−500 |
| 1-7, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{8}^{-}$ | 192 | 56 | 2.55–2.80 | 2.15–2.29 | 1.23–1.26 | 1.87–2.10 | 75–86 | 2122–2492 | 1162–1247 | 456–480 |
| 1-8 ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{10}}^{-}$ | 268 | 77 | 2.55–2.75 | 2.11–2.27 | 1.21–1.24 | 1.87–2.25 | 74–78 | 2264–2495 | 1165–1244 | 456–476 |
| 1-9, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{12}}^{-}$ | 314 | 46 | 2.55–2.75 | 2.10–2.25 | 1.20–1.22 | 1.90–2.25 | 71–78 | 2236–2495 | 1169–1247 | 430–475 |
| 1-10, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{14}}^{-}$ | 367 | 53 | 2.55–3.20 | 2.10–2.25 | 1.20–1.25 | 1.95–2.37 | 72–78 | 2241–2461 | 1172–1266 | 425–453 |
| 1-11, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{16}}^{-}$ | 427 | 427 | 2.55–3.05 | 2.10–2.25 | 1.20–1.25 | 2.00–2.60 | 75–85 | |||
| 1-12, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{17}}^{-}$ | 391 | 391 | 2.55–3.55 | 2.10–2.60 | 1.20–1.25 | 77–104 | 2046–2386 | 1200–1315 | 450–480 |
Примечание..Энергии Е, межъядерные расстояния R и валентный угол φ = φ(BHbA) выражены в ккал/моль, ангстремах и градусах соответственно. Обозначения: E(nBH3) и E(2BH3) − энергии отрыва всех (n) и двух молекул ВН3 от комплекса ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}.$ Расстояния R1(AlAl), R2(AlB), R3(AlHb) и R4(BHb) отвечают связям между атомами Al, B и мостиковым атомом Hb. Частоты колебаний ν1(BHb), ν2(AlHb) и ν3(BH)2 соответствуют валентным колебаниям мостиковых фрагментов BHb и AlHb и терминального фрагмента B(Ht)2 соответственно. Для геометрических параметров и частот ν приведены интервалы между их минимальными и максимальными значениями. Оптимизированные структуры 1-1−1-12 борановых комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$ изображены на рис. 1.
Рис. 2.
Структуры предпочтительных изомеров алановых комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }.$
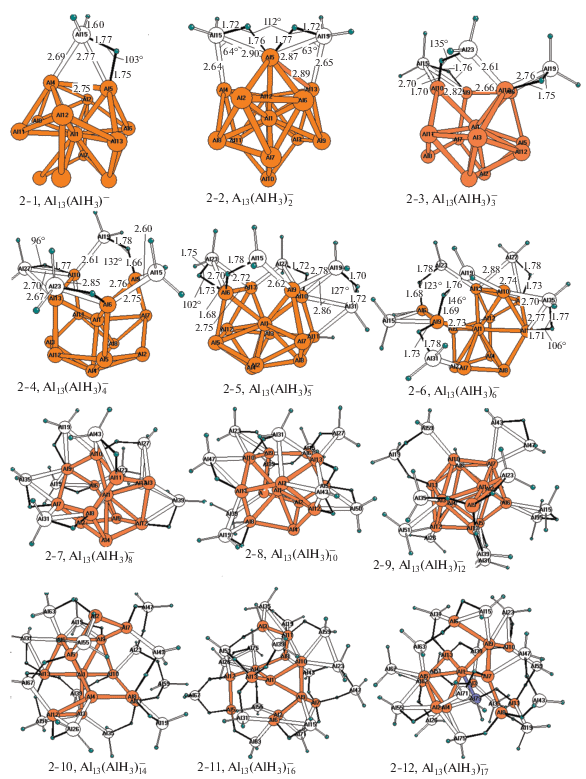
Таблица 2.
Рассчитанные характеристики алановых комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$
| ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{-}$ | E(nAlH3) | R1(AlAl) | R2(AlAl)′ | R3(AlHb) | R4(Al′Hb) | φ | ν||(AlHbAl′) | ν⊥(Al′HbAl′) | ν(AlAl′) |
|---|---|---|---|---|---|---|---|---|---|
| 2-1, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}{{({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})}^{-}}$ | 19 | 2.75 | 2.69 | 1.77 | 1.75 | 105 | 1326 | 1175 | 355 |
| 2-2, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{2}^{-}$ | 35 | 2.87–2.90 | 2.64–2.90 | 1.72 | 1.77 | 110 112 |
1417 1633 |
1107 1167 |
355 |
| 2-3, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{3}^{-}$ | 47 | 2.80 3.74 |
2.63 3.17 |
1.72 1.77 |
1.67 1.78 |
102 134 |
1378 1760 |
944 1234 |
389 394 |
| 2-4, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{4}^{-}$ | 64 | 2.75 2.95 |
2.65 2.85 |
1.73 1.78 |
1.74 1.78 |
108 132 |
1395 1768 |
979 1269 |
∼370 |
| 2-5, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{5}^{-}$ | 85 | 2.64 2.92 |
2.60 2.90 |
1.74 1.77 |
1.78 | 112 | 1410 1757 |
991 1253 |
∼380 |
| 2-6, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{6}^{-}$ | 107 | ∼2.78 | 2.60 2.92 |
∼1.78 | 1.71 1.78 |
95 120 |
1395 1775 |
835 1242 |
∼410 |
| 2-7, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{8}^{-}$ | 140 | 2.65 2.78 |
2.61 2.82 |
1.72 1.77 |
1.71 1.75 |
101 132 |
1324 1745 |
949 1218 |
∼390 |
| 2-8, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{10}}^{-}$ | 186 | 2.55 2.73 |
2.61 2.78 |
1.66 1.78 |
1.65 1.75 |
101 132 |
1403 1765 |
890 1248 |
∼375 |
| 2-9, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{12}}^{-}$ | 250 | 2.60 2.71 |
2.60 2.76 |
1.67 1.82 |
1.66 1.78 |
98 150 |
1423 1791 |
805 1315 |
∼403 |
| 2-10, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{14}}^{-}$ | 270 | 2.60 2.70 |
2.60 2.74 |
1.70 1.76 |
1.70 1.75 |
100 164 |
1484 1810 |
750 1470 |
∼390 |
| 2-11, ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{16}}^{-}$ | 300 | 2.61 2.76 |
2.66 2.78 |
1.73 1.82 |
1.70 1.86 |
116 166 |
1445 1850 |
771 1256 |
∼400 |
Примечание.Энергии Е, межъядерные расстояния R и валентный угол φ = φ(AlHbAl') выражены в ккал/моль, ангстремах и градусах соответственно. E(nAlH3) − энергия распада комплекса Al13(Al'H3)n с отрывом всех (n) молекул AlН3. Расстояния R1(AlAl), R2(AlAl'), R3(AlHb) и R4(Al'Hb) характеризуют связи между атомами Al, Al' и мостиковым атомом Hb. Частоты ν||(AlHbAl') и ν⊥(AlHbAl') отвечают валентным колебаниям мостиков AlHbAl' со смещениями атома Hb вдоль и перпендикулярно линии Al−Al', а частота ν(AlAl') – колебаниям связей Al−Al' в координированных внешних фрагментах Al−Al'Н2 и 2Al−Al'Н2 соответственно. Для геометрических параметров и колебательных частот приведены интервалы между их минимальными и максимальными значениями. В случае частот эти величины имеют приближенный характер из-за смешанного характера колебаний. Оптимизированные структуры 2-1−2-11 предпочтительных изомеров алановых комплексов изображены на рис. 2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Борановые комплексы ${\mathbf{A}}{{{\mathbf{l}}}_{{{\mathbf{13}}}}}{\mathbf{(B}}{{{\mathbf{H}}}_{{\mathbf{3}}}}{\mathbf{)}}_{n}^{ - }.$ Согласно расчетам, у структур 1-1−1-12 боранового семейства (рис. 1) внешнесферные лиганды ВН3 чаще всего координируются к ребрам алюминиевого каркаса Al13 и образуют группы Al2BH3 c трехчленными циклами BAl2, в которых расстояния R(BAl) и R(AlAl) варьируют в интервалах ∼2.10−2.30 и ∼2.60−2.70 Å. Каждый атом бора, помимо пары связей B−Аl, связывается с одним из атомов Al асимметричным водородным мостиком В−Нb−Al c длинами фрагментов R(BHb) ∼ ~ 1.24−1.28 и R(HbAl) ∼ 1.80−1.95 Å и валентным углом φ(BHbAl) ∼80°−90°. Две терминальные связи B−Ht борановых групп сохраняют стандартные значения R(BHt) ∼ 1.19−1.20 Å. Параметры циклов BAl2 и мостиков В−Нb−Al зависят от числа n координированных групп ВН3 и деформаций соседней области каркаса Al13 и, как правило, варьируют в вышеуказанных пределах.
Эта простая хартина доминирует в первой половине серии ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ с n = 1−7, где все ВН3-группы координируются к ребрам Al13. Во второй половиние серии она усложняется и становится более разнообразной. С помощью рис. 1 можно проследить эволюцию структурных изменений боратных комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ с увеличением числа ВН3-групп.
Наиболее сильные изменения касаются способов присоединения борановых групп. Например, уже при n = 8 (структура 1-7) две ВН3-группы координируются к граням каркаса и несимметрично связываются с ними двумя Н-мостиками. У структур 1-8, 1-9 и 1-10 с n = 10, 12 и 14 имеются уплощенно-пирамидальные группы ВН3, связанные с ребром двумя связями B−Al без участия Н-мостиков, так что все три связи В−Н остаются терминальными и направленными во внешнюю сферу комплексов. У структуры 1-11 (n = 16) группа ВН3 сохраняет лишь одну терминальную связь В−Н, а две остальные оказываются включенными в Н-мостики. Параллельно нарастают деформации каркаса ${\text{Al}}_{{{\text{13}}}}^{ - }.$ При n = 10 (структура 1-8) несколько связей Al−Al сильно растягиваются или разрываются, в результате чего в каркасе Al13 открывается пятиугольное “окно”. При n = 12 (структура 1-9) три ВН3-группы координируются к граням, а пятиугольное “окно” расширяется до шестиугольного. При n = 14 и 16 (структуры 1-10 и 1-11) уже четыре ВН3-группы координируются к граням и в каркасе открываются несколько больших “окон”. Наконец, при n = 17 в одном из изомеров (структура 1-12) семнадцатая ВН3-группа с атомом В(75) не координируется во внешней сфере, а внедряется в его внутреннюю полость и образует связь с центральным атомом Al(1)−ВН3 c длиной ∼2.15 Å и частотой валентного колебания ∼506 см–1.
С помощью данных рис. 1 и табл. 1 можно проследить также характер и быстрое нарастание несимметричных деформаций связей Al−Al и мостиков Al−Hb−B с ростом n. Разница в длинах каркасных связей R(AlAl), которая не превышает нескольких сотых долей ангстрема в начале серии, увеличивается до ∼0.2−0.4 при n > 6 и до ∼0.5−0.6 Å при n > 12, а водородные мостики В−Нb−Al, неэквивалентные даже при одном и том же фиксированном значении n, становятся все более асимметричными. При увеличении n фрагменты В−Hb монотонно укорачиваются от ∼1.26 до ∼1.20 Å, а соответствующие им колебательные частоты ν1(ВHb) увеличиваются от 2100 до 2250−2500 см–1. Соответственно, фрагменты Al−Hb, меняющиеся в более узких пределах, следуют противоположной тенденции с увеличением их длины R(Al−Hb) и уменьшением частоты ν2(AlHb), что свидетельствует о некотором усилении взаимодействия В−Нb и ослаблении взаимодействия Al−Нb в мостиках Al−Hb−B при увеличении n.
В табл. 1 приведены энергии E(nBH3) полного распада ионов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ на фрагменты
(1)
${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{n}^{ - } \to {\text{Al}}_{{{\text{13}}}}^{ - } + n\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)$(2)
${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{n}^{ - } \to {\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{n - {\text{2}}}}^{ - } + {\text{2}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right).$Таблица 3.
Сравнение рассчитанных энергий распада комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{L}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{L}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$
| ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{L}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ | ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{L}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$ | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| n | Е(BH3) | Е(2BH3) | Е(AlH3) | Е(2AlH3) | n | Е(BH3) | Е(2BH3) | Е(AlH3) | Е(2AlH3) |
| 1 | 17 | – | 19 | – | 1 | 19 | – | 17 | – |
| 2 | 19 | 38 | 17 | 35 | 2 | 22 | 44 | 20 | 39 |
| 3 | 20 | 44 | 18 | 28 | 3 | 23 | 49 | 19 | 41 |
| 4 | 23 | 53 | 16 | 29 | 4 | 23 | 49 | 19 | 35 |
| 6 | 23 | 45 | 17 | 43 | 6 | 24 | 48 | 15 | 36 |
| 8 | 24 | 56 | 18 | 34 | 8 | 24 | 47 | 13 | 20 |
| 10 | 27 | 63 | 19 | 46 | 10 | 23 | 45 | 13 | 22 |
| 12 | 26 | 52 | 21 | 45 | 12 | 23 | 46 | 13 | 27 |
| 14 | 26 | 53 | 20 | 47 | |||||
| 16 | 27 | 60 | 19 | 31 | |||||
Примечание.E(LH3) = (1/n)E(nLH3) − средние энергии отрыва лиганда LH3, E(2LH3) = E(nLH3) − Е((n − 2)LH3) + 2LH3 − энергии отрыва пары лигандов 2LH3 у комплексов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{L}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{L}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$ при разных значениях n. Данные для комплексов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{L}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}}--}}$ взяты из [23].
Из табл. 3 следует, что энергии E(2BH3) имеют общую тенденцию к увеличению с ростом n и лежат в интервале ∼40−60 ккал/моль. Эти величины на ∼10−30 ккал/моль больше энергии димеризации борана в диборан 2ВН3 → В2Н6 (∼32.5 ккал/моль (наш расчет), экспериментальная оценка 35 ± ± 4 ккал/моль [29]). На этом основании можно заключить, что все борановые комплексы типа ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ в интервале n = 2−16 должны быть энергетически стабильными к распаду с отщеплением молекулы диборана
(3)
${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{n}^{ - } \to {\text{A}}{{{\text{l}}}_{{{\text{13}}}}}\left( {{\text{B}}{{{\text{H}}}_{{\text{3}}}}} \right)_{{n - {\text{2}}}}^{ - } + {{{\text{B}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{6}}}}$Следует отметить, что “сольватация” не останавливается на комплексе ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{12}}}}^{ - }$ (1-9) с двенадцатью лигандами, но остается столь же энергетически выгодной у суперсольватированных ионов ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{14}}}}^{ - }$ (1-10) и ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{16}}}}^{ - }$ (1-11). Согласно данным табл. 3, при увеличении n > 12 средняя энергия E(BH3) отрыва молекулы ВН3 продолжает медленно возрастать параллельно с увеличением числа водородных связей между лигандами и образованием новых внешнесферных биядерных фрагментов типа В2Н3, В2Н5 и В2Н6, также связанных с каркасом водородными мостиками. К сожалению, оценить предел насыщения “сольватации” и указать максимальное значение nmax пока не представляется возможным по техническим причинам. При распространении B3LYP-расчетов на аналоги с n > 16 возникают серьезные проблемы оптимизационной процедуры, которая не достигала пороговой сходимости даже после нескольких сотен оптимизационных циклов при очень медленном понижении полной энергии, и мы были вынуждены прервать систематические расчеты из-за несоразмерно больших затрат машинного времени. Здесь можно лишь кратко отметить результаты для нескольких структур, оптимизацию которых удалось завершить, хотя они не представляют полной картины и рассматриваются как предварительные. Расчеты систем с n =17 и 18 свидетельствуют о присутствии у каждой из них нескольких изомеров с близкими энергиями и разными структурами, о дальнейшем (по сравнению с n = 14 и 15) увеличении числа диборановых и появлении триборановых фрагментов в поверхностной области, а также о тенденции к дальнейшему уменьшению стабильности комплексов с ростом n (в частности, уже изомер ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{17}}}}^{ - }$ (1-12) предсказывается малостабильным к отрыву диборана). Вместе с тем нельзя исключать, что в этих случаях локализованные изомеры не являются самыми предпочтительными. Для поиска последних и для окончательных выводов необходимы дальнейшие исследования “суперсольватированных” комплексов с включением более широкого круга альтернативных структур.
Алановые комплексы ${\mathbf{A}}{{{\mathbf{l}}}_{{{\mathbf{13}}}}}{\mathbf{(Al'}}{{{\mathbf{H}}}_{{\mathbf{3}}}}{\mathbf{)}}_{n}^{ - }.$ Алановые комплексы серии ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - }$ отличаются от борановых аналогов большим разнообразием способов координации и ассоциаций внешнесферных алановых групп, значительно более сильными деформациями каркаса Al13 (особенно во второй половине серии) и меньшей стабильностью к распаду с отщеплением диалана.
Анализ структур 2-1−2-11, изображенных на рис. 2, и данных табл. 2 свидетельствует, что у алановых анионов начала серии лиганды Al'H3 тоже координируются к ребрам каркаса Al13 и образуют группы Al2Al′H3 c трехчленными циклами Al2Al', в которых расстояния R(AlAl), R(AlAl') и валентный угол φ(AlAl'Al) лежат в интервалах ∼2.80−2.90, ∼2.60−2.90 Å и 60°−65°. (Здесь и ниже символы Al и Al' соответствуют атомам алюминия, принадлежащим каркасу Al13 и алановым группам соответственно. На рис. 2 каркасные атомы Al и связи между ними выделены красным цветом). Каждый атом Al′ (помимо пары связей Al'−Al) связан с одним из атомов Al каркасного ребра почти симметричным водородным мостиком Al'−Нb−Al c длинами фрагментов R(Al'Hb) ∼ ~ 1.68−1.74 Å, R(HbAl) ∼ 1.72−1.78 Å и валентным углом φ(Al'HbAl) ∼ 100°−110°. В отличие от ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{B}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - },$ у которых этот способ координации сохраняется во всей первой половине серии с n = = 1−7, у алановых аналогов он реализуется только у первых двух начальных членов серии. Уже в интервале n = 3−5 у них разрывается одно ребро, а при n = 6 разрываются два ребра Al−Al, каркас теряет клозо-форму, а угол φ(Al'HbAl) в мостике увеличивается от ∼100°−110° до 125°−130° и более. У борановых комплексов с ростом n > 8 увеличивается число ВН3-групп, координированных к граням каркаса Al13. Напротив, координация Al'Н3-групп к граням не характерна, и структурная эволюция у алановых аналогов следует более изощренным путем. Так, у комплекса ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{1}}0}}^{ - }$ (2-8) появляется внешняя ортоаланатная группа Al'H4, связанная двумя Н-мостиками c разделенным атомами Al' соседних ребер, разрываются несколько каркасных связей Al−Al и в каркасе образуются большие “окна”. Во внешней сфере кластера ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{12}}}}^{ - }$ (2-9) появляется биядерный одномостиковый фрагмент ${\text{Al}}_{{\text{2}}}^{'}{{{\text{H}}}_{{\text{6}}}},$ а центральный атом Al(1), который у предыдущих членов серии находился во внутренней полости каркаса, смещается из центра на поверхность и одновременно выталкивает наружу соседний атом Al(9), который связывается с каркасом тремя мостиками. При этом каркас меняет состав (Al13 → Al12) и становится полым, а внешнесферные Al′H3-группы ассоциируют и образуют одномостиковые диалановые лиганды типа ${\text{Al}}_{{\text{2}}}^{'}{{{\text{H}}}_{{\text{3}}}},$ ${\text{Al}}_{{\text{2}}}^{'}{{{\text{H}}}_{{\text{5}}}},$ и ${\text{Al}}_{{\text{2}}}^{'}{{{\text{H}}}_{{\text{6}}}}.$ Число Н-мостиков и биядерных лигандов возрастает далее у ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{14}}}}^{ - }$ (2-10) и ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{16}}}}^{ - }$ (2-11) параллельно с увеличением размеров “окон” в каркасе, который полностью раскрывается и уже ничем не напоминает исходный центрированный икосаэдр. У следующего члена серии ${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{{\text{17}}}}^{ - }$ (2-12) два атома Al(11) и Al(13) отделяются от каркаса и связываются с ним только Н-мостиками. Различия между атомами Al каркаса и алановых групп начинают размываться, а структура комплекса, в котором внешняя (поверхностная) сетка водородных связей “обволакивает” внутренний каркас, становится все более бесформенной.
Из табл. 3 видно, что в отличие от борановых систем, у которых усредненные энергии одной и двух молекул борана Е(BH3) и E(2BH3) монотонно увеличиваются с ростом n от в интервалах ∼17−27 и ∼35−55 ккал/моль, у алановых комплексов эти энергии отрыва одной и двух молекул алана проявляют более слабую зависимость от n и лежат в более узких интервалах ∼17−20 и ∼35−40 ккал/моль соответственно. Энергия димеризации алана Eдимер(AlH3), рассчитанная в рамках приближений B3LYP/6-311+G* и CCSD(T)/6-311++G**с учетом энергий нулевых колебаний, составляет 29 и 32 ккал/моль и близка к величине 33 ккал/моль, рассчитанной в [30]. Алановые комплексы значительно менее стабильны к распаду с отщеплением молекулы Al2H6:
(4)
${\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{n}^{ - } \to {\text{A}}{{{\text{l}}}_{{{\text{13}}}}}({\text{Al'}}{{{\text{H}}}_{{\text{3}}}})_{{n - {\text{2}}}}^{ - } + {\text{Al}}_{{\text{2}}}^{'}{{{\text{H}}}_{{\text{6}}}},$Уместно сравнить стабильность к распаду с отрывом диборана у борановых анионов ${\text{Al}}_{{{\text{13}}}}^{ - }{{(В {{{\text{H}}}_{{\text{3}}}})}_{n}}$ и боранатных дианионов ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{\text{H}}_{{{\text{12}} - n}}^{{{\text{2}} - }}{{({\text{B}}{{{\text{H}}}_{{\text{4}}}})}_{n}}$ [23]. Данные табл. 3 свидетельствуют, что у первого семейства, у которых лиганды ВН3 координируются посредством связей Al−В и Н-мостиков, начальные члены серии (с n = 2 и 3) на несколько ккал/моль менее стабильны, а последующие аналоги (с n ≥ 4) на ∼5−10 ккал/моль более стабильны по сравнению с дианионами второго семейства, у которых каждый лиганд ВН4 координируется посредством пары Н-мостиков. У стабильных боранатов максимальное число координированных лигандов равно 12, в то время как у анионов ${\text{Al}}_{{13}}^{ - }$(ВH3)n это число возрастает до 14−16 за счет образования дополнительных Н-мостиков между лигандами и внешнесферных ассоциатов типа В2Н5 и В2Н6.
Алановые комплексы обоих семейств, как правило, менее стабильны по сравнению с борановыми аналогами. Отличия между анионами ${\text{Al}}_{{{\text{13}}}}^{ - }{{({\text{Al}}{{{\text{H}}}_{{\text{3}}}})}_{n}}$ и дианионами ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}({\text{Al}}{{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}} - }}$ проявляются иначе, чем отличия между ${\text{Al}}_{{{\text{13}}}}^{ - }{{(В {{{\text{H}}}_{{\text{3}}}})}_{n}}$ и ${\text{A}}{{{\text{l}}}_{{{\text{12}}}}}{{{\text{H}}}_{{{\text{12}} - n}}}(В {{{\text{H}}}_{{\text{4}}}})_{n}^{{{\text{2}} - }}.$ У аланатов стабильность к распаду с отщеплением диалана быстро падает с увеличением n и энергетически стабильными могут считаться лишь начальные члены их серии. Для алановых комплексов характерна противоположная тенденция: их стабильность растет с ростом n и оказывается наибольшей во второй половине серии ${\text{Al}}_{{{\text{13}}}}^{ - }{{({\text{Al}}{{{\text{H}}}_{{\text{3}}}})}_{n}}$ в интервале n = 6–14, также за счет новых Н-мостиков между лигандами и образования внешнесферных ассоциатов типа Al2Н3, Al2Н5 и Al2Н6.
На наш взгляд, полученные результаты и качественные выводы могут быть полезными при квантово-химических моделировании и прогнозировании структуры и стабильности более сложных наноразмерных алюмоборогидридных и алюмогидридных соединений с высоким содержанием водорода.
Список литературы
Jeon K.J., Moon H.R., Ruminski A.M. et al. // Nature Mat. 2011. V. 10. P. 286. doi https://doi.org/10.1038/NMAT2978
Francombe T.J. // Chem. Rev. 2012. V. 112. P. 2164.
Graetz J., Reilly J.J., Yartys V.A. et al. // J. Alloys Compd. 2011. V. 509. P. 5517. doi https://doi.org/10.1016/j.jallcom2010.11.115
Lai Q., Paskevicius M., Sheppard D.A. et al. // Chem. Sus. Chem. 2015. V. 8. P. 2789. doi https://doi.org/10.1002/cssc.201500231
Тарасов Б.П., Лотоцкий М.В. // Рос. хим. журн. 2006. Т. 50. № 6. С. 5.
Андриевский Р.А. // Успехи физ. наук. 2007. Т. 177. № 7. С. 721.
Li X., Grubisic A., Stokes S.T. et al. // Science. 2007. V. 315. P. 356. doi 10126/science/1133767
Charkin O.P., Klimenko N.M., Charkin D.O., Mebel A.M. // Faraday Discuss. 2003. V. 124. P. 215.
Kawamura H., Kumar V., Sun Q., Kawazoe Y. // Phys. Rev. A. 2003. V. 67. P. 063205.
Grubisic A., Li X., Stokes S.T. et al. // J. Am. Chem. Soc. 2007. V. 129. P. 5969. doi https://doi.org/10.1021/ja0700404CCC
Roach P.J., Reber A.C., Hoodward W.H. et al. // Proc. Natt Acad. Sci. US. 2007. V. 104. № 37. P. 14565. doi https://doi.org/10.1073/PNAS.07066113104
Zhang X., Wang H., Collins E. et al. // J. Chem. Phys. 2013. V. 138. P. 124 303. doi https://doi.org/10.1063/1.47962000
Wang H., Zhang X., Ko Y. et al. // J. Chem. Phys. 2014. V. 140. № 16. P. 164317. doi https://doi.org/10.1063/1.4871884
Andrews L., Wang X. // J. Phys. Chem. A. 2004. P. 4202.
Rienstra-Kirakofe J.C., Tschumper G.S., Schaefer H.F. et al. // Chem. Rev. 2002. V. 102. P. 231.
Koyashi K., Akutsu M., Atobe J. et al. // Chem. Phys. Lett. 2006. V. 421. P. 534.
Jung J., Han Y.-K. // J. Chem. Phys. 2006. V. 125. P. 064306.
Goldberg A., Yarovsky I. // Phys. Rev. B. 2007. V. 75. P. 195403.
Constanzo F., Hemert M.C., Kroes G.-J. // J. Phys. Chem. 2013. V. 118. № 1. P. 513.
Pandey K.K. // J. Mol. Struct. Theochem. 2008. V. 855. P. 18.
Seo D.K., Corbett J.D. // Science. 2001. V. 291. P. 841.
Schnepf A., Stosser G., Koppe Schnokel H. // Angew. Chem. Int. Ed. Engl. 2000. V. 39. P. 1637.
Schnepf A., Schnoekel H. // Angew. Chem., Int. Ed. Engl. 712 2001. V. 40. P. 712.
Чаркин О.П. // Журн. неорган. химии. 2019. Т. 64. № 4. С. 379. [Charkin O.P. // Russ. J. Inorg. Chem. 2019. V. 64. № 4.]
Frisch M.J., Trucks G.W., Schlegel H.B. et al. GAUSSIAN-03, Revision B.03 (Gaussian, Inc., Pittsburg, PA. 2003).
Becke A. D.J. // J. Chem. Phys. 1993. V. 98. P. 5648.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1998. V. 37. P. 785.
Charkin O.P. // Russ. J. Inorg. Chem. 2007. V. 51. № 11. P. 1746. [Чаркин О.П. // Журн. неорган. химии. 2007. Т. 51. № 11. С. 1856.]
Charkin O.P. // Russ. J. Inorg. Chem. 2007. V. 51. № 12. P. 1925. [Чаркин О.П. // Журн. неорган. химии. 2007. Т. 51. № 12. С. 2033.]
Гурвич Л.В., Карачевцев Г.В., Кондратьев В.Н. и др. Энергии разрыва химических связей, потенциалы ионизации и сродство к электрону / Под ред. Кондратьева В.Н. М.: Наука, 1974. 351 с.
Goebert D.J., Hernandes H., Francisco J.S. et al. // J. Am. Chem. Soc. 2005. V. 137. P. 16694.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


