Журнал неорганической химии, 2019, T. 64, № 5, стр. 524-527
Влияние примеси 4d-металлов на электронные свойства нанотрубок ZrO2
Е. П. Дьячков 1, *, П. Н. Дьячков 1
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: evg_dyachkov@mail.ru
Поступила в редакцию 06.08.2018
После доработки 15.10.2018
Принята к публикации 12.11.2018
Аннотация
Методами квантовой химии изучено электронное строение нанотрубок ZrO2 с примесью 4d-металлов. Вычисленные плотности электронных состояний с содержанием примеси 4 ат. % свидетельствуют о том, что частичная замена атомов Zr на Y, Nb Tc, Ru, Rh и Ag приводит к уменьшению оптической щели нанотрубок (4,4) ZrO2 от 3.7 до 1.5–2.2 эВ за счет уширения краев зон и образования новых пиков плотности состояний вблизи потолка валентной зоны и дна зоны проводимости ZrO2. В этих случаях легирование ZrO2 приводит к смещению поглощения из УФ в видимую область, и нанотрубки становятся перспективными материалами для использования в качестве электродов для фотолиза воды под действием солнечного света.
ВВЕДЕНИЕ
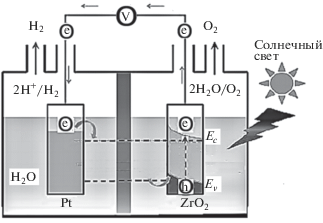
Нанотрубки ZrO2 [1–8] под действием солнечного света обнаруживают фотокаталитическую активность в реакциях разложения воды с образованием водорода. Принципиальная схема фотоэлектрохимической ячейки, используемой для разложения воды с помощью диоксида циркония, показана на рис. 1. В качестве катода используется полупроводник, соединенный электрической цепью с металлическим анодом. При освещении на поверхности ZrO2 образуются электронно-дырочные пары:
Подвижные электроны переносятся на анод, где осуществляется окисление протонов с образованием молекулярного водорода:
а с участием положительно заряженных дырок на катоде идет реакция восстановления воды с образованием кислорода и протонов:В результате суммарная реакция описывает разложение воды до водорода и кислорода:
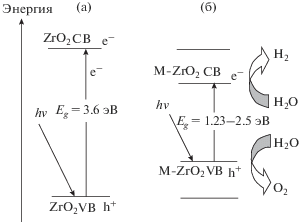
Однако практическое использование кристаллов и нанотрубок ZrO2 в водородной энергетике ограничивается большой шириной оптической щели Eg = 3.6–3.7 эВ [1–3]: для поглощения в видимой области требуется использование материала фотоэлектродов с Eg не более 2.5 эВ [9–16] (рис. 2а). Ширина запрещенной зоны фотокатализатора при этом должна быть не менее 1.23 эВ, чтобы потенциалы окисления и восстановления воды могли располагаться в оптической щели материала. Изменение состава диоксида циркония путем допирования нанотрубок является возможным способом создания более эффективных фотокатализаторов получения водорода. Чистый и допированный металлами ZrO2 получают гидротермальным методом и анодизацией сплавов, частичная замена катионов в образцах ZrO2 меняет их физико-химические характеристики [17–25]. Схема электронных уровней легированного диоксида циркония, удовлетворяющая этим требованиям, приведена на рис. 2б.
Рис. 2.
Диаграммы электронных уровней для чистого (а) и легированного (б) диоксида циркония; в последнем случае представлена схема уровней, отвечающая требованиям высокой каталитической активности материала.
В настоящей работе с целью поиска материалов на основе нанотрубок ZrO2 с оптическими щелями в интервале 1.23–2.5 эВ, удовлетворяющими условиям рис. 2б, изучили влияние примеси 4d-металлов на электронное строение гексагональных трубок (4,4) ZrO2 (рис. 3), в трансляционной ячейке которых находятся 24 атома. При этом один атом циркония замещается на 4d-металл, что соответствует содержанию примеси около 4 ат. %. Эта работа дополняет предыдущие исследования влияния непереходных элементов пятой группы и 3d-металлов на зонную структуру этих трубок, выполненные методом линеаризованных присоединенных цилиндрических волн (ЛПЦВ) [26, 27].
МЕТОД РАСЧЕТА
Метод ЛПЦВ удобно рассматривать как распространение хорошо известного и наиболее точного в теории электронного строения кристаллов метода линеаризованных присоединенных плоских волн (ЛППВ) на случай одномерных многоатомных систем с цилиндрической геометрией типа исследованных в данной работе нанотрубок из диоксида циркония. Метод ЛПЦВ и его применение описаны в обзорной работе [28], поэтому перечислим только основные приближения, используемые в этой теории. Подобно оригинальной технике ЛППВ для объемных материалов, метод ЛПЦВ основан на применении маффин-тин (MT) приближения для электронного потенциала V(r), а именно, для потенциала V(r) берется сферически симметричная часть в областях атомов, где используется приближение функционала локальной плотности, а в межатомном пространстве постоянный потенциал выбирается за начало отсчета энергии. Внутри атомных сфер электронная плотность ρ(r) нанотрубки вычисляется как суперпозиция атомных плотностей ρat(r) и рассматривается сферически симметричная часть ρ(r). Обменно-корреляционное взаимодействие рассчитывали с помощью слейтеровского ρ1/3 приближения.
Геометрия объемных кристаллов и наноматериалов существенно различается, поэтому невозможно непосредственное использование MT-приближения для расчета электронных свойств наноматериалов. Действительно, в кристаллах электронный транспорт неограничен во всех направлениях, а в нанотрубках перенос электронов определяется их размерами и трубчатой формой. Поэтому МТ-приближение должно быть адаптировано к цилиндрическим структурам: в цилиндрическом МТ-приближении помещали нанотрубку между бесконечными цилиндрическими барьерами Ωa и Ωb, отделяющими многоатомную систему от вакуумных областей снаружи и внутри трубки. При этом требуется введение одного параметра, а именно такого расстояния между Ωa и Ωb, чтобы ширина запрещенной зоны в нелегированной нанотрубке ZrO2 была равна 3.6 эВ; в данном случае δ = 4.06 Å практически совпадает с ван-дер-ваальсовой толщиной нанотрубки ZrO2.
Использование цилиндрического МТ-потенциала существенно упрощает решение уравнения Шредингера. В межсферной области, где задача соответствует электрону в цилиндрической потенциальной яме, базисные функции имеют вид суперпозиции функций Бесселя, а в атомных МТ-областях они располагаются в ряд по сферическим гармоникам и решениям радиального волнового уравнения [28]. Окончательный вид уравнений для расчетов зонной структуры нанотрубок приведен в [28].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
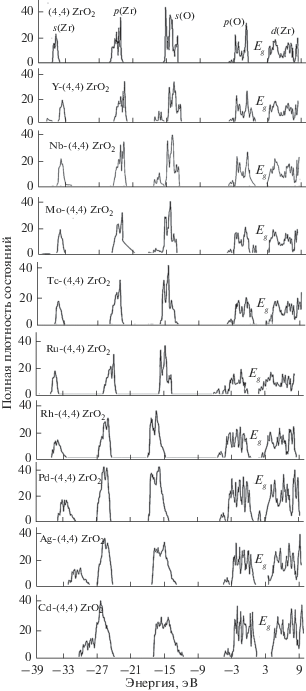
На рис. 4 и в табл. 1 приведены вычисленные плотности электронных состояний и энергии оптических щелей в чистой и в девяти легированных нанотрубках M-ZrO2 с M от Y до Cd. Положение потолка валентной зоны в незамещенной трубке выбрано за начало отсчета энергии. Зонная структура всех нанотрубок характеризуется системой из четырех полос в валентной зоне и одной полосы в зоне проводимости, происхождение которых объясняется ионной моделью химической связи в соединении Zr4+(O2–)2. Именно состояния при положительных значениях энергии обусловлены преимущественно 4d-орбиталями циркония и металлических примесей. Верхняя полоса валентной зоны соответствует заполненным 2р(O)-состояниям, ниже которых расположены внутренние s(O), а затем р- и s-электроны металла. Можно видеть, что присутствие примеси оказывает сильное влияние на электронные состояния запрещенной и валентной зон ZrO2. Ширина щели в той или иной мере уменьшается при наличии любой 4d-примеси за счет уширения краев валентной зоны и зоны проводимости и образования новых полос вблизи этих краев или в центре щели. В соединениях Mo-ZrO2 и Pd-ZrO2 частично заполненные примесные зоны располагаются в центре запрещенной зоны ZrO2 и образуют оптические щели с энергиями 0.4–1.9 и 0.6–0.7 эВ, не соответствующими требованию 1.23 ≤ Eg ≤ 2.5 эВ. За пределами этого интервала также оказывается оптическая щель в легированном кадмием соединении Cd-ZrO2 с Eg = 2.7 эВ. Добавление примесей Y и Nb, Tc, Ru, Rh и Ag сопровождается необходимым сужением запрещенной зоны до 1.5–2.4 эВ за счет только уширения краев валентной зоны и зоны проводимости. Нанотрубки диоксида циркония с этими легирующими добавками можно использовать как фотокатализаторы для расщепления воды под действием солнечного света.
ЗАКЛЮЧЕНИЕ
Частичная замена в нанотрубоках ZrO2 атомов Zr на Y, Nb Tc, Ru, Rh и Ag приводит к уменьшению оптической щели нанотрубок от 3.7 до 1.5–2.2 эВ и смещению поглощения из УФ в видимую область. Нанотрубки становятся перспективными материалами для использования в качестве электродов для фотолиза воды под действием солнечного света.
Список литературы
Amer A.W., El-Sayed-M.A., Allam N.K. // J. Phys. Chem. C. 2016. V. 120. P. 7025.
Amer A.W., Mohamed-S.M., Hafez A.M. // RSC Adv. 2014. V. 4. P. 36336.
Kammler H.K., Madler L., Pratsinis S.E. // Chem. Eng. Technol. 2001. V. 24. P. 583.
Suryanarayana C. // Mater. Today. 2005. V. 8. P. 62.
Hassan N.K., Hashim M.R., Mahdi M.A. // ECS J. Solid State Sci. Technol. 2012. № 1. P. 86.
Lefevre V. Nanowires: properties, synthesis and applications. N.Y.: Nova Science Publishers, 2012.
Dai H. // Acc. Chem. Res. 2002. V. 35. P. 1035.
Rozana M., Soaid-N.I., Kian T.W. // Nanotechnology. 2017. V. 28. P. 155604.
Fujishima A., Honda K. // Nature. 1972. V. 238. P. 37.
Zaleska A. // Recent Pat. Eng. 2008. V. 2. P. 157.
Anpo M. // Pure Appl. Chem. 2000. V. 72. P. 1787.
Pelaez M., Nolan N.T., Pillai S.C. // Appl. Catal. B. 2012. V. 125. P. 331.
Inoue T., Okumura T., Shimazu Y. // J. Appl. Phys. 2014. V. 53. P. 6.
Umebayashi T., Yamaki T., Itoh H. // J. Phys. Chem. Solids. 2002. V. 63. P. 1909.
Shao G. // J. Phys. Chem. C. 2008. V. 112. P. 18677.
Valentin C.D., Pacchioni G., Onishi H. // Chem. Phys. Lett. 2009. V. 469. P. 166.
Alvarez M., López T., Odriozola J.A. // Appl. Catal. B. 2007. V. 73. P. 34.
Garcia J.C., Scolfaro L.M., Lino A.T. // J. Appl. Phys. 2006. V. 100. P. 104103.
Fu N., Wang X., Ma Y. et al. // J. Phys. D: Appl. Phys. 2016. V. 49. P. 135105.
Vidya Y.S., Anantharaju K.S., Nagabhushana H. et al. // Spectrochim. Acta. Part A. 2015. V. 135. P. 241.
Zhang H.W., Fu X.Y., Niu S.Y. et al. // J. Non-Cryst. Solids. 2008. V. 354. P. 1559.
Qu X., Xie D., Cao L. et al. // Ceram. Intern. 2014. V. 40. P. 12647.
Neppolian B., Wang Q., Yamashita H. // Appl. Catal. A. 2007. V. 333. P. 264.
Fu N., Wang X., Guo L. et al. // J. Mater. Sci.-Mater. Electron. doi https://doi.org/10.1007/s10854-017-6407-7
Garcia-Hipolito M., Martinez R., Alvarez-Fregoso O. // J. Lumin. 2001. V. 93. P. 9.
D’yachkov P.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1076. doi https://doi.org/10.1134/S0036023618080041
D’yachkov E.P., Bochkov I.A., Makaev D.V., D’yachkov P.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1340. doi 10.1134/S0036023618100054 [Дьячков Е.П., Бочков И.А., Макаев Д. В., Дьячков П.Н. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1324.]
D’yachkov P.N. // Int. J. Quantum Chem. 2016. V. 116. P. 174.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии