Журнал неорганической химии, 2019, T. 64, № 5, стр. 538-544
Экстракция редкоземельных элементов в системе 1,1,7-тригидрододекафторгептанол–вода фосфорилподандами, производными дифосфоновых кислот
И. С. Иванова 1, 2, *, Е. С. Криворотько 2, А. Б. Илюхин 1, С. В. Демин 1, 2, Е. Н. Пятова 1, 2, В. Е. Баулин 2, 3, А. Ю. Цивадзе 2
1 Институт общей и неорганической химии им. Н.C. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, Россия
3 Институт физиологически активных веществ РАН
142432 Московской обл., Черноголовка, Северный пр-д, 1, Россия
* E-mail: isivanova@mail.ru
Поступила в редакцию 05.11.2018
После доработки 21.11.2018
Принята к публикации 23.11.2018
Аннотация
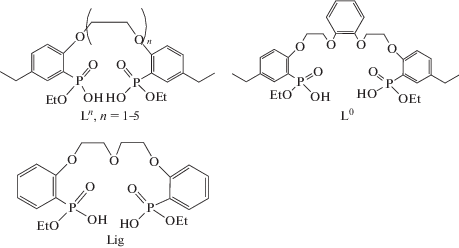
Изучена экстракция редкоземельных элементов (РЗЭ) в системе 1,1,7-тригидрододекафторгептанол–вода с использованием фосфорилподандов, производных дифосфоновых кислот общей формулы 2-[(HO)(EtO)(O)P]-4-Et–C6H3–(OCH2CH2)n–OC6H3-4-Et-2-[P(O)(OEt)(OH)], n = 1–5. Изучено влияние кислотности среды на эффективность и селективность извлечения РЗЭ. Методом РСА установлена кристаллическая структура 1,5-бис[2-(оксиэтоксифосфорил)фенокси]-3-оксапентана.
ВВЕДЕНИЕ
Известно [1–3], что редкоземельные элементы (РЗЭ) находят применение в различных областях химической и металлургической промышленности, ядерной энергетики, в производстве лазерных материалов и высокотемпературных сверхпроводников. Для этого требуется высокая чистота металлов. Поэтому большое значение имеют эффективность их разделения и очистка от примесей. Одним из методов, применяемым для разделения РЗЭ, является жидкостная экстракция [2–10]. Большое промышленное значение для извлечения трехвалентных f-элементов имеют липофильные фосфорорганические лиганды различного строения [2, 3]. Сравнительно недавние исследования [11–13] показали, что фосфорилподанды, производные дифосфоновых кислот, являются весьма перспективными соединениями для их использования в качестве избирательных экстрагентов для извлечения f-элементов. По своим характеристикам такие поданды существенно превосходят хорошо известный экстрагент ди-2-этилгексилфосфорную кислоту [14]. Изучена экстракция урана(VI), тория(IV) и лантана(III) в 1,2-дихлорэтан бинарными экстрагентами, полученными на основе стехиометрических смесей дифосфоновых кислот – 1,5-бис[о-(диоксифосфорил)фенокси]-3-оксапентана или 1,5-бис[о-(диоксифосфорил)-п-этилфенокси]-3-оксапентана и триоктиламина [15]. Найдены условия регенерации экстрагентов после реэкстракции, что допускает их повторное применение. Авторами [16, 17] исследована экстракционная способность органической соли поданда 1,5-бис[о-(гидроксиэтоксифосфорил)фенокси]-3-оксапентана и триоктиламина по отношению к цезию в азотнокислых и карбонатных средах. Показана более высокая экстракционная способность данного экстрагента при экстракции цезия из этих сред по сравнению с дибензо-18-краун-6 и ди-трет-бутилдициклогексано-18-краун-6. Кроме того, фосфорилподанды могут использоваться как компоненты неподвижной фазы сорбентов импрегнированного типа для экстракционно-хроматографического извлечения 99Мо [18], 147Pm [19], разделения U(VI), Th(IV), Np(IV) и Pu(IV) [20, 21] из растворов, полученных при переработке отработанного ядерного топлива.
О влиянии строения фосфорсодержащих подандов кислотного типа или природы разбавителя на экстракционное разделение многокомпонентных растворов редкоземельных элементов известно немного. В основном такие исследования были проведены для подандов с этиленгликолевой цепочкой, не превышающей трех звеньев. В работах [11, 14] в качестве экстрагентов выборочно взятых РЗЭ были проверены поданды с различными заместителями при атоме фосфора или бензольного кольца. Однако длина этиленгликолевой цепочки подандов также была ограничена (n = 3). Тем не менее экстракционно-хроматографические исследования, проведенные в [18], показали, что фосфорилподанд с числом этиленгликолевых звеньев n = 4 обладает лучшими характеристиками в качестве основного компонента неподвижной фазы сорбента импрегнированного типа. Авторы [11] также отмечали, что эффективность экстракции лантана заметно возрастает с ростом числа звеньев в этиленгликолевой цепочке поданда (n = 1 → 3).
Представляло интерес проверить экстракционные свойства подандов кислотного типа с более длинной полиэфирной цепью по отношению к целому ряду редкоземельных элементов и в других условиях. В настоящей работе изучена экстракция РЗЭ фосфорилподандами Ln (n = 1–5) и L0 в системе 1,1,7-тригидрододекафторгептанол–вода. Применение подобного разбавителя имеет ряд преимуществ перед хлорпроизводными углеводородов, а именно: он обладает высокой радиационной устойчивостью, не горючий, малотоксичный, достаточно хорошо растворяет краун-эфиры и их производные.
Установлена зависимость экстракционной способности от длины Ln и жесткости L0 полиэфирной цепи. Методом РСА определена кристаллическая структура 1,5-бис(2-оксиэтоксифосфорилфенокси)-3-оксапентана (Lig (I)).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез 1,2-бис(2-оксиэтоксифосфорил-4-этилфенокси)-3-оксапентана (L1). К раствору 2.58 г (10.0 ммоль) 2-диэтоксифосфорил-4-этилфенола в 25 мл сухого диоксана добавляли 3.26 г (10.0 ммоль) свежепрокаленного карбоната цезия и нагревали до кипения. После 0.5 ч перемешивания добавляли 1.85 г (5.0 ммоль) дитозилата этиленгликоля и перемешивали еще в течение 7 ч. После охлаждения смесь выливали в 100 мл воды, подкисляли HClконц до рН 1 и экстрагировали CHCl3 (3 × 25 мл). Экстракт промывали водой (3 × 25 мл), упаривали растворитель в вакууме. Остаток растворяли в 10 мл этилового спирта и добавляли 5 мл 40%-ного раствора гидроксида натрия. Смесь кипятили в течение 5 ч, затем HClконц подкисляли до рН 1 и экстрагировали CHCl3 (3 × 25 мл). Полученный экстракт упаривали в вакууме, остаток затирали с диэтиловым эфиром. Выход L1 составил 3.20 г (65.8%), tпл = = 189–191°С (этанол).
| С | Н | P | |
| Найдено, %: | 54.21, 54.08; | 6.33, 6.41; | 12.45, 12.64. |
| Для С22Н32О8P2 | |||
| вычислено, %: | 54.32; | 6.63; | 12.74. |
Спектр ПМР (СDCl3, δ, м. д.): 1.19 т (6Н, 3Jн–н = = 7.0 Гц 2СН3СН2–Ar), 1.25 т (6Н, 3Jн–н = 7.0 Гц 2СН3СН2О), 2.61 м (4Н, Ar–СН2СН3), 4.18 м (4Н, 2ОСН2СН3 + 4Н, 2ОСН2СН2O), 6.81 м (2H, Ar–H), 7.22 м (2Н, Ar–H), 7.54 м (2H, Ar–H). Спектр ЯМР 31Р (СDCl3, δ, м. д.): 19.32.
1,5-Бис(2-оксиэтоксифосфорил-4-этилфенокси)-3-оксапентан (L2) получен аналогично L1 из 2.58 г (10.0 ммоль) 2-диэтоксифосфорил-4-этилфенола в 25 мл сухого диоксана, 3.26 г (10.0 ммоль) свежепрокаленного карбоната цезия и 2.07 г (5.0 ммоль) дитозилата диэтиленгликоля. Выход L2 составил 3.98 г (75%), tпл = 143–145°С (этанол–вода).
| С | Н | P | |
| Найдено, %: | 54.15, 54.12; | 6.71, 6.87; | 11.37, 11.55. |
| Для С24Н36O9P2 | |||
| вычислено, %: | 54.34; | 6.84; | 11.68. |
Спектр ПМР (СDCl3, δ, м. д.): 1.16 т (6Н, 3Jн–н = = 7.0 Гц 2СН3СН2–Ar), 1.37 т (6Н, 3Jн–н = 7.0 Гц 2СН3СН2О), 2.68 м (4Н, Ar–СН2СН3), 4.13 м (12Н, 2ОСН2СН3 + 8Н, 2ОСН2СН2O), 6.84 м (2H, Ar–H), 7.26 м (2Н, Ar–H), 7.57 м (2H, Ar–H). Спектр ЯМР 31Р (СDCl3, δ, м. д.): 19.22.
1,8-Бис(2-оксиэтоксифосфорил-4-этилфенокси)-3,6-диоксаоктан (L3) получен аналогично L1 из 3.82 г (15.0 ммоль) 2-диэтоксифосфорил-4-этилфенола в 25 мл сухого диоксана, 4.86 г (15.0 ммоль) свежепрокаленного карбоната цезия и 3.44 г (7.5 ммоль) дитозилата диэтиленгликоля. Выход L3 составил 3.10 г (72%), tпл = 153–155°С (этанол–вода).
| С | Н | P | |
| Найдено, %: | 54.31, 54.48; | 6.93, 6.89; | 10.43, 10.63. |
| Для С26Н40O10P2 | |||
| вычислено, %: | 54.35; | 7.02; | 10.78. |
Спектр ПМР (СDCl3, δ, м. д.): 1.18 т (6Н, 3Jн–н = 7.0 Гц 2СН3СН2–Ar), 1.31 т (6Н, 3Jн–н = 7.0 Гц 2СН3СН2О), 2.61 м (4Н, Ar–СН2СН3), 4.13 м (16Н, 2ОСН2СН3 + 12Н, 3ОСН2СН2O), 6.87 м (2H, Ar–H), 7.30 м (2Н, Ar–H), 7.55 м (2H, Ar–H). Спектр ЯМР 31Р (СDCl3, δ, м. д.): 29.80.
1,11-Бис(2-оксиэтоксифосфорил-4-этилфенокси)-3,6,9-триоксаундекан (L4) получен аналогично L1 из 3.58 г (14.0 ммоль) 2-диэтоксифосфорил-4-этилфенола в 25 мл сухого диоксана, 4.56 г (14.0 ммоль) свежепрокаленного карбоната цезия и 1.73 г (7.5 ммоль) 1.11-бис-дихлор-3,6,9-триоксаундекана. Выход L4 составил 3.15 г (68%), tпл = = 120–122°С (этанол–вода).
| С | Н | P | |
| Найдено, %: | 54.21, 54.38; | 7.09, 7.19; | 9.67, 9.93. |
| Для С28Н44O11P2 | |||
| вычислено, %: | 54.37; | 7.17; | 10.01. |
Спектр ПМР (СDCl3, δ, м. д.): 1.19 т (6Н, 3Jн–н = = 7.0 Гц 2СН3СН2–Ar), 1.33 т (6Н, 3Jн–н = 7.0 Гц 2СН3СН2О), 2.61 м (4Н, Ar–СН2СН3), 4.13 м (20Н, 2ОСН2СН3 + 16Н, 2ОСН2СН2O), 6.89 м (2H, Ar–H), 7.34 м (2Н, Ar–H), 7.56 м (2H, Ar–H). Спектр ЯМР 31Р (СDCl3, δ, м. д.): 28.82.
1,14-Бис(2-оксиэтоксифосфорил-4-этилфенокси)-3,6,9,12-тетраоксатетрадекан (L5) получен аналогично L4 из 3.78 г (14.8 ммоль) 2-диэтоксифосфорил-4-этилфенола в 25 мл сухого диоксана, 4.82 г (14.8 ммоль) свежепрокаленного карбоната цезия и 1.73 г (7.4 ммоль) 1.14-бис-дихлор-3,6,9,11-тетраоксаундекана. Выход L5 составил 3.15 г (64%), tпл = 82–84°С (этанол–вода).
| С | Н | P | |
| Найдено, %: | 54.25, 54.12; | 7.11, 7.27; | 9.27, 9.14. |
| Для С30Н48O12P2 | |||
| вычислено, %: | 54.38; | 7.30; | 9.35. |
Спектр ПМР (СDCl3, δ, м. д.): 1.16 т (6Н, 3Jн–н = = 7.0 Гц 2СН3СН2–Ar), 1.35 т (6Н, 3Jн–н = 7.0 Гц 2СН3СН2О), 2.66 м (4Н, Ar–СН2СН3), 4.17 м (24Н, 2ОСН2СН3 + 20Н, 2ОСН2СН2O), 6.86 м (2H, Ar–H), 7.33 м (2Н, Ar–H), 7.58 м (2H, Ar–H). Спектр ЯМР 31Р (СDCl3, δ, м. д.): 28.12.
1,2-Бис[2-(2-оксиэтоксифосфорил-4-фенокси)этокси]бензол (L0) получен аналогично L1 из 2.75 г (10.6 ммоль) 2-диэтоксифосфорил-4-этилфенола в 25 мл сухого диоксана, 3.47 г (10.6 ммоль) свежепрокаленного карбоната цезия и 2.68 г (5.3 ммоль) дитозилата 2,2'-(1,2-фенилен-бис(oкси)диэтанола. Выход L0 составил 2.14 г (65%), tпл = 116–118°С (этанол–вода).
| С | Н | P | |
| Найдено, %: | 57.45, 57.72; | 6.41, 6.37; | 9.67, 9.84. |
| Для С30Н48O12P2 | |||
| вычислено, %: | 57.88; | 6.48; | 9.95. |
Спектр ЯМР 1Н, (СDCl3, δ, м. д.): 1.25 м (12Н, 2СН3СН2–Ar + 2ОСН2СН3), 2.61 м (4Н, 2СН3СН2–Ar), 4.14 м (4Н, 2OСН2CH3), 4.34 м (8Н, 4ОСН2), 6.93 м (6H, Ar–H), 7.26 м (2Н, Ar–H), 7.65 м (2H, Ar–H), 8.23 c (2H, 2OH). Спектр ЯМР 31Р, (СDCl3, δ, м. д.): 28.36.
| С | Н | P | |
| Найдено, %: | 57.75, 57.82; | 6.41, 6.37; | 9.97, 9.74. |
| Для С30Н40O10P2 | |||
| вычислено, %: | 57.88; | 6.48; | 9.95. |
Экстракционные исследования. Для наших исследований в качестве основного использовали водный раствор суммы РЗЭ (кроме Sc и Pm) в 1 М HNO3 с содержанием каждого металла ~1 г/л, который готовили по навескам соответствующих нитратов металлов. Точное определение концентрации РЗЭ в этом растворе проводили методом ICP MS на приборе Agilent Technologies 7500 с использованием многоэлементных стандартов.
Исследование экстракции РЗЭ проводили следующим образом. В делительную воронку помещали по 0.5 мл базового раствора и 4.5 мл раствора азотной кислоты, концентрацию которой варьировали от 0 до 1 моль/л, и 5 мл раствора лиганда в 1,1,7-тригидрододекафторгептаноле. Раствор для экстракции с нулевой концентрацией азотной кислоты получали упариванием раствора с минимальной концентрацией 0.1 моль/л HNO3 досуха. После перемешивания в течение 15–20 мин отстаивали 2–3 ч для разделения фаз (t = 20°С). Затем проводили реэкстракцию 10 мл 1 моль/л раствором HNO3 в аналогичных условиях. Для определения полноты реэкстракции к 1 мл органической фазы добавляли по 1 мл концентрированных азотной (ос. ч.) и хлорной (х. ч.) кислот и кипятили до полного разложения органических веществ, проводили так называемое “мокрое сжигание”. Остаток разбавляли бидистиллированной водой и анализировали на содержание РЗЭ. Концентрацию всех РЗЭ определяли методом ICP MS на приборе Agilent Technologies 7500.
Для каждой концентрации проводили не менее трех независимых опытов. Все эксперименты выполняли при температуре 20 ± 1°С.
Коэффициенты распределения (Kd = [M]о/[M]в) определяли при постоянных концентрациях экстрагента и металлов.
Характеристика погрешности определения концентрации металлов при доверительной вероятности Р = 0.95 в экстракционных исследованиях составляет 0.33, доверительные границы погрешности определения концентрации металла – 8.25 мкг/мл (или 0.00825 г/л).
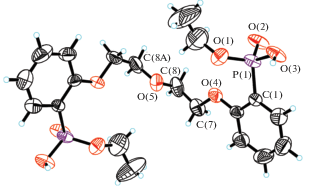
РСА. Экспериментальные данные для соединения I получены на дифрактометре Bruker SMART APEX2 [22]. Поглощение учтено полуэмпирическим методом по эквивалентам (SADABS) [23]. Структура I определена комбинацией прямого метода и Фурье-синтезов. Атом H(1) фосфорильной группы локализован из разностного синтеза Фурье, остальные атомы H рассчитаны из геометрических соображений. Структура I уточнена полноматричным анизотропным МНК, для атома H(1) уточняли координаты, остальные атомы водорода учитывали в модели “наездника”. Качество кристалла не позволило определить абсолютную конфигурацию: уточнение структуры как рацемического двойника привело к величине BASF 0.2(3). Все расчеты выполнены по программам SHELXS-2018 и SHELXL-2018 [24]. Кристаллографические данные и параметры уточнения структуры I приведены в табл. 1. Экспериментальные данные для структуры I депонированы в Кембриджском банке структурных данных данных (CCDC № 1843476).
Таблица 1.
Основные кристаллографические данные и результаты уточнения структуры I
| Соединение | I |
| Формула | C20H28O9P2 |
| М | 474.36 |
| T, K | 295(2) |
| Излучение, λ, Å | 0.71073 |
| Сингония | Ромбическая |
| пр. гр., Z | P21212, 2 |
| a, Å | 15.360(2) |
| b, Å | 15.633(2) |
| c, Å | 4.8459(8) |
| V, Å3 | 1163.6(3) |
| ρ, г/см3 | 1.354 |
| μ, мм–1 | 0.234 |
| F(000) | 500 |
| Размер образца, мм | 0.4 × 0.02 × 0.02 |
| Интервал θ, град | 2.606, 25.371 |
| Пределы h, k, l | –18 ≤ h ≤ 18, –18 ≤ k ≤ 18, –5 ≤ l ≤ 5 |
| Число измеренных отражений | 6168 |
| Число независимых отражений, Rint | 2067, 0.1491 |
| Полнота до θ = 25.242° | 97.7% |
| Max, min пропускание | 1, 0.8159 |
| Метод уточнения | МНК по F2 |
| Число параметров | 145 |
| S | 0.941 |
| R1, wR2 [I > 2σ(I)] | 0.0681, 0.0877 |
| R1, wR2 (все данные) | 0.1624, 0.1064 |
| ∆ρmax/∆ρmin э/Å3 | 0.382, –0.289 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для всех исследованных в настоящей работе подандов значения Kd обеих подгрупп РЗЭ плавно возрастают с увеличением порядкового номера элемента. Наилучшими экстракционными характеристиками обладает поданд 1,8-бис[2-(оксиэтоксифосфорил)-4-этилфенокси]-3,6-диоксаоктан (L3), этиленгликолевая цепочка которого состоит из трех звеньев. Введение бензольного фрагмента в полиэфирную цепь лиганда с целью закрепления его С-образной конформации, как и при экстракции в 1,2-дихлорэтан [14], приводит к уменьшению коэффициентов распределения РЗЭ. Результаты экспериментов приведены в табл. 2 и 3.
Таблица 2.
Коэффициенты распределения РЗЭ в зависимости от концентрации азотной кислоты в водной фазе для L3. Концентрация поданда L3 0.028 моль/л, исходная концентрация РЗЭ 0.1 г/л по каждому металлу
| HNO3, моль/л | Y | La | Ce | Pr | Nd | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 5.23 | 0.15 | 0.33 | 0.50 | 0.57 | 1.29 | 1.58 | 1.25 | 2.37 | 3.26 | 3.64 | 6.03 | 6.49 | 18.86 | 32.92 |
| 0.1 | 0.08 | 0.00 | 0.01 | 0.01 | 0.02 | 0.03 | 0.04 | 0.03 | 0.05 | 0.07 | 0.07 | 0.10 | 0.17 | 0.38 | 0.59 |
| 0.2 | 0.01 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.01 | 0.00 | 0.01 | 0.01 | 0.01 | 0.01 | 0.02 | 0.03 | 0.04 |
| 0.5 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.01 | 0.01 | 0.01 |
| 1 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 | 0.00 |
Таблица 3.
Коэффициенты распределения РЗЭ. Концентрация исходного раствора 1 г/л по каждому из металлов, концентрация подандов 0.028 М, среда нейтральная
| Ln | Y | La | Ce | Pr | Nd | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| L0 | 2.32 | 0.10 | 0.26 | 0.40 | 0.40 | 0.83 | 1.16 | 0.72 | 1.47 | 1.20 | 1.90 | 2.38 | 2.66 | 3.35 | 3.39 |
| L1 | 4.42 | 0.49 | 0.66 | 1.00 | 0.85 | 1.39 | 2.17 | 2.60 | 3.78 | 3.98 | 4.15 | 5.44 | 3.86 | 3.66 | 2.77 |
| L2 | 1.19 | 0.06 | 0.13 | 0.18 | 0.22 | 0.51 | 0.58 | 0.49 | 0.65 | 0.98 | 1.02 | 1.19 | 2.64 | 4.79 | 5.69 |
| L3 | 5.23 | 0.15 | 0.33 | 0.50 | 0.57 | 1.29 | 1.58 | 1.25 | 2.37 | 3.26 | 3.64 | 6.03 | 6.49 | 18.86 | 32.92 |
| L4 | 1.14 | 0.04 | 0.08 | 0.11 | 0.11 | 0.27 | 0.38 | 0.40 | 0.75 | 1.06 | 1.27 | 1.80 | 2.39 | 3.45 | 3.54 |
| L5 | 0.48 | 0.02 | 0.05 | 0.06 | 0.07 | 0.17 | 0.24 | 0.24 | 0.38 | 0.48 | 0.53 | 0.77 | 1.29 | 2.36 | 2.89 |
Проведенные исследования показали, что экстракционные свойства данных систем лучше проявляются в среде, приближенной к нейтральной (до 0.1 М азотной кислоты), в отличие от изученных ранее подандов нейтрального типа [25], экстракционная способность которых возрастает в сильнокислых средах (6 М). Фосфорилподанды кислотного типа, так же как и фосфорилподанды нейтрального типа, селективно извлекают РЗЭ иттриевой подгруппы лучше, чем цериевой, при прочих равных условиях.
Установлено, что реэкстракция 1М раствором HNO3 в бидистиллированной воде позволяет полностью извлечь РЗЭ из органической фазы в случае каждого лиганда. Остаточное содержание РЗЭ после такой реэкстракции в органической фазе составляло не более 10 мкг/л.
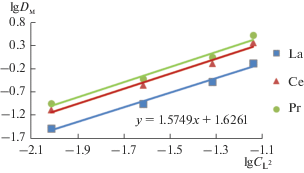
Cтехиометрию комплексов суммы РЗЭ цериевой подгруппы определяли на примере поданда L2 методом сдвига экстракционного равновесия [21], поскольку в работах [11, 12, 14] именно этот поданд был исследован наиболее полно. Зависимость lg DM от lg cL2 РЗЭ цериевой подгруппы для лиганда L2 приведена на рис. 1, из которого видно, что соотношение Ln : L2 = 2 : 3. В случае экстракции в дихлорэтан [14] стехиометрическое соотношение металл: экстрагент было определено методом сдвига равновесия и показано, что сольватное число при экстракции всех РЗЭ близко к 2.
Рис. 1.
Зависимость коэффициентов распределения при экстракции La(III), Ce(III) и Pr(III) от концентрации лиганда L2.
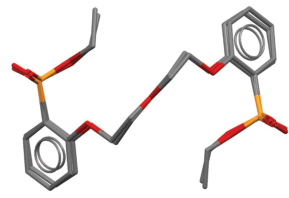
К сожалению, выделить комплексы с РЗЭ в виде монокристаллов или монокристаллы свободных Ln, пригодных для рентгеноструктурного анализа, не удалось. Ранее [26] нами методом порошкового рентгеноструктурного анализа (пРСА) была определена структура их менее липофильного структурного аналога 1,5-бис(2-оксиэтоксифосфорилфенокси)-3-оксапентана Lig (II, пр. гр. Pbcn, a = 16.830(2), b = 8.8689(15), c = = 15.718(2) Å, V = 2346.1(6) Å3, Z = 4). В настоящей работе нам удалось получить монокристалл Lig (I) из смеси ацетонитрила и бензола (1 : 5) и методом РСА определить его кристаллическую структуру.
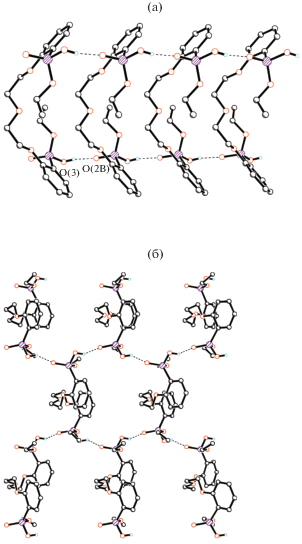
Новая модификация I кристаллизуется в пр. гр. P21212. В обеих модификациях молекула обладает кристаллографической симметрией 2, строение Lig в структурах I (рис. 2) и II одинаково (рис. 3). В структуре I “кислый” атом H участвует в образовании водородной связи (ВС) с фосфорильным атомом соседней молекулы, что приводит к образованию 1D-цепочек (рис. 4а). Геометрия ВС в структуре I: расстояния O(3)–H(1) 0.79(8), H(1)…O(2B) 1.72(8), O(3)…O(2B) 2.502(7) Å, угол O(3)–H(1)…O(2B) 168(8)°, O(2B) связан с базисным атомом O(2) трансляцией x, y, z + 1. Две ВС одной молекулы Lig объединяют в I две молекулы Lig, что приводит к образованию ${\text{R}}_{{\text{2}}}^{{\text{2}}}\left( {{\text{32}}} \right)$ цикла (рис. 3а). В структуре II аналогичная ВС объединяет молекулы Lig в 2D-слои (рис. 3б).
Объем, приходящийся на одну молекулу в структуре I, несколько меньше, чем в II (581.8 и 586.5 Å3), что позволяет говорить об энергетической выгодности полиморфа I.
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали, что фосфорилсодержащие поданды Ln, производные дифосфоновых кислот, проявляют высокую экстракционную способность в нейтральных средах. Наилучшими экстракционными характеристиками обладает 1,8-бис[2-(оксиэтоксифосфорил)-4-этилфенокси]-3,6-диоксаоктан (L3), этиленгликолевая цепочка которого состоит из трех звеньев. Потенциально он может быть использован для отделения металлов иттриевой подгруппы от цериевой. Установлена кристаллическая структура 1,5-бис(2-оксиэтоксифосфорилфенокси)-3-оксапентана и показано, что поданд существует в двух полиморфных модификациях.
БЛАГОДАРНОСТЬ
Работа выполнена в рамках государственного задания 2018 г. (темы № 0088-2014-0001, 0081-2014-0015, 0090-2017-0024) и при частичной финансовой поддержке Программы Президиума РАН № 34 и РФФИ (грант № 18-29-24069). Исследования проведены с использованием оборудования ЦКП ФМИ ИОНХ РАН. Авторы статьи благодарят В.И. Жилова за помощь в определении концентрации всех РЗЭ методом ICP MS и Л.Х. Миначеву за участие в рентгеноструктурном эксперименте.
Список литературы
El-Nadi Y.A. // Hydrometallurgy. 2012. V. 119–120. P. 23. doi https://doi.org/10.1016/j.hydromet.2012.03.003
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev. 2017. V. 46. P. 7229. doi https://doi.org/10.1039/c7cs00574a
Lumetta G.J., Sinkov S.I., Krause J.A. et al. // Inorg. Chem. 2016. V. 55. № 4. P. 13 027. doi https://doi.org/10.1021/acs.inorgchem.5b02524
Alyapyshev M., Babain V.A., Tkachenko L.I. et al. // Solvent Extr. Ion Exch. 2014. V. 32. № 2. P. 138. doi https://doi.org/10.1080/07366299.2013.833783
Makrlík E., Vaňura P., Selucký P. et al. // J. Radioanal. Nucl. Chem. 2010. V. 283. № 3. P. 839. doi https://doi.org/10.1007/s10967-009-0425-8
Li Y., Jia Y., Wang Z. et al. // RSC Advances. 2014. V. 4. № 56. P. 29702. doi https://doi.org/10.1039/C4RA02030H
Sinharoy P., Khan P.N., Nair D. et al. // Radiochim. Acta. 2016. V. 105. № 34. P. 265. doi https://doi.org/10.1515/ract-2016-2646
Tyumentsev M.S., Foreman M., Ekberg Ch. et al. // Hydrometallurgy. 2016. V. 164. P. 24. doi https://doi.org/10.1016/j.hydromet.2016.05.007
Yang Liua, Seong Ho Sohnb, Man Seung Leea // Geosystem Engineering. 2016. doi https://doi.org/10.1080/ 12269328.2016.1223558
Myasoedov B.F., Kalmykov S.N. // Mendeleev Commun. 2015. V. 25. № 5. P. 319. doi https://doi.org/10.1016/j.mencom.2015.09.001
Safiulina A.M., Matveeva A.G., Ivanets D.V. et al. // Russ. Chem. Bull. 2015. V. 64. № 1. P. 161. doi 10.1007/s11172-015-0837-2 [Сафиулина А.М., Матвеева А.Г., Иванец Д.В. и др. // Изв. Академии наук. Сер. хим. 2015. № 1. С. 161.]
Safiulina A.M., Matveeva A.G., Ivanets D.V. et al. // Russ. Chem. Bull. 2015. V. 64. № 1. P. 169. doi 10.1007/s11172-015-0838-1 [Сафиулина А.М., Матвеева А.Г., Иванец Д.В. и др. // Изв. Академии наук. Сер. хим. 2015. № 1. С. 169.]
Timofeeva G.I., Matveeva A.G., Safiulina A.M. et al. // Russ. Chem. Bull. 2015. V. 64. № 1. P. 224. doi 10.1007/s11172-015-0847-0 [Тимофеева Г.И., Матвеева А.Г., Сафиулина А.М. и др. // Изв. Академии наук. Сер. хим. 2015. Т. 64. № 1. С. 224.]
Turanov A.N., Karandashev V.K., Baulin V.E. et al. // Radiochemistry. 2014. V. 56. № 1. P. 22. doi 10.1134/ S1066362214010056 [Туранов А.Н., Карандашев В.К., Баулин В.Е. и др. // Радиохимия. 2014. Т. 56. № 1. С. 21.]
Safiullina A.M., Ivanets D.V., Kudryavtsev E.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1679. doi 10.1134/S00360236 [Сафиулина А.М., Иванец Д.В., Кудрявцев М.Е. и др. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1659. doi 10.1134/S0044457X18120188]
Safiulina A.M., Ivanets D.V., Kudryavtsev E.M. et al. // Russ. J. Inorg. Chem. 2012. V. 57. № 4. P. 601. doi 10.1134/S0036023612040213 [Сафиулина А.М., Иванец Д.В., Кудрявцев Е.М., Тананаев И.Г. // Журн. неорган. химии. 2012. Т. 57. № 4. С. 666.]
Tananaev I.G., Myasoedov B.F. // Radiochemistry. 2016. V. 58. № 3. Р. 257. doi 10.1134/S1066362216030061 [Тананаев И.Г., Мясоедов Б.Ф. // Радиохимия. 2016. Т. 58. № 3. С. 222.]
Baulin V.E., Kovalenko O.V., Turanov A.N. et al. // Radiochemistry. 2015. V. 57. № 1. P. 61. doi 10.1134/ S1066362215010099 [Баулин В.Е., Коваленко О.В., Туранов А.Н. и др. // Радиохимия. 2015. Т. 57. № 1. С. 53.]
Baulin V.E., Kalashnikova I.P., Kovalenko O.V. et al. // Prot. Met. Phys. Chem. Surf. 2016. V. 52. № 6. P. 996. doi 10.7868/ S0044185616060085 [Баулин В.Е., Калашникова И.П., Коваленко О.В. и др. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 6. С. 604.]
Чухланцева Е.В., Усолкин А.Н., Коваленко О.В. и др. // Аналитика и контроль. 2013. Т. 17. № 2. С. 219.
Демин С.В., Жилов В.И., Цивадзе А.Ю. и др. // Журн. неорган. химии. 2006. Т. 51. № 10. С. 1182.
Bruker (2007). APEX2 and SAINT. Bruker AXS Inc., Wisconsin, USA.
Sheldrick G.M., SADABS. University of Göttingen, Germany, 1997.
Sheldrick G. Crystal structure refinement with SHELXL // Acta Crystallogr., Sect. C. 2015. V. 71. № 1. P. 3.
Polyakova I.N., Krivorot’ko E.S., Ivanova I.S. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 10. P. 1372. doi 10.1134/S0036023618100169 [Полякова И.Н., Криворотько Е.С., Иванова И.С. и др. // Журн. неорган. химии. 2018. Т. 63. № 10. С. 1353. doi 10.1134/S0044457X18100161]
Baulin V.E., Ivanova I.S., Pyatova E.N. et al. // Russ. J. Inorg. Chem. 2012. V. 57. № 11. P. 1443. doi 10.1134/S0036023612110046 [Баулин В.E., Иванова И.С., Пятова Е.Н. и др. // Журн. неорган. химии. 2012. Т. 57. № 11. С. 1535.]
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии