Журнал неорганической химии, 2019, T. 64, № 5, стр. 553-562
Влияние изовалентного допирования ионами Zr4+ на электрохимическое поведение TiO2(B)
Д. П. Опра 1, *, С. В. Гнеденков 1, С. Л. Синебрюхов 1, А. Ю. Устинов 1, 2, А. Б. Подгорбунский 1, А. А. Соколов 1, 2
1 Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159д, Россия
2 Дальневосточный федеральный университет
690950 Владивосток, ул. Суханова, 8, Россия
* E-mail: dp.opra@gmail.com
Поступила в редакцию 27.10.2018
После доработки 27.10.2018
Принята к публикации 05.11.2018
Аннотация
В гидротермальных условиях синтезированы соединения на основе TiO2(B) (β-фаза TiO2), допированного ионами Zr4+ (Zr/Ti = 0.03; 0.06). Показано, что материалы представляют собой наноленты (толщина 10–15 нм, ширина 50–100 нм, длина несколько микрометров, удельная поверхность 72–76 м2/г). Установлено, что введение Zr4+ в структуру TiO2(B) сопровождается образованием твердого раствора Ti1 –xZrxO2(B) (x = 0.03; 0.06), причем объем элементарной ячейки увеличивается с ростом содержания циркония. Для допированного TiO2(B) зафиксировано повышение электропроводности на два порядка: с 1.6 × 10–11 (недопированный образец) до 8.2 × 10–10 См/см (Zr/Ti = 0.06). После 90 циклов заряда/разряда в режиме C/10 на электродах из Ti0.94Zr0.06O2(B) реализована емкость 165 мАч/г. В то же время для недопированного TiO2(B) значение этого параметра составило 135 мАч/г. При этом Ti0.94Zr0.06O2(B) сохраняет обратимую емкость около 107 мАч/г даже в условиях повышенной токовой нагрузки 5С. Основными факторами, влияющими на электрохимическое поведение Ti0.94Zr0.06O2(B), являются повышенная устойчивость структуры при внедрении/извлечении ионов Li+ и улучшенная электропроводность.
ВВЕДЕНИЕ
Литий-ионные аккумуляторы (ЛИА), основу которых составляют углеродный анод (обычно графит) и катод на основе литированного оксида металла (LiCoO2, LiMn2O4, LiNiO2), широко применяются в качестве источников питания портативной электронной техники, электроинструмента, медицинских устройств. В последнее время достаточно успешно (в основном за счет применения многокомпонентных слоистых оксидов) происходит коммерциализация данных устройств в качестве систем энергоснабжения электротранспорта, робототехнических комплексов, модулей накопления и хранения энергии от возобновляемых источников и т.д. При этом ряд проблем, характерных для электродных материалов ЛИА, остаются нерешенными по сей день. В частности, одной из задач, определяющей прогресс в данной области, является разработка новых усовершенствованных анодных материалов, способных безопасно функционировать в условиях форсированного заряда, в том числе при температурах ниже 0°С [1–3]. На этом фоне перспективной альтернативой анодным материалам на основе углеродного сырья являются соединения титана, например, титанат лития Li4Ti5O12 и диоксид титана TiO2, обладающие трехмерной кристаллической решеткой, способной свободно интеркалировать/деинтеркалировать ионы Li+, а также высоким потенциалом относительно металлического лития (около 1.5 В [4]), значение которого находится в пределах окна стабильности (1.2–4.3 В) типичных электролитов ЛИА. Стоит отметить, что в настоящее время коммерциализация титаната лития, характеризующегося превосходной устойчивостью структуры при внедрении/извлечении ионов Li+ (объемные деформации решетки не превышают 1% [5], в то время как для графита данный параметр составляет 10% [6]), уже фактически произошла (например, в качестве анода ЛИА электрокара Mitsubishi i-MiEV). Вместе с тем максимальная удельная емкость, реализующаяся при электрохимической интеркаляции ионов лития в структуру Li4Ti5O12, невысока и составляет 175 мАч/г [7]. Последний факт может стать серьезным недостатком титаната лития при его использовании в паре с потенциально высокоемкими (>200 мАч/г) катодными материалами, такими как слоистые тройные оксиды никеля-кобальта-алюминия LiNixCoyAlzO2 или марганца-никеля-кобальта LiNixMnyCozO2 (x + y + z = 1) [8–10].
С другой стороны, теоретическая емкость диоксида титана может достигать 335 мАч/г в расчете на заряженную форму LiTiO2 [11]. Для TiO2 известно четыре устойчивые кристаллографические модификации: брукит, рутил, анатаз и TiO2(B) (или β-фаза), которые все состоят из искаженных октаэдров TiO6, соединенных между собой через общие вершины и ребра [12, 13]. В то же время каждая из кристаллографических структур TiO2 характеризуется собственным характером соединения и искажения октаэдров (например, для TiO2(анатаз) на один октаэдр TiO6 приходятся четыре общих ребра, в то время как для TiO2(рутил) – два [13]), именно это является причиной различия их физико-химических характеристик и, соответственно, применения для решения задач в той или иной области [14–21].
Исходя непосредственно из особенностей кристаллической структуры, широкий интерес в качестве анодного материала представляет менее плотная (3.64–3.76 г/см3) по сравнению с другими полиморфными модификациями β-фаза TiO2, кристаллизующаяся в пространственной группе C2/m моноклинной сингонии. Структура TiO2(B) представлена слоями в плоскостях ab, состоящими из связанных ребрами и вершинами октаэдров TiO6. Слои соединены друг с другом в направлении оси с мостиковыми связями, где мостиком является кислород [22, 23]. Таким образом, β-фаза диоксида титана характеризуется наличием открытых каналов вдоль оси b, что делает ее перспективным трехмерным каркасом для размещения ионов, таких как Li+. Действительно, как было показано в [24], элементарная ячейка TiO2(B) имеет 10 кристаллографических позиций (потенциально вмещающих ионы лития) трех типов: A1 (4 позиции), A2 (4 позиции), С (2 позиции). A1 и A2 представляют собой позиции для лития, пятикратно координированные атомами кислорода (LiO5) и расположенные, соответственно, в поперечной и продольной плоскостях симметрии. Наиболее “просторная” позиция С, имеющая четырехкратную координацию с мостиковыми атомами кислорода (LiO4), находится в центре канала вдоль кристаллографической оси b. Размещение ионов лития во всех 10 позициях предполагает высокую теоретическую емкость TiO2(B) вплоть до 420 мАч/г, что соответствует 1.25 Li+ на структурную единицу диоксида титана [25]. Принимая во внимание электростатическое отталкивание (Li+–Li+), под влиянием которого ионы Li+ стремятся увеличить расстояние между собой, термодинамически благоприятным является заполнение не более 8 позиций [26], что подразумевает внедрение ионов лития в решетку TiO2(B) вплоть до 1 Li+ на структурную единицу. Важным обстоятельством, отличающим β-фазу диоксида титана от других кристаллографических модификаций, является то, что, как было впервые показано в [27], внедрение ионов лития в решетку TiO2(B) осуществляется по принципу псевдоемкости – протекание быстрых фарадеевских реакций с переносом заряда, скорость которых не ограничивается твердотельной диффузией Li+. К сожалению, использованию TiO2(B) в качестве анода ЛИА препятствует большая ширина запрещенной зоны (3.0–3.2 эВ), результатом которой является его низкая электропроводность (~10–12 См/см), [27, 28]. Кроме того, деформация кристаллической решетки диоксида титана при внедрении/извлечении ионов лития заметно выше (до 3% [29]) по сравнению с Li4Ti5O12.
Известно, что перспективным способом модифицирования соединений является введение в их кристаллическую структуру ионов металлов, которое может приводить к получению уникальных функциональных свойств. При этом выбор допирующего агента определяет физико-химические особенности материала [30–32]. Однако количество публикаций, посвященных введению ионов металлов в решетку β-фазы диоксида титана, досадно мало. Здесь следует упомянуть результаты работы [33], в которой авторы показывают, что отрицательные электроды на основе TiO2(B), допированного Fe3+, проявляют существенно более стабильное циклирование (230 мАч/г) при низкой скорости C/10 по сравнению с недопированным материалом (165 мАч/г). В работе [34] продемонстрировано устойчивое циклирование допированного ионами ниобия композитного материала TiO2(анатаз)/TiO2(B) даже при повышенных нагрузках вплоть до 30°С (около 120 мАч/г). В целом, анализ литературы отражает недостаток сведений в рамках данной проблематики.
В настоящей работе гидротермальным способом синтезированы соединения Ti1 –xZrxO2(B) (x = 0.03; 0.06). С использованием комплекса различных методов исследования изучены физико-химические особенности синтезированных материалов. Оценена эффективность изовалентного допирования ионами циркония β-фазы диоксида титана с точки зрения использования в качестве анодного материала ЛИА. Выбор циркония в качестве допирующего агента обусловлен вероятностью его положительного влияния на устойчивость структуры TiO2(B) в процессе внедрения/извлечения ионов Li+.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
При синтезе образцов Ti1 –xZrxO2(B) в качестве исходных веществ использовали порошкообразный TiO2(анатаз), оксихлорид циркония ZrOCl2 ⋅ ⋅ 8H2O, а также 10 М водный раствор NaOH. Для оптимизации концентрации циркония в кристаллической решетке диоксида титана поддерживали следующие расчетные отношения Zr/Ti: 0.03 (Ti0.97Zr0.03O2) и 0.06 (Ti0.94Zr0.06O2). Гидротермальную обработку веществ осуществляли в автоклаве Shijishuangke KH-25 объемом 20 мл при температуре 170°C в течение 96 ч. Степень заполнения автоклава составляла ~80%. После завершения стадии гидротермальной обработки автоклав извлекали из печи и охлаждали до комнатной температуры. Полученный продукт помещали в 0.05 М раствор HCl на 72 ч при постоянном перемешивании на магнитной мешалке IKA C-MAG HS 7 с целью осуществления ионного обмена Na+ на H+. Раз в 24 ч производили замену раствора HCl. По окончании стадии ионообмена осадок отделяли от раствора на центрифуге Hettich EVA 200, промывали дистиллированной водой до pH 7, а затем сушили на воздухе в течение 12 ч при температуре 80°C. Кристаллизацию образцов проводили путем выдержки в атмосфере воздуха при температуре 400°C в течение 3 ч. Сравнение свойств допированного цирконием диоксида титана осуществляли относительно недопированного TiO2, синтезированного в тех же условиях, но в отсутствие оксихлорида циркония.
Анализ морфологии проводили методом сканирующей электронной микроскопии (СЭМ) с помощью Hitachi S5500 (Япония). Распределение элементов исследовали на микроскопе Hitachi TM3000 (Япония) с приставкой Bruker Quantax 70 (Германия) для рентгеновского энергодисперсионного микроанализа. Кристаллическую структуру изучали методом рентгенофазового анализа (РФА) с использованием дифрактометра Stoe Stadi P (ФРГ). Анализ экспериментальных РФА-дифрактограмм проводили с привлечением программного обеспечения EVA в соответствии с базой эталонных данных PDF-2 (2006 г.). Удельную поверхность определяли методом Брунауэра–Эмметта–Теллера (БЭТ) на анализаторе Micrometrics ASAP 2020 V3.04 H (США). Химический состав поверхности исследовали методом рентгеновской фотоэлектронной спектроскопии (РФЭС) с помощью комплекса SPECS (ФРГ) на основе 150 мм полусферического электростатического анализатора Phoibos-150. Калибровку РФЭС-спектров проводили по линии C1s углеводородов, энергия связи которой полагалась равной 285.0 эВ. Электропроводность исследовали при комнатной температуре методом электрохимической импедансной спектроскопии (ЭИС) по двухэлектродной схеме с помощью анализатора частотного отклика Solartron 1260 (Великобритания). Пробоподготовку для ЭИС-измерений проводили прессованием образца в форме таблетки, на торцы которой наносили серебряную электропроводную краску Dotite D-550 (Япония), обеспечивающую электрический контакт с измерительным устройством.
Электродную массу получали путем смешения в N-метилпирролидоне 80 мас. % Ti1 – xZrxO2(B), 10 мас. % ацетиленовой сажи Super P и 10 мас. % поливинилиденфторида. С помощью автоматического устройства MTI EQ-AFA-I (США) массу наносили равномерным слоем толщиной 50 мкм на медный токосъемник. Электродную пластину подвергали сушке при 60°С в течение 5 ч, после чего вырубали электродные диски площадью 1.75 см2. Содержание активного вещества на 1 см2 площади электрода составляло около 2 мг.
Источник тока изготавливали в боксе Plas-Labs 890-NB (США) в атмосфере аргона (99.999%) с использованием двухэлектродной ячейки Bio-Logic ECC-STD Сell (Франция). Диск металлического лития использовали в качестве и противоэлектрода, и электрода сравнения. Электролит представлял собой 1 М раствор LiClO4 в смеси пропиленкарбоната и диметоксиэтана в объемном соотношении 5 : 1. Электрохимические испытания проводили с использованием потенциостата/гальваностата Solartron 1470E (Великобритания) в режиме гальваностатического заряда/разряда в диапазоне от 1.0 до 3.0 В при различных плотностях тока. Механизм электрохимического внедрения/извлечения ионов лития в/из Ti1 – xZrxO2(B) изучали методом циклической вольтамперометрии (ЦВ) при скорости развертки потенциала 100 мкВ/с.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1а представлены дифрактограммы Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06) соединений, синтезированных гидротермальным способом. Положение рефлексов позволяет идентифицировать образцы как β-фазу диоксида титана (JSCD 74-1940) моноклинной сингонии (пр. гр. C2/m). Введение Zr4+ вплоть до отношения Zr/Ti = 0.06 не приводит к изменению фазового состава материала. В то же время наблюдается сдвиг дифракционных пиков, характеризующий искажение элементарной ячейки TiO2(B). Ионный радиус Zr4+ составляет 0.72 Å (КЧ = 6), в то время как радиус иона Ti4+ равен 0.604 Å (КЧ = 6) [35]. Следовательно, за счет разницы в значениях ионных радиусов частичное замещение ионов Ti4+ на Zr4+ способно вызвать изменение параметров решетки. Действительно, анализ дифрактограмм показывает, что повышение концентрации Zr допанта в Ti1 – xZrxO2(B) приводит к увеличению параметров a, b, с и β элементарной ячейки (табл. 1), подтверждая тем самым факт внедрения Zr4+в решетку TiO2(B) с образованием твердого раствора Ti1 –xZrxO2(B) (x = = 0.03; 0.06). Значение объема элементарной ячейки (V) Ti1 – xZrxO2(B), меняющееся в диапазоне 279.394–281.086 Å3 (табл. 1), строго коррелирует с атомным отношением Zr/Ti. При этом увеличение объема элементарной ячейки TiO2(B) потенциально способно привести к уменьшению структурных напряжений в кристаллической решетке, вызванных внедрением/извлечением ионов, например, Li+. Следует отметить, что на дифрактограммах образцов Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06) регистрируются рефлексы тетрагональной (пр. гр. I41/amd) фазы TiO2(анатаз) (JSCD 214-1272), которая образуется в следовых количествах в процессе прокаливания при 350–500°С слоистого протонированного титаната [36, 37]. Действительно, дифрактограмма (рис. 1б) недопированного TiO2(B) образца после сушки при 80°С (т.е. до прокаливания при 400°C) демонстрирует наличие пиков, характерных только для H2Ti3O7, подтверждая тем самым, что прекурсор TiO2(анатаз) полностью прореагировал с раствором гидроксида натрия в процессе гидротермальной обработки в среде NaOH.
Рис. 1.
Рентгеновские дифрактограммы: а – всех синтезированных образцов Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06); б – недопированный образец после сушки при 80°С (до прокаливания при 400°C).
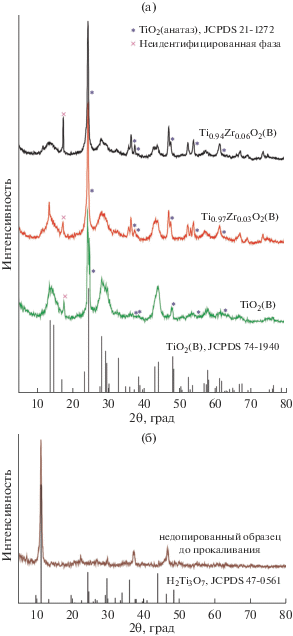
Таблица 1.
Изменение параметров решетки TiO2(B) в результате допирования ионами Zr4+
| Образец | a, Å | b, Å | c, Å | β, град | V, Å3 |
|---|---|---|---|---|---|
| TiO2(B) | 12.246 | 3.735 | 6.366 | 106.353 | 279.394 |
| Ti0.97Zr0.03O2(B) | 12.255 | 3.741 | 6.371 | 106.288 | 280.362 |
| Ti0.94Zr0.06O2(B) | 12.268 | 3.745 | 6.372 | 106.230 | 281.086 |
Исследование методом СЭМ показывает, что образцы Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06) обладают схожей морфологией. В качестве примера на рис. 2 представлены изображения, характеризующие микроструктуру образца Ti0.94Zr0.06O2(B). Как следует из полученных данных, гидротермальная обработка в среде NaOH при 170°C в течение 96 ч приводит к трансформации частиц TiO2(анатаз) в ленточные (nanobelts) наноструктуры TiO2(B) толщиной 10–15 нм, шириной 50–100 нм и длиной в несколько микрометров. Для более глубокого анализа особенностей микроструктуры синтезированных образцов методом адсорбции азота были проведены измерения величин их удельной поверхности. Полученные данные показывают, что площадь поверхности Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06) практически не изменяется и составляет 72–76 м2/г. Таким образом, допирование β-фазы диоксида титана ионами циркония не приводит к значимому изменению микроструктуры поверхности.
Картирование (рис. 3) показало однородное распределение в нанолентах Ti0.94Zr0.06O2(B) элементов Ti, Zr и O. Следовательно, цирконий равномерно внедряется в решетку TiO2(B), причем отношение Zr/Ti для исследуемого образца составило 0.059, что близко к расчетному значению (0.06).
Результаты исследования состава поверхностных слоев Ti0.94Zr0.06O2(B) методом РФЭС находятся в полном соответствии с данными ЭДС. В частности, обзорный спектр (рис. 4а) показывает присутствие сигналов Ti2p-, O1s- и Zr3d-линий. Анализ спектра высокого разрешения Ti2p (рис. 4б) показывает наличие линий Ti2p1/2 при 464.6 эВ и Ti2p3/2 при 458.8 эВ, соответствующих титану в степени окисления +4 [38]. Выявить в энергетическом спектре Ti0.94Zr0.06O2(B) наличие титана в состоянии Ti3+ (около 455.0 эВ [39]) не удалось. Спектр O1s (рис. 4в) представлен неравномерно уширенной линией, что говорит о его многокомпонентности. Линия O1s при 532.1 эВ позволяет предположить наличие H–O-, C–O-, и O=C–O-групп [40], в то время как полоса энергии связи 530.1 эВ относится к O1s-электронам TiO2 [41]. Следует отметить, что, согласно экспериментальным данным (табл. 2), атомное отношение O/Ti близко к 2 (44.3/20.1). РФЭС-спектр высокого разрешения Zr3d (рис. 4г) имеет фотоэлектронные линии Zr3d5/2 при 182.3 эВ и Zr3d3/2 при 184.8 эВ, что говорит о нахождении циркония в степени окисления +4 в структуре допированного TiO2(B) [42]. Согласно РФЭС-данным, атомное отношение Zr/Ti в Ti0.94Zr0.06O2(B) составляет 0.064 (табл. 2), что согласуется с расчетным значением и результатами ЭДС. Обработка спектра С1s (рис. 4д) показывает, что пик углерода состоит из нескольких компонент. Значения энергии связи 289.0 и 286.6 эВ соответствуют углероду, входящему в состав С=O- и С–O-групп соответственно [40]. Линия при 285.0 эВ в спектре С1s отражает наличие алифатического углерода [43].
Рис. 4.
РФЭС спектры поверхности Ti0.94Zr0.06O2(B): а – обзорный; б – Ti2p; в – O1s; г – Zr3d; д – С1s.
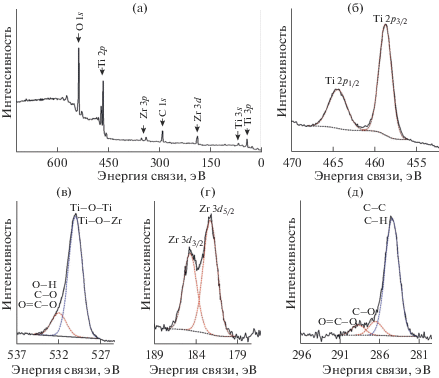
Таблица 2.
Химическое состояние и содержание элементов в Ti0.94Zr0.06O2(B)
| Пик | Содержание, ат. % | Энергия связи, эВ |
|---|---|---|
| Ti2p | 20.1 | 458.8 |
| 464.6 | ||
| О1s | 44.3 | 530.1 |
| 8.4 | 532.1 | |
| Zr3d | 1.3 | 184.8 |
| 182.3 | ||
| C1s | 2.4 | 289.0 |
| 3.2 | 286.6 | |
| 20.3 | 285.0 |
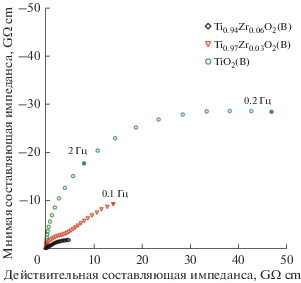
Согласно данным ЭИС (рис. 5), электропроводность недопированного TiO2(B), Ti0.97Zr0.03O2(B) и Ti0.94Zr0.06O2(B) составила 1.6 × 10–11, 1.7 × 10–10 и 8.2 × 10–10 См/см соответственно. Наблюдаемое в результате внедрения Zr4+ увеличение проводимости диоксида титана, в целом, невысоко. Действительно, электронные свойства TiO2 определяются концентрацией свободных электронов в зоне проводимости и/или дырок в валентной зоне. Как известно, эффективным способом генерации свободных носителей заряда является допирование TiO2 ионами металлов, имеющих степень окисления выше или ниже +4. Например, внедрение в TiO2(анатаз) ионов V5+ приводит к увеличению электропроводности материала до 1.2 × 10–6 См/см [44].
С целью изучения влияния изовалентного допирования ионами циркония β-фазы диоксида титана на его электрохимическое поведение в качестве анода ЛИА в рамках данного проекта были проведены исследования методами гальваностатического заряда/разряда и циклической вольтамперометрии.
На рис. 6а представлены кривые заряда/разряда первого цикла для образцов Ti0.97Zr0.03O2(B), Ti0.94Zr0.06O2(B) и недопированного TiO2(B) при скорости циклирования C/10 (плотность тока 33.5 мА/г). Следует отметить типичный для диоксида титана в кристаллографической модификации бронз вид кривых, на которых присутствуют относительно пологие участки (с малым углом наклона) при 1.5–1.6 В. Соответствующие представленным кривым процессы интеркаляции и деинтеркаляции ионов лития протекают согласно реакциям:
Рис. 6.
Профили заряда/разряда первого цикла Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06) электродов, полученные при плотности тока 33.5 мА/г (a); 90-кратное циклирование синтезированных материалов в режиме С/10 в диапазоне 1.0–3.0 В (процессы внедрения и извлечения Li+ отмечены соответственно пустыми и заполненными символами) (б); зависимость обратимой емкости образцов от плотности тока (указаны на рисунке) (в); циклические вольтамперограммы Ti0.94Zr0.06O2(B) электрода с первого по десятый цикл (г).
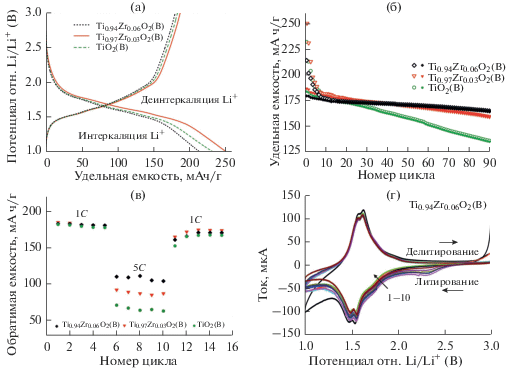
Небольшие перегибы в области 1.75 В на гальваностатических кривых, соответствующих процессу внедрения ионов Li+, следует отнести к вкладу TiO2(анатаз) [45], присутствующего в образцах в виде примеси. Как следует из полученных данных, значения интеркаляционной и деинтеркаляционной емкости для всех образцов достигают 214–250 и 180–187 мАч/г соответственно, что согласуется с данными других авторов [46, 47]. По результатам 90-кратного циклирования (рис. 6б), обратимая емкость для электродов на основе Ti0.97Zr0.03O2(B) и Ti0.94Zr0.06O2(B) все еще составляет 159 и 165 мАч/г соответственно, в то время как значение данного параметра для недопированного TiO2(B) не превышает 135 мАч/г. По-видимому, изменение параметров кристаллической решетки и объема элементарной ячейки допированного цирконием диоксида титана, по крайней мере частично, компенсирует объемные деформации и обеспечивает повышенную устойчивость структуры при внедрении/извлечении ионов Li+.
Исследование при высокой плотности тока (рис. 6в) также демонстрирует некоторое различие в поведении электродов на основе Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06). Действительно, при скорости циклирования 5С (плотность тока 1675 мА/г) Ti0.94Zr0.06O2(B) сохраняет удельную емкость около 107 мАч/г, в то время как ее значения для недопированного TiO2(B) и Ti0.97Zr0.03O2(B) составляют 64 м и 88 мА ч/г соответственно. При этом прослеживается четкая взаимосвязь между проводимостью материалов и их способностью функционировать при повышенных токовых нагрузках. Следует отметить, что при возвращении к низкой скорости циклирования C/10 (33.5 мА/г) емкость образцов восстанавливалась практически полностью.
Циклические вольтамперограммы с первого по десятый цикл (рис. 6г) для Ti0.94Zr0.06O2(B) электрода, характеризующие механизм интеркаляции/деинтеркаляции ионов Li+ в/из структуру(ы) β-фазы диоксида титана, имеют вид, свойственный для обратимых процессов. Наличие так называемых S-пиков в катодных областях ЦВ-кривых около 1.48 и 1.54 В определяется интеркаляцией ионов Li+ в A1- и A2/C-позиции кристаллической структуры TiO2(B) соответственно [27]. Анодные пики вблизи 1.59 и 1.61 В отражают деинтеркаляцию ионов лития из соответствующих позиций. Наличие размытого A-пика при 1.75 В в катодной области ЦВ-кривых определяется литированием TiO2(анатаз) [27], присутствующего в следовых количествах в составе материала. Симметричность S-пиков в катодной и анодной областях свидетельствует о практически полном извлечении внедренных ионов лития. ЦВ-кривые десятого цикла по интенсивности пиков несколько отличаются от начальных, что определяется наличием необратимых процессов по мере циклирования, в том числе формированием твердоэлектролитного слоя (в диапазоне напряжений 1.0–1.2 В) на границе раздела электрод/электролит [48–50].
ЗАКЛЮЧЕНИЕ
В настоящей работе гидротермальным способом синтезирован наноструктурированный диоксид титана в кристаллографической модификации бронз TiO2(B) (β-фаза TiO2), допированный ионами Zr4+ (Zr/Ti = 0.03; 0.06). Результаты анализа РФА-дифрактограмм образцов демонстрируют, что допирование TiO2(B) сопровождается внедрением ионов Zr4+ в решетку путем частичного замещения Ti4+ с образованием твердого раствора Ti1 – xZrxO2(B) (x = 0.03; 0.06). При этом значения a, b, с и β параметров решетки и объема элементарной ячейки Ti1 –xZrxO2(B) строго коррелируют с атомным отношением Zr/Ti. Совокупность данных РФЭС и ЭДС демонстрирует однородное распределение в образцах Ti1 –xZrxO2(B) элементов Ti, Zr и O. Следовательно, цирконий равномерно внедряется в решетку TiO2(B). Методом СЭМ показано, что синтезированные материалы представляют собой ленточные (nanobelts) наноструктуры TiO2(B) толщиной 10–15 нм, шириной 50–100 нм и длиной в несколько микрометров. Исследование методом адсорбции азота показало, что удельная площадь поверхности синтезированных образцов составляет 72–76 м2/г. Согласно результатам ЭИС, допирование TiO2(B) ионами циркония Zr4+ приводит к повышению электропроводности приблизительно на два порядка: 1.6 × 10–11, 1.7 × 10–10 и 8.2 × 10–10 См/см для недопированного TiO2(B), Ti0.97Zr0.03O2(B) и Ti0.94Zr0.06O2(B) соответственно. Методом гальваностатического заряда/разряда показано, что после 90-кратного циклирования в диапазоне от 1.0 до 3.0 В при плотности тока 33.5 мА/г (C/10) обратимая емкость для электродов на основе Ti0.97Zr0.03O2(B) и Ti0.94Zr0.06O2(B) составляет 159 и 165 мАч/г соответственно, в то время как значение данного параметра для недопированного TiO2(B) не превышает 135 мА ч/г. Последний факт демонстрирует, что изменение параметров кристаллической решетки и объема элементарной ячейки допированного цирконием диоксида титана, по крайней мере частично, компенсирует объемные деформации и обеспечивает повышенную устойчивость структуры при внедрении/извлечении ионов Li+. Исследование при высокой плотности тока также показывает некоторое различие в поведении электродов на основе Ti1 –xZrxO2(B) (x = 0; 0.03; 0.06). В частности, при скорости циклирования 5С (плотность тока 1675 мА/г) Ti0.94Zr0.06O2(B) сохраняет удельную емкость около 107 мА ч/г, в то время как ее значение для недопированного TiO2(B) равно 64 мА ч/г. Полученные данные демонстрируют строгую корреляцию между проводимостью материалов и их работоспособностью при повышенных плотностях тока в качестве анодов литий-ионного аккумулятора.
Список литературы
Mikhaylov A.A., Medvedev A.G., Tripol’skaya T.A. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 11. P. 1430.
Menictas C., Skyllas-Kazacos M., Lim T.M. Advances in batteries for medium and large-scale energy storage. Sawston, Cambridge: Woodhead Publishing, 2015.
Mikhaylov A.A., Medvedev A.G., Grishanov D.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 12. P. 1624.
Stenina I.A., Kulova T.L., Skundin A.M. et al. // J. Solid State Electrochem. 2018. V. 22. № 9. P. 2631.
Nikiforova P.A., Stenina I.A., Kulova T.L. et al. // Inorg. Mater. 2016. V. 52. № 11. P. 1137.
Drozhzhin O.A., Vorotyntsev M.A., Maduar S.R. et al. // Electrochim. Acta. 2013. V. 89. № 9. P. 262.
Stenina I.A., Sobolev A.N., Kuz’mina A.A. et al. // Inorg. Mater. 2017. V. 53. № 10. P. 1039.
Ahmed S., Trask S.E., Dees D.W. et al. // J. Power Sources. 2018. V. 403. P. 56.
Kulova T.L., Skundin A.M. // Russ. J. Electrochem. 2016. V. 52. № 6. P. 501.
Voronov V.A., Shvetsov A.O., Gubin S.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 9. P. 1153.
Aravindan V., Lee Y.-S., Yazami R. et al. // Mater. Today. 2015. V. 18. № 9. P. 345.
Gerasimova T.V., Evdokimova (Galkina) O.L., Kraev A.S. et al. // Micropor. Mesopor. Mater. 2016. V. 235. P. 185.
Ge M., Cao C., Huang J. et al. // J. Mater. Chem. A. 2016. V. 4. № 18. P. 6772. doi https://doi.org/10.1039/C5TA09323F
Agafonov A.V., Afanas’ev D.A., Borilo L.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 5. P. 560.
Jia J., Mu L., Lin Y. et al. // Electrochem. Acta. 2018. V. 266. P. 103.
Simonenko N.P., Nikolaev V.A., Simonenko E.P. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 8. P. 929.
Manera M.G., Taurino A., Catalano M. et al. // Sensor. Actuat. B: Chem. 2012. V. 161. № 1. P. 869.
Soderginova M.M., Tarasova D.V., Chibirova F.Kh. // Russ. J. Inorg. Chem. 2016. V. 61. № 6. P. 695.
Kozyukhin S.A., Grinberg V.A., Baranchikov A.E. et al. // Russ. J. Electrochem. 2013. V. 49. № 5. P. 423.
Zherebtsov D.A., Kulikovskikh S.A., Viktorov V.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 1451.
Ivanov V.K., Maksimov V.D., Shaporev A.S. et al. // Russ. J. Inorg. Chem. 2010. V. 55. № 2. P. 150.
Dylla A.G., Henkelman G., Stevenson K.J. // Acc. Chem. Res. 2013. V. 46. № 5. P. 1104.
Okumura T., Fukutsuka T., Yanagihara A. et al. // J. Mater. Chem. 2011. V. 21. P. 15369.
Brohan L., Marchand R. // Solid State Ionics. 1983. V. 9–10. № 1. P. 419.
Dalton A.S., Belak A.A., Van der Ven A. // Chem. Mater. 2012. V. 24. № 9. P. 1568.
Armstrong A.R., Arrouvel C., Gentili V. et al. // Chem. Mater. 2010. V. 22. P. 6426.
Zukalová M., Kalbáč M., Kavan L. et al. // Chem. Mater. 2005. V. 17. P. 1248.
Zhang Z., Zhou Z., Nie S. et al. // J. Power Sources. 2014. V. 267. P. 388.
Etacheri V., Yourey J.E., Bartlett B.M. // ACS Nano. 2014. V. 8. № 2. P. 1491.
D’yachkov E.P., Bochkov I.A., Zaluev V.A. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 8. P. 1048.
Zaleska A. // Recent Pat. Eng. 2008. V. 2. P. 157.
D’yachkov E.P., Makaev D.V., Khoroshavin L.O. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 8. P. 931.
Grosjean R., Fehse M., Pigeot-Remy S. et al. // J. Power Sources. 2015. V. 278. P. 1.
Ventosa E., Mei B., Xia W. et al. // ChemSusChem. 2013. V. 6. P. 1312.
Shannon R.D. // Acta Crystallogr. 1976. V. A32. № 5. P. 751.
Yang Z., Du G., Guo Z. et al. // Electrochem. Commun. 2011. V. 13. P. 46.
Zakharova G.S. // Russ. J. Inorg. Chem. 2014. V. 59. № 1. P. 24.
Wang Y., Smarsly B.M., Djerdj I. // Chem. Mater. 2010. V. 22. № 24. P. 6624.
Lai Y., Liu W., Fang J. et al. // RCS Adv. 2015. V. 5. P. 93 676.
Kyeremateng N.A., Vacandio F., Sougrati M.-T. et al. // J. Power Sources. 2013. V. 224. P. 269.
Benjwal P., Kar K.K. // RCS Adv. 2015. V. 5. P. 98166.
Stefanov P., Stoychev D., Stoycheva M. et al. // Surf. Interf. Anal. 2000. V. 30. P. 628.
Gnedenkov S.V., Sinebryukhov S.L., Zheleznov V.V. et al. // R. Soc. Open Sci. 2018. V. 5. Article ID 171811.
Anh L.T., Rai A.K., Thi T.V. et al. // J. Power Sources. 2013. V. 243. P. 891.
Stenina I.A., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. // Russ. J. Inorg. Chem. 2015. V. 60. № 11. P. 1380.
Liu Z., Andreev Yu.G., Armstrong A.R. et al. // Prog. Nat. Sci.: Mater. Int. 2013. V. 23. № 3. P. 235.
Mason C.W., Yeo I., Saravanan K., Balaya P. // RCS Adv. 2013. V. 3. P. 2935.
Brutti S., Gentili V., Menard H. et al. // Adv. Energ. Mater. 2012. V. 2. P. 322.
Makaev S.V., Ivanov V.K., Kulova T.L. et al. // Russ. J. Inorg. Chem. 2010. V. 55. № 7. P. 991.
Churikov A.V., Ivanishchev A.V., Ivanishcheva I.A. et al. // Russ. J. Electrochem. 2008. V. 44. P. 530.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии