Журнал неорганической химии, 2019, T. 64, № 6, стр. 646-654
Фазовые равновесия в системе Cu2Se–SnSe–CuSbSe2
Э. Н. Исмаилова 1, Л. Ф. Машадиева 1, *, И. Б. Бахтиярлы 1, М. Б. Бабанлы 1
1 Институт катализа и неорганической химии им. М. Нагиева НАН Азербайджана
AZ-1143 Баку, пр-т Г. Джавида, 113, Азербайджан
* E-mail: leylafm76@gmail.com
Поступила в редакцию 13.06.2018
После доработки 15.11.2018
Принята к публикации 23.11.2018
Аннотация
Методами дифференциального термического и рентгенофазового анализа изучены фазовые равновесия в системе Cu2Se–SnSe–CuSbSe2. Сплавы получены сплавлением предварительно синтезированных и идентифицированных исходных соединений в вакууме с последующим отжигом при 650 K в течение 500 ч. Построены политермические сечения SnSe–Cu3SbSe3, Cu2Se–[A], CuSbSe2–[B], где [A] и [В] – сплавы состава (SnSe)0.5(CuSbSe2)0.5 и (Cu2Se)0.5(SnSe)0.5 соответственно, и изотермическое сечение при 300 K фазовой диаграммы, а также проекция поверхности ликвидуса. Показано, что данная система является квазитройной плоскостью четверной системы Cu–Sn–Sb–Se и характеризуется нонвариантными переходным и эвтектическим равновесиями. Определены поля первичной кристаллизации фаз, типы и координаты нон- и моновариантных равновесий. Выявлены широкие области твердых растворов на основе SnSe и CuSbSe2.
ВВЕДЕНИЕ
Тройные халькогениды меди и серебра на протяжении многих лет вызывают большой интерес благодаря тому, что многие из них проявляют фотоэлектрические, термоэлектрические, нелинейные оптические и др. свойства, а также смешанную электронно-ионную проводимость. Это делает их перспективными для применения в качестве преобразователей энергии, электродных материалов, составных элементов аналоговых интеграторов, твердотельных топливных элементов, ионисторов, электрохромных визуализаторов, ионоселективных электродов и т.д. [1–9]. В частности, системы Cu–Sb–Sn–X (X = S, Se) представляют большой практический интерес в связи с возможностью разработки на их основе новых экологически безопасных термоэлектрических материалов. Согласно результатам исследований последних лет, некоторые фазы с общей формулой Cu12 –xМxSb4S13 –ySey (M = Zn, Sn, Fe, Co, Ni и т.д.) – производные от синтетического аналога минерала тетраэдрита Cu12Sb4S13 – демонстрируют высокие значения коэффициента термоэлектрической добротности (ZT = 1) в среднетемпературном диапазоне (600–800 K), что сопоставимо или превышает значения ZT для классических коммерческих термоэлектриков на основе теллуридов свинца и висмута [10–20].
Для разработки научных основ синтеза новых многокомпонентных фаз и материалов целесообразно исследовать фазовые равновесия и термодинамические свойства соответствующих систем [21, 22]. Ранее нами [23–28] были проведены подобные комплексные исследования сложных систем на основе халькогенидов меди.
В настоящей работе представлены новые экспериментальные данные по фазовым равновесиям в квазитройной системе Cu2Se–SnSe–CuSbSe2 (I).
Все исходные компоненты системы I плавятся конгруэнтно. Соединение Cu2Se плавится при 1403 K, претерпевая полиморфное превращение при 396 K [29] и имеет область гомогенности в сторону избытка селена, максимальную при 800 K (33.3–36.6 ат. % Se). Высокотемпературная модификация селенида меди кристаллизуется в кубической решетке (пр. гр. Fm3m) с параметром а = 5.859(1) Å, а низкотемпературная имеет моноклинную решетку (пр. гр. C2/c) с параметрами: a = 7.1379(4), b = 12.3823(7), с = 27.3904(9) Å, β = = 94.308° [30]. Соединение SnSe плавится при 1153 K [29] и кристаллизуется в орторомбической решетке (пр. гр. Pcmn) с параметрами: a = 4.44175 (7), b = 4.15096 (5), c = 11.49417 (12) Å [31]. Соединение CuSbSe2 плавится конгруэнтно при 760 K [2] (при 753 K по данным [32], при 765 K по данным [33]), имеет алмазоподобную структуру и кристаллизуется в орторомбической решетке (пр. гр. Pnma) с параметрами: a = 6.467, b = 4.045, c = 15.048 Å; Z = = 4 [34].
Граничные квазибинарные системы Cu2Se–SnSe, Cu2Se–CuSbSe2 и SnSe–CuSbSe2 изучены в работах [2, 33, 35–38]. Система Cu2Se–SnSe имеет фазовую диаграмму простого эвтектического типа с координатами эвтектики 813 K и 46 мол. % Cu2Se [35].
В системе Cu2Se–CuSbSe2 образуется одно тройное соединение Cu3SbSe3, плавящееся инконгруэнтно при 808 K [2, 33] (по данным [36], при 800 K) и кристаллизующееся в орторомбической решетке (пр. гр. Pnma) с параметрами: a = = 7.9865(8), b = 10.6138(9), c = 6.8372(7) Å, Z = 4 [37]. В системе при 748 K кристаллизуется эвтектический расплав состава 90 мол. % CuSbSe2 [2, 33].
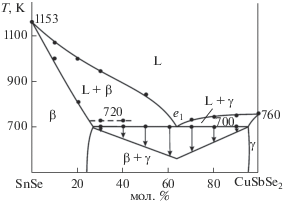
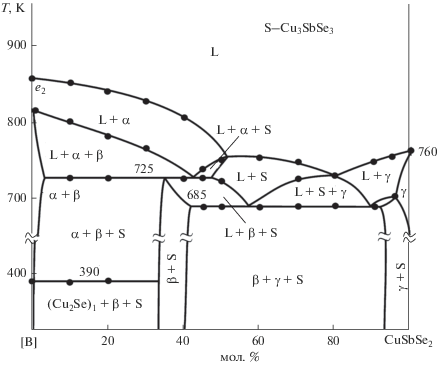
Фазовая диаграмма граничной системы SnSe–CuSbSe2 (рис. 1) построена нами [38] на основании данных дифференциального термического (ДТА) и рентгенофазового анализа (РФА). Диаграмма системы эвтектического типа с ограниченной растворимостью на основе исходных соединений. Эвтектика имеет состав ∼63 мол. % CuSbSe2 и кристаллизуется при 700 K. Растворимость на основе SnSe (β-фаза) и CuSbSe2 (γ-фаза) максимальна при эвтектической температуре и составляет ∼25 и 5 мол. % соответственно.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для экспериментов использовали простые вещества фирмы Evochem Advanced Materials GMBH (Германия) высокой степени чистоты: медь в гранулах (Cu-00029, 99.9999%), сурьму в гранулах (Sb-00002, 99.999%), олово в гранулах (Sn-00005, 99.999%), селен в гранулах (Sе-00002, 99.999%). Бинарные и тройные соединения для исследования фазовых равновесий в системе I синтезировали сплавлением простых веществ в стехиометрических соотношениях в вакуумированных до ~10–2 Па и запаянных кварцевых ампулах при температурах на 50° выше температур плавления синтезируемых соединений. При синтезе соединений CuSbSe2 и Cu3SbSe3 ампулы с навесками нагревали до 800 и 850 K соответственно, полученные расплавы выдерживали при этих температурах в течение 3–4 ч. После синтеза ампулу с CuSbSe2 охлаждали в режиме выключенной печи до 300 K. Учитывая инконгруэнтный характер плавления Cu3SbSe3 и рекомендации работы [39], после синтеза ампулу с этим соединением быстро охлаждали из расплава, а затем отжигали при 600–673 K. Синтез соединений Cu2Se и SnSe проводили в двухзонной наклонной печи. Температура нижней “горячей” зоны для Cu2Se и SnSe составляла 1420 и 1200 K соответственно, а верхней “холодной” – 900 K, что несколько ниже точки кипения селена (958 K [40]). Для получения однородного Cu2Se стехиометрического состава после синтеза проводили закалку от температуры 1300 K в холодную воду [41].
Индивидуальность всех синтезированных соединений контролировали методами ДТА и РФА. Полученные температуры плавления и параметры кристаллических решеток всех синтезированных соединений в пределах погрешности (±3 K и ±0.0003 Å) были близки к вышеуказанным литературным значениям.
Для проведения экспериментов сплавлением исходных соединений в условиях вакуума были приготовлены 36 сплавов, составы которых находятся по разрезам SnSe–Cu3SbSe3, Cu2Se–[A] и CuSbSe2–[В] ([A] и [В] – сплавы состава (SnSe)0.5(CuSbSe2)0.5 и (Cu2Se)0.5(SnSe)0.5 соответственно), а также ряд дополнительных сплавов вне их. По данным ДТА литых негомогенезированных сплавов, их кристаллизация из расплавов завершается при 685 K. С учетом этого для достижения состояния, максимально близкого к равновесному, литые сплавы, полученные быстрым охлаждением расплавов, были отожжены при 650 K в течение 500 ч. При визуальном наблюдении отожженных образцов состава 90–95 мол. % Cu2Se по разрезу Cu2Se–[А] были обнаружены следы металлической меди, что связано с отклонением полуселенида меди от стехиометрии.
ДТА проводили в интервале температур от комнатной до 1400 K со скоростью нагревания 10 град/мин на дифференциальном сканирующем калориметре 404 F1 Pegasus System фирмы Netzsch. Результаты измерений обрабатывали с помощью программного обеспечения Netzsch Proteus Software. Точность измерения температуры составляла ±2 K.
РФА проводили при комнатной температуре на дифрактометре D8 Advance фирмы Bruker с CuKα1-излучением. Рентгенограммы индексировали с помощью программы Topas V3.0 Software Bruker.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Совместная обработка всех полученных экспериментальных результатов с использованием литературных данных по боковым системам Cu2Se–SnSe [35], Cu2Se–Sb2Se3 [2, 33] и SnSe–CuSbSe2 [38] позволила получить взаимосогласованную картину фазовых равновесий в системе Cu2Se–SnSe–CuSbSe2.
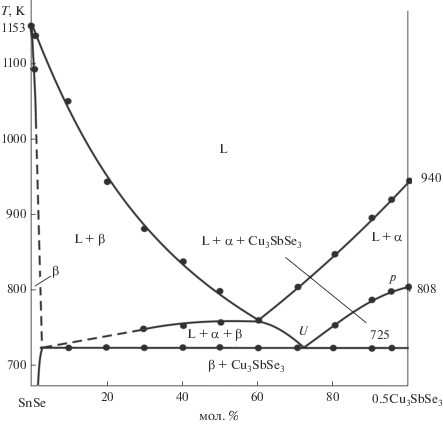
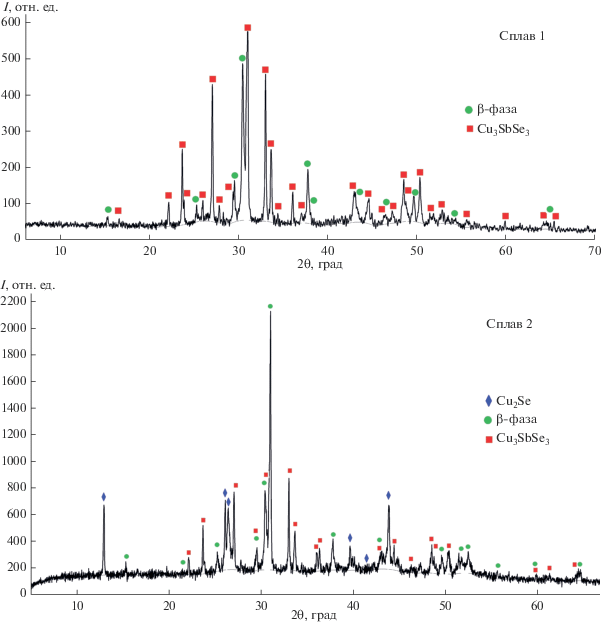
Фазовые соотношения при комнатной температуре. На рис. 2 представлена диаграмма твердофазных равновесий в системе I, которая наглядно показывает расположение фазовых областей при комнатной температуре. β-Фаза образует коноды с низкотемпературной модификацией Cu2Se и соединением Cu3SbSe3, а γ-фаза – только с соединением Cu3SbSe3. В результате концентрационный треугольник делится на три двухфазные и две трехфазные области. Фазовые составы сплавов подтверждены рентгенографически. В качестве примера на рис. 3 представлены порошковые дифрактограммы сплава 1 состава 40 мол. % SnSe–60 мол. % Cu3SbSe3 и сплава 2 состава 60 мол. % Cu2Se–20 мол. % SnSe–20 мол. % CuSbSe2 (рис. 2). Видно, что сплав 1 состоит из двухфазной смеси β + Cu3SbSe3, а сплав 2 – из трехфазной смеси (Cu2Se)I + β + Cu3SbSe3. Из данных порошковых рентгенограмм вычислены следующие параметры элементарных ячеек соединений: Cu2Se – моноклинная решетка, пр. гр. C2/c, a = = 7.1381(6), b = 12.3819(5), с = 27.3917(7) Å, β = = 94.308°; β (SnSe) – орторомбическая решетка, пр. гр. Pcmn, a = 4.4416(5), b = 4.1508(4), c = = 11.4941(9) Å; Cu3SbSe3 – орторомбическая решетка, пр. гр. Pnma, a = 7.9867(6), b = 10.6140(6), c = 6.8374(5) Å, которые практически совпадают с результатами [30, 31, 34]. Незначительная разница между параметрами решетки β-фазы и SnSe стехиометрического состава обусловлена тем, что составы этих фаз отличаются не более чем на 2–3 мол. %.
Рис. 2.
Изотермическое сечение при 300 K фазовой диаграммы системы Cu2Se–SnSe–CuSbSe2. Пунктиры – разрезы Cu2Se–[A] и CuSbSe2–[В]. 1 и 2 – сплавы, порошковые рентгенограммы которых представлены на рис. 3.
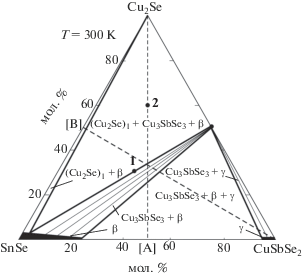
Рис. 3.
Порошковые дифрактограммы сплавов 1 (40 мол. % SnSe–60 мол. % Cu3SbSe3) и 2 (60 мол. % Cu2Se–20 мол. % SnSe–20 мол. % CuSbSe2).
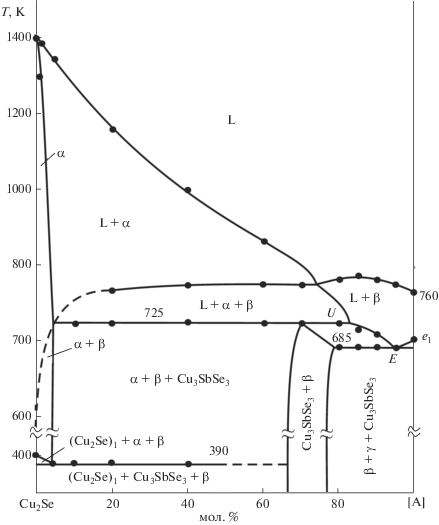
Поверхность ликвидуса. Ликвидус системы Cu2Se–SnSe–CuSbSe2 (рис. 4) состоит из полей первичной кристаллизации α-, β- и γ-фаз, а также тройного соединения Cu3SbSe3 (соответственно поля 1, 2, 3 и 4 на рис. 4). Наибольшую протяженность имеет поверхность ликвидуса α-фазы на основе самого тугоплавкого соединения системы. Поля первичной кристаллизации фаз разграничены одной перитектической (pU) и четырьмя эвтектическими (e2U, UЕ, е1Е, е3Е) кривыми. Кривые, исходящие из перитектической точки р и эвтектической точки е2, сходятся в переходной точке U, отвечающей составу расплава, находящегося в нонвариантном равновесии L + α ↔ β + + Cu3SbSe3. В подсистеме Cu2Se–SnSe–Cu3SbSe3 эта реакция завершается при избытке α-фазы и ниже солидуса образуется трехфазная область α + + β + Cu3SbSe3. В области составов SnSe–CuSbSe2–Cu3SbSe3 кристаллизация завершается эвтектическим процессом Е и в результате формируется трехфазная область β + γ + Cu3SbSe3. Типы и координаты нонвариантных равновесий, а также температурные интервалы моновариантных равновесий приведены в табл. 1. Составы в точках U и Е определены сопоставлением экспериментальных данных по трем политермическим разрезам, описание которых приведено ниже.
Рис. 4.
Проекция поверхности ликвидуса системы Cu2Se–SnSe–CuSbSe2. Поля первичной кристаллизации: 1 – α, 2 – β, 3 – γ, 4 – Cu3SbSe3.
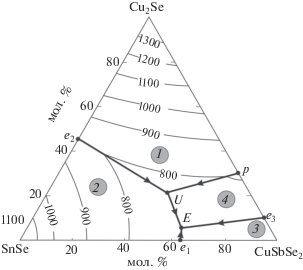
Таблица 1.
Нон- и моновариантные равновесия в системе Cu2Se–SnSe–CuSbSe2
| Точка или кривая на рис. 4 | Равновесие | Состав, мол. % | Т, K | ||
|---|---|---|---|---|---|
| Cu2Se | CuSbSe2 | SnSe | |||
| е1 | L ↔ β + γ | – | 63 | 37 | 700 |
| е2 | L ↔ α + β | 46 | – | 54 | 815 |
| е3 | L ↔ γ + Cu3SbSe3 | 10 | 90 | – | 748 |
| р | L + γ ↔ Cu3SbSe3 | 30 | 70 | – | 808 |
| U | L + α ↔ β + Cu3SbSe3 | 22 | 47 | 31 | 725 |
| Е | L ↔ β + γ + Cu3SbSe3 | 6 | 60 | 34 | 685 |
| е2U | L ↔ α + β | 815–725 | |||
| рU | L + γ ↔ Cu3SbSe3 | 808–725 | |||
| е1Е | L ↔ β + γ | 700–685 | |||
| е3Е | L ↔ γ + Cu3SbSe3 | 748–685 | |||
| UЕ | L ↔ β + Cu3SbSe3 | 725–685 | |||
Политермические сечения
Ниже приведены и описаны в контексте с рис. 2 и 4 политермические разрезы SnSe–Cu3SbSe3, Cu2Se–[A] и CuSbSe2–[В].
Разрез SnSe–Cu3SbSe3 (рис. 5). Результаты РФА отожженных сплавов этого разреза показали, что они являются двухфазными смесями исходных соединений. Это указывает на стабильность данного разреза ниже солидуса. На основании полученных данных ДТА построен политермический разрез SnSe–Cu3SbSe3 фазовой диаграммы системы I (рис. 5). Этот разрез является стабильным ниже солидуса сечением системы Cu2Se–SnSe–Sb2Se3, но неквазибинарным в силу инконгруэнтного характера плавления соединения Cu3SbSe3. В системе наблюдается растворимость на основе SnSe (β-фаза) с протяженностью ∼3 мол. %.
Ликвидус состоит из двух ветвей, характеризующих первичную кристаллизацию β-фазы и твердых растворов на основе высокотемпературной модификации соединения Cu2Sе (α-фаза). Ниже ликвидуса в интервале составов 0–30 мол. % SnSe наблюдаются термические эффекты, относящиеся к моновариантной перитектической реакции L + α ↔ Cu3SbSe3. В ходе этой реакции формируется трехфазная область L + α + + Cu3SbSe3. В интервале составов 30–95 мол. % SnSe происходит совместная кристаллизация α- и β-фаз. Горизонталь при 725 K отвечает нонвариантной переходной реакции (U): L + α ↔ ↔ Cu3SbSe3 + β. Поскольку данный разрез стабилен ниже солидуса, в этой реакции обе исходные фазы полностью расходуются и образуется двухфазная смесь Cu3SbSe3 + β.
Разрез Cu2Se–[A] (рис. 6). В субсолидусе этот разрез проходит через фазовые поля α + Cu3SbSe3 + β, Cu3SbSe3 + β и Cu3SbSe3 + β + γ (рис. 2). Ликвидус состоит из двух ветвей, отвечающих первичной кристаллизации α-фазы на основе высокотемпературной модификации Cu2Se и β-фазы на основе SnSe. После первичной кристаллизации α- и β-фаз наблюдается моновариантная кристаллизация эвтектической смеси α + β (в области составов 20–95 мол. % Cu2Se). Кривые UЕ и е1Е относятся к моновариантным эвтектическим равновесиям. Горизонталь при 725 K характеризует нонвариантное переходное равновесие U, а при 685 K – кристаллизацию тройной эвтектики (табл. 1). После завершения этих процессов формируются трехфазные области α + β + Cu3SbSe3 и β + γ + + Cu3SbSe3. Горизонталь при 390 K соответствует фазовому переходу Cu2Se, который протекает по эвтектоидной реакции:
(1)
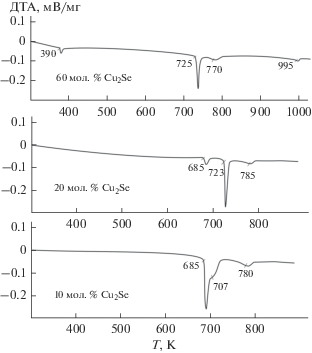
$\alpha \leftrightarrow {{({\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{Se}})}_{{\text{I}}}} + {\text{C}}{{{\text{u}}}_{{\text{3}}}}{\text{SbS}}{{{\text{e}}}_{3}} + \beta .$На рис. 7 представлены кривые ДТА нагревания некоторых сплавов по разрезу Cu2Se–[A]. Их сравнение с рис. 6 показывает, что термические эффекты по своим характеристикам (температура, интенсивность, четкость или размытость пиков) находятся в соответствии с фазовой диаграммой. Например, на термограмме сплава состава 60 мол. % Cu2Se четкие эндоэффекты при 390 и 725 K соответствуют эвтектоидной реакции (1) и переходной реакции U, а размытые пики при ≤770 и ≤995 K – моновариантному эвтектическому процессу е2U и концу плавления α-фазы.
Разрез CuSbSe2–[В] (рис. 8). Этот разрез проходит через поля первичной кристаллизации α- и γ-фаз, а также тройного соединения Cu3SbSe3. Ниже линии ликвидуса расположены кривые, отвечающие моновариантным процессам е2U (0–42 мол. % CuSbSe2), рU (42–52 мол. % CuSbSe2), UЕ (47–57 мол. % CuSbSe2), е3Е (57–90 мол. % CuSbSe2) и е1Е (90–95 мол. % CuSbSe2). В интервале составов 3–35 мол. % CuSbSe2 при завершении переходной реакции U (табл. 1) α-фаза остается в избытке и формируется трехфазная область α + β + + Cu3SbSe3, а в интервале 42–92 мол. % CuSbSe2 кристаллизация завершается нонвариантным эвтектическим процессом Е и образуется трехфазная область β + γ + Cu3SbSe3. На данном разрезе указаны также двухфазные области β + Cu3SbSe3 и γ + Cu3SbSe3, протяженности которых находятся в соответствии с диаграммой твердофазных равновесий (рис. 2).
ЗАКЛЮЧЕНИЕ
Получены новые экспериментальные данные по фазовым равновесиям в квазитройной системе Cu2Se–SnSe–CuSbSe2, включающие политермические разрезы SnSe–Cu3SbSe3, Cu2Se–[A] и CuSbSe2–[В], изотермическое сечение при 300 K фазовой диаграммы, а также проекцию поверхности ликвидуса. Установлено, что поверхность ликвидуса состоит из полей первичной кристаллизации α-, β- и γ-фаз, а также Cu3SbSe3. Определены типы и координаты нон- и моновариантных равновесий. В системе выявлены широкие области твердых растворов на основе SnSe и CuSbSe2.
Список литературы
Applications of Chalcogenides: S, Se, and Te / Ed. Ahluwalia G.K. 2016. Cham.: Springer, 461 p.
Бабанлы М.Б., Юсибов Ю.А., Абишев В.Т. Трехкомпонентные халькогениды на основе меди и серебра. Баку: Изд-во БГУ, 1993. 342 с.
Lin Y., Fang S., Su D. et al. // Nat. Commun. 2015. V. 6. Article № 6824. https://doi.org/10.1038/ncomms7824
Yokota I., Miyatani S. // Solid State Ionics. 1981. V. 3–4. P. 17. https://doi.org/10.1016/0167-2738(81)90047-3
Xia Z., Fang H., Zhang X. et al. // Chem. Mater. 2018. V. 30. № 3. P. 1121. https://doi.org/10.1021/acs.chemmater.7b05104
Chen D., Zhao Y., Chen Y. et al. // Adv. Electron. Mater. 2016. V. 2. № 6. P. 1500473. https://doi.org/10.1002/aelm.201500473
Wang Q., Li J., Li J. // Phys. Chem. Chem. Phys. 2018. V. 20. № 3. P. 1460. https://doi.org/10.1039/C7CP06465A
Xiao Ch. Synthesis and Optimization of Chalcogenides Quantum Dots Thermoelectric Materials. Springer, 2016. 114 p.
Qiu P., Agne M.T., Liu Y. et al. // Nat. Commun. 2018. V. 9. Article № 2910. https://doi.org/10.1038/s41467-018-05248-8
Lu X., Morelli D.T., Wang Y. et al. // Chem. Mater. 2016. V. 28. № 6. P. 1781. https://doi.org/10.1021/acs.chemmater.5b04796
Sun F.-H., Wu C.-F., Li Z. et al. // RSC Advances. 2017. V. 7. № 31. P. 18909. https://doi.org/10.1039/c7ra02564e
Wang L., Yang B., Xia Z. et al. // Sol. Energy Mater. Sol. Cells. 2016. V. 144. P. 33. https://doi.org/10.1016/j.solmat.2015.08.016
Chetty R., Bali A., Mallik R.C. // J. Mater. Chem. C. 2015. V. 3. № 48. P. 12364. https://doi.org/10.1039/c5tc02537k
Prem-Kumar D.S., Ren M., Osipowicz T. // Sol. Energy. 2018. V. 174. P. 422. https://doi.org/10.1016/j.solener.2018.08.080
Weller D.P., Stevens D.L., Kunkel G.E. et al. // Chem. Mater. 2017. V. 29. № 4. P. 1656. https://doi.org/10.1021/ acs.chemmater.6b04950
Wang J., Gu M., Bao Y. et al. // J. Electron. Mater. 2016. V. 45. № 4. P. 2274. https://doi.org/10.1007/s11664-015-4301-8
Sun F.-H., Dong J., Dey S. et al. // Sci. China Mater. 2018. V. 61. № 9. P. 1209. https://doi.org/10.1007/s40843-018-9241-x
Suekuni K., Takabatake T. // Appl. Mater. 2016. V. 4. P. 104503. https://doi.org/10.1063/1.4955398
Nasonova D.I., Verchenko V.Yu., Tsirlin A.A., Shevelkov A.V. // Chem. Mater. 2016. V. 28. P. 6621. https://doi.org/10.1021/ acs.chemmater.6b02720
Kim F.S., Suekuni K., Nishiate H. et al. // J. Appl. Phys. 2016. V. 119. P. 175105. https://doi.org/10.1063/1.4948475
Villars P., Prince A., Okamoto H. Handbook of Ternary Alloy Phase Diagrams (10 volume set). USA: ASM Int. Publ., 1995. 15000 p.
Babanly M.B., Chulkov E.V., Aliev Z.S. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1703. https://doi.org/10.1134/S0036023617130034
Alverdiyev I.J., Aliev Z.S., Bagheri S.M. et al. // J. Alloys Compd. 2017. V. 691. P. 255. https://doi.org/10.1016/j.jallcom.2016.08.251
Mashadiyeva L.F., Gasanova Z.T., Yusibov Yu.A., Babanly M.B. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 598. doi 10.1134/S0036023617050151 [Машадиева Л.Ф., Гасанова З.Т., Юсибов Ю.А., Бабанлы М.Б. // Журн. неорган. химии. 2017. Т. 62. № 5. С. 599.]
Gasanova Z.T., Mashadiyeva L.F., Yusibov Yu.A., Babanly M.B. // Russ. J. Inorg. Chem. 2017. V. 62. № 5. P. 591. doi 10.1134/ S0036023617050126 [Гасанова З.Т., Машадиева Л.Ф., Юсибов Ю.А., Бабанлы М.Б. // Журн. неорган. химии. 2017. Т. 62. № 5. С. 592.]
Mashadieva L.F., Gasanova Z.T., Yusibov Yu.A., Babanly M.B. // Inorg. Mater. 2018. V. 54. № 1. P. 8. doi 10.1134/ S0020168518010090 [Машадиева Л.Ф., Гасанова З.Т., Юсибов Ю.А., Бабанлы М.Б. // Неорган. материалы. 2018. Т. 54. № 1. С. 11. doi 10.7868/S0044457X17050130]
Алвердиев И.Дж., Аббасова В.А., Юсибов Ю.А., Бабанлы М.Б. // Конденсированные среды и межфазные границы. 2017. Т. 19. № 1. С. 22.
Алвердиев И.Дж., Аббасова В.А., Юсибов Ю.А. и др. // Электрохимия. 2018. Т. 54. № 2. С. 224. [Alverdiev I.J., Abbasova V.A., Yusibov Yu.A. et al. // Russ. J. Electrochem. 2018. V. 54. № 2. P. 153. doi 10.1134/ S1023193518020027]
Binary Alloy Phase Diagrams / Ed. Massalski T.B. Second ed. Ohio: ASM International, Materials Park, 1990. P. 3589.
Gulay L., Daszkiewicz M., Strok O., Pietraszko A. // Chem. Met. Alloys. 2011. V. 4. P. 200.
Sist M., Zhang J., Iversen B. // Acta Crystallogr. 2016. V. 72B. P. 310. https://doi.org/10.1107/S2052520616003334
Yang C., Wang Y., Li S. et al. // J. Mater. Sci. 2012. V. 47. P. 7085. https://doi.org/10.1007/s10853-012-6385-3
Головей М.И., Ткаченко В.И., Риган М.Ю., Стасюк И.П. // Неорган. материалы. 1990. Т. 26. № 5. С. 933.
Qiu W., Wu L., Ke X. et al. // Sci. Rep. 2015. V. 5. P. 13643.
Tomashyk V., Lebrun N., Perrot P. // Landolt-Börnstein Database, MSIT, New Series IV/11C1 / Eds. Effenberg G., Ilyenko S. 2006. P. 361.
Ostapyuk T.A., Yermiychuk I.M., Zmiy O.F., Olekseyuk I.D. // Chem. Met. Alloys. 2009. V. 2. P. 164.
Pfitzner A. // Z. Anorg. Allg. Chem. 1995. V. 621. P. 685. https://doi.org/10.1002/zaac.19956210431
Ismayilova E.N., Shukurova G.M., Mashadieva L.F. // Azerbaijan Chem. J. 2018. V. 0. № 4. P. 29.
Majsztrik P.W., Kirkham M., Garcia-Negron V. et al. // J. Mater. Sci. 2013. V. 48. P. 2188. https://doi.org/10.1007/s10853-012-6994-x
Эмсли Дж. Элементы. М.: Мир, 1993. 256 с.
Глазов В.М., Бурханов А.С., Салеева Н.М. // Изв. АН СССР. Неорган. материалы. 1977. Т. 13. № 5. С. 917.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии