Журнал неорганической химии, 2019, T. 64, № 6, стр. 630-642
Термическое разложение итаконата никеля
С. А. Семенов 1, *, В. Ю. Мусатова 1, Д. В. Дробот 1, Г. И. Джардималиева 2
1 МИРЭА – Российский технологический университет
(Институт тонких химических технологий им. М.В. Ломоносова),
119454 Москва, пр-т Вернадского, 78, Россия
2 Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, пр-т Академика Семенова, 1, Россия
* E-mail: srg.semenov@gmail.com
Поступила в редакцию 26.04.2018
После доработки 20.11.2018
Принята к публикации 15.01.2019
Аннотация
Получены экспериментально-статистические математические модели термолиза итаконата никеля, связывающие ряд функций отклика (концентрацию углерода, водорода, кислорода и никеля в нанокомпозите, выход нанокомпозита, содержание фаз β-никеля и оксида никеля, диаметр наночастиц) с температурой и временем процесса термолиза. Построены поверхности отклика, иллюстрирующие зависимость перечисленных функций отклика от температуры и времени термолиза. В результате анализа полученных поверхностей отклика определены условия синтеза нанокомпозита с заданными характеристиками, в частности с максимальным содержанием магнитоактивной фазы β-никеля.
ВВЕДЕНИЕ
Благодаря уникальным физико-химическим свойствам магнитные нанокомпозиты могут найти применение в системах записи и хранения информации, как биомедицинские материалы, активные элементы электронных устройств, магнитные сенсоры и др. [1–8]. В настоящее время вырос интерес к никельсодержащим нанокомпозитам, что обусловлено их магнитными, электрофизическими и каталитическими свойствами [2, 9–11]. Термические превращения металлосодержащих мономеров – это современный и эффективный метод получения нанокомпозитов, позволяющий совместить в себе формирование как высокодисперсных наночастиц металлов, так и стабилизирующей их полимерной матрицы [12–14]. Ранее нами в работе [15] получены и охарактеризованы кислые карбоксилаты никеля(II) (ККН) ненасыщенных дикарбоновых кислот (малеиновой (MalA), итаконовой (ItA), ацетилендикарбоновой (ADCA), аллилмалоновой (AlMalA), глютаконовой (GlutA), цис,цис-муконовой (MucA)). Проведен термолиз синтезированных ККН, изучена микроструктура и магнитные характеристики полученных нанокомпозитов: максимальная и остаточная намагниченность, коэрцитивная сила. При обработке результатов изучения свойств нанокомпозитов, синтезированных в процессе термолиза ненасыщенных дикарбоксилатов никеля, получены уравнения множественной регрессии, связывающие эти свойства с магнитными характеристиками [16].
В работе [17] нами исследовано термическое разложение ККН ненасыщенных дикарбоновых кислот методами термогравиметрического (ТГА) и дифференциального термического анализа (ДТА) в сочетании с дифференциальной сканирующей калориметрией (ДСК) и масс-спектрометрией газообразных продуктов термолиза.
Характер и особенности термического разложения прекурсоров зависят от ряда факторов: температуры, времени, среды, энергии Гиббса образования предшественников наночастиц [1, 3, 4, 12, 15, 17–19]. Влияние времени и температуры на особенности термического разложения итаконата никеля изучено недостаточно. В настоящей работе приведены результаты исследования влияния времени и температуры на характеристики нанокомпозита (концентрацию углерода, водорода, кислорода и никеля в нанокомпозите, выход нанокомпозита, содержание фаз β-никеля и оксида никеля, диаметр наночастиц), полученного в результате термолиза итаконата никеля.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы: ацетат никеля Ni(CH3COO)2 ⋅ 4H2O квалификации “ч.”, итаконовая кислота (99%, Alfa Aesar).
Синтез кислого итаконата никеля осуществляли взаимодействием концентрированного водного раствора ацетата никеля с водным раствором итаконовой кислоты (мольное соотношение 1 : 2) при перемешивании в течение 5 ч при температуре 40–50°С. Раствор упаривали до выпадения осадка, который промывали ацетоном и сушили в вакууме в течение 3 ч при температуре 40–50°С.
Анализ. ИК-спектры образцов в виде таблеток с KBr регистрировали в области 4000–500 см–1 на ИК-Фурье-спектрометре EQUINOX 55 фирмы Bruker (Германия).
Элементный анализ проводили на автоматическом элементном CHNS-анализаторе фирмы Thermo Finnigan (Италия).
Содержание никеля определяли прямым титрованием ЭДТА с мурексидом [20]. Рентгенофазовый анализ (РФА) выполняли на дифрактометре ДРОН-4.0 с использованием монохроматизированного CoKα-излучения. Для интерпретации дифракционного спектра использовали программу количественного фазового анализа PHAN% [21].
Синтез композитов никеля проводили в изотермических условиях при температуре 285–385 ± ± 1°С в течение 7–11 ч в атмосфере аргона с использованием электротигля ЭТ-МГК 0.7 × 1.5/12 с цифровым регулятором температуры “Дельта” серии ДТА. Интервалы варьирования температуры и времени были выбраны на основании данных [15].
Полученные композиты исследовали методами просвечивающей электронной микроскопии (ПЭМ) на электронном микроскопе JEOL 100СХ (Япония) с ускоряющим напряжением 80 кВ и сканирующей электронной микроскопии (СЭМ) на электронном микроскопе JSM 6480LV (“JEOL”, Япония) с приставкой для энергодисперсионной спектрометрии INCA (Oxford, UK). Проведен элементный анализ композитов на содержание углерода и водорода. Для автоматической обработки электронных фотографий использовали программный продукт (ПП) LabVIEW 8.5.1 [22].
Для получения значений коэффициентов уравнений регрессии 2-ой степени применяли программу регрессионного анализа многомерных полиномиальных моделей для нескольких откликов EXPQG [23]. С использованием этой программы в результате расчетов получили лучшее (в соответствии с критерием Фишера) уравнение регрессии.
Все опыты проводили два раза, в табл. 1–4 приведены соответствующие средние значения.
Таблица 1.
Данные элементного анализа и условия проведения термолиза
| № опыта | X1 (τ, ч) | X2 (t,°С) | Y1 (C, %) | Y2 (H, %) | Выход, % |
|---|---|---|---|---|---|
| 1 | 11 | 385 | 0.64 | 0 | 18.38 |
| 2 | 11 | 285 | 31.31 | 3.22 | 48.53 |
| 3 | 7 | 385 | 21.72 | 0 | 24.26 |
| 4 | 7 | 285 | 29.78 | 3.29 | 51.47 |
| 5 | 9 | 335 | 19.42 | 0.99 | 27.94 |
| 6 | 11 | 310 | 18.72 | 1.72 | 16.18 |
| 7 | 7 | 310 | 31.31 | 3.13 | 45.59 |
Таблица 2.
Результаты РФА продуктов термолиза итаконата никеля(II)
| № опыта | Фаза | Параметр решетки а, Å | Массовая доля, % |
|---|---|---|---|
| 1 | NiO | 4.1789 | 94.4 |
| Ni | 3.5247 | 5.6 | |
| 3 | NiO | 4.2640 | 88.5 |
| Ni | 3.5234 | 11.5 | |
| 5 | NiO | 4.1845 | 74.7 |
| Ni | 3.5380 | 25.3 | |
| 6 | NiO | 4.1880 | 71.0 |
| Ni | 3.5200 | 29.0 | |
| 7 | NiO | 4.1920 | 100 |
Таблица 3.
Результаты энергодисперсионного рентгеновского микроанализа продуктов термолиза итаконата никеля
| № опыта | О, мас. % | Ni, мас. % |
|---|---|---|
| 1 | 8.91 | 90.45 |
| 3 | 21.0 | 54.32 |
| 5 | 18.27 | 62.18 |
| 6 | 20.99 | 49.25 |
| 7 | 22.43 | 48.08 |
Таблица 4.
Результаты обработки ПЭМ-изображений продуктов термического разложения кислого итаконата никеля
| Номер нанокомпозита | ПЭМ-изображение одного из исследуемых фрагментов | Количество частиц в исследованных фрагментах | Полученные значения диаметра наночастиц и средний диаметр, нм (уровень значимости α = 0.05) | ||
|---|---|---|---|---|---|
| d1 | d2 | dср | |||
| 1 | 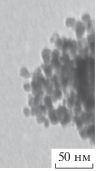 |
78 и 165 | 7.67 | 7.73 | 7.70 ± 0.02 |
| 3 |  |
298 и 156 | 5.04 | 4.99 | 5.01 ± 0.02 |
| 5 | 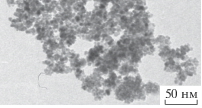 |
536 и 688 | 4.89 | 4.92 | 4.90 ± 0.01 |
| 6 |  |
439 и 409 | 4.88 | 4.80 | 4.84 ± 0.04 |
| 7 |  |
749 и 239 | 4.54 | 4.59 | 4.56 ± 0.02 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С целью подтверждения получения кислого итаконата никеля использовали данные ИК-спектроскопии и элементного анализа (табл. 5, 6). Установлено, что синтезированное соединение является хорошо растворимым в воде карбоксилатом (νOH(H2O) = 3297 см–1), что подтверждается данными элементного анализа (табл. 5).
Таблица 5.
Данные элементного анализа кислого итаконата никеля
| Полученная соль | Найдено/Вычислено | Брутто-формула | ||
|---|---|---|---|---|
| С, % | Н, % | Ni, % | ||
| Ni(C5H5O4)2 · 2H2O | 33.03/34.01 | 4.10/3.97 | 15.25/16.64 | С10Н14NiО10 |
Таблица 6.
Характеристические частоты (см–1) в ИК-спектрах итаконата никеля и итаконовой кислоты
| Соединение | νOH(H2O) | ν(COOH) | ν(C=C) | νs(COO–) | νas(COO–) |
|---|---|---|---|---|---|
| Итаконовая кислота | – | 1696 (с) | 1628 (ср) | – | – |
| Итаконат никеля | 3297 (ш. ср) | 1704 (сл) | 1636 (сл) | 1405 (ср) 1365 (сл) |
1574 (с) |
В ИК-спектре кислого итаконата никеля(II) имеются полосы поглощения при 1574 и 1365–1405 см–1, обусловленные соответственно асимметричными (νas(COO–)) и симметричными (νs(COO–)) валентными колебаниями монодентатного карбоксилат-иона [24, 25] (табл. 6).
Частоты валентных колебаний связи >C=C< существенно не изменяются при образовании карбоксилатов никеля.
Влияние времени и температуры на термолиз итаконата никеля и характеристики получаемого нанокомпозита изучали методом планирования эксперимента, для этого использовали полный факторный эксперимент. Условия проведения опытов, результаты элементного анализа нанокомпозита и его выход приведены в табл. 1.
Условия проведения опытов 1–4 выбирали в соответствии с планом полного факторного эксперимента. Опыт 5 был в центре плана и соответствовал условиям проведения термолиза в работе [15] для проверки воспроизводимости опытов. Расчет критерия Кохрена показал, что опыты воспроизводимы, а оценки дисперсий однородны (доверительная вероятность 0.95). Поскольку нанокомпозиты, полученные при t = 285°C (опыты 2 и 4), оказались рентгеноаморфными, были проведены дополнительные опыты 6 и 7 при t = = 310°C.
В табл. 2 приведены результаты РФА продуктов термолиза итаконата никеля. Все полученные фазы обладают кубической сингонией и имеют пр. гр. Fm3m. В соответствии с базой данных ICDD PDF, параметр решетки β-никеля a = = 3.5238 Å, NiO – a = 4.1768 Å. РФА продуктов термолиза итаконата никеля показал, что нанокомпозиты в опытах 2 и 4 являются ренгеноаморфными, кристаллические фазы Ni и NiO не образуются из-за низкой температуры проведения процесса – 285°С. Как видно из табл. 2, в продуктах термолиза итаконата никеля в остальных пяти опытах преобладает кубический оксид никеля (Fm3m), в указанных образцах также присутствует металлический кубический β-никель (Fm3m) в количестве до 29%.
Методом энергодисперсионного рентгеновского микроанализа в композитах, полученных разложением кислого итаконата никеля, обнаружены рефлексы, отвечающие Ni, О и С (рис. 1). Результаты энергодисперсионного рентгеновского микроанализа нанокомпозитов приведены в табл. 3.
Рис. 1.
Исследуемые области и рентгеновские спектры нанокомпозитов, полученных при термическом разложении итаконата никеля: 1 (a), 3 (б), 5 (в), 6 (г), 7 (д).
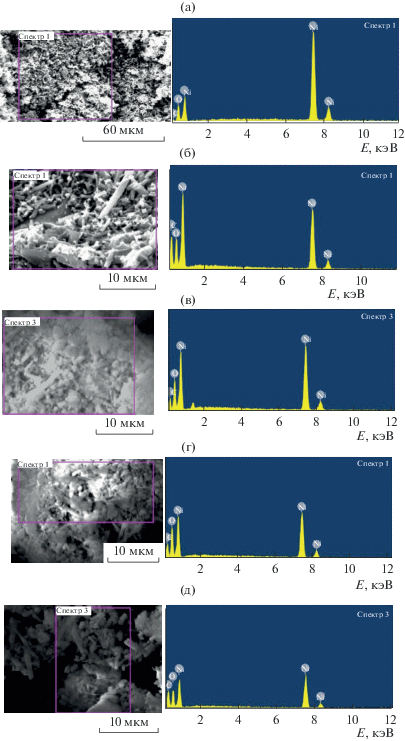
При помощи СЭМ установлено, что все полученные нанокомпозиты состоят из агрегатов размером от 1 до 100 мкм. На рис. 2 представлена электронная микрофотография продукта термолиза 1.
В табл. 4 приведены результаты обработки ПЭМ-изображений композитов, полученных разложением кислого итаконата никеля.
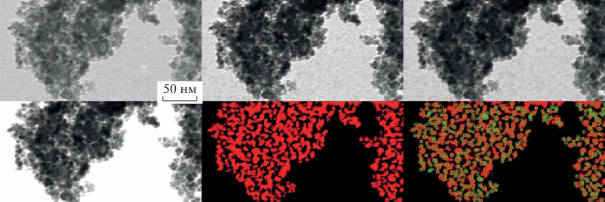
Изображения продуктов термолиза итаконата никеля имеют характерную, морфологически близкую картину: в менее электронно-плотной матрице распределены электронно-плотные частицы, имеющие форму, близкую к сферической. По данным ПЭМ, с изменением времени и температуры размер наночастиц варьируется в интервале 4.6–7.7 нм. Средний диаметр наночастиц (dcр) нанокомпозитов никеля был определен при помощи ПП LabVIEW 8.5.1 NI Vision Assistant для автоматической обработки электронных фотографий (рис. 3).
Рис. 3.
Стадии обработки ПЭМ-изображения нанокомпозита, полученного термическим разложением кислого итаконата никеля(II) при температуре 310 ± 1°С при помощи ПП LabVIEW 8.5.1.
Для получения экспериментально-статистических математических моделей процесса термолиза итаконата никеля, описывающих влияние температуры и времени на характеристики процесса, использовали программу регрессионного анализа многомерных полиномиальных моделей для нескольких откликов EXPQG [23]. Полученные уравнения регрессии и соответствующие им поверхности отклика приведены в табл. 7.
Таблица 7.
Уравнения регрессии и соответствующие им поверхности отклика
| № п/п | Функция отклика | Уравнение регрессии | Поверхность отклика |
|---|---|---|---|
| 1 | Содержание углерода в нанокомпозите, мас. % | Y1 = –51 – 11.3X1 + 1.58X2 + + 1.54$X_{1}^{2}$ – 0.0565X1X2 – – 0.00189$X_{2}^{2}$ | 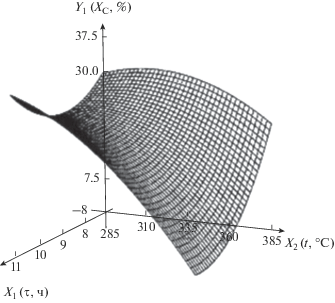 |
| 2 | Содержание водорода в нанокомпозите, мас. % | Y2 = 3.65 – 6.91X1 + 0.202X2 + + 0.380$X_{1}^{2}$ + 0.000175X1X2 – – 0.000353$X_{2}^{2}$ | 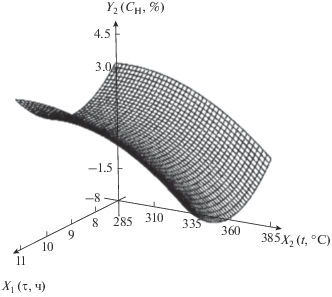 |
| 3 | Общее содержание никеля в нанокомпозите, мас. % | Y3 = 104 – 18.8X1 – 0.160X2 – – 1.11$X_{1}^{2}$ + 0.124X1X2 – – 0.000925$X_{2}^{2}$ | 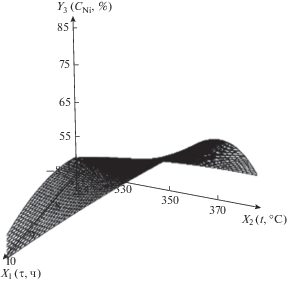 |
| 4 | Выход нанокомпозита, % | Y4 = 661 – 3.44X2 – 0.179$X_{1}^{2}$ + + 0.00473$X_{2}^{2}$ | 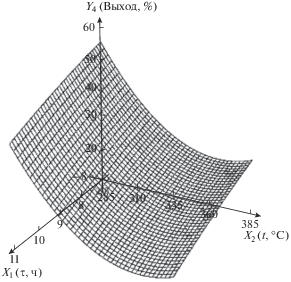 |
| 5 | Содержание кислорода в нанокомпозите, мас. % | Y5 = 34.0 + 14.3X1 – 0.345X2 – – 0.0451X1X2 + 0.000951$X_{2}^{2}$ | 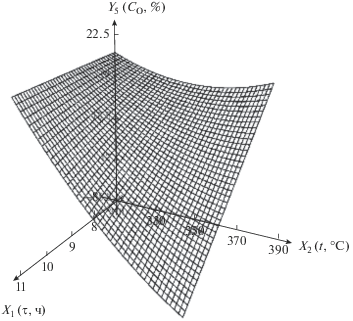 |
| 6 | Содержание фазы β-никеля в нанокомпозите, мас. % (сумма фаз Ni и NiO равна 100%) | Y6 = –617 + 43.3X1 + 2.52X2 – – 0.116X1X2 – 0.00223$X_{2}^{2}$ | 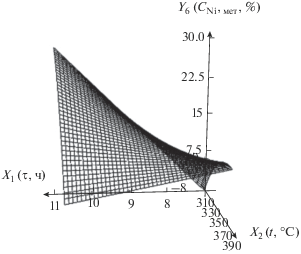 |
| 7 | Содержание фазы NiO в нанокомпозите, мас. % | Y7 = 410 – 61.4X1 – 0.279X2 + + $X_{1}^{2}$ + 0.116X1X2 – 0.000991$X_{2}^{2}$ | 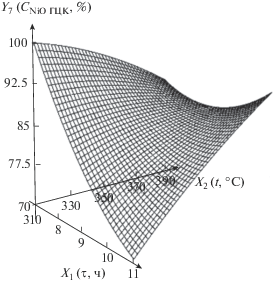 |
| 8 | Диаметр наночастиц, нм | Y8 = 26.4 – 3.99X1 – 0.0502X2 + + 0.0872$X_{1}^{2}$ + 0.00803X1X2 | 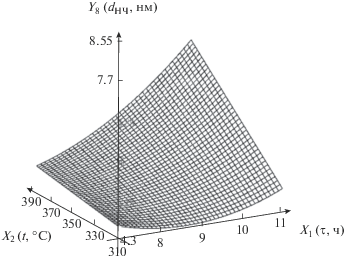 |
Следует отметить, что в приведенных уравнениях регрессии представлены не все члены, а только те, которые остались после проверки коэффициентов регрессии на значимость.
В табл. 8 приведены статистические характеристики полученных уравнений регрессии.
Таблица 8.
Статистические характеристики полученных уравнений регрессии
| Номер уравнения регрессии | Дисперсия относительно среднего | Остаточная дисперсия | Критерий Фишера |
|---|---|---|---|
| 1 | 177 | 7.42 | 23.8 |
| 2 | 4.38 | 1.78 × 10–8 | 2.47 × 108 |
| 3 | 406 | 5.52 × 10–6 | 7.36 × 107 |
| 4 | 335 | 79.4 | 4.22 |
| 5 | 47.9 | 2.97 × 10–8 | 1.62 × 109 |
| 6 | 194 | 0.63 × 10–6 | 0.308 × 109 |
| 7 | 166 | 2.38 × 10–6 | 6.96 × 107 |
| 8 | 2.68 | 8.01 × 10–9 | 3.35 × 108 |
Полученные математические модели целесообразно анализировать, используя поверхности отклика, приведенные в табл. 7. Из табл. 7 видно, что с ростом температуры содержание углерода в нанокомпозите уменьшается: при небольшом времени незначительно, при большом – более заметно. Это связано с процессом декарбоксилирования, в ходе которого углерод выделяется в виде СО2. Ранее в работе [17] нами было исследовано термическое разложение кислого итаконата никеля методом ТГА/ДТА в сочетании с ДСК-анализом и масс-спектрометрией газообразных продуктов термолиза. Как видно из рис. 4 [17], на кривой ДСК итаконата никеля реакции полного декарбоксилирования соответствует эндоэффект с минимумом при 378°С, при этом происходит основное газовыделение в виде СО2. Следует отметить, что частичное декарбоксилирование, сопровождаемое выделением СО и СО2, начинается уже при температуре 172°С, на это указывает рост масс-спектрометрических (МС) кривых выделения СО и СО2 (массовые числа m/e = 28 и 44 соответственно).
Рис. 4.
Данные ТГА, ДСК и масс-спектры итаконата никеля (скорость нагрева 10 град/мин, аргон). Общая потеря массы 75.65% [17].
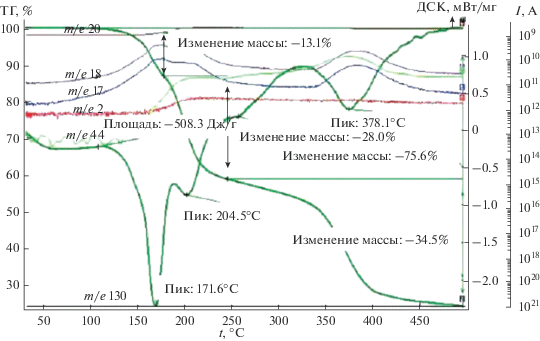
Полученные данные позволяют определить условия, при которых происходит декарбоксилирование в наибольшей степени, – это высокая температура термолиза и большое время проведения процесса.
Из табл. 7 видно, что при низкой температуре с увеличением времени содержание углерода в нанокомпозите падает, а потом возрастает. Падение связано с реакцией декарбоксилирования, а рост – с уменьшением доли других элементов – выделением водорода в виде Н2 и Н2О и кислорода в виде СО2 и СО. Как видно из рис. 4, МС-кривые, соответствующие выделению СО и Н2 (массовые числа m/e = 28 и 2 соответственно), симбатны, их рост наблюдается при 180°С.
Из табл. 7 видно, что при высокой температуре содержание углерода падает из-за реакции декарбоксилирования, которая при высокой температуре идет интенсивнее.
С увеличением температуры содержание водорода в нанокомпозите уменьшается, это связано с обеднением полимерной матрицы водородом в результате его выделения в виде газообразного водорода и воды. На рис. 2 потеря воды наблюдается при 172°С (дегидратация) и 390°С. С течением времени содержание водорода в нанокомпозите сначала убывает, а затем возрастает. Падение связано с выделением водорода, а рост – с повышением его доли в полимерной матрице в результате выделения углерода и кислорода в ходе протекания реакции декарбоксилирования.
С увеличением времени содержание Ni в нанокомпозите при низкой температуре меняется мало, а при высокой – довольно сильно растет. Это связано с небольшой скоростью декарбоксилирования при низкой температуре.
С ростом температуры при малом времени проведения термолиза содержание никеля меняется незначительно, а при большом времени – заметно увеличивается. Это связано с тем, что при большем времени удаление других элементов (углерода, водорода, кислорода) в газовую фазу протекает более полно, в результате увеличивается доля никеля в нанокомпозите.
Выход нанокомпозита (процент продукта термолиза по отношению к исходной массе образца) уменьшается как с ростом температуры, так и с течением времени из-за потери массы в ходе реакций дегидратации и декарбоксилирования, сопровождаемых выделением СО, СО2, Н2 и Н2О, причем с увеличением температуры выход значительно меньше. Это свидетельствует о том, что температура оказывает более сильное влияние на потерю массы образцом, чем время. Полученное уравнение регрессии позволяет прогнозировать потерю массы образцом при заданных условиях процесса термолиза.
При повышении температуры и малом времени проведения термолиза содержание кислорода в нанокомпозите сначала уменьшается, а затем растет. Уменьшение содержания кислорода связано с выделением СО2 и Н2О при протекании процессов дегидратации и декарбоксилирования, а рост – с уменьшением содержания в нанокомпозите углерода и водорода в ходе термолиза.
При большом времени проведения процесса с ростом температуры содержание кислорода снижается сильнее, чем при малом. Это связано с тем, что при большом времени термолиза процессы дегидратации и декарбоксилирования протекают более полно.
С увеличением времени при низкой температуре содержание кислорода в нанокомпозите меняется незначительно, что объясняется невысокой интенсивностью процессов дегидратации и декарбоксилирования. С увеличением температуры и времени содержание кислорода резко падает, что связано с более высокой интенсивностью реакций декарбоксилирования и дегидратации при высокой температуре.
Полученные результаты позволяют установить области на поверхности отклика, характеризующиеся невысоким содержанием кислорода в нанокомпозите. Невысокое содержание кислорода в полученном нанокомпозите свидетельствует о большем содержании ферромагнитной фазы металлического никеля и большей степени декарбоксилирования исходного прекурсора.
С увеличением температуры при небольшом времени термолиза содержание фазы β-никеля увеличивается. Это связано с протеканием реакции декарбоксилирования и образованием фазы β-никеля. При большом времени содержание этой фазы уменьшается вследствие окисления никеля до NiO. С увеличением времени термолиза при высокой температуре содержание металлического Ni уменьшается из-за его окисления до NiO. С увеличением времени при низкой температуре содержание металлического никеля растет, что объясняется реакцией декарбоксилирования, которая, согласно рис. 4, начинает протекать при 160–190°С.
Поскольку β-никель обладает ферромагнитными свойствами [9, 26], целесообразнее проводить термолиз длительное время (11 ч) при невысокой температуре (310°С), эти условия обеспечивают максимальное содержание фазы β-никеля.
С ростом температуры при малом времени термолиза содержание фазы NiO в нанокомпозите уменьшается в связи с увеличением содержания металлического никеля (суммарное содержание NiO и β-никеля составляет 100%). При большом времени с ростом температуры содержание NiO растет, что связано с окислением металлического никеля.
С увеличением времени при невысокой температуре содержание NiO уменьшается, это связано с ростом содержания фазы металлического никеля. При высокой температуре с увеличением времени содержание NiO сначала уменьшается, а потом возрастает, это обусловлено влиянием двух противоположно направленных факторов: уменьшение связано с ростом содержания фазы металлического никеля, а рост – с окислением β-никеля до NiO.
Полученные результаты позволяют прогнозировать оптимальные условия образования более высокой доли ферромагнитной фазы нанокомпозита, сокращая неизбежное из-за окисления β-никеля содержание в нем суперпарамагнитного оксида никеля [27, 28] и тем самым улучшая магнитные характеристики данного образца, − это температура 310°С и длительность процесса термолиза 11 ч.
Следует отметить существенное влияние температуры и длительности процесса на диаметр наночастиц. С ростом температуры диаметр наночастиц значительно увеличивается при большом времени термолиза. Это связано с тем, что в ходе декарбоксилирования высвобождаются все новые атомы никеля, которые принимают участие в процессе нуклеации. При малом времени проведения термолиза рост диаметра наночастиц с увеличением температуры не так заметен. С ростом времени при высокой температуре диаметр наночастиц также в значительной степени увеличивается. Полученные результаты позволяют прогнозировать размер наночастиц при разной температуре и разном времени проведения термолиза.
ЗАКЛЮЧЕНИЕ
Представленные экспериментально-статистические математические модели термолиза итаконата никеля позволяют получить информацию о влиянии на характеристики процесса (концентрацию углерода, водорода, кислорода, никеля в нанокомпозите, выход нанокомпозита, содержание фаз β-никеля и оксида никеля, диаметр наночастиц) таких факторов, как время и температура.
Список литературы
Pal M., De A. // Hybrid Nanocomposites for Nanotechnology / Ed. Merhari L. Springer Science + Business Media, 2009. P. 455.
Manukyan A., Gyulasaryan H., Ginoyan A. et al. // Fundamental and Applied Nano-Electromagnetics. NATO Science for Peace and Security Series B: Physics and Biophysics / Eds. Maffucci A., Maksimenko S.A. Springer Science+Business Media Dordrecht, 2016. P. 273.
Gubin S.P., Yurkov G.Yu., Koksharov Yu.A., Khomutov G.B. // Russ. Chem. Rev. 2005. V. 74. № 6. P. 489. doi 10.1070/ RC2005v074n06ABEH000897 [Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю. // Успехи химии. 2005. Т. 74. № 6. С. 539.]
Баранов Д.А., Губин С.П. // Радиоэлектроника. Наносистемы. Информационные технологии. 2009. Т. 1. № 1–2. С. 129.
Guimaraes A.A. Principles of nanomagnetism. Berlin–Heidelberg: Springer, 2009.
Huang K.C. // J. Phys. D. Appl. Phys. 2010. V. 43. P. 374001.
Pankhurst Q.A., Thank N.T.K., Jones S.K., Dobson J. // J. Phys. D. Appl. Phys. 2009. V. 42. P. 224001.
Zhentao L., Chao H., Chang Y., Jieshan Q. // J. Nanosci. Nanotechnol. 2009. V. 9. P. 7473.
Bagmut A.G., Shipkova I.G., Zhuchkov V.A. // Techn. Phys. Russ. J. Appl. Phys. 2011. V. 56. № 4. P. 531. doi 10.1134/S1063784211040050 [Багмут А.Г., Шипкова И.Г., Жучков В.А. // Журн. техн. физики. 2011. Т. 81. Вып. 4. С. 102.]
Tsurin V.A., Yermakov A.Y., Uimin M.A. et al. // Phys. Solid State. 2014. V. 56. № 2. P. 287. doi 10.1134/S1063783414020309 [Цурин В.А., Ермаков А.Е., Уймин М.А. и др. // Физика твердого тела. 2014. Т. 56. Вып. 2. С. 287.]
Behera B.C., Ravindra A.V., Padhan P. // J. Appl. Phys. 2014. V. 115. P. 17B510.
Pomogailo A.D., Dzhardimalieva G.I. Nanostructured Materials Preparation via Condensation Ways. London: Springer, 2014. 460 p.
Хлебников В.К., Вишвасрао Х.М., Сокольская М.А. и др. // Вестн. МИТХТ. 2012. Т. 7. № 1. С. 64.
Джардималиева Г.И., Помогайло А.Д., Пономарев В.И. и др. // Изв. АН СССР. Сер. хим. 1988. Т. 49. № 10. С. 1525.
Musatova V.Yu., Semenov S.A., Drobot D.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. № 9. P. 1111. doi 10.1134/S0036023616090163 [Мусатова В.Ю., Семенов С.А., Дробот Д.В. и др. // Журн. неорган. химии. 2016. Т. 61. № 9. С. 1168]
Semenovhttps://doi.org/ S. A., Musatova V. Yu., Drobot D. V., Dzhardimalieva G. I. // Russ. J. Inorg. Chem. 2018. V. 63. № 11. P. 1424. doi 10.1134/S0036023618110153 [Семенов С.А., Мусатова В.Ю., Дробот Д.В., Джардималиева Г.И. // Журн. неорган. химии. 2018. Т. 63. № 11. С. 1400.]
Semenov S.A., Musatova V.Yu., Drobot D.V., Dzhardimalieva G.I. // Russ. J. Inorg. Chem. 2018. V. 63. № 9. P. 1217. doi 10.1134/S0036023618090164 [Семенов С.А., Мусатова В.Ю., Дробот Д.В., Джардималиева Г.И. // Журн. неорган. химии. 2018. Т. 63. № 9. С. 1195. doi 10.1134/ S0044457X18090167]
Pronin A.S., Semenov S.A., Drobot D.V., Dzhardimalieva G.I. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1041. doi 10.1134/S0036023618080193 [Пронин А.С., Семенов С.А., Дробот Д.В., Джардималиева Г.И. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 1005. doi 10.1134/ S0044457X18080196]
Semenov S.A., Drobot D.V., Musatova V.Yu. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 8. P. 897. doi 10.1134/S0036023615080161 [Семенов С.А., Дробот Д.В., Мусатова В.Ю. и др. // Журн. неорган. химии. 2015. Т. 60. № 8. С. 991.]
Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия, 1970. 360 с.
Shelekhov E.V., Sviridova T.A. // Met. Sci. Heat Treat. 2000. V. 42. № 7–8. С. 309. [Шелехов Е.В., Свиридова Т.А. // Металловедение и термическая обработка металлов. 2000. Т. 42. № 8. С. 16.]
Визильтер Ю.В. Обработка и анализ цифровых изображений с примерами на LabVIEW IMAQ Vision М.: ДМК Пресс, 2009. 464 с.
Semenov S.A., Reznik A.M. // Russ. J. Inorg. Chem. 2000. V. 45. № 11. P. 1775. [Семенов С.А., Резник А.М. // Журн. неорган. химии. 2000. Т. 45. № 11. С. 1934.]
Porollo N.P., Aliev Z.G., Dzhardimalieva G.I. et al. // Russ. Chem. Bull. 1997. V. 46. № 2. P. 362. [Поролло Н.П., Алиев З.Г., Джардималиева Г.И. и др. // Изв. АН СССР. Сер. хим. 1997. Т. 46. № 2. С. 375.]
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 258 с.
Yoon Tae Jeon, Je Yong Moon, Gang Ho Lee et al. // J. Phys. Chem. B. 2006. V. 110. № 3. P. 1187. doi https://doi.org/10.1021/jp054608b
Mahendraprabhu K., Elumalai P. // J. Sol-Gel Sci. Technol. 2015. V. 73. P. 428.
Thota S., Kumar J. // J. Phys. Chem. Solids. 2007. V. 68. P. 1951.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



