Журнал неорганической химии, 2019, T. 64, № 7, стр. 731-735
Синтез и исследование термодинамических свойств германата Tb2Ge2O7
Л. Т. Денисова 1, *, Ю. Ф. Каргин 2, Л. А. Иртюго 1, Н. В. Белоусова 1, В. В. Белецкий 1, В. М. Денисов 1
1 Сибирский федеральный университет, Институт цветных металлов и материаловедения
660041 Красноярск, Свободный пр-т, 79, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 10.10.2018
После доработки 16.11.2018
Принята к публикации 30.11.2018
Аннотация
Твердофазным синтезом из стехиометрической смеси Tb2O3 и GeO2 последовательным обжигом на воздухе при температурах 1273–1473 K получен германат Tb2Ge2O7. Методом дифференциальной сканирующей калориметрии исследовано влияние температуры на его молярную теплоемкость. По полученной зависимости Cp = f(T) рассчитаны термодинамические свойства (изменение энтальпии и энтропии, приведенная энергия Гиббса), оценено значение удельной теплоемкости при 298 K.
ВВЕДЕНИЕ
Внимание исследователей к германатам состава R2Ge2O7 (R = La–Lu, Sc, Y) обусловлено особенностями их структуры. Согласно [1–3], они по типу структур разделяются на четыре структурные подгруппы: La–Pr, Nd–Gd, Tb–Lu, Sc. Соединения с R = La–Eu содержат в архитектуре два германиевых радикала – [Ge3O10] и [GeO4], их химическую формулу представляют в виде R4[Ge3O10][GeO4] [1, 4]. Германаты R2Ge2O7 (R = = Gd, Dy, Ho, Er, Tm, Yb, Lu, Sc, Y) со структурой пирохлора были получены при повышенном давлении [2, 5, 6]. Следует отметить, что, согласно [3], германаты гадолиния и европия диморфны:
(1)
$2{\text{G}}{{{\text{d}}}_{2}}[{\text{G}}{{{\text{e}}}_{2}}{{{\text{O}}}_{7}}]\overset {1525\, \pm \,50\,\,{\text{K}}} \longleftrightarrow {\text{G}}{{{\text{d}}}_{4}}[{\text{G}}{{{\text{e}}}_{3}}{{{\text{O}}}_{{10}}}][{\text{Ge}}{{{\text{O}}}_{4}}],$(2)
$2{\text{E}}{{{\text{u}}}_{2}}[{\text{G}}{{{\text{e}}}_{2}}{{{\text{O}}}_{7}}]\overset {1375\, \pm \,75\,\,{\text{K}}} \longleftrightarrow {\text{E}}{{{\text{u}}}_{4}}[{\text{G}}{{{\text{e}}}_{3}}{{{\text{O}}}_{{10}}}][{\text{Ge}}{{{\text{O}}}_{4}}].$Несмотря на большое внимание к соединениям R2Ge2O7 [3, 5–9], их свойства исследованы фрагментарно. Для Tb2Ge2O7 имеются сведения о структуре [1–3], магнитных свойствах и низкотемпературной теплоемкости [10], однако калориметрические характеристики в широком температурном интервале, позволяющие получить важную информацию о теплофизических и термодинамических свойствах синтезируемых материалов, в литературе представлены недостаточно.
Цель настоящей работы – исследование теплоемкости германата Tb2Ge2O7 и определение его термодинамических свойств в широком интервале температур.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
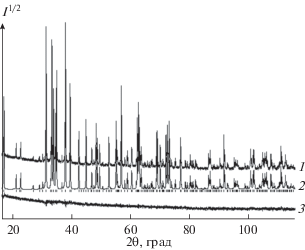
Для получения Tb2Ge2O7 использовали керамический метод. Предварительно исходные навески Tb2O3 (“ос. ч.”, ООО “Ланхит”) и GeO2 (99.999%, ФГУП “Германий”) прокаливали на воздухе при температуре 1173 K. Стехиометрическую смесь исходных компонентов гомогенизировали в агатовой ступке, прессовали в таблетки, обжигали на воздухе последовательно при температурах 1273 (40 ч), 1373 (100 ч) и 1473 K (60 ч). Известно, что достаточно высокая температура твердофазного синтеза может привести к испарению GeO2 и отклонению состава от стехиометрии [3, 4]. По данным [3], у германата лантана La4[Ge3O10][GeO4] наблюдаются большие потери в массе за счет сублимации GeO2, причем в зависимости от температуры и времени он распадается на La9.33[GeO4]6O2, La2[GeO4]O и La2O3. Учитывая это, синтез Tb2Ge2O7 проводили в тиглях с крышкой. Время синтеза и введение дополнительного количества GeO2 подбирали экспериментально, контролируя состав полученных образцов методом рентгенофазового анализа с помощью дифрактометра X′Pert Pro MPD PANalytical (Нидерланды), CoKα-излучение. Регистрацию дифрактограмм выполняли высокоскоростным детектором PIXcel в интервале углов 2θ = 16°–116° с шагом 0.013°. Дифрактограмма синтезированного германата показана на рис. 1. Параметры решетки Tb2Ge2O7 определяли аналогично [11]. Полученный образец имел молочно-белый цвет.
Рис. 1.
Экспериментальный (1), расчетный (2) и разностный (3) профили рентгенограммы Tb2Ge2O7; штрихи указывают расчетные положения рефлексов.
Теплоемкость Cp измеряли методом дифференциальной сканирующей калориметрии в платиновых тиглях с крышкой на приборе STA 449 C Jupiter (NETZSCH, Германия), при этом использовали специальный держатель TG+DSC 6.226.1–72+S. Проводили не менее трех измерений. Масса образцов была близка к массе эталона и составляла 114 ± 3 мг. Методика измерений описана нами ранее [12, 13]. Полученные данные обрабатывали с помощью пакета программ NETZSCH Proteus Thermal Analysis и лицензионной программы Systat Sigma Plot 12 (“Systat Software Inc”, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Параметры решетки синтезированного Tb2Ge2O7 в сравнении с данными других авторов приведены в табл. 1. Видно, что они хорошо согласуются между собой.
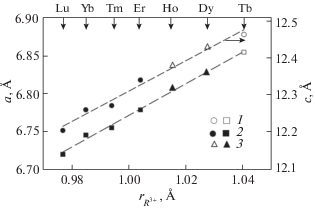
На рис. 2 показана корреляция между значениями параметров решетки соединений R2Ge2O7, относящихся к одной структурной подгруппе (R = Tb–Lu, пр. гр. P41212), и ионным радиусом ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ РЗЭ. Видно, что с увеличением ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ значения a и c увеличиваются практически по линейному закону и могут быть описаны следующими уравнениями:
(3)
$a = \left( {4.6769 \pm 0.0693} \right) + \left( {2.0344 \pm 0.0683} \right){{r}_{{{{{\text{R}}}^{{3 + }}}}}},$(4)
$c = \left( {8.1884 \pm 0.2434} \right) + \left( {4.1230 \pm 0.2419} \right){{r}_{{{{{\text{R}}}^{{3 + }}}}}}.$Коэффициенты корреляции для уравнений (3) и (4) равны соответственно 0.9973 и 0.9915, значения ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ взяты из [15].
Ранее линейная корреляция между значениями ${{r}_{{{{{\text{R}}}^{{3 + }}}}}}$ и постоянной решетки была установлена для станнатов R2Sn2O7 (R = Pr–Lu) со структурой пирохлора.
Для Gd4[Ge3O10][GeO4] и Eu4[Ge3O10][GeO4] рассчитанные параметры элементарной ячейки a и c по уравнениям (3) и (4) хорошо совпадают с экспериментальными значениями для пр. гр. P41212 [3].
На рис. 3 показано влияние температуры на теплоемкость Tb2Ge2O7. Видно, что в интервале температур 350–1000 K значения Cp закономерно увеличиваются, а на зависимости Cp = f(T) нет экстремумов. Этот факт может свидетельствовать о том, что у данного соединения в исследованном интервале температур нет полиморфных превращений. Аппроксимирующая кривая может быть описана классическим уравнением Майера–Келли:
(5)
$\begin{gathered} {{C}_{p}} = \left( {243.40 \pm 0.46} \right) + \left( {41.48 \pm 0.50} \right) \times \\ \times \,\,{{10}^{{ - 3}}}T - \left( {25.50 \pm 5.03} \right) \times {{10}^{5}}{{T}^{{ - 2}}}. \\ \end{gathered} $Рис. 3.
Температурная зависимость молярной теплоемкости Tb2Ge2O7: 1 – экспериментальные значения, 2 – расчет по уравнению (7).
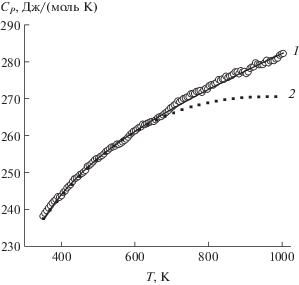
Коэффициент корреляции для уравнения (5) равен 0.999, а максимальное отклонение от сглаживающей кривой – 0.57%.
В табл. 2 представлены изменения энтальпии H°(T) – H°(350 K) и энтропии S°(T) – S°(350 K), а также приведенная энергия Гиббса Ф°(Т) – Ф°(350 K) германата Tb2Ge2O7, рассчитанные с использованием соотношения (5) и известных термодинамических уравнений.
Таблица 2.
Термодинамические свойства Tb2Ge2O7
| T, K | Cp, Дж/(моль K) |
H°(T) – H°(350 K), кДж/моль |
S°(T) – S°(350 K), Дж/(моль K) |
Ф°(Т) – Ф°(350 K), Дж/(моль K) |
|---|---|---|---|---|
| 350 | 237.1 | – | – | – |
| 400 450 500 |
244.1 249.5 253.9 |
12.04 24.38 36.97 |
32.14 61.21 87.73 |
2.04 7.03 13.79 |
| 550 600 650 700 |
257.8 261.2 264.3 267.2 |
49.76 62.74 75.88 89.17 |
112.1 134.7 155.7 175.4 |
21.64 30.13 38.99 48.04 |
| 750 800 850 900 950 |
270.0 272.6 275.1 277.6 280.0 |
102.6 116.2 129.9 143.7 157.6 |
194.0 211.5 228.1 243.9 258.9 |
57.16 66.26 75.30 84.22 93.02 |
| 1000 | 282.3 | 171.7 | 273.4 | 101.7 |
Из табл. 2 следует, что значения Cp при T > 850 K превышают предел Дюлонга–Пти 3Rs, где R – универсальная газовая постоянная, s – число атомов в формульной единице Tb2Ge2O7 (s = 11). Для сравнения экспериментальных величин теплоемкости со значениями 3Rs необходимо использовать теплоемкость при постоянном объеме CV, а не при постоянном давлении Cp. Однако для определения CV на основании опытных величин Cp требуются дополнительные данные. Например, для термодинамически строгого уравнения [16]:
необходимы сведения о коэффициенте объемного расширения α, коэффициенте сжимаемости μ и объеме V, данные о которых для Tb2Ge2O7 в литературе отсутствуют.
Значения Cp были рассчитаны с использованием простой модели, описывающей теплоемкость функцией Дебая [17]:
(7)
${{C}_{p}} \approx D\left( {{{{{\Theta }_{D}}} \mathord{\left/ {\vphantom {{{{\Theta }_{D}}} T}} \right. \kern-0em} T}} \right),$Сравнить полученные нами данные по теплоемкости Tb2Ge2O7 с данными других авторов не представлялось возможным, так как эти данные известны только для очень низких температур [10]. Расчет Cp298 для Tb2Ge2O7 инкрементным методом Кумока [19, 20] дает значение 228.9 Дж/моль K, что совпадает с величиной, полученной по уравнению (5) – 227.1 Дж/моль K. В то же время можно отметить, что значения удельной теплоемкости $c_{p}^{{\text{o}}}$ возрастают в ряду Tb2O3–Tb2Ge2O7–GeO2 (0.32–0.39–0.50 Дж/(г K)). Это согласуется с данными [21, 22] о том, что между составом образующихся оксидных соединений и их удельной теплоемкостью имеется корреляция. Значения теплоемкости для Tb2O3 взяты из работы [23], GeO2 – из [19].
ЗАКЛЮЧЕНИЕ
Обжигом на воздухе при 1273–1473 K стехиометрической смеси Tb2O3 и GeO2 синтезирован германат Tb2Ge2O7. Исследовано влияние температуры на его молярную теплоемкость. На основании зависимости Cp = f(T) рассчитаны термодинамические свойства германата тербия.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке в рамках государственного задания Министерства науки и высшего образования Российской Федерации Сибирскому федеральному университету на 2017–2019 гг. (проект 4.8083.2017/8.9 “Формирование банка данных термодинамических характеристик сложнооксидных полифункциональных материалов, содержащих редкие и рассеянные элементы”).
Список литературы
Демьянец Л.Н., Лобачов Л.Н., Емельченко Г.А. Германаты редкоземельных элементов. М.: Наука, 1980. 152 с.
Портной К.И., Тимофеева Н.И. Кислородные соединения редкоземельных элементов. М.: Металлургия, 1986. 480 с.
Becker U.W., Felsche J. // J. Less-Common. Met. 1987. V. 128. P. 269.
Бондарь И.А., Виноградова Н.В., Демьянец Л.Н. и др. Соединения редкоземельных элементов. Силикаты, германаты, фосфаты, арсенаты, ванадаты. М.: Наука, 1983. 288 с.
Subramanian M.A., Sleight A.W. // Handbook Phys. Chem. Rare Earth. 1993. V. 16. P. 225.
Li X., Cai Y.Q., Cui Q. et al. // Phys. Rew. B. 2016. V. 94. P. 214429-1. https://doi.org/10.1103/PhysRevB.94.214429
Stadnicka K., Glazer A.M., Korelewski M. et al. // J. Phys.: Condens. Matter. 1990. V. 2. P. 4795.
Morosan E., Fleitmann J.A., Huang Q. et al. // Phys. Rev. B. 2008. V. 77. P. 224423-1. https://doi.org/10.1103/PhysRevB.77.224423
Ke X., Dahlberg M.L., Morosan E. et al. // Phys. Rev. B. 2008. V. 78. P. 10441-1.https://doi.org/10.1103/PhysRevB.78.104411
Jana Y.M., Ghosh M., Ghosh D. et al. // J. Magn. Magn. Mater. 2000. V. 210. P. 93.
Denisova L.T., Karginb Yu.F., Chumilina L.G., Denisov V.M. // Russ. J. Inorg. Chem. 2016. V. 61. №. 4. P. 420. [Денисова Л.Т., Каргин Ю.Ф., Чумилина Л.Г., Денисов В.М. // Журн. неорган. химии. 2016. Т. 61. № 4. С. 441.]https://doi.org/10.1134/S0036023616040082
Denisov V.M., Denisova L.T., Irtyugo L.A., Biront V.S. // Phys. Solid State. 2010.Т. 52. № 7. P. 1362. [Денисов В.М., Денисова Л.Т., Иртюго Л.А., Биронт В.С. // Физика тв. тела. 2010. Т. 52. № 7. С. 1274.]https://doi.org/10.1134/S1063783410070073
Денисова Л.Т., Каргин Ю.Ф., Чумилина Л.Г. и др. // Журн. неорган. химии. 2015. Т. 60. № 2. С. 173. [Denisova L.T., Kargin Yu.F., Chumilina L.G. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 2. P. 137.]https://doi.org/10.1134/S0036023615020035
Denisova L.T., Irtyugo L.A., Kargin Yu.F. // Inorg. Mater. 2018. V. 54. № 4. P. 361. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2018. Т. 54. № 4. С. 382.]https://doi.org/10.1134/S0020168518040039
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. 32. № 5. P. 751.
Скуратов С.М., Колесов В.П., Воробьев А.Ф. Термохимия. Ч. II. М.: Изд-во Моск. ун-та, 1966. 434 с.
Pet'kov V.I., Markin A.V., Smirnova N.N. // Russ. J. Phys. Chem. A. 2013. Т. 87. № 8. P. 1266. [Петьков В.И., Маркин А.В., Смирнова Н.Н. // Журн. физ. химии. 2013. Т. 87. № 8. С. 1279.]https://doi.org/10.7868/S0044453713070273
Сирота Н.Н., Новиков А.В., Новикова В.В. и др. // Журн. физ. химии. 1990. Т. 64. № 7. С. 1750.
Leitner J., Chuchvalec P., Sedmidybský D. et al. // Thermochim. Acta. 2003. V. 295. P. 27.
Моисеев Г.К., Ватолин Н.А., Маршук Л.А. и др. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных АСТРА. OWN). Екатеринбург: УрО РАН, 1997. 230 с.
Denisova L.T., Irtyugo L.A., Karginet Yu.F. et al. // Inorg. Mater. 2017. V. 53. № 3. P. 289. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф. и др. // Неорган. материалы. 2017. Т. 53. № 3. С. 289.]https://doi.org/10.1134/S0020168517030037
Denisova L.T., Izotov A.D., Chumilina L.G. et al. // Dokl. Phys. Chem. 2016. Т. 467. № 1. P. 41. [Денисова Л.Т., Изотов А.Д., Чумилина Л.Г. и др. // Докл. АН. 2016. Т. 467. № 1. С. 58.]https://doi.org/10.1134/S0012501616030015
Гордиенко С.П., Феночка Б.В., Виксман Г.Ш. Термодинамика соединений лантаноидов. Киев: Наук. думка, 1979. 376 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии