Журнал неорганической химии, 2019, T. 64, № 7, стр. 700-706
Новый способ получения композитов TiO2/C с использованием титанорганических соединений
З. А. Фаттахова 1, *, Г. С. Захарова 1, Е. И. Андрейков 2, И. С. Пузырев 2
1 Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
2 Институт органического синтеза им. И.Я. Постовского УрО РАН
620137 Екатеринбург, ул. Софьи Ковалевской, 22, Россия
* E-mail: fattahova.zilara@yandex.ru
Поступила в редакцию 26.10.2018
После доработки 25.12.2018
Принята к публикации 15.02.2019
Аннотация
Термическим разложением глицеролата титана, полученного взаимодействием глицерина с тетраэтоксититаном или тетрабутоксититаном, синтезированы нанокомпозиты на основе диоксида титана анатазной модификации TiO2/С. Содержание углерода в композитном материале изменяется от 22.3 до 23.5 мас. %. С использованием методов рентгенофазового и термогравиметрического анализа, ИК- и КР-спектроскопии, сканирующей электронной микроскопии определены основные физико-химические характеристики синтезированных соединений. Установлено, что текстурные и морфологические особенности нанокомпозитов TiO2/C определяются типом алкоксида титана, используемого для получения прекурсора – глицеролата титана.
ВВЕДЕНИЕ
Диоксид титана (TiO2) широко используется при разработке элементов солнечных батарей [1], фотокатализаторов [2], датчиков газа и влажности [3], химических источников тока [4]. Широкое применение TiO2 в качестве перспективного материала обусловлено его низкой стоимостью, малой токсичностью и высокой химической стабильностью. Низкая проводимость значительно ограничивает использование диоксида титана, вследствие чего внимание исследователей направлено на ее повышение. Одним из наиболее эффективных методов изменения проводимости TiO2 является получение его в наноразмерном состоянии с требуемой структурой и морфологией [5]. В настоящее время наноразмерный TiO2 получают в виде шарообразных частиц [6], пленок [7], трубок [8], стержней [9]. Несмотря на эффективность использования наноструктурирования в качестве подхода для улучшения свойств материалов, наиболее надежным остается метод допирования TiO2 атомами азота [10], серы [11], фтора [12] и т.д. При этом значительное повышение проводимости достигается за счет образования дефектов кристаллической решетки диоксида титана. Электронную проводимость TiO2 можно увеличить также формированием композитов с проводящим соединением, например, с углеродом [13], анилином [14], поливинилпирролидоном [15].
В последнее время возрос интерес к созданию композитов на основе диоксида титана и углерода. Основным способом получения композита TiO2/С является гидротермальная обработка смеси диоксида титана с углеродным наноматериалом. В качестве углеродных наноматериалов используют углеродные нанотрубки [16], графен [17], фуллерен [18]. Недостатком данного метода является необходимость предварительной активации поверхности углеродсодержащих соединений. Классическим методом получения композита TiO2/С является термообработка смеси титансодержащих соединений (нитрат титана(IV), тетрабутоксититан) и углеродной компоненты (мезопористый углерод, резорцин, циклогексан) в инертной атмосфере при 450−900°С [19–21]. Широкое распространение находит способ синтеза композита на основе TiO2 путем термического разложения титанорганического соединения, выполняющего роль прекурсора. При этом прекурсор одновременно является источником углерода и оксида титана. Так, термолиз ацетилацетоната титана при 600°С в атмосфере аргона позволяет синтезировать композит TiO2/С анатазной модификации c нерегулярной морфологией сильно агломерированных частиц размером 10–30 мкм [22]. Перспективным прекурсором для получения наноразмерных композитов TiO2/С определенной структуры и морфологии являются алкоксиды титана [23]. Установлено, что физико-химические свойства конечного продукта во многом зависят от выбора исходного алкоксида и условий термообработки. Например, гликолят титана, кристаллизующийся в виде протяженных (стержни, проволоки) или сферических объектов, позволяет получать композит TiO2/С, сохраняющий морфологию исходного прекурсора [24, 25]. В последнее время вызывает интерес глицеролат титана, получаемый взаимодействием алкоксида титана и глицерина [26–28]. Применение глицеролата титана в качестве твердофазного прекурсора позволяет получать наноразмерный композит на основе диоксида титана различной модификации (аморфной, анатазной и рутильной или их смесь) [29].
В настоящей работе предложен новый подход к получению нанокомпозитов TiO2/C термолизом глицеролата титана, синтезированного с использованием двух различных типов алкоксидов титана – тетраэтоксититана и тетрабутоксититана.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных веществ использовали тетраэтоксититан Ti(OС2Н5)4 (ТЭТ) и тетрабутоксититан Ti(OС4Н9)4 (ТБТ) марки “ч.” и свежеперегнанный под вакуумом глицерин C3H5(OH)3 марки “ч. д. а.”. Глицеролат титана (ГТ) синтезировали согласно реакции:
(1)
$\begin{gathered} {\text{Ti}}{{\left( {{\text{OR}}} \right)}_{{\text{4}}}} + {\text{4}}{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{5}}}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} = \\ = \,\,{\text{Ti}}{{\left( {{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{7}}}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{4}}}} + {\text{4ROH}}, \\ \end{gathered} $К 150 мл глицерина добавляли 15 мл ТЭТ. Полученный раствор затем нагревали до 190°С в атмосфере азота в течение 24 ч. После охлаждения до комнатной температуры полученную реакционную массу собирали центрифугированием, промывали этанолом и сушили при 100°С в течение 24 ч. Аналогично синтезировали ГТ с использованием ТБТ. Синтезированные из ТЭТ и ТБТ образцы глицеролата титана обозначены как ГТ-Х, где Х = Э и Б соответственно. Порошки ГТ-Х использовали в качестве твердофазных прекурсоров для получения композита на основе диоксида титана. Для этого ГТ-Х отжигали при температуре 550°С в течение 1 ч (скорость нагрева 5 град/мин) в токе азота. Выбор данной температуры отжига обусловлен формированием конечного продукта как композита TiO2/C на основе анатазной модификации диоксида титана [29].
Рентгенофазовый анализ (РФА) образцов выполняли на дифрактометре Shimadzu XRD 7000 (CuKα-излучение, λ = 1.5418 Å). Морфологию порошков исследовали на сканирующем электронном микроскопе Tescan Mira, Maia 3 LMH (Tescan Orsay Holding). Исследования образцов методом ИК-Фурье-спектроскопии проводили на спектрометре Spectrum One (Perkin–Elmer). Спектры комбинационного рассеяния регистрировали на спектрометре U1000 (Renishaw) с использованием Не–Ne-лазера с длиной волны 532 нм мощностью 40 мВт. Термический анализ выполняли на анализаторе STA 449 F3 Jupiter (Netzsch), совмещенном с масс-спектрометром QMS 403 при скорости нагрева 10 град/мин в атмосфере воздуха (ТГ-ДСК-МС). Площадь удельной поверхности и пористость определяли методом низкотемпературной адсорбции азота на анализаторе Gemini VII (Micromeritics). Пробоподготовку образцов проводили вакуумированием при 150°С в течение 2 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
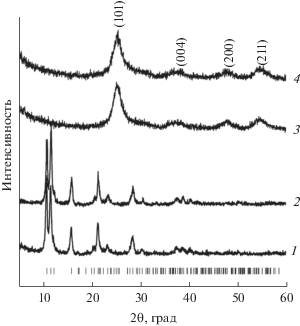
Согласно РФА (рис. 1), дифрактограммы образцов ГТ, синтезированных с использованием ТЭТ и ТБТ, полностью совпадают с данными [30]. Структура ГТ индицируется в пр. гр. P2/c с параметрами элементарной ячейки: a = 8.37515, b = 15.33781, c = 5.57151 Å, β = 99.824°. Дифрактограммы композитов TiO2/C-Э и TiO2/C-Б, полученных термической обработкой ГТ-Х при 550°С, независимо от выбора исходного прекурсора свидетельствуют о формировании композита на основе анатазной модификации диоксида титана. Соединения кристаллизуются в тетрагональной сингонии с пр. гр. I4/amd и параметрами элементарной ячейки: a = 3.814(6), c = 9.578(3) Å, V = = 139.373 Å3 и a = 3.803(9), c = 9.348(9) Å, V = = 135.280 Å3 для TiO2/C-Э и TiO2/C-Б соответственно. С использованием уравнения Шеррера проведена оценка среднего размера частиц TiO2 композитов:
где D – размеры кристаллитов, K – безразмерный коэффициент формы частиц, равный 0.93 (постоянная Шеррера), Δ(2θ) – ширина рефлекса на полувысоте, θ – брэгговский угол, λ – длина волны рентгеновского излучения. Расчет вели по интенсивному и хорошо разрешенному дифракционному пику (101). Средний размер частиц диоксида титана композитов TiO2/C-Э и TiO2/C-Б равен 4.2 и 3.9 нм соответственно.Рис. 1.
Дифрактограммы порошков ГТ-Э (1), ГТ-Б (2) и позиции брэгговских пиков ГТ, по данным [30], для TiO2/C-Э (3) и TiO2/C-Б (4).
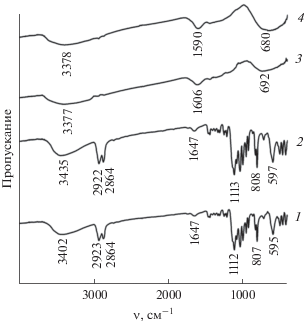
Дополнительные исследования фазовых превращений композита TiO2/C-Х в процессе термолиза ГТ проводили с использованием ИК- и КР-спектроскопии. ИК-спектры ГТ-Х и композитов TiO2/C-Х представлены на рис. 2. В ИК-спектрах глицеролата титана в интервале частот 1125–500 см–1 проявляются характеристические полосы, соответствующие валентным колебаниям связей C–O и деформационным колебаниям Ti–O–C алкоксигрупп [27, 31]. В области 2846–2970 см–1 наблюдаются полосы поглощения средней интенсивности, соответствующие симметричным и асимметричным валентным колебаниям связей С–Н [32, 33]. Слабые полосы в интервале 1460–1200 см–1 могут быть отнесены к деформационным колебаниям связей С–Н. Термообработка ГТ-Х приводит к исчезновению основных полос поглощения алкоксидов и появлению интенсивного поглощения валентных колебаний ν(Ti–O) в октаэдре TiO6 в интервале 500–850 см–1 [34]. Во всех четырех образцах в области 3378–3435 см–1 наблюдаются широкие полосы, характерные для валентных колебаний ОН-групп и молекул воды. Полосы в области 1590–1647 см–1 соответствуют деформационным колебаниям адсорбированных молекул воды.
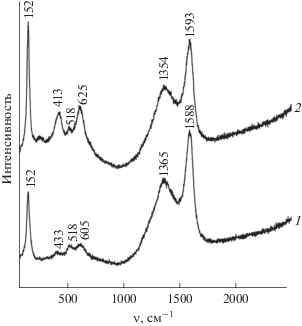
Данные спектроскопии КР также подтверждают образование нанокомпозитов на основе диоксида титана анатазной модификации. В спектрах КР соединений TiO2/C-X в интервале 140–700 см–1 наблюдаются вибрационные моды, характерные для анатазной модификации TiO2 [35] (рис. 3). Сдвиг пиков в сторону больших волновых чисел по сравнению с монокристаллической фазой анатаза свидетельствует о наличии дефектов и уменьшении размеров кристаллитов нанокомпозитов на основе TiO2 [36]. Дополнительный анализ спектров КР позволил идентифицировать присутствие углерода в композите TiO2/C-Х. В спектре КР в интервале 1100–1700 см–1 наблюдаются две характеристические полосы углерода. Пик при 1350 см–1 описывает D-линию, которая соответствует колебаниям атомов углерода с sp3-типом гибридизации и свидетельствует о наличии разупорядочения. Пик при 1600 см–1 описывает G-линию, соответствующую колебаниям атомов углерода в sp2-гибридизации, и указывает на наличие в образце мелкокристаллического графита [37]. Таким образом, полученные спектры КР показывают, что при формировании композитов TiO2/C-X происходит образование разупорядоченного мелкокристаллического графита. Для оценки степени упорядоченности углерода использовали в качестве показателя отношение интенсивностей D- и G-полос (ID/IG). Для композитов TiO2/C-Э и TiO2/C-Б отношение ID/IG = 0.64. Вычисленное значение ID/IG свидетельствует о более высокой степени упорядочения углеродного каркаса композитов TiO2/C-X по сравнению с оксидом графена, графита или их композитов с диоксидом титана, для которых аналогичное значение существенно выше [38].
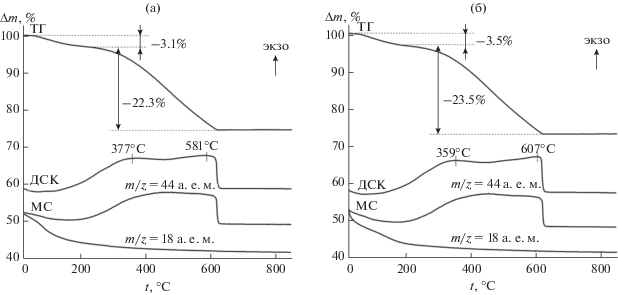
Согласно данным ТГ-ДСК-МС, термическое разложение композита TiO2/C-X (независимо от выбора исходного ГТ) происходит в две стадии (рис. 4). В интервале температур 20–220°С наблюдается незначительная убыль массы. При этом на МС-кривой регистрируется широкий и размытый пик молекулярного иона воды H2O+ с m/z = 18 а.е.м., соответствующий удалению адсорбционной воды. Присутствие адсорбционной воды в TiO2/C-X также подтверждено данными ИК-спектроскопии. На второй стадии в интервале 220–620°С происходит основная убыль массы, обусловленная окислением углеродной составляющей композита. Выделение диоксида углерода подтверждается интенсивным пиком молекулярного иона ${\text{CO}}_{2}^{ + }$ в масс-спектре с m/z = 44 а.е.м. При этом на кривых ДСК фиксируются два широких перекрывающихся экзотермических эффекта с максимумами при 377 и 581°С для TiO2/C-Э и 359, 607°С для TiO2/C-Б. По-видимому, наличие двойного экзоэффекта с хорошо разрешимыми максимальными температурами связано с различным состоянием углерода в композитах. Термогравиметрический анализ композита TiO2/C-X позволил оценить содержание углерода в образцах, которое составляет 22.3 и 23.5 мас. % для TiO2/C-Э и TiO2/C-Б соответственно.
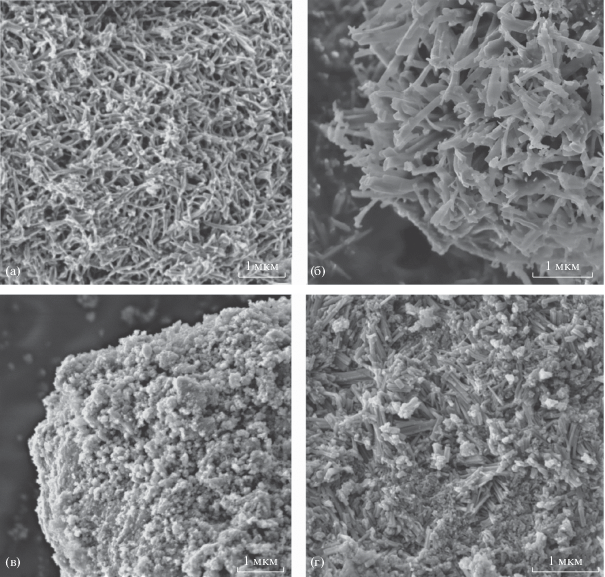
На рис. 5 представлены СЭМ-изображения ГТ-Э, ГТ-Б, TiO2/C-Э и TiO2/C-Б. Порошок ГТ-Э состоит из частиц с морфологией наноремней шириной 25–40, толщиной ~30 и длиной до 550 нм (рис. 5а). Порошок ГТ-Б образован слабоагломерированными протяженными частицами с морфологией, подобной ремням шириной 100–300, толщиной 30–60 нм и длиной до 1.6 мкм (рис. 5б). Термолиз ГТ-Э сопровождается полным изменением его морфологии с образованием агломерированных сферических наночастиц композита TiO2/C-Э размером 25–35 нм (рис. 5в). Пиролиз ГТ-Б приводит к частичному разрушению протяженных структур и формированию наночастиц TiO2/C-Б с нерегулярной морфологией шириной ~50 и длиной до 250 нм (рис. 5г). По-видимому, размерные и морфологические характеристики композитов TiO2/C-X обусловлены природой прекурсора, используемого для его получения (длина углеводородного радикала, термическая стабильность и др.).
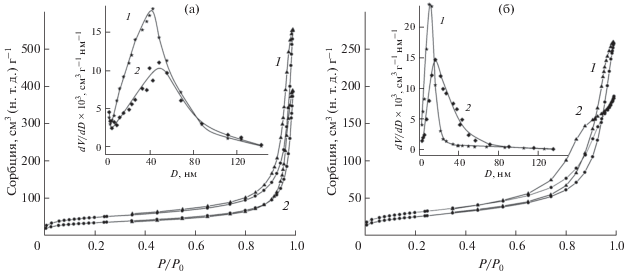
На рис. 6 представлены результаты исследования удельной поверхности, пористости образцов ГТ-Э, ГТ-Б и композитов TiO2/C-Э, TiO2/C-Б. Согласно классификации ИЮПАК [39], изотермы сорбции синтезированных соединений относятся к IV типу, характерному для мезопористых материалов с петлей гистерезиса Н3. Такое поведение ассоциируется с наличием в соединении пор щелевидной формы. Площадь удельной поверхности прекурсоров ГТ-Э, ГТ-Б и нанокомпозитов TiO2/C-Э, TiO2/C-Б составляет 163.6, 110.0 и 110.3, 94.2 м2/г соответственно. Следует отметить, что величина площади удельной поверхности композитов TiO2/C-X значительно меньше по сравнению с аналогичной величиной для исходных ГТ-Х. Очевидно, это связано с агрегированием образующихся наночастиц композита TiO2/C-X в процессе пиролиза глицеролата титана. Заметное отличие в величине площади удельной поверхности композитов TiO2/C, синтезированных с использованием ТЭТ и ТБТ, по-видимому, обусловлено морфологией их частиц. Распределение пор по размерам было вычислено с использованием дифференциальной кривой десорбционной ветви полной изотермы сорбции азота. Размер пор прекурсоров ГТ-X изменяется в широком интервале с преимущественным размером ~45 нм (рис. 6, вставка). Композит TiO2/C-Э имеет узкое распределение пор по размерам, при этом преимущественный размер пор составляет ~10 нм. Соединение TiO2/C-Б характеризуется более широким распределением пор с преимущественным размером ~20 нм.
ЗАКЛЮЧЕНИЕ
Установлено, что термическим разложением глицеролата титана, синтезированного с использованием ТЭТ и ТБТ в инертной атмосфере, могут быть получены композитные материалы на основе TiO2 анатазной модификации. Содержание углерода в композитах практически не зависит от типа используемого прекурсора и составляет 22.3 и 23.5 мас. % для TiO2/C-Э и TiO2/C-Б соответственно. Текстурный анализ показал, что величина удельной поверхности определяется типом алкоксида титана и максимальна для TiO2/C-Э. Очевидно, величину удельной поверхности композитного материала TiO2/C, определяющей электрохимические, сорбционные и другие свойства, можно регулировать, используя в качестве исходных веществ различные алкоксиды титана.
Список литературы
Gratzel M.J. // Photochem. Photobiol. 2003. V. 4. № 2. P. 145.https://doi.org/10.1016/S1389-5567(03)00026-1
Byrne J.A., Davidson A., Dunlop P.S.M. et al. // J. Photochem. Photobiol., A. 2002. V. 148. P. 365.
Abdullah M., Kamarudin S.K. // Renew. Sust. Energ. Rev. 2017. V. 76. P. 212.
Hu Y.-S., Kienle L., Guo Y.-G. et al. // Adv. Mater. 2006. V. 18. № 11. P. 1421.https://doi.org/10.1002/adma.200502723
Chen X., Mao S.S. // Chem. Rev. 2007. V. 107. № 7. P. 2891.https://doi.org/10.1021/cr0500535
Yang H.G., Zeng H.C. // J. Phys. Chem. B. 2004. V. 108. P. 3492.https://doi.org/10.1021/jp0377782
Chen L., Tian J., Qiu H. et al. // Ceram. Int. 2009. V. 35. № 8. P. 3275. https://doi.org/10.1016/j.ceramint.2009.05.021
Roy P., Berger S., Schmuki P. // Angew. Chem. Int. Ed. 2011. V. 50. № 13. P. 2904. https://doi.org/10.1002/anie.201001374
Cozzoli D.P., Kornowski A., Weller H. // J. Am. Chem. Soc. 2003. V. 125. № 47. P. 14539.https://doi.org/10.1021/ja036505h
Valentin D.C., Finazzi E., Pacchioni G. // Chem. Phys. 2007. V. 339. № 1–3. P. 44.https://doi.org/10.1016/j.chemphys.2007.07.020
Ohno T., Mitsui T., Matsumura M. // Chem. Lett. 2003. V. 32. № 4. P. 364. https://doi.org/10.1246/cl.2003.364
Yu J.C., Yu J., Ho W. et al. // Chem. Mater. 2002. V. 14. № 9. P. 3808. https://doi.org/10.1021/cm020027c
Shi X., Zhang Z., Du K. et al. // J. Power Sources. 2016. V. 330. P. 1.https://doi.org/10.1016/j.jpowsour.2016.08.132
Guo Y., He D., Xia S. et al. // J. Nanomater. 2012. V. 2012. P. 1.https://doi.org/10.1155/2012/202794
Zheng M.-P., Jin Y.-P., Jin G.-L. et al. // J. Mater. Sci. Lett. 2000. V. 19. № 5. P. 433.https://doi.org/10.1023/a:1006703224379
Yen C.-Y., Lin Y.-F., Hung C.-H. et al. // Nanotechnol. 2008. V. 19. № 4. P. 045604. https://doi.org/10.1088/0957-4484/19/04/045604
Huang Q., Tian S., Zeng D. et al. // ACS Catal. 2013. V. 3. № 7. P. 1477. https://doi.org/10.1021/cs400080w
Yang M.-Q., Zhang N., Xu Y.-J. // ACS Appl. Mater. Inter. 2013. V. 5. № 3. P. 1156. https://doi.org/10.1021/am3029798
Zeng L., Zheng C., Xia L. et al. // J. Mater. Chem. 2013. V. 1. № 13. P. 4293. https://doi.org/10.1039/c3ta10275k
Maldonado-Hódar F.J., Moreno-Castilla C., Rivera-Utrilla J. // Appl. Catal., A. 2000. V. 203. № 1. P. 151. https://doi.org/10.1016/s0926-860x(00)00480-4
Gea Y., Zhu J., Lub Y. et al. // Electrochim. Acta. 2015. V. 176. № 10. P. 989.
Xiong L., Xu Y., Lei P. et al. // Solid State Ionics. 2014. V. 268. P. 265. https://doi.org/10.1016/j.ssi.2014.08.009
Zhao J., Liu Y., Fan M. et al. // Inorg. Chem. Frontiers. 2015. V. 2. № 3. P. 198. https://doi.org/10.1039/c4qi00191e
Wei Y., Zhu J., Gan Y. et al. // Adv. Powder Technol. 2018. V. 29. № 10. P. 2289. https://doi.org/10.1016/j.apt.2018.05.016
Jiang X., Wang Y., Herricks T. et al. // J. Mater. Chem. 2004. V. 14. № 4. P. 695. https://doi.org/10.1039/b313938g
Jiang J., Gu F., Shao W. et al. // Ind. Eng. Chem. Res. 2012. V. 51. № 7. P. 2838. https://doi.org/10.1021/ie202049j
Zakharova G.S., Andreikov E.I., Osipova V.A. et al. // Inorg. Mater. 2013. V. 49. № 11. P. 1216. [Захарова Г.С., Андрейков Е.И., Осипова В.А. и др. // Неорган. материалы. 2013. Т. 49. № 11. С. 1216.]https://doi.org/10.1134/S0020168513100154
Kim H.-B., Jang D.-J. // Cryst. Eng. Comm. 2015. V. 17. № 17. P. 3325. https://doi.org/10.1039/c5ce00257e
Zakharova G.S., Ottmann A., Möller L. et al. // J. Mater. Sci. 2018. V. 53. P. 12244. https://doi.org/https://doi.org/10.1007/s10853-018-2488-9
Das J., Freitas F.S., Evans I.R. et al. // J. Mater. Chem. 2010. V. 20. № 21. P. 4425. https://doi.org/10.1039/b921373b
Velasco M., Rubio F., Rubio J., Oteo J.L. // Thermochim. Acta. 1999. V. 326. P. 91. https://doi.org/10.1016/j.supflu.2018.04.017
Doeuff S., Henry M., Sanchez C. et al. // J. Non-Cryst. Solids. 1987. V. 89. P. 206.
Казаков Д.А., Портнова А.В., Онорин С.А. и др. // Химия и хим. технология. 2011. Т. 54. № 6. С. 39.
Kuz'micheva G.M., Savinkina E.V., Obolenskaya L.N. et al. // Crystallography Reports. 2010. V. 55. № 5. P. 866. [Кузьмичева Г.М., Савинкина Е.В., Оболенская Л.Н. и др. // Кристаллография. 2010. Т. 55. № 5. С. 919.]https://doi.org/10.1134/S1063774510050287
Ohsaka T., Izumi F., Fujiki Y. // J. Raman Spectrosc. 1978. V. 7. № 6. P. 321. https://doi.org/10.1002/jrs.1250070606
Zhang W.F., He Y.L, Zhang M.S. et al. // J. Phys. D: Appl. Phys. 2000. V. 33. P. 912. https://doi.org/10.1088/0022-3727/33/8/305
Ferrari A.C., Robertson J. // Phys. Rev. B. 2000. V. 61. № 20. P. 14095. https://doi.org/10.1103/physrevb.61.14095
Liu R., Guo W., Sun B. et al. // Electrochim. Acta. 2015. V. 156. P. 274. https://doi.org/10.1016/j.electacta.2015.01.012
Sing K.S.W., Everett D.H., Haul R.A.W. et al. // Pure Appl. Chem. 1985. V. 57. № 4. P. 603. https://doi.org/10.1351/pac198557040603
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии