Журнал неорганической химии, 2019, T. 64, № 7, стр. 727-730
Строение мономерных октаэдрических монооксокомплексов d2-рения(V) [ReO(Lтри)(Lби)], [ReO(Lтетра)(Lмоно)] с атомами кислорода тридентатно (О, О, О)- и тетрадентатно (О, О, О, О)-хелатных лигандов
В. С. Сергиенко 1, 2, *, С. Б. Страшнова 3
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Всероссийский институт научной и технической информации РАН
125190 Москва, ул. Усиевича, 20, Россия
3 Российский университет дружбы народов
117198 Москва, ул. Миклухо-Маклая, 6, Россия
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 20.04.2018
После доработки 04.02.2019
Принята к публикации 15.02.2019
Аннотация
Рассмотрены особенности строения четырех (по два) моноядерных октаэдрических монооксокомплексов d2-Re(V) с тридентатно (O, O, O)- и тетрадентатно (О, О, О, О)-хелатными лигандами [ReO(Lтри)(Lби)] и [ReO(Lтетра)(Lмоно)]. Показано, что связи Re–O(Lтри)транс удлинены, а Re–O(Lтетра)транс– укорочены по сравнению со связями Re–O(L)цис.
ВВЕДЕНИЕ
Строение мономерных октаэдрических комплексов (МОК) d0-, d2-металлов V–VII групп (Nb, V, Mo, W, Re, Tc) с кратносвязанными лигандами О(оксо) подробно рассмотрено в работах [1–7]. Для d2-Re(V) методом рентгеноструктурного анализа определена кристаллическая структура более пятисот соединений (см. Кембриджский банк структурных данных, вeрсия 5.38, ноябрь 2017 г. [8]). Большинство из них – МОК ReOоксоО(Lig)транс с атомами кислорода моно- и полидентатных лигандов в транс-позициях к оксолигандам. Ранее мы опубликовали ряд обобщающих статей по МОК d2-Re(V) c лигандами: атомами галогенидов, азота, серы и водорода, кислорода монодентатных ацидолигандов (гидроксо-, алкоксо- (метоксо-, этоксо-, пропоксо-), ОRn– (n = 1, 2; R = = Ph, Cy, C6H4OH, C6H4OMe, P(O)(OMe)2, C(O)(CF3), OCMe(CF3)2, BF3), OERn– (n = 1, 2; Е = Si, B, S; R = Me3, F3, О2CF3)), бидентатно-хелатных (О, О) [9], (O, S) и (O, C), (О, Р), (O, N) однозарядных лигандов, тридентатно-хелатных (О, N, O) одно- и двухзарядных лигандов [10], а также нейтральных кислородсодержащих лигандов (молекул воды, фосфин- и арсиноксидных OER3 (E = P, As; R3 = Ph3, PhEt2), молекул OR' (ДМФ), R"OH (R" = Me, Et, Pr), L (ON4C6 · C6H10, O–(C6H3MeCH2NH+Et2), O–(NH+C5H4))) в транс-позициях к кратносвязанным лигандам О(оксо). Опубликованы обзорные статьи по особенностям строения МОК d0-Re(VII) [11] и d0-, d2-Tc(V, VII) [12].
Структурное проявление трансвлияния (СПТВ) кратносвязанного лиганда O(оксо) – удлинение противолежащей связи Re–Lтранс – характеризуется параметром ∆ – разностью длин одноименных связей [Re–Lтранс] – [Re–Lцис]. Если в структуре нет лигандов одного сорта и в транс-, и в цис-позициях к О(оксо), мы используем параметр Δ, равный [Re–Lтранс] – [Re–L(СТ)], где СТ – среднестатистическая стандартная длина связи Re(V) с атомом лиганда того же сорта, что и Lтранс. В качестве параметра Re–O(СТ) приняли, как в [4], величину 2.04 Å.
В настоящей статье обсуждается строение мономерных октаэдрических монооксокомплексов [ReO(Lтри)(Lби)] и [ReO(Lтетра)(Lмоно)], содержащих тридентатно (О, О, О)- и тетрадентатно (О, О, О, О)-хелатные, а также бидентатно-хелатные (Lби) или монодентатные (Lмоно) лиганды. Транс-позиции к кратносвязанным оксолигандам занимают атомы кислорода О(Lтри), О(Lтетра).
Основные длины связей в структурно исследованных комплексах приведены в табл. 1.
Таблица 1.
Основные геометрические параметры (в Å) в мономерных октаэдрических комплексах [ReO(Lтри)(Lмоно)2] и [ReO(Lтетра)(Lмоно)] с тридентатно (О, О, О)- и тетрадентатно (О, О, О, О)-хелатными лигандами
| № | Комплекс | Re=O | Re–Lцис | Re–О(L)транс | Δ | Литeрa-тура |
|---|---|---|---|---|---|---|
| I | [ReO(Lтри)(Tmen)] · 2Н2О | 1.678(3) | 1.948(3) ± 0.007 O(Lтри) 2.227(4) ± 0.003 N(Tmen) |
2.067(3) | 0.119 | [13] |
| II | [ReO(Lтри)(Phen)] · MeOH | 1.690(6) | 1.937(6) ± 0.020 O(Lтри) 2.144(7) ± 0.015 N(Phen) |
2.102(6) | 0.165 | [13] |
| III | Na(NCMe2)[ReO(Lтетра)(PPh3)] · 4MeCN | 1.698(2) | 2.059(2) ± 0.010O(Lтетра) 2.4390(9) P(PPh3) | 1.938(2) | –0.121 | [15] |
| IV | K(NCMe2)[ReO(Lтетра) ⋅ (PPh3)] · 4MeCN | 1.699(2) | 2.062(2) ± 0.008 O(Lтетра) 2.4432(10) P(PPh3) | 1.925(2) | –0.137 | [15] |
КОМПЛЕКСЫ [ReO(Lтри)(Lби)]
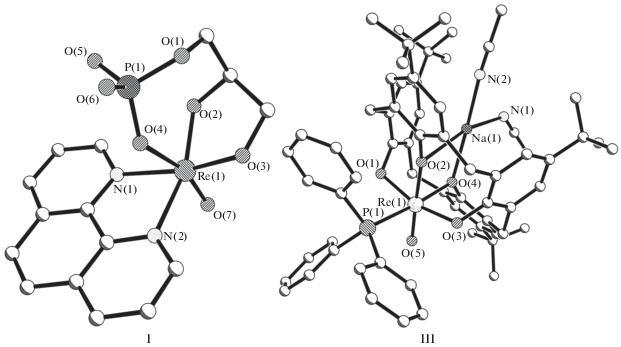
Известна структура двух близких по составу комплексов [13], различающихся лишь типом бидентатно-хелатного (N, N) лиганда и сольватной молекулой: [ReO(Lтри)(Lби)] · Solv, где Lби – тетраметилэтан-1,2-диамин ((NMe2)CH2)2 (Tmen), Solv = H2O (I, рис. 1а); Lби – 1,10-фенантролин NC5H3(СH)2NС5H3 (Phen) (II). Трехзарядные сахарофосфонатные лиганды (Lтри)3–, 2,3-ди(гидрокси)пропилдигидрофосфато ОСН2С(О)СН2ОР(О)(ОН)О, в обеих структурах замыкающие по два сочлененных по связям Re–O(2), O(2)–C металлоцикла (семичленный ReOC2OPO и пятичленный ReOC2O), координируют атом рения тремя атомами кислорода на общей грани октаэдра RеO4N2. Интервал углов ОReOцис в I, II составляет 82.3°–88.5°. Связи Re–O(Lтри) с нейтральными атомами кислорода фосфатогрупп в транс-позициях к О(оксо) (2.067 и 2.102 Å соответственно в I и II) заметно длиннее (в среднем на 0.119 и 0.165 Å) аналогичных связей Re–O(Lтри)цис (1.948 ± 0.007 и 1.937 ± 0.020 Å) вследствие СПТВ. Авторы [13] отмечают, что в единственном структурно исследованном комплексе [ReVO(Lмоно)(1-MeIm4)](PF6)2 · толуол [14] с лигандом L – диэфиром фосфорной кислоты OP(O)(OMe)2 – связь Re–Oтранс (1.988 Å) существенно короче, чем в I и II. В тетраэдре РО4 обеих структур атомы фосфора координированы атомами кислорода в разной функции и на разных расстояниях Р–О: 1.587 и 1.583 Å соответственно в I и II с атомом О(1) семичленного металлоцикла; 1.528 и 1.527 Å с О(4) (координирован с Re); 1.558 и 1.558 Å с О(5) (гидроксогруппа); 1.483 и 1.490 Å с О(6) (концевой). Фосфатогруппы депротонированы по атомам О(1). В структуре I есть прочная водородная связь (ВC) O(5)–H…O(w) между концевой гидроксогруппой и сольватной молекулой воды (О…О 2.522 Å). В структуре II две короткие ВС типа О(5)–Н…О(6) (О…О 2.495 Å) формируют центросимметричный димер.
СОЕДИНЕНИЯ [ReO(Lтетра)(Lмоно)]
Определена кристаллическая структура двух соединений [15], содержащих комплексные молекулы с общей формулой [M(NCMe)2] [ReO(Lтетра)(Lмоно))] · 4MeCN, где Lмоно = PPh3, M = = Na (III, рис. 1б) и K (IV). Кристаллы III и IV изоструктурные. Четырехзарядный лиганд (Lтетра)4– – μ2-5,11,17,23-тетра-4-бутилкаликс(4)арен-25,26,27,28-тетраолат (OC6H2(трет-Bu)CH2)4 – имеет эллиптическую форму и содержит четыре эквивалентных фрагмента ОС6Н2(трет-Bu)CH2, координирующих атом рения ацидоатомами кислорода. При координации рения с лигандом Lтетра замыкаются четыре восьмичленных металлоцикла ReOC5O, попарно сочлененных по связям Re–O, O–C. Кроме того, в структурах III, IV формируется биметаллический четырехчленный хелатный цикл ReOMO. Связи Re–O(Lтетра)транс (1.938 и 1.925 Å соответственно в III и IV) существенно короче, а не длиннее, как в I, II, чем Re–O(Lтетра)цис (средн. 2.059 и 2.062, Δ = –0.121 и –0.137 Å). Атомы щелочных металлов М имеют КЧ = 4: M–Oмост 2.309 и 2.591, М–N 2.386 ± 0.010 Å (III, M = Na); M–O 2.595 и 2.867, M–N 2.745 ± 0.040 Å (IV, M = = K). Валентные углы NMN 92.54°, ОМО 66.39° (III, M = Na); 92.90°, 59.45° (IV, M = K). Расстояния Rе–Na 3.525, Re–K 3.834 Å, углы ReONa 101.64° и 107.55°, ReOK 104.52° и 110.19°.
ОСОБЕННОСТИ СТРОЕНИЯ МОНОМЕРНЫХ ОКТАЭДРИЧЕСКИХ МОНООКСОКОМПЛЕКСОВ РЕНИЯ(V). [ReO(Lтри)(Lби)] и [ReO(Lтетра)(Lмоно)] С ТРИДЕНТАТНО (О,О,О)- И ТЕТРАДЕНТАТНО (О,О,О,О)-ХЕЛАТНЫМИ ЛИГАНДАМИ
В табл. 1 приведены средние значения основных геометрических параметров в структурах I–IV. Отметим две особенности стереохимии октаэдрических монооксокомплексов металлов V–VII групп (в том числе рения).
1. Выбор транс-партнера (при наличии конкурирующих лигандов) определяется правилом самосогласованности [2]: в транс-положении к кратносвязанному лиганду О(оксо), как правило, размещается наименее поляризуемый нейтральный σ-донорный лиганд (атом), связь с которым легче ослабить, а не отрицательно заряженный (ацидо) лиганд (атом).
2. Связи Re–L, транс к О(оксо), удлиняются из-за СПТВ кратносвязанного оксолиганда.
Оба правила реализуются в комплексах I и II. В этих соединениях транс-положение к оксолигандам занимают нейтральные атомы кислорода лиганда Lтри, связи Re–Oтранс с которыми (2.067 и 2.102 Å соответственно в I и II) существенно длиннее (на 0.119 и 0.165 Å), чем Re–O(Lтри)цис (средн. 1.948 и 1.937 Å).
В комплексах III и IV в транс-позициях к О(оксо) расположены ацидоатомы кислорода лиганда Lтетра.
При этом в соединениях III, IV имеет место принципиально иной вариант, чем в вышеописанных комплексах I, II. В комплексах III, IV связи Re–O(Lтетра)транс (1.938, 1.925 Å), как сказано выше, существенно (в среднем на 0.121 и 0.137 Å) короче, чем Re–O(Lтетра)цис, а не длиннее вследствие СПТВ, как в I, II и в большинстве монооксооктаэдрических комплексов d2-Re(V). Этот факт, казалось бы, противоречит правилу самосогласованности [2]. Однако на самом деле связи Re–O(L) в транс-позициях к оксолигандам в соединениях III, IV можно рассматривать как имеющие повышенную кратность, так как они меньше не только одноименных расстояний Re–O(Lтетра) (отрицательная величина параметра Δ), но и величины Re–O(СТ) 2.04 Å [4], т.е. в этом случае можно говорить о псевдодиоксокомплексах, содержащих два лиганда (О(оксо) и О(L)транс) повышенной кратности. Напомним, что в диоксокомплексах d2-металлов V–VII групп два кратносвязанных лиганда всегда располагаются в транс-позициях друг к другу.
Список литературы
Порай-Кошиц М.А., Гилинская Э.А. Кристаллохимия. М.: ВИНИТИ, Итоги науки и техники. 1966. С. 126.
Порай-Кошиц М.А., Атовмян Л.О. // Коорд. химия. 1975. Т. 1. С. 1271.
Griffith F., Wicing C. // J. Chem. Soc. A. 1968. P. 379.
Порай-Кошиц М.А. // Изв. Югосл. кристаллогр. центра. 1974. Т. 9. С. 19.
Порай-Кошиц М.А., Атовмян Л.О. Кристаллохимия координационных соединений молибдена. М.: Наука, 1974. 231 с.
Shustorovich E.M., Porai-Koshits M.A., Buslaev Yu.A. // Coord. Chem. Rev. 1975. V. 17. P. 1.
Порай-Кошиц М.А., Сергиенко В.С. // Успехи химии. 1990. Т. 59. С. 86.
Allen F.H. // Acta Crystallogr. 2002. V. 58B. P. 380.
Sergienko V.S., Churakov A.V. // Russ. J. Inorg. Chem. 2016. V. 61. № 13. P. 1708.
Sergienko V.S. // Russ. J. Inorg. Chem. 2015. V. 60. № 14. P. 1723.
Sergienko V.S., Churakov A.V. // Сrystallogr. Rep. 2014. V. 59. № 3. Р. 300. doi 10 1134/S106377451140301711 [Сергиенко В.С., Чураков А.В. // Кристаллография. 2014. Т. 59. № 3. С. 341.]
Sergienko V.S., Churakov A.V. // Сrystallogr. Rep. 2013. V. 58. № 1. Р. 5. doi 10 1134/S1063774513010112 [Сергиенко В.С., Чураков А.В. // Кристаллография. 2013. Т. 58. № 1. С. 3.]
Steinborn M., Suhanji M., Klüfter P. // Dalton Trans. 2013. V. 42. P. 5749.
Bëlanger S., Beauchamp A.L. // Inorg. Chem. 1997. V. 36. P. 3640.
Redshaw C., Liu X., Zhan S. et al. // Eur. J. Inorg. Chem. 2008. P. 2698.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии