Журнал неорганической химии, 2019, T. 64, № 7, стр. 754-761
Система Tl–Bi–Er–Te в области составов Tl2Te–Tl9BiTe6–Tl9ErTe6
С. З. Имамалиева 1, 2, *, И. Ф. Мехдиева 1, 2, В. А. Гасымов 1, 2, М. Б. Бабанлы 1, 2
1 Филиал Московского государственного университета им.М.В. Ломоносова в г. Баку
AZ 1144 Баку, ул. Университетская, 1, пос. Ходжасан, Азербайджан
2 Институт катализа и неорганической химии НАН Азербайджана
AZ 1143 Баку, пр-т Г. Джавида, 113, Азербайджан
* E-mail: samira9597a@gmail.com
Поступила в редакцию 13.02.2019
После доработки 26.02.2019
Принята к публикации 15.03.2019
Аннотация
Методами физико-химического анализа исследованы фазовые равновесия в четверной системе Tl–Bi–Er–Те в области составов Tl2Te–Tl9BiTe6–Tl9ErTe6 (1). Уточнена фазовая диаграмма граничной системы Tl2Te–Tl9BiTe6. Показано, что она квазибинарная, перитектического типа и характеризуется образованием ограниченных твердых растворов на основе исходных соединений. Впервые построен ряд политермических сечений, изотермические сечения при 300, 760 и 780 K фазовой диаграммы, проекции поверхностей ликвидуса и солидуса системы (1). Показано, что в ней образуется широкая область твердых растворов со структурой Tl5Te3 (δ-фаза), занимающая свыше 90% площади концентрационного треугольника. Область гомогенности Tl2Te составляет 5–7 мол. %. Полученные результаты могут быть использованы для выбора составов раствор–расплавов и температурных режимов при выращивании кристаллов δ-фазы заданного состава, представляющих практический интерес как потенциальные термоэлектрические и магнитные материалы.
ВВЕДЕНИЕ
Сложные халькогениды тяжелых металлов, в том числе таллия, относятся к числу важных функциональных материалов. Многие из них обладают термоэлектрическими свойствами с аномально низкой теплопроводностью [1–3]. Кроме того, они представляют интерес как топологические изоляторы [4–6] и полуметаллы Вейля [7]. Некоторые из них обладают фотопроводимостью и перспективны для применения в качестве детекторов γ- и рентгеновского излучения [8–10].
Благодаря особенностям кристаллической структуры [11, 12] теллурид таллия Tl5Te3 является одним из наиболее подходящих матричных соединений для получения его новых катион- и анионзамещенных аналогов [13–22]. Тройные и более сложные структурные аналоги Tl5Te3 обладают рядом уникальных функциональных свойств, что делает их весьма перспективными для применения в различных областях современных высоких технологий [22–30].
Поиск и разработка физико-химических основ целенаправленного синтеза новых многокомпонентных халькогенидных фаз и материалов базируются на данных по фазовым равновесиям и термодинамическим свойствам соответствующих систем [31, 32]. При этом наибольший интерес представляют системы, в которых возможно образование структурных аналогов известных бинарных и тройных соединений или твердых растворов на их основе [33, 34].
Ранее с целью получения многокомпонентных твердых растворов со структурой Tl5Te3 – потенциальных термоэлектрических и магнитных материалов – нами были изучены фазовые равновесия в некоторых системах, содержащих Tl5Te3 и его РЗЭ-содержащие структурные аналоги [34–36].
В настоящей работе представлены результаты исследования фазовых равновесий в четверной системе Tl–Bi–Er–Te в области Tl2Te–Tl9BiTe6–Tl9ErTe6.
Соединения Tl2Te и Tl9BiTe6 плавятся конгруэнтно при 695 [37] и 830 K [14] соответственно, а Tl9ErTe6 – инконгруэнтно с разложением по перитектической реакции Tl9ErTe6 → ж + TlErTe2 при 705 K [38]. Соединение Tl2Te кристаллизуется в моноклинной сингонии (пр. гр. С2/С, a = 1.5662, b = 0.8987, с = 3.1196 нм, β = 100.76°, z = 44) [39], а параметры тетрагональных кристаллических решеток Tl9BiTe6 и Tl9ErTe6 равны: a = 0.88551, c = = 1.3048 нм, z = 2 [40] и a = 0.88501, c = 1.29524 нм, z = 2 [38] соответственно.
Граничная составляющая система Tl9BiTe6–Tl9ErTe6 [38] характеризуется образованием непрерывного ряда твердых растворов со структурой Tl5Te3.
Фазовая диаграмма системы Tl2Te–Tl9BiTe6 изучена в работах [14, 41]. Согласно [41], она характеризуется образованием непрерывного ряда твердых растворов со структурой Tl5Te3. Согласно данным [14], в системе наблюдается морфотропный фазовый переход вблизи Tl2Te. Принимая во внимание, что Tl2Te и Tl9BiTe6 обладают различными кристаллическими структурами, это утверждение представляется маловероятным. Поэтому мы уточнили характер фазовых превращений в системе Tl2Te–Tl9BiTe6.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Конгруэнтно плавящиеся соединения Tl2Te и Tl9BiTe6 синтезированы прямым взаимодействием элементарных компонентов высокой степени чистоты (не менее 99.999 ат. %). Все элементарные компоненты были приобретены у компании Alpha Aesar. Синтез проводили в вакуумированных (~10–2 Па) кварцевых ампулах при температуре 850 K с последующим медленным охлаждением в режиме выключенной печи.
Поскольку для предотвращения окисления на воздухе таллий хранился в воде, его высушивали непосредственно перед использованием. Принимая во внимание токсичность таллия и его соединений, во время работы с ним использовали защитные перчатки.
При синтезе Tl9ErTe6 учитывали, что Tl и Er образуют между собой термодинамически устойчивые соединения, что несколько затрудняет получение тройного соединения из элементов. Поэтому синтез соединения проводили сплавлением стехиометрических количеств Tl2Te, Er и Te. Учитывая инконгруэнтный характер плавления Tl9ErTe6 [38], после сплавления этой смеси полученный слиток Tl9ErTe6 перетирали в порошок, тщательно перемешивали, запрессовывали в таблетку и отжигали при 680 K в течение 800 ч. С целью предотвращения взаимодействия кварца с эрбием синтез соединения Tl9ErTe6 и сплавов исследуемой системы проводили в графитизированных ампулах.
Индивидуальность синтезированных соединений контролировали методами дифференциального термического (ДТА) и рентгенофазового анализа (РФА). На термограмме нагревания было обнаружено по одному эндотермическому эффекту для Tl2Te (695 K) и Tl9BiTe6 (830 K), а также два пика для Tl9ErTe6, которые соответствовали перитектической реакции (705 K) и концу кристаллизации (1120 K), что соответствует литературным данным [14, 37, 38].
Результаты РФА также подтвердили однофазность синтезированных соединений. Параметры кристаллических решеток, определенные по данным порошковых рентгенограмм с помощью программного обеспечения Topas V3.0, находились в хорошем соответствии с литературными данными [38–40].
Сплавлением синтезированных и идентифицированных исходных соединений в условиях вакуума при 900 K были получены сплавы системы Tl2Te–Tl9BiTe6–Tl9ErTe6 (каждый массой 1 г). После синтеза для ускорения достижения равновесного состояния литые негомогенизированные образцы перетирали в порошок в агатовой ступке, тщательно перемешивали, запрессовывали в таблетки и отжигали при температуре 650 K в течение 800 ч.
Исследования проводили методами ДТА и РФА, а также измерением микротвердости. Кривые нагревания снимали на дифференциальном сканирующем калориметре NETZSCH 404 F1 Pegasus system в интервале температур от комнатной до ~1300 K со скоростью нагревания 10 град/мин и точностью ±2°.
Кристаллическую структуру исходных соединений и промежуточных сплавов анализировали по порошковым рентгенограммам, снятым при комнатной температуре на дифрактометре Bruker D8 (CuKα-излучение) в интервале углов 2θ = 10°–70°. Точность определения параметров кристаллической решетки приведена в скобках (табл. 1).
Таблица 1.
Данные ДТА, измерений микротвердости и параметры кристаллической решетки сплавов системы Tl2Te–Tl9BiTe6–Tl9ErTe6
| Соединение | Параметры кристаллической решетки, нм | Тпл, K | Нμ, МПа | |
|---|---|---|---|---|
| Tl2Te | a = 1.5662, b = 0.8987, с = 3.1196, β = 100.76°, z = 44 | 695 | 1400 | |
| Tl9ErTe6 | 0.88501(3) | 1.2952(2) | 705; 1120 | 1070 |
| Tl9BiTe6 | 0.88551(3) | 1.3048(3) | 830 | 980 |
| 5.3Tl2Te–Tl9BiTe6 | ||||
| Tl9.5Bi0.05Te5.05 | – | – | 702 | 1420 |
| Tl9.9Bi0.1Te5.1 | – | – | 702–715 | 1450 |
| Tl9.85Bi0.15Te5.15 | – | – | 702–724 | – |
| Tl9.8Bi0.2Te5.2 | 0.89135(4) | 1.2692(3) | 708–737 | 1200; 1450 |
| Tl9.7Bi0.3Te5.3 | – | – | 720–749 | 1220 |
| Tl9.6Bi0.4Te5.4 | 0.89001(4) | 1.2780(2) | 732–767 | 1200 |
| Tl9.4Bi0.6Te5.6 | 0.88863(3) | 1.2870(2) | 763–790 | 1160 |
| Tl9.2Bi0.8Te5.8 | 0.88712(3) | 1.2.958(3) | 793–815 | 1080 |
| 5Tl2Te–Tl9ErTe6 | ||||
| Tl9.95Er0.05Te5.05 | – | – | 696 | 1420 |
| Tl9.9Er0.1Te5.1 | – | – | 698 | 1450 |
| Tl9.8Er0.2Te5.2 | – | – | 698–701 | 1230, 1460 |
| Tl9.7Er0.3Te5.3 | – | – | 698–703 | 1230, 1460 |
| Tl9.6Er0.4Te5.4 | 0.88985(4) | 1.2736(4) | 700–704 | 1200 |
| Tl9.4Er0.6Te5.6 | 0.88818(4) | 1.2817(5) | 702–705 | 1180 |
| Tl9.2Er0.8Te5.8 | 0.88661(3) | 1.2892(3) | 705; 1010 | 1150 |
| Tl9.1Er0.9Te5.9 | – | – | 705; 1085 | – |
Измерения микротвердости проводили на микротвердомере ПМТ-3 с нагрузкой 20 г. Точность определения микротвердости составляла ±20 МПа.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Совместная обработка экспериментальных данных, полученных методами ДТА и РФА, а также измерением микротвердости, позволила установить характер фазовых равновесий в системе Tl2Te–Tl9BiTe6–Tl9ErTe6.
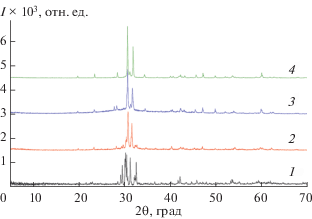
Система Tl2Te–Tl9BiTe6 (рис. 1). РФА показал наличие широких областей твердых растворов в системе Tl2Te–Tl9BiTe6. На дифрактограммах этой системы наблюдали три типа дифракционных картин. Так, дифратограммы образцов с составами до 5 мол. % Tl9BiTe6 содержали рефлексы только соединения Tl2Te (α-фаза), образцы с составами ≥20 мол. % Tl9BiTe6 имели дифракционную картину, идентичную таковой для Tl9BiTe6 (δ-фаза), а образцы состава 8–18 мол. % Tl9BiTe6 наряду с α-фазой содержали рефлексы δ-фазы, т.е. были двухфазные. На рис. 2 представлены порошковые рентгенограммы некоторых сплавов системы. В пределах области гомогенности δ-фазы зависимости параметров кристаллической решетки от состава являются линейными.
Рис. 1.
Фазовая диаграмма (а), зависимости микротвердости (б) и параметров кристаллической решетки (в) сплавов системы $\frac{{16}}{3}{\text{T}}{{{\text{l}}}_{2}}{\text{Te}}--{\text{T}}{{{\text{l}}}_{9}}{\text{BiT}}{{{\text{e}}}_{6}}.$
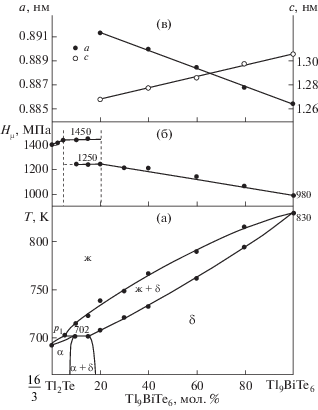
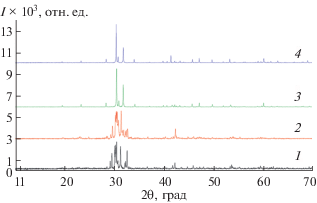
Рис. 2.
Порошковые рентгенограммы сплавов системы Tl2Te–Tl9BiTe6: 1 – Tl2Te, 2 – 10 мол. % Tl9BiTe6, 3 – 20 мол. % Tl9BiTe6, 4 – Tl9BiTe6.
Согласно фазовой диаграмме, данная система является квазибинарной и образует фазовую диаграмму перитектического типа. Координаты перитектической точки (р1) для равновесия ж + δ ↔ α составляют 5 мол. % Tl9BiTe6 и 702 K (α- и δ- твердые растворы на основе Tl2Te и Tl9BiTe6 соответственно). При перитектической температуре области гомогенности Tl2Te и Tl9BiTe6 составляют около 7 и 85 мол. %. При понижении температуры эти области несколько сужаются и, согласно данным измерений микротвердости и РФА, составляют 5 и 80 мол. % соответственно при 300 K (рис. 1в).
Характер зависимости микротвердости от состава находится в соответствии с фазовой диаграммой (рис. 1б). Значения микротвердости исходных соединений несколько повышаются в пределах областей гомогенности α- и δ-фаз, а в двухфазной области α + δ остаются постоянными (рис. 1в).
Система Tl2Te–Tl9ErTe6 (рис. 3) неквазибинарная в силу перитектического характера плавления Tl9ErTe6 и характеризуется широкой областью твердых растворов (δ) со структурой Tl5Te3. Ликвидус состоит из трех кривых, отвечающих первичной кристаллизации α- и δ-фаз на основе Tl2Te и Tl9ErTe6 соответственно, а также TlErTe2. Горизонтали при 705 и 698 K отвечают перитектическим равновесиям ж +δ ↔ α и ж + TlErTe2 ↔ δ. Точки перитектики р2 и р3 имеют составы 8 и 70 мол. % Tl9ErTe6 соответственно.
Рис. 3.
Фазовая диаграмма (а), зависимости микротвердости (б) и параметров кристаллической решетки (в) сплавов системы $\frac{{16}}{3}{\text{T}}{{{\text{l}}}_{2}}{\text{Te}}--{\text{T}}{{{\text{l}}}_{9}}{\text{ErT}}{{{\text{e}}}_{6}}.$
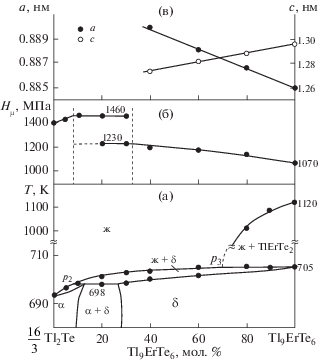
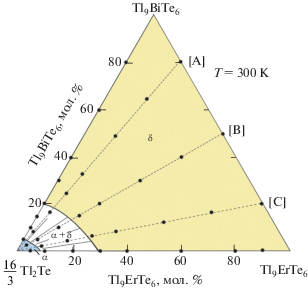
Диаграмма твердофазных равновесий при 300 K (рис. 4) наглядно демонстрирует расположение фазовых областей в системе Tl2Te–Tl9BiTe6–Tl9ErTe6 при этой температуре. Система состоит из двух однофазных полей (α- и δ-фазы), ограниченных двухфазным полем α + δ. На рис. 4 представлены составы изученных сплавов.
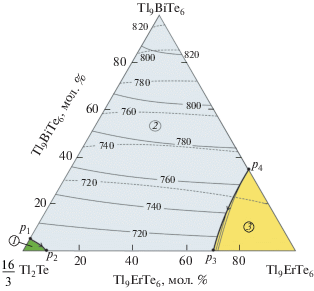
Проекции поверхностей ликвидуса и солидуса системы Tl2Te–Tl9BiTe6–Tl9ErTe6 приведены на рис. 5. Ликвидус состоит из трех полей первичной кристаллизации α-, δ-фаз и соединения TlErTe2. Кривые p1p2 и p3p4, разграничивающие эти поля, отвечают моновариантным перитектическим равновесиям ж + δ ↔ α и ж + TlErTe2 ↔ δ. Вблизи точки эвтектики (е) равновесие ж + δ ↔ α должно трансформироваться в эвтектическое ж ↔ α + δ. Поверхность солидуса состоит из двух поверхностей, соответствующих завершению кристаллизации α- и δ-фаз.
Рис. 5.
Поверхности ликвидуса и солидуса (пунктирные линии) системы Tl2Te–Tl9BiTe6–Tl9ErTe6. Поля первичной кристаллизации: 1 – α-фаза, 2 – δ-фаза, 3 – TlErTe2.
Результаты исследований внутренних политермических сечений Tl2Te–[A], Tl2Te–[В] и Tl2Te–[С] фазовой диаграммы системы Tl2Te–Tl9BiTe6–Tl9ErTe6 (А, В, С – составы 20, 50, 80 мол. % Tl9ErTe6 системы Tl9BiTe6–Tl9ErTe6) представлены на рис. 6. Для подтверждения правильного построения политермических разрезов на рис. 7 приведены порошковые рентгенограммы некоторых сплавов по разрезу Tl2Te–[В].
Рис. 6.
Политермические разрезы Tl2Te–[A] (а), Tl2Te–[В] (б) и Tl2Te–[С] (в) фазовой диаграммы системы Tl2Te–Tl9BiTe6–Tl9ErTe6 (А, В, С– составы 20, 50, 80 мол. % Tl9ErTe6 системы Tl9BiTe6–Tl9ErTe6). Обозначение Δ на рис. 6в – термический эффект на кривой охлаждения.
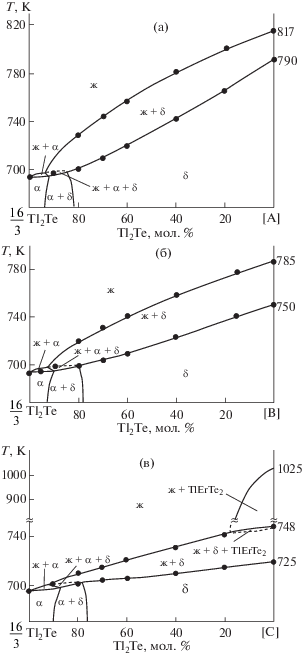
Рис. 7.
Порошковые рентгенограммы сплавов политермического разреза Tl2Te– [B] (Tl9Bi0.5Er0.5Te6): 1 – Tl2Te, 2 – 80 мол. % Tl2Te, 3 – 70 мол. % Tl2Te, 4 – Tl9Bi0.5Er0.5Te6.
Характер фазовых равновесий по разрезам Tl2Te–[A] и Tl2Te–[В] (рис. 6а, 6б) качественно аналогичен. Кривые ликвидуса состоят из двух ветвей, отвечающих первичной кристаллизации α- и δ-фаз. Их точки пересечения соответствуют началу моновариантной перитектической реакции ж + δ ↔ α. По разрезу Tl2Te–[С] ликвидус состоит из трех кривых первичной кристаллизации α- и δ-фаз, а также TlErTe2 (рис. 6в). Термические эффекты, отвечающие первичной кристаллизации TlErTe2 по данному разрезу, не были обнаружены на кривых нагревания, хотя, согласно рис. 5, разрез должен пересекать поверхность ликвидуса TlErTe2. На кривой охлаждения сплава состава 10 мол. % Tl2Te фиксируется слабый экзотермический эффект при 945 K, который мы отнесли к первичной кристаллизации TlErTe2. Ниже солидуса вышеуказанные политермические разрезы проходят через фазовые поля α, α + δ и δ.
Наличие моновариантной перитектической реакции ж + δ ↔ α (рис. 5, кривая р1р2) в системе Tl2Te–Tl9BiTe6–Tl9ErTe6 должно привести к образованию трехфазной области ж + α + δ на всех рассмотренных выше политермических сечениях (рис. 6). Очень узкий температурный интервал (698–702 K) протекания этой реакции не позволяет зафиксировать данную область методом ДТА. Учитывая известные положения [42] построения политермических сечений, эти узкие области, а также область ж + TlErTe2 + δ на разрезе Tl2Te–[С] разграничили пунктиром.
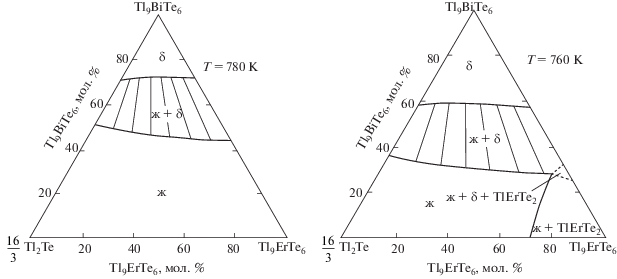
Изотермические сечения при 780 и 760 K фазовой диаграммы представлены на рис. 8. Первое сечение состоит из сопряженных кривых ликвидуса и солидуса, разграничивающих однофазные области L и δ. Эти кривые находятся в коннодной связи и образуют двухфазное поле ж + δ. Изотермическое сечение при 760 K помимо этих фазовых областей отражает также гетерогенные области ж + TlErTe2 и ж + TlErTe2 + δ, которые разграничены с учетом данных по граничной системе Tl9BiTe6–Tl9ErTe6 [38].
Сопоставление изотермических (рис. 8) и политермических (рис. 6) сечений фазовой диаграммы Tl2Te–Tl9BiTe6–Tl9ErTe6 наглядно показывает, что направления коннодных линий не совпадают с плоскостями Т–х изученных внутренних разрезов, что характерно для неквазибинарных политермических разрезов.
ЗАКЛЮЧЕНИЕ
Впервые получена полная картина фазовых равновесий в области составов Tl2Te–Tl9BiTe6–Tl9ErTe6 системы Tl–Bi–Er–Te в координатах Т–х–у. Построены фазовые диаграммы боковых систем Tl2Te–Tl9BiTe6 и Tl2Te–Tl9ErTe6, диаграмма твердофазных равновесий при 300 K, проекции поверхностей ликвидуса и солидуса, а также некоторые политермические и изотермические (760 и 780 K) сечения фазовой диаграммы указанной подсистемы. Показано, что более 90% площади концентрационного треугольника данной системы занимает область гомогенности твердых растворов со структурой Tl5Te3 (δ-фаза) – потенциальных термоэлектрических и магнитных материалов.
Список литературы
Шевельков А.В. // Успехи химии. 2008. Т. 77. № 1. С. 31. https://doi.org/10.1070/RC2008v077n01ABEH003746
Kurosaki K., Yamanaka S. // Phys. Status Solidi A. 2013. V. 210. № 1. P. 82. https://doi.org/10.1002/pssa.201228680
Shi Y., Assoud A., Ponou S. et al. // J. Am. Chem. Soc. 2018. V. 140. № 27. P. 8578. https://doi.org/10.1021/jacs.8b04639
Eremeev S.V., Koroteev Y.M., Chulkov E.V. // JETP Lett. 2010. V. 91. P. 594. https://doi.org/10.1134/S0021364010110111
Breunig O., Wang Z., Taskin A.A. et al. // Nat. Commun. 2017. V. 8. P. 15545. https://doi.org/10.1038/ncomms15545
Singh B., Lin H., Prasad R. et al. // Phys. Rev. B. 2016. V. 93. P. 085113. https://doi.org/10.1103/PhysRevB.93.085113
Ruan J., Jian S.K., Zhang D. et al. // Phys. Rev. Lett. 2016. V. 115. P. 226801. https://doi.org/10.1103/PhysRevLett.116.226801
Lin W., Chen H., He J. et al. // ACS Photonics. 2017. V. 4. № 11. P. 2891. https://doi.org/10.1021/acsphotonics.7b00891
Lin W., Kontsevoi O.Y., Liu Z. et al. // Cryst. Growth Des. 2018. V. 18. № 6. P. 3484. https://doi.org/10.1021/acs.cgd.8b00242
Guler I., Gasanly N. // Optik. 2018. V. 157. P. 895. https://doi.org/10.1016/j.ijleo.2017.11.120
Schewe I., Böttcher P., Schnering H.G. // Z. Kristallogr. 1989. Bd. 188. P. 287. https://doi.org/10.1524/zkri.1989.188.14.287
Bhan S., Shubert K. // J. Less. Common. Met. 1970. B. 20. № 3. P. 229.
Babanly M.B., Akhmadyar A., Kuliev A.A. // Russ. J. Inorg. Chem. 1985. V. 30 P. 1051. [Бабанлы М.Б., Ахмадьяр А., Кулиев А.А. // Журн. неорган. химии. 1985. Т. 30. № 4. С. 1051.]
Babanly M.B., Akhmadyar A., Kuliev A.A. // Russ. J. Inorg. Chem. 1985. V. 30. № 9. P. 2356. [Бабанлы М.Б., Ахмадьяр А., Кулиев А.А. // Журн. неорган. химии. 1985. Т. 30. № 9. С. 2356.]
Имамалиева С.З., Садыгов Ф.М., Бабанлы М.Б. // Неорган. материалы. 2008. Т. 44. № 9. С. 1054. https://doi.org/10.1134/S0020168508090070
Babanly D.M., Amiraslanov I.R., Shevelkov A.V. et al. // J. Alloys. Compd. 2015. V. 644. P. 106.
Bradtmöller S., Böttcher P. // Z. Kristallogr. 1994. V. 209. № 1. P. 97. https://doi.org/10.1524/zkri.1994.209.1.97
Bradtmöller S., Böttcher P. // Z. Kristallogr. 1994. V. 209. № 1. P. 75. https://doi.org/10.1524/zkri.1994.209.1.75
Bradtmöller S., Böttcher P. // Z. Anorg. Allg. Chem. 1993. V. 619. P. 1155. https://doi.org/10.1002/zaac.19936190702
Blachnik R., Dreibach H.A. // J. Solid State Chem. 1984. V. 52. P. 53. https://doi.org/10.1016/0022-4596(84)90197-X
Babanly D.M., Chiragov M.I., Babanly M.B. // Chem. Problems. 2005. № 2. P. 149.
Piasecki M., Brik M.G., Barchiy I.E. et al. // J. Alloys Compd. 2017. V. 710. P. 600. https://doi.org/10.1016/j.jallcom.2017.03.280
Heinke F., Eisenburger L., Schlegel R. et al. // Z. Anorg. Allg. Chem. 2017. V. 643. P. 447. https://doi.org/10.1002/zaac.201600449
Arpino K.E., Wasser B.D., McQueen T.M. // APL Mattr. 2015. V. 3. № 4. P. 041507. https://doi.org/10.1063/1.4913392
Bangarigadu-Sanasy S., Sankar C.R., Schlender P. et al. // J. Alloys Compd. 2013. V. 549. P. 126. https://doi.org/10.1016/j.jallcom.2012.09.023
Bangarigadu-Sanasy S., Sankar C.R., Dube P.A. et al. // J. Alloys. Compd. 2014. V. 589. P. 389. https://doi.org/10.1016/j.jallcom.2013.11.229
Guo Q., Kleinke H. // J. Alloys Compd. 2015. V. 630. P. 37. https://doi.org/10.1016/j.jallcom.2015.01.025
Shah W. H., Khan A., Waqas M. et al. // Chalcogenide Lett. 2017. V. 14. № 2. P. 61.
Shah W.H., Khan A., Tajudin S. et al. // Chalcogenide Lett. 2018. V. 14. P. 187.
Khan W.M., Shah W.H., Khan S. et al. // Int. J. Heat Techn. 2018. V. 36. P. 602. https://doi.org/10.18280/ijht.360224
Tomashyk V.N. Multinary Alloys Based on III–V Semiconductors. RC Press, 2016.
Zlomanov V.P. // Russ. J. Inorg. Chem. 2010. V. 55. № 11. P. 1740. https://doi.org/10.1134/S0036023610110112
Babanly M.B., Chulkov E.V., Aliev Z.S. et al. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1703. https://doi.org/10.1134/S0036023617130034
Imamaliyeva S.Z., Babanly D.M., Tagiev D.B., Babanly M.B. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1703. https://doi.org/10.1134/S0036023618130041
Imamaliyeva S.Z., Gasanly T.M., Sadygov F.M. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. P. 262. [Имамалиева С.З., Гасанлы Т.М., Садыгов Ф.М. и др. // Журн. неорган. химии. 2018. Т. 63. № 2. С. 251.]https://doi.org/10.1134/S0036023618020079
Имамалиева С.З., Гасанлы Т.М., Зломанов В.П. и др. // Неорган. материалы. 2017. Т. 53. № 4. С. 354. https://doi.org/10.1134/S0020168517040069
Асадов М.М., Бабанлы М.Б., Кулиев А.А. // Неорган. материалы. 1977. Т. 13. № 8. С. 1407.
Mekhdiyeva I.F., Babanly K.N., Mahmudova M.A. et al. // Azerb. Chem. J. 2018. № 2. P. 80.
Cerny R., Joubert J., Filinchuk Y., Feutelais Y. // Acta Crystallogr. C. 2002. V. 58. № 5. P. 163. https://doi.org/10.1107/S0108270102005085
Doert T., Böttcher P. // Z. Kristallogr. 1994. V. 209. P. 95. https://doi.org/10.1524/zkri.1994.209.1.95
Gawel W., Zaleska E., Terpilowski J. // J. Therm. Anal. 1989. V. 35. P. 59. https://doi.org/10.1007/BF01914264
Афиногенов Ю.П., Гончаров Е.Г., Семенова Г.В. и др. Физико-химический анализ многокомпонентных систем. М., 2006. 332 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии