Журнал неорганической химии, 2019, T. 64, № 8, стр. 894-898
Экстракция редкоземельных металлов бинарным экстрагентом на основе N,N-диоктиламида дигликолевой кислоты и триоктиламина
В. В. Белова 1, *, М. М. Мартынова 1, В. Е. Баулин 2, 3, Д. В. Баулин 2
1 Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
2 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, корп. 4, Россия
3 Институт физиологически активных веществ РАН
142432 Черноголовка, Московской обл., Северный пр-д, 1, Россия
* E-mail: belova@igic.ras.ru
Поступила в редакцию 07.12.2018
После доработки 10.02.2019
Принята к публикации 15.02.2019
Аннотация
Исследована экстракция хлорида и нитрата лантана из нейтральных хлоридных и нитратных растворов бинарным экстрагентом (R3NHA) на основе эквимолярной смеси N,N-диоктиламида дигликолевой кислоты и три-н-октиламина. Показано, что экстракция хлорида лантана экстрагентом R3NHA протекает в соответствии с механизмом бинарной экстракции солей с образованием в органической фазе экстрагируемого соединения LaA3. При экстракции нитрата лантана в органической фазе образуются комплексы другого состава с отношением концентрации металла в органической фазе к исходной концентрации бинарного экстрагента, равным 1 : 1. Показано, что экстрагируемость РЗМ в системе с изученным бинарным экстрагентом увеличивается с ростом атомного номера металла.
ВВЕДЕНИЕ
Редкоземельные металлы (РЗМ) широко используются не только в традиционных отраслях промышленности, но и в современном производстве, так как они обладают люминесцентными, электронными, магнитными и другими полезными свойствами. В большинстве случаев необходима высокая степень чистоты используемых РЗМ, однако из-за близости их химических и физических свойств разделение этих металлов затруднено. Среди известных способов разделения одним из наиболее эффективных методов извлечения, разделения и очистки РЗМ является экстракция [1], а наиболее известными коммерческими экстрагентами являются фосфорорганические реагенты, например ди-2-этилгексилфосфорная и 2-этилгексил-2-этилгексилфосфониевая кислоты [2]. Однако фосфорорганические экстрагенты – это токсичные соединения, загрязняющие окружающую среду, так как при их утилизации образуются фосфорсодержащие отходы. Экстрагенты на основе производных карбоновых кислот, состоящие только из атомов C, H, O и N, не содержат фосфора и с точки зрения экологии являются перспективными экстрагентами для создания новых технологических процессов извлечения РЗМ. В работах [3–5] изучена экстракция ряда РЗМ из нитратных и хлоридных растворов N,N-диоктиламидом дигликолевой кислоты (HDGA).
Показано, что с увеличением рН водной фазы наблюдается повышение коэффициентов распределения РЗМ в соответствии с катионообменным механизмом экстракции. В отличие от известных экстрагентов – производных карбоновых кислот, содержащих только атомы С, Н и О (например, Versatic 10), которые экстрагируют лантаноиды из нейтральных сред [6], практически количественное извлечение РЗМ в системе с HDGA наблюдается из слабокислых растворов (1 ≤ pH ≤ 3), т.е. эффективность экстракции экстрагентом HDGA сопоставима с экстракцией фосфорорганическими кислотами. Определена стехиометрия экстракции в системах с HDGA (НА) и показано, что РЗМ из нитратных растворов извлекаются с образованием комплексов состава LnA3 [3, 4], а из хлоридных сред, например в случае эрбия, возможно также образование экстрагируемых соединений состава LnA2Cl [5].
Наряду с традиционными экстрагентами для извлечения и разделения РЗМ применяются бинарные экстрагенты, которые можно классифицировать как ионные жидкости (ИЖ) – органические соли, находящиеся в жидком состоянии при комнатной температуре [7–17]. В литературе описаны экстракционные системы с использованием ИЖ на основе N,N-диоктиламида дигликолевой кислоты и четвертичных аммониевых оснований [18–20]. В работах [18, 19] показано, что межфазное распределение нитратов лантаноидов в системах с ИЖ – солью HDGA и триоктилметиламмония (R4NA) отличается от экстракции этих металлов смесью исходных экстрагентов. Согласно [19], экстракция нитрата европия растворами R4NA в додекане протекает с образованием сольватов Eu(NO3)3 · (R4NА)3. Экстрагируемый комплекс аналогичного состава образуется при экстракции неодима из нитратных растворов растворами R4NA в додекане [19]. Однако при использовании в качестве растворителя ионной жидкости нитрата триоктилметиламмония и в присутствии высаливателя NaNO3 меняется стехиометрия экстракции и неодим извлекается в органическую фазу в виде соединений Nd(NO3)3 · ⋅ R4NA [18]. При увеличении концентрации NaNO3 повышаются коэффициенты распределения лантаноидов, и при очень высоких концентрациях нитрат-ионов экстракция металлов ионной жидкостью протекает по анионообменному и координационному механизмам [18, 19].
Отмечается, что ИЖ на основе HDGA имеют более высокую экстракционную способность по сравнению со смесью исходных экстрагентов при одинаковых равновесных значениях рН [18]. Представляло интерес исследовать экстракцию солей лантаноидов из нитратных и хлоридных растворов новым бинарным экстрагентом на основе HDGA и три-н-октиламина (ТОА).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные растворы нитрата и хлорида лантана готовили растворением навесок солей La(NO3)3 · ⋅ 6H2O (х. ч.) и LaCl3 · 7H2O (х. ч.) в дистиллированной воде. Исходные растворы нитратов Nd, Eu и Er готовили растворением навесок оксидов этих металлов квалификации “х. ч.” в концентрированной HNO3 с последующим многократным упариванием растворов с водой на водяной бане для удаления избытка кислоты. Экстрагент N,N-диоктиламид дигликолевой кислоты был синтезирован по методике [3]. Бинарный экстрагент ТОА-HDGA готовили растворением эквимолярных количеств три-н-октиламина (Fluka) и N,N-диоктиламида дигликолевой кислоты в толуоле.
Перемешивание фаз осуществляли при 20°С в пробирках с пришлифованными пробками в течение 15 мин, этого времени было достаточно для установления постоянных значений коэффициентов распределения лантаноидов.
Концентрацию лантаноидов в исходных растворах и водных фазах после экстракции определяли трилонометрическим титрованием с индикатором ксиленоловым оранжевым. Концентрацию лантаноидов в органических фазах определяли по разности между концентрациями в исходном растворе и в водной фазе после экстракции.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Экстракцию РЗМ бинарным экстрагентом на основе ТОА и HDGA (R3NHA) исследовали на примере солей лантана. Для установления стехиометрии межфазного распределения были изучены изотермы экстракции хлорида лантана из 0.5 М растворов NaCl, а также нитрата лантана из водных растворов без добавления высаливателя и из 0.5 М растворов NaNO3 в системе с 0.01 моль/л раствором R3NHA в толуоле (рис. 1). Из данных, представленных на рис. 1 (кривая 1), видно, что при экстракции LaCl3 из хлоридных растворов в условиях насыщения органической фазы отношение экстрагента к металлу близко к 3, что свидетельствует об образовании экстрагируемой соли LaA3 (А– – анион HDGA). Можно предположить, что распределение хлорида лантана в системе с R3NHA в общем виде без учета возможных взаимодействий компонентов в органической фазе описывается уравнением бинарной экстракции солей:
(1)
$\begin{gathered} {\text{La}}_{{\left( {\text{в }} \right)}}^{{3 + }} + 3{\text{Cl}}_{{\left( {\text{в }} \right)}}^{--} + 3{{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{{\text{(o)}}}}} \Leftrightarrow {\text{La}}{{{\text{A}}}_{{{\text{3(o)}}}}} + \\ + \,\,3{{{\text{R}}}_{3}}{\text{NHC}}{{{\text{l}}}_{{{\text{(o)}}}}}. \\ \end{gathered} $Рис. 1.
Изотермы экстракции хлорида лантана из 0.5 М раствора NaCl (1) и нитрата лантана из водных растворов в отсутствие NaNO3 (2) и в присутствии 0.5 М NaNO3 (3) 0.01 М раствором R3NHA в толуоле.
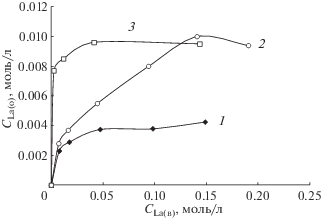
Изотерма экстракции La(NO3)3 из водных растворов в отсутствие высаливателя (рис. 1, кривая 2) имеет плато при отношении концентрации металла в органической фазе к исходной концентрации бинарного экстрагента, равном 1 : 1. Можно предположить, что в органической фазе в системе с R3NHA образуются соединения, в состав которых входят металлсодержащие анионы со смешанными лигандами, как это наблюдалось, например, при экстракции нитратов лантаноидов диалкилфосфинатом метилтриоктиламмония [15]. Образование соединений такого состава можно объяснить более сильными комплексообразующими свойствами нитрат-ионов по сравнению с хлорид-ионами, а также меньшим значением энергии гидратации ${\text{NO}}_{3}^{--}$ в водной фазе. Процесс экстракции нитрата лантана бинарным экстрагентом в этом случае описывается уравнением с образованием двух экстрагируемых соединений:
(2)
$\begin{gathered} {\text{La}}_{{{\text{(в )}}}}^{{3 + }} + 3{\text{NO}}_{{3{\text{(в )}}}}^{--} + {{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{{\text{(o)}}}}} \Leftrightarrow \\ \Leftrightarrow {\text{La}}{{\left( {{\text{N}}{{{\text{O}}}_{3}}} \right)}_{2}}{{{\text{A}}}_{{{\text{(o)}}}}} + {{{\text{R}}}_{3}}{\text{NHN}}{{{\text{O}}}_{{{\text{3(o)}}}}}. \\ \end{gathered} $Известно, что при экстракции лантаноидов из нитратных растворов нитратами триоктиламмония образуются экстрагируемые соединения с металлсодержащими анионами [21], поэтому можно предположить также процесс экстракции с образованием одного экстрагируемого соединения:
(3)
$\begin{gathered} {\text{La}}_{{{\text{(в )}}}}^{{3 + }} + 3{\text{NO}}_{{3{\text{(в )}}}}^{--} + {{{\text{R}}}_{3}}{\text{NH}}{{{\text{A}}}_{{{\text{(o)}}}}} \Leftrightarrow \\ \Leftrightarrow \left( {{{{\text{R}}}_{{\text{3}}}}{\text{NH}}} \right){{\left[ {{\text{La}}{{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}}_{{\text{3}}}}{\text{A}}} \right]}_{{{\text{(o)}}}}}. \\ \end{gathered} $Параллельно с процессом бинарной экстракции при высоких концентрациях нитрат-иона в водной фазе могут извлекаться сольваты в соответствии с уравнением:
(4)
$\begin{gathered} {\text{La}}_{{{\text{(в )}}}}^{{{\text{3 + }}}} + {\text{3NO}}_{{{\text{3(в )}}}}^{{\text{--}}} + {\text{ }}{{{\text{R}}}_{{\text{3}}}}{\text{NH}}{{{\text{A}}}_{{{\text{(o)}}}}} \Leftrightarrow \\ \Leftrightarrow {\text{La}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}} \cdot {{{\text{R}}}_{{\text{3}}}}{\text{NH}}{{{\text{A}}}_{{{\text{(o)}}}}}{\text{.}} \\ \end{gathered} $При избытке экстрагента экстрагируемые соединения могут сольватироваться молекулами бинарного экстрагента или нитрата триоктиламмония.
Экстракция нитрата лантана из нитратных растворов (рис. 1, кривая 3) протекает более эффективно, чем из водных растворов в отсутствие высаливателя, и тем более в сравнении с хлоридом лантана. В условиях насыщения отношение исходной концентрации экстрагента к концентрации лантана в органической фазе равно 1, как и при экстракции из растворов без добавления высаливателя.
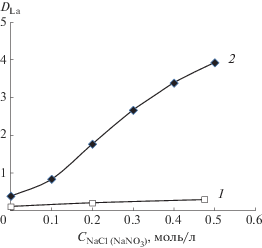
Изучено влияние концентрации NaCl и N-aNO3 на экстракцию хлорида и нитрата лантана соответственно (рис. 2). Из данных, представленных на рис. 2 (кривая 1), следует, что -увеличение концентрации NaCl сопровождается незначительным увеличением коэффициентов распределения хлорида лантана в соответствии с уравнением (1). Увеличение концентрации N-aNO3 приводит к существенному повышению извлечения нитрата лантана (рис. 2, кривая 2), что также подтверждает соэкстракцию нитрат-ионов с лантаном и присутствие их в экстрагируемом комплексе в соответствии с уравнениями (2)–(4).
Рис. 2.
Зависимость экстракции хлорида лантана от концентрации NaCl (1) и нитрата лантана от концентрации NaNO3 (2) 0.01 М раствором R3NHA в толуоле; CLa(исх) = 0.01 моль/л.
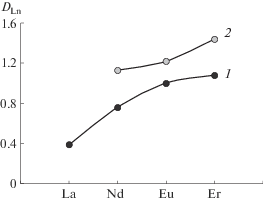
Проведено сравнение экстракции нитратов РЗМ из водных растворов в отсутствие NaNO3 и в присутствии 0.5 М NaNO3 в системе с 0.01 М раствором R3NHA в толуоле (рис. 3). Из полученных результатов видно, что экстрагируемость РЗМ увеличивается с ростом атомного номера металла, это характерно также для систем с бинарными экстрагентами на основе диалкилфосфорных [11, 12] и диалкилфосфиновых кислот [13, 14].
Рис. 3.
Коэффициенты распределения нитратов РЗМ из водных растворов в отсутствие NaNO3 (1) и в присутствии 0.5 М NaNO3 (2) при экстракции 0.01 М раствором R3NHA в толуоле; CLn(исх) = 0.01 моль/л.
Проведенные исследования показали высокую емкость бинарного экстрагента ТОА-HDGA по отношению к нитратам лантаноидов, что может иметь практическое значение. Кроме того, в системах с данным бинарным экстрагентом в условиях проведенных экспериментов не наблюдалось образования осадков (CLn(о) ≤ 0.01 моль/л), тогда как при экстракции бинарными экстрагентами на основе диалкилфосфорных кислот растворимость экстрагируемых соединений не превышает 0.006 моль/л [11, 12]. Полученные результаты показывают перспективность экстракционных систем на основе ТОА-HDGA для использования, например, в процессах жидкостной хроматографии и в комбинированных экстракционно-хроматографических процессах разделения [22–25]. Бинарный экстрагент на основе ТОА и HDGA может найти применение также в процессах экстракции с использованием принципа жидких мембран [26–30]. Это обусловлено тем, что перечисленные процессы не требуют использования больших количеств экстрагентов.
Список литературы
Xie F., Zhang T.A., Dreisinger D. et al. // Miner Eng. 2014. V. 56. P. 10. https://doi.org/10.1016/j.mineng.2013.10.021
Wang X.L., Li W., Meng S.L. et al. // J. Chem. Technol. Bio. 2006. V. 81. P. 761. https://doi.org/10.1002/jctb.1532
Shimojo K., Naganawa H., Noro J. et al. // Anal. Sci. 2007. V. 23. P. 1427. https://doi.org/10.2116/analsci.23.1427
Shimojo K., Aoyagi N., Saito T. et al. // Anal. Sci. 2014. V. 30. № 2. P. 263. https://doi.org/10.2116/analsci.30.263
Safarbali R., Yaftian M.R., Zamani A. // J. Rare Earths. 2016. V. 34. № 1. P. 91. https://doi.org/10.1016/S1002-0721(14)60583-4
Kubota F., Shinohara K., Shimojo K. et al. // Sep. Purif. Technol. 2001. V. 24. P. 93. https://doi.org/10.1016/S1383-5866(00)00215-X
Sun X., Ji Y., Hu F. et al. // Talanta. 2010. V. 81. P. 1877. https://doi.org/10.1016/j.talanta.2010.03.041
Yang H.L., Wang W., Cui H.M. et al. // Chin. J. Anal. Chem. 2011. V. 39. P. 1561. https://doi.org/10.1016/S1872-2040(10)60475-6
Guo L., Chen J., Shen L. et al. // ACS Sustainable Chem. Eng. 2014. V. 2. № 8. P. 1968. https://doi.org/10.1021/sc400541b
Kubota F., Baba Y., Goto M. // Solvent Extr. Res. Dev. Jpn. 2012. V. 19. P. 17. https://doi.org/10.15261/serdj.19.17
Калякин С.Н., Кузьмин В.И., Мулагалеева М.А. // Цветные металлы. 2011. № 3. С. 51.
Kalyakin S.N., Kuzmin V.I., Mulagaleeva M.A. // Hydrometallurgy. 2015. V. 151. P. 116. https://doi.org/10.1016/j.hydromet.2014.11.013
Egorova N.S., Belova V.V., Voshkin A.A. et al. // Russ. J. Inorg. Chem. 2015. V. 50. № 11. P. 1781. [Егорова Н.С., Белова В.В., Вошкин А.А. и др. // Журн. неорган. химии. 2005. Т. 50. № 11. С. 1902.]
Belova V.V., Voshkin A.A., Kholkin A.I., Payrtman A.K. // Hydrometallurgy. 2009. V. 97. P. 198. https://doi.org/10.1016/j.hydromet.2009.03.004
Belova V.V., Voshkin A.A., Egorova N.S., Kholkin A.I. // Russ. J. Inorg. Chem. 2010. V. 55. № 4. P. 629. [Белова В.В., Вошкин А.А., Егорова Н.С., Холькин А.И. // Журн. неорган. химии. 2010. Т. 55. № 4. С. 679.]https://doi.org/10.1134/S0036023610040224
Заходяева Ю.А., Белова В.В., Егорова Н.С., Холькин А.И. // Хим. технология. 2015. Т. 16. № 1. С. 23.
Belova V.V., Zakhodyaeva Yu.A., Kholkin A.I. // Russ. J. Inorg. Chem. 2015. V. 60. № 4. P. 526. https://doi.org/10.1134/S0036023615040026
Rout A., Binnemans K. // Ind. Eng. Chem. Res. 2014. V. 53. P. 6500. https://doi.org/10.1021/ie404340p
Rout A., Venkatesan K.A., Srinivasan T.G., Vasudeva Rao P.R. // Sep. Purif. Technol. 2012. V. 95. P. 26. https://doi.org/10.1016/j.seppur.2012.04.020
Qiu L., Pan Y., Zhang W., Gong A. // PLOS ONE. 2018. V. 13. P. 1. https://doi.org/10.1371/journal.pone.0201405
Sahoo A., Swain J., Bhatta B.C. // OSR J. Appl. Chem. 2017. V. 10. № 10. P. 52. https://doi.org/10.9790/5736-1010015258
Kostanyan A., Martynova M., Erastov A., Belova V. // J. Chromatogr. A. 2018. V. 1560. P. 26. https://doi.org/10.1016/j.chroma.2018.05.032
Kostanyan A., Erastov A. // J. Chromatogr. A. 2018. V. 1572. P. 212. https://doi.org/10.1016/j.chroma.2018.08.039
Kostanyan A.E., Erastov A.A. // J. Chromatogr. A. 2015. V. 1406. P. 118. https://doi.org/10.1016/j.chroma.2015.05.074
Kostanyan A.E., Erastov A.A., Shishilov O.N. // J. Chromatogr. A. 2014. V. 1347. P. 87. https://doi.org/10.1016/j.chroma.2014.04.064
Belova V.V., Kostanyan A.E., Zakhodyaeva Y.A. et al. // Hydrometallurgy. 2014. V. 150. P. 144. https://doi.org/10.1016/j.hydromet.2014.10.011
Kostanyan A.E. // Russ. J. Inorg. Chem. 2018. V. 63. № 2. P. 287. [Костанян А.Е. // Журн. неорган. химии. 2017. Т. 62. № 12. С. 1666. https://doi.org/10.7868/ S0044457X17120170]https://doi.org/10.1134/S0036023618020122
Kostanyan A.E., Safiulina A.M., Tananaev I.G., Myasoedov B.F. // Dokl. Chem. 2005. V. 404. № 4–6. P. 203. [Костанян А.Е., Сафиулина А.М., Тананаев И.Г., Мясоедов Б.Ф. // Докл. АН. 2005. Т. 404. № 6. С. 778.]
Костанян А.Е., Сафиулина А.М., Тананаев И.Г. // Хим. технология. 2006. Т. 7. № 8. С. 35.
Костанян А.Е. // Хим. технология. 2012. Т. 13. № 6. С. 376.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии