Журнал неорганической химии, 2019, T. 64, № 8, стр. 881-888
Исследование трехкомпонентной взаимной системы Na,Ba||Br,MoO4
Е. Г. Данилушкина 1, *, И. К. Гаркушин 1, Д. С. Рыжкова 1
1 Самарский государственный технический университет
443100 Самара, ул. Молодогвардейская, 244, Россия
* E-mail: e_danilu@mail.ru
Поступила в редакцию 24.12.2018
После доработки 08.02.2019
Принята к публикации 15.02.2019
Аннотация
Проведено теоретическое разбиение трехкомпонентной взаимной системы Na,Ba||Br,MoO4 на симплексы, определена стабильная диагональ системы и рассчитан тепловой эффект реакции в точке конверсии. Описано химическое взаимодействие в системе и фазовые равновесия, разграничены поля кристаллизации фаз. Для подтверждения теоретического разбиения проведено экспериментальное исследование стабильной диагонали и двух стабильных элементов трехкомпонентной взаимной системы Na,Ba||Br,MoO4 методом дифференциального термического анализа. Установлено, что система Na,Ba||Br,MoO4 относится к сингулярной необратимо-взаимной с эвтектическим типом плавления. Система разбивается стабильной секущей диагональю NaBr–BaMoO4 на два стабильных фазовых треугольника: NaBr–BaBr2–Na2MoO4 и NaBr–BaMoO4–Na2MoO4. Результаты разбиения подтверждены данными рентгенофазового анализа. На стабильной секущей выявлена перевальная квазидвойная эвтектическая точка e 721°C. Определены координаты (температура плавления, состав) двух тройных эвтектик: E1 586°C и E2 525°C. Максимальное поле кристаллизации на квадрате составов отвечает тугоплавкому молибдату бария.
ВВЕДЕНИЕ
Большинство технологических процессов и конструирование изделий тесно связаны с использованием неорганических функциональных композиций на основе солей. Распространенными и важными в технологическом отношении являются соли галогенидов, молибдатов, сульфатов s-элементов [1–9]. Эти соединения востребованы в качестве сред для проведения химических реакций, электролитов различного назначения, флюсов для сварки и пайки, а также для рабочих тел тепловых аккумуляторов, работающих при высоких температурах [10–12], теплоносителей для отопительного оборудования жилых зданий [13]. Вследствие достаточно низкой вязкости и высокой теплопроводности расплавленные соли используются для теплообмена или охлаждения в различных системах, например, в солнечных электростанциях, находят применение при термообработке сталей [14]. Конструирование составов различного назначения тесно связано с изучением многокомпонентных систем [15].
Объектом исследования является трехкомпонентная взаимная система из бромидов и молибдатов натрия и бария Na,Ba||Br,MoO4. Данные по исходным соединениям приведены в табл. 1 [16–18].
Таблица 1.
| Вещество | ${{\Delta }_{r}}H_{{298}}^{^\circ },$ кДж/моль | ${{\Delta }_{r}}G_{{298}}^{^\circ },$ кДж/моль | tпл, °C | Температура полиморфных переходов |
|---|---|---|---|---|
| NaBr (кI, куб.) | –361.192 | –349.129 | 747 ± 2 | – |
| BaBr2 (к, ромб.) | –756.490 | –732.263 | 857 ± 2 | – |
| Na2MoO4 (кI, куб.) | –1469.002 | –1355.147 | 688 ± 3 | 451 ± 5 (β/α) 585 ± 5 (β/γ) 635 ± 5 (δ/γ) |
| BaMoO4 (к, тетр.) | –1533.372 | –1427.709 | 1458 ± 3 | – |
Трехкомпонентная взаимная система Na,Ba||Br,MoO4 включает четыре составляющих вещества, образующих четыре двухкомпонентные системы, исследованные ранее [19–22].
Система BaBr2–BaMoO4 эвтектического типа с координатами эвтектики: 70 экв. % BaBr2, 30 экв. % BaMoO4, tпл = 758°С (трехфазное равновесие же1 ⇄ BaBr2 + BaMoO4).
Система NaBr–BaBr2 имеет координаты эвтектической точки: 58 экв. % NaBr, 42 экв.% BaBr2, tпл = 594°С (трехфазное равновесие же2 ⇄ ⇄ NaBr + BaBr2) [19, 20].
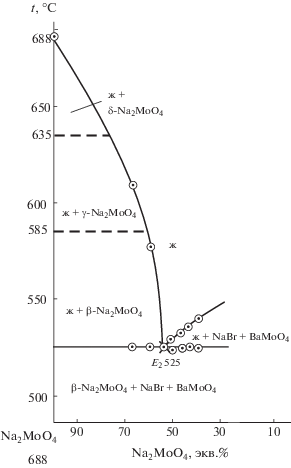
Система NaBr–Na2MoO4 эвтектического типа с трехфазным равновесием же3 ⇄ NaBr + β-Na2MoO4 при 535°С и 44 экв. % NaBr, 54 экв. % Na2MoO4 [21]. В ликвидусе системы отмечаются полиморфные превращения Na2MoO4 при 635 (δ/γ) и 585°С (γ/β). В солидусе во всем интервале концентраций отмечается полиморфное превращение β/α‑Na2MoO4 при 451°С.
В системе Na2MoO4–BaMoO4 отмечено образование эвтектики при 678°С и 95 экв. % Na2MoO4, 9.7 экв. % BaMoO4 [22, 23] с фазовым равновесием же4 ⇄ α' + BaMoO4, где α' – граничный твердый раствор на основе δ-Na2MoO4.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования является трехкомпонентная взаимная система из бромидов и молибдатов натрия и бария Na,Ba||Br,MoO4. Экспериментальные исследования проводили методом дифференциального термического анализа (ДТА) [15, 24, 25]. Исходные реактивы квалификации “х. ч.” (NaBr, BaBr2, Na2MoO4, BaMoO4) были предварительно обезвожены. Температуры плавления веществ соответствовали справочным данным [16–18]. Кривые нагревания и охлаждения образцов снимали на установке ДТA, включающей печь нагрева шахтного типа, датчик термо-эдс, комбинированную платина-платинородиевую термопару, АЦП (аналого-цифровой преобразователь), программатор нагрева (охлаждения). Термоaнaлитичеcкие исследования проводили в стандартных платиновых микротиглях. Холодные спаи термопар термостатировали при 0°C в сосуде Дьюара с тающим льдом. Скорость нагрева (охлаждения) образцов составляла 10–15 град/мин. В качестве индифферентного вещества использовали свежепрокаленный Al2O3 (ч. д. а.). Масса навесок составляла 0.4 г. Градуировку термопар проводили по температурам плавления и полиморфных превращений безводных неорганических солей [16–18]. Точность измерения температур составляла ±2.5°C при точности взвешивания 0.1% на электронных весах Adventurer Ohaus RV214. Составы – молярные массы эквивалентов, выраженные в процентах.
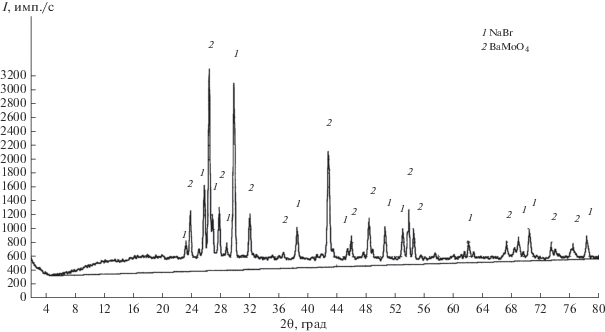
Рентгенофазовый анализ (РФА) проводили на дифрактометре ARL X’TRA (CuKα-излучение) с использованием программных комплексов Crystallographica search-match и Siroquant.
Термодинамическое планирование и методика эксперимента
Проведено исследование трехкомпонентной взаимной системы Na,Ba||Br,MoO4 с целью установления фазовых равновесий и нахождения точек, отвечающих нонвариантным составам системы.
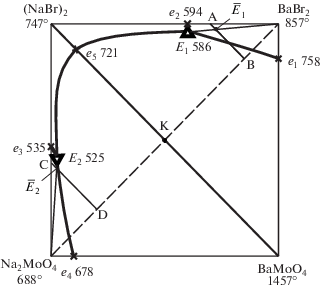
В точке К (рис. 1) протекает реакция обмена:
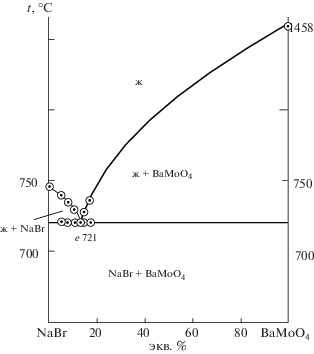
Для подтверждения разбиения системы исследовано взаимодействие смеси эквивалентных количеств солей – молибдата натрия и бромида бария (рис. 2). Образец состава 50 экв. % BaBr2 и 50 экв. % Na2MoO4 нагрели до 540°C, выдержали при этой температуре 30 мин, затем закалили во льду. По результатам РФА, в образце кристаллизуются две фазы – NaBr и BaMoO4 (рис. 1), что также подтверждает теоретический вариант разбиения системы термодинамическим методом. Вариант разбиения подтвержден исследованием стабильной диагонали NaBr–BaMoO4 (рис. 3), на которой определены температура плавления и содержание компонентов в квазидвойной эвтектической точке: 721°C, 11 экв. % BaMoO4, 89 экв. % NaBr.
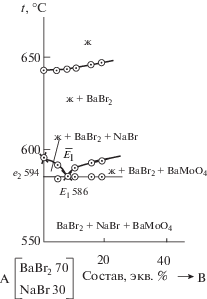
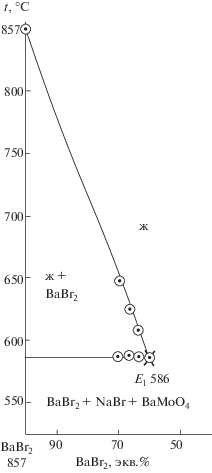
Для экспериментального изучения системы по правилам проекционно-термографического метода [29] в стабильном треугольнике NaBr–BaBr2–BaMoO4 выбран и исследован политермический разрез AB (составы в поле кристаллизации бромида бария, рис. 3). При изучении разреза установлено наличие третичной кристаллизации, соответствующей тройной эвтектике Е1 (tЕ1 = = 586°C). Пересечением ветвей вторичной кристаллизации молибдатов бария и бромида натрия с соответствующей эвтектической прямой в точке ${{\bar {E}}_{1}}$ определили проекцию тройной эвтектики на плоскость разреза АВ с постоянным соотношением компонентов NaBr и BaMoO4 (рис. 4). Исследованием разреза BaBr2 → ${{\bar {E}}_{1}}$ → E1 (рис. 5), исходящего из вершины BaBr2, найден состав тройной эвтектической точки E1: 586.60 экв. % BaBr2, 37 экв. % NaBr и 3 экв. % BaMoO4.
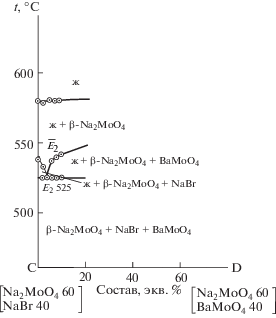
Аналогично проведено экспериментальное исследование стабильного треугольника NaBr–BaMoO4–Na2MoO4. В результате исследования политермического разреза CD определена температура плавления эвтектики Е2 (${{t}_{{{{Е }_{2}}}}}$ = 525°C), а также выявлено направление ${{\bar {E}}_{2}}$ на тройную эвтектическую точку (рис. 6) Исследованием разреза Na2MoO4 → ${{\bar {E}}_{2}}$ → E2, исходящего из вершины молибдата натрия и проходящего через найденное направление, определен состав тройной эвтектической точки: 53 экв. % Na2MoO4 + 42 экв. % NaBr + + 5 экв. % BaMoO4 (риc. 7).
Температуры плавления эвтектик Е1 и Е2 и нонвариантные равновесия приведены в табл. 2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе экспериментальных исследований установлено, что система Na,Ba||Br,MoO4 относится к сингулярной необратимо-взаимной с эвтектическим типом плавления.
Термохимические расчеты ${{\Delta }_{r}}H_{{298}}^{^\circ }$ и ${{\Delta }_{r}}G_{{298}}^{^\circ }$ реакции обмена для состава, отвечающего точке полной конверсии, исследование твердофазного взаимодействия смеси BaBr2 + Na2MoO4, анализ продуктов взаимодействия методом РФА, а также исследование фазовой диаграммы квазибинарной системы NaBr–BaMoO4 подтвердили вариант разбиения на два стабильных фазовых треугольника: NaBr–BaBr2–Na2MoO4 и NaBr–BaMoO4–Na2MoO4. На стабильной секущей выявлена перевальная квазидвойная эвтектическая точка e 721°C. Определены координаты (температура плавления, состав) двух тройных эвтектик: E1 586°C и E2 525°C и квазидвойной эвтектики e5 721°C.
Максимальное поле из четырех полей кристаллизации на квадрате составов (рис. 3) отвечает тугоплавкому молибдату бария, оттесняющему поля кристаллизации остальных фаз к бинарным сторонам, что также является подтверждением сингулярного характера тройной взаимной системы. Фазовые равновесные состояния для различных элементов квадрата составов приведены в табл. 3.
Таблица 3.
Фазовые равновесные состояния для различных элементов квадрата составов
| Элемент диаграммы | Фазовое равновесие |
|---|---|
| Дивариантные равновесия | |
| Поле e2E1e5E2e3 | ж ⇄ NaBr |
| Поле e1E1e5E2e4 | ж ⇄ BaMoO4 |
| Поле e1E1e2 | ж ⇄ BaBr2 |
| Поле e3E2e4 | ж ⇄ β-Na2MoO4 |
| Моновариантные равновесия | |
| Линия e1–E1 | ж ⇄ BaBr2–BaMoO4 |
| Линия e2–E1 | ж ⇄ NaBr–BaBr2 |
| Линия e5–E1 | ж ⇄ NaBr–BaMoO4 |
| Линия e5–E2 | ж ⇄ NaBr–BaMoO4 |
| Линия e3–E2 | ж ⇄ NaBr–β-Na2MoO4 |
| Линия e4–E2 | ж ⇄ BaMoO4–β-Na2MoO4 |
| Нонвариантные равновесия | |
| Точка Е1 | ж ⇄ NaBr–BaBr2–BaMoO4 |
| Точка Е2 | ж ⇄ NaBr–BaMoO4–β-Na2MoO4 |
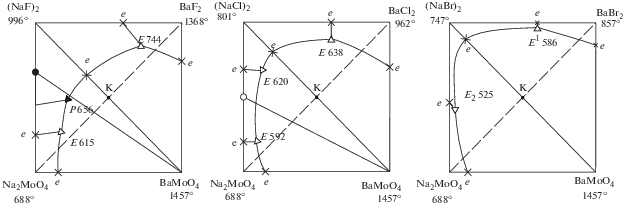
Имеющиеся в литературе данные по тройным взаимным системам Na,Ba||F,MoO4, Na,Ba||Cl, MoO4 [30] и исследованной в данной работе системе Na,Ba||Br,MoO4 позволяют сравнить топологию фазовых диаграмм (рис. 8). В двойных системах NaF–Na2MoO4 и NaCl–Na2MoO4 образуются соединения 2NaF ⋅ Na2MoO4 и Na3ClMoO4 инконгруэнтного и конгруэнтного типа плавления соответственно. Поэтому системы Na,Ba||F(Cl),MoO4 кроме основной стабильной диагонали NaF(Cl)–BaMoO4 имеют секущие. Квадраты составов указанных систем имеют не четыре, а пять полей кристаллизации. Сравнение тепловых эффектов реакций обмена систем Na,Ba||F,MoO4 (${{\Delta }_{r}}H_{{298}}^{^\circ }$ = = –21.88 кДж), Na,Ba||Cl,MoO4 (${{\Delta }_{r}}H_{{298}}^{^\circ }$ = –30.82 кДж) и Na,Ba||Br,MoO4 (ΔrH°298 = –30.26 кДж) показывает, что все системы имеют сингулярный характер. Максимальное поле кристаллизации соответствует наиболее тугоплавкому компоненту – BaMoO4.
Отличие систем Na,Ba||F(Cl),MoO4 от системы Na,Ba||Br,MoO4 в том, что в системах Na,Ba||F(Cl),MoO4 помимо реакций обмена протекают и реакции образования двойных соединений:
В каждой из систем Na,Ba||F(Cl),MoO4, в отличие от системы Na,Ba||Br,MoO4, выявлены три тройные нонвариантные точки: две эвтектики и перитектика в системе Na,Ba||F,MoO4 и три эвтектики в системе Na,Ba||Cl,MoO4.
ЗАКЛЮЧЕНИЕ
Выявлено разбиение трехкомпонентной взаимной системы Na,Ba||Br,MoO4 и экспериментально установлены характеристики нонвариантных равновесий. На стабильной секущей NaBr–BaMoO4 выявлена перевальная квазидвойная эвтектическая точка e 721°C. Определены координаты (температура плавления, состав) двух тройных эвтектик: E1 586°C и E2 525°C. Максимальное поле кристаллизации на квадрате составов отвечает тугоплавкому молибдату бария.
Сравнение тройных эвтектик систем Na,Ba||Hal,MoO4 (Hal = F, Cl, Br) показало, что самые низкоплавкие тройные эвтектики выявлены в трехкомпонентной взаимной системе Na,Ba||Br,MoO4.
Помимо обширного применения солевых композиций низкоплавкие эвтектические составы тройных эвтектик могут быть рекомендованы для электролитического получения молибдена.
Список литературы
Ushak S., Fernández A.G., Grageda M. // Advances in Thermal Energy Storage Systems. 2015. P. 49.
Коровин Н.В., Скундин А.М. и др. Химические источники тока. Справочник / Отв. ред. Коровин Н.В., Скундин А.М. М.: Изд-во МЭИ, 2003. 740 с.
Dinker Abhay, Agarwal Madhu, Agarwal G.D. // J. Energy Institute. 2017. V. 90. № 1. P. 1. https://doi.org/10.1016/j.joei.2015.10.002
Kochkarov Zh.A., Zhizhuev R.A. // Russ. J. Inorg. Chem. 2014. V. 59. № 4. P. 387. [Кочкаров Ж.А., Жижуев Р.А. // Журн. неорган. химии. 2014. Т. 59. № 4. С. 545. https://doi.org/ 10.7868/S0044457X14040096]https://doi.org/10.1134/S0036023614040093
Кочкаров Ж.А., Сокурова З.А., Битокова А.Р. // Расплавы. 2017. № 2. С. 127.
Kochkarov Zh.A., Khubaeva M.A., Shogenov I.A. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 2. P. 282. [Кочкаров Ж.А., Хубаева М.В., Шогенов И.А. и др. // Журн. неорган. химии. 2011. Т. 56. № 2. С. 321.]https://doi.org/10.1134/S0036023611020124
Garkushin I.K., Ragrina M.S., Sukharenko M.A. // Russ. J. Inorg. Chem. 2018. V. 63. № 1. P. 98. [Гаркушин И.К., Рагрина М.С., Сухаренко М.А. // Журн. неорган. химии. 2018. Т. 63. № 1. С. 94. https://doi.org/10.7868/S0044457X18010130]https://doi.org/10.1134/S0036023618010084
Mancini T. Advantages of Using Molten Salt. Sandia National Laboratories. http://www.webcitation.org/60AE7heEZ
Uhlíř J. // Origin. Res. Article J. Nuclear Maters. 2007. V. 360. № 1. P. 6. https://doi.org/10.1016/j.jnucmat.2006.08.008
Garkushin I.K., Dvoryanova E.M., Gubanova T.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 3. P. 324. [Гаркушин И.К., Дворянова Е.М., Губанова Т.В. и др. // Журн. неорган. химии. 2015. Т. 60. № 3. С. 374. https://doi.org/10.7868/S0044457X14120095]https://doi.org/10.1134/S0036023614120092
Гаркушин И.К., Егорцев Г.Е., Истомова М.А. // Электрохимическая энергетика. 2009. Т. 9. № 2. С. 95.
Быстров В.П., Ливчак А.В. Теплоаккумуляторы с использованием фазового перехода // Вопросы экономии теплоэнергетич. ресурсов в системах вентиляции и теплоснабжения. Сб. науч. трудов. М.: Изд-во ЦНИИЭПИО, 1984.
Zhihang Zhao, Mohammad T.Arif, Amanullah M.T.O. // Energy Procedia. 2017. V. 110. P. 243. https://doi.org/10.1016/j.egypro.2017.03.134
Rapp Bob // Mater. Today. 2015. V. 8. № 12. P. 6. https://doi.org/10.1016/S1369-7021(05)71195-0
Гаркушин И.К., Кондратюк И.М., Егорцев Г.Е. и др. Теоретические и экспериментальные методы исследования многокомпонентных систем. Самара: СамГТУ, 2012. 125 с.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. X. Ч. 1. 300 с.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. Х. Ч. 2. 440 с.
База данных. Термические константы веществ. Ин-т теплофизики экстремальных состояний РАН Объединенного ин-та высоких температур РАН. Химический факультет МГУ М.В. Ломоносова http://www.chem.msu.ru/cgi-bin/tkv.pl?show=welcome.html
Данилушкина Е.Г., Кондратюк И.М., Гаркушин И.К. и др. // Междунар. конф. “Физико-химический анализ жидкофазных систем”. Тез. докл. Саратов: СГУ, 2003. 159 с.
Данилушкина Е.Г., Дворянова Е.М., Кондратюк И.М., Гаркушин И.К. // Матер. Всерос. конф. по термич. анализу. Самара: Самарск. гос. арх.-стр. акад., 2003. С. 51.
Воскресенская Н.К., Евсеева Н.Н., Беруль С.И. и др. Справочник по плавкости систем из безводных неорганических солей. М.: Изд-во АН СССР, 1961. Т. 1. 845 с.
Verdiev N.N., Babaev B.D., Gasanaliev A.M. // Russ. J. Inorg. Chem. 1996. V. 41. № 2. P. 296. [Вердиев Н.Н., Бабаев Б.Д., Гасакалиев А.М. // Журн. неорган. химии. 1996. Т. 41. № 2. С. 309.]
Космынин А.С. Проекционно-термографический метод исследования гетерогенных равновесий в конденсированных системах. Автореф. дис. …канд. хим. наук. Куйбышев, 1977. 20 с.
Уэндландт У. Термические методы анализа. М.: Мир, 1978. 526 с.
Егунов В.П. Введение в термический анализ. Самара: СамВен, 1996. 270 с.
Бергман А.Г., Бухалова Г.А. // Изв. сектора физ.-хим. анализа. 1952. Т. 21. С. 228.
Лупейко Т.Г., Тарасов Н.И., Зяблин В.Н. и др. // Новые возможности расчетов термодинамических характеристик солевых систем на основе их диаграмм плавкости. М., 2012. С. 90.
Васина Н.А., Грызлова Е.С., Шапошникова С.Г. Теплофизические свойства многокомпонентных солевых систем. М.: Химия, 1984. 112 с.
Космынин А.С., Трунин А.С. // Тр. Самар. научн. школы по физ.-хим. анализу многокомпонентных систем. 2006. 183 с.
Трунин А.С. Комплексная методология исследования многокомпонентных систем. Самара: СамГТУ, 1997. 307 с. ISBN 5-230-558-3
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии