Журнал неорганической химии, 2019, T. 64, № 8, стр. 818-828
О кратности связей Se–Se в селенсодержащих соединениях лантанидов
В. Н. Сережкин 1, *, М. Албакаджажи 1, Л. Б. Сережкина 1
1 Самарский национальный исследовательский университет им. академика С.П. Королева
443011 Самара, ул. Академика Павлова, 1, Россия
* E-mail: serezhkin@samsu.ru
Поступила в редакцию 10.01.2019
После доработки 04.02.2019
Принята к публикации 12.02.2019
Аннотация
С помощью полиэдров Вороного–Дирихле (ПВД) проведен анализ строения 420 соединений, содержащих в структурах кристаллов 646 координационных полиэдров LnSen, где Ln – любой лантанид от La до Lu. Показано, что параметры ПВД позволяют определять валентное состояние атомов Ln. Установлено, что в селенидах содержатся атомы Ln(II) и Ln(III), связывающие от 4 до 10 атомов селена, которые существуют в виде ионов Se2– или Sе–. Исследованы ПВД атомов Se и выяснено, что гомоатомные связи Se–Se возникают только при дефиците электронодонорных атомов металлов в составе кристаллических веществ. С помощью параметров ПВД выявлена зависимость кратности ковалентной связи Se–Se от ее длины, работоспособность которой апробирована на примере ряда соединений, в том числе полиcеленидов Ln. Изучены некоторые особенности лантанидного сжатия в селенидах.
ВВЕДЕНИЕ
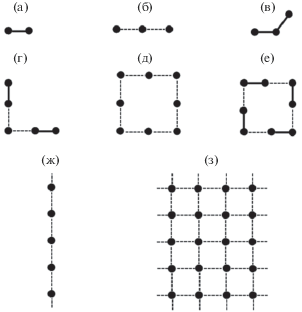
За последние полвека изучены состав и строение около двух тысяч соединений, в кристаллах которых одновременно присутствуют атомы селена и лантанидов (Ln) [1, 2]. Интерес к таким соединениям (далее селенидам Ln) обусловлен их практически важными магнитными, оптическими, электрофизическими и некоторыми другими свойствами [3–8]. Селениды Ln представляют также теоретический интерес, поскольку позволяют оценить кристаллоструктурную роль гомоатомных взаимодействий Se–Se, которые являются важной особенностью стереохимии селена. Так, межатомные контакты между атомами селена в селенидах Ln изменяются в диапазоне от ∼2.3 (ковалентная связь Se–Se) до ∼3.8 Å (ван-дер-ваальсовы взаимодействия Se⋅⋅⋅Se) [9, 10]. Согласно [3, 4], взаимодействия с d(Se–Se) < 2.6 Å можно рассматривать как одинарные связи, хотя и более длинные контакты 2.7–3.0 Å тоже являются связывающими, поскольку стабилизируют соседние пары атомов селена соответственно на –0.9 и –0.2 эВ. По имеющимся данным, за счет связей Se–Se в селенидах Ln могут реализоваться разнообразные по топологии олигомерные, цепочечные или слоистые группировки (рис. 1).
Рис. 1.
Схематическое строение структурных группировок из атомов Se (черные кружки) в структурах селенидов Ln: а – гантели ${\text{Se}}_{2}^{{2--}},$ б, в – соответственно линейные и уголковые тримеры ${\text{Se}}_{3}^{{2--}},$ г – пентамер (Se5)6–, д–е – квадратные октамеры (Se8)8–, ж – цепь (Se–)∞, з – квадратная сетка 44 [11] (Se–)2∞. Короткие (2.3–2.6 Å) контакты Se–Se показаны сплошными линиями, более длинные (2.6–3.0 Å) – пунктиром.
Наличие в структурах селенидов широкого спектра контактов Se–Se затрудняет, а в некоторых случаях делает невозможным однозначное определение формальных зарядов атомов, особенно если в составе веществ содержатся атомы элементов, способных существовать в нескольких валентных состояниях. Примером может служить U2La2Se9 {248052} [12]. В фигурных скобках здесь и далее указан цифровой или буквенный код соединения в базах данных [1, 2]. Согласно [12], на четыре атома металлов (2U и 2La) в структуре U2La2Se9 приходится три иона Se2–, остальные шесть атомов селена входят в состав трех кристаллографически разных линейных цепей ‒Se–Se–Se–, в которых расстояния Se–Se лежат в диапазоне 2.71–2.81 Å. Из нескольких возможных вариантов распределения формальных валентностей в U2La2Se9, включая ${\text{U}}_{{\text{2}}}^{{{\text{III}}}}$${\text{La}}_{{\text{2}}}^{{{\text{III}}}}$(Se2–)3(Se–)6 и ${\text{U}}_{{\text{2}}}^{{{\text{IV}}}}$${\text{La}}_{{\text{2}}}^{{{\text{III}}}}$(Se2–)3(Se1.33–)6, авторы [12] предпочли последний, который лучше согласуется с результатами спектроскопии XANES для атомов металлов, хотя при этом атомам селена в составе цепей в среднем отвечает формальный заряд 1.33 ē.
Как известно, некоторые лантаниды также могут реализовывать не только трех-, но и двух- или четырехвалентное состояние. Поэтому даже для диселенидов LnSe2 следует ожидать три возможных варианта строения: LnIV(Se2–)2 (v1), LnIII(Se2–)(Se–) = = ${\text{Ln}}_{{\text{2}}}^{{{\text{III}}}}$(Se2–)2(Se2)2– (v2) и LnII(Se–)2 = LnII(Se2)2– (v3), которые отличаются отсутствием связей Se–Se в структуре веществ (случай v1) или их наличием у половины (v2) или у всех (v3) атомов селена.
На примере соединений, содержащих более 3900 кристаллографически неэквивалентных координационных полиэдров (КП) LnOn [13], 166 LnFn [14] и 337 LnTen [15], было показано, что параметры полиэдров Вороного–Дирихле (ПВД) позволяют четко различать атомы Ln(II), Ln(III) и Ln(IV), существующие в структурах кристаллов. Результаты [13–15] позволяют предположить, что характеристики ПВД могут быть использованы для оценки валентного состояния атомов и в селенидах Ln. Экспериментальная проверка указанного предположения явилась основной целью работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами анализа явились все соединения Ln, сведения о структурах кристаллов которых имеются в базах данных [1, 2] и удовлетворяют двум требованиям: все кристаллографически неэквивалентные атомы Ln образуют КП или “комплексы” LnSen, при этом отсутствует какое-либо разупорядочение в размещении атомов любых элементов. Этим требованиям соответствовали данные для 420 соединений, в структурах которых содержалось соответственно 646 и 1306 кристаллографически разных атомов Ln и Se. Кристаллохимический анализ проводили c позиций стереоатомной модели структуры кристаллов (СМСК), в рамках которой геометрическим образом любого атома является соответствующий ему ПВД [13–18]. На основании данных о симметрии кристаллов, параметрах их элементарных ячеек и координатах базисных атомов были рассчитаны характеристики ПВД всех атомов, а по методу пересекающихся сфер [16] – их координационные числа (КЧ). Все расчеты проводили с помощью комплекса программ TOPOS-InterMol [18].
В структурах рассмотренных кристаллов обнаружено около 60 топологически разных типов комплексных группировок [LnpSeq]z–. Для сокращения объема статьи в табл. 1 дана краткая характеристика только тех 15 типов комплексов [LnpSeq]z–, в структурах которых имеются связи Se–Se. Для этих комплексов по методике [18] указаны кристаллохимические формулы (КХФ), которые характеризуют кристаллоструктурную роль атомов Se, рассматриваемых в качестве мостиковых лигандов Mm, одновременно связывающих m атомов Ln. Отметим, что использованные КХФ не учитывают связи Se–Se, наличие которых отражено только во вторых формулах, описывающих состав комплексов (третья колонка в табл. 1).
Таблица 1.
Характеристики комплексов [LnpSeq]z–, имеющих в структурах кристаллов связи Se–Se
| № комп- лекса | КЧ атома Ln в комплексе |
Состав “комплекса” [LnpSeq]z– | Se : Ln | Размерность комплекса |
КХФ* | Ln | R и пример соединения** |
|---|---|---|---|---|---|---|---|
| 1 | 7, 8, 9 | [${\text{Ln}}_{{\text{8}}}^{{{\text{III}}}}$Se15] = [Ln24(Se2–)27$\left( {{\text{Se}}_{2}^{{2--}}} \right)$5(Se8)8–] | 1.88 | 3D | A24${\text{M}}_{{{\text{24}}}}^{{\text{5}}}$${\text{M}}_{{{\text{19}}}}^{{\text{4}}}$${\text{M}}_{{\text{2}}}^{{\text{3}}}$ | Gd | {411069} [19] |
| 2 | 8, 9 | [${\text{Ln}}_{{{\text{10}}}}^{{{\text{III}}}}$Se19] = [Ln10(Se2–)11(Se8)8–] | 1.9 | 3D | A10${\text{M}}_{{{\text{10}}}}^{{\text{5}}}$${\text{M}}_{{\text{9}}}^{{\text{4}}}$ | La, Ce, Pr, Nd, Sm | {409471} [20] |
| 3 | 8 | [LnIISe2] = [Ln$\left( {{\text{Se}}_{2}^{{2--}}} \right)$] | 2 | 3D | ${\text{А M}}_{{\text{2}}}^{{\text{4}}}$ | Eu | [21] |
| 4 | 8 | β-[LnIIISe2] = β-[Ln(Se2–)(Se–)] | 2 | 3D | ${\text{А M}}_{{\text{2}}}^{{\text{4}}}$ | Er | {631111} [22] |
| 5 | 9 | [LnIIISe2] = [Ln2(Se2–)2(Se22–)] | 2 | 3D | AM5M4 | La, Ce, Pr, Nd, | {32530} [23] |
| 6 | 9 | [LnIIISe2] = [Ln(Se2–)(Se–)] | 2 | 3D | AM5M4 | La, Ce, Pr, Nd, Sm, Gd, Dy, Ho, Er, Tm, Yb, Lu | {42969} [24] |
| 7 | 9 | [LnIIISe2] = [Ln4(Se2–)5(Se32–)] | 2 | 3D | AM5M4 | Pr | {239610} [8] |
| 8 | 9 | [${\text{Ln}}_{{\text{2}}}^{{{\text{II}}}}$Se5]4– = [Ln4(Se2–)7(Se3)2–]8– | 2.5 | 3D | A4${\text{M}}_{{\text{7}}}^{{\text{4}}}$${\text{M}}_{{\text{2}}}^{{\text{3}}}$M2 | Eu | Sn {411890} [25] |
| 9 | 8, 9 | [LnIISe3]3– = [Ln4(Se2–)9(Se3)2–]12– | 3 | 3D | A4${\text{M}}_{{\text{6}}}^{{\text{4}}}$${\text{M}}_{{\text{2}}}^{{\text{3}}}$M2M13 | Eu | Bi {194848} [26] |
| 10 | 9 | [LnIISe3]3– = [Ln4(Se2–)9(Se3)2–]12– | 3 | 3D | A4${\text{M}}_{{\text{7}}}^{{\text{4}}}$M3M2M13 | Eu | Sb {415725} [27] |
| 11 | 8 | [LnIIISe4]– = [Ln$\left( {{\text{Se}}_{2}^{{2--}}} \right)$2]– | 4 | 2D | ${\text{А M}}_{{\text{4}}}^{{\text{2}}}$ | Ce | K {67656} [28] |
| 12 | 8 | [LnIIISe4]3– = [Ln(Se2–)2(Se2)2–]3– | 4 | 2D | ${\text{А M}}_{{\text{4}}}^{{\text{2}}}$ | Sm, Gd | K, As, Sb{260254} [29] |
| 13 | 9 | [LnIISe4]4– = [Ln(Se2–)2(Se2)2–]4– | 4 | 2D | ${\text{А M}}_{{\text{2}}}^{{\text{3}}}$M2M1 | Eu | K, Ge, Si {280648} [30] |
| 14 | 8, 10 | [${\text{Ln}}_{{\text{2}}}^{{{\text{III}}}}$Se9]8– = [Ln2(Se2–)3(Se1.33–)6]8– | 4.5 | 3D | A2${\text{M}}_{{\text{9}}}^{{\text{2}}}$ | La | U {248052} [12] |
| 15 | 9 | [LnIIISe5]6– = [Ln2(Se2–)8(Se2)2–]12– | 5 | 1D | AM3${\text{M}}_{{\text{2}}}^{{\text{2}}}$M12 | La | Ba, Sb {421269} [31] |
* КХФ – кристаллохимическая формула комплекса. Во всех случаях A = Ln, M = Se. Надстрочные цифры указывают число связей Se–Ln, образованных одним атомом селена. Подстрочные цифры – стехиометрические индексы. ** Rz+ – катионы, компенсаторы заряда анионных комплексов [LnpSeq]z–. Кристаллоструктурные данные для EuSe2 указаны в [21], но отсутствуют в базах [1, 2].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ПВД атомов лантанидов
В селенидах атомы Ln проявляют КЧ = 4, 6, 7, 8, 9 или 10 (табл. 2, S1 ). Важнейшие характеристики ПВД атомов Ln указаны в табл. 2. В общем случае ПВД атома Ln имеет состав LnSenZr, где n – КЧ атома Ln, Z – атомы второй координационной сферы, а сумма n + r равна общему числу граней ПВД. Отметим, что ПВД атомов Z, так же как и атомов Se, обязательно имеют общую грань с ПВД атома Ln, но, в соответствии с критериями [16], контакты Ln/Z не учитываются при определении КЧ атомов. Однозначно классифицировать все контакты атомов Ln на связи Ln–Se и невалентные взаимодействия Ln/Z (слеш отмечает наличие общей грани у ПВД атомов Ln и Z) позволяет метод пересекающихся сфер [16].
Таблица 2.
Важнейшие характеристики ПВД атомов Ln*
| Ln | КЧ | Число атомов | Rsd, Å | DA, Å | G3 | d(Ln–Se), Å | ||
|---|---|---|---|---|---|---|---|---|
| диапазон | среднее | μ | ||||||
| La3+ | 6–10 | 47 | 1.827(31) | 0.035(33) | 0.0813(14) | 2.85–3.49 | 3.11(11) | 372 |
| Ce3+ | 4, 6–9 | 50 | 1.815(42) | 0.044(37) | 0.0815(15) | 2.66–3.52 | 3.08(13) | 389 |
| Pr3+ | 6–9 | 31 | 1.802(28) | 0.036(31) | 0.0814(14) | 2.88–3.40 | 3.06(9) | 240 |
| Nd3+ | 6–9 | 28 | 1.803(30) | 0.028(30) | 0.0821(16) | 2.82–3.37 | 3.02(9) | 204 |
| Sm2+ | 6, 8 | 12 | 1.908(20) | 0.013(23) | 0.0830(13) | 3.09–3.46 | 3.16(7) | 84 |
| Sm3+ | 4, 6–9 | 45 | 1.784(27) | 0.048(37) | 0.0821(19) | 2.51–3.47 | 3.00(11) | 332 |
| Eu2+ | 6–9 | 65 | 1.874(32) | 0.039(38) | 0.0812(15) | 2.55–3.70 | 3.21(12) | 527 |
| Eu3+ | 6 ** | 2 | 1.908(3) | 0.023(11) | 0.08344(4) | 3.04–3.10 | 3.07(2) | 12 |
| Gd3+ | 6–9 | 54 | 1.768(25) | 0.052(45) | 0.0820(14) | 2.52–3.52 | 2.98(11) | 401 |
| Tb3+ | 4, 6–8 | 30 | 1.769(23) | 0.043(48) | 0.0831(19) | 2.47–3.46 | 2.91(13) | 200 |
| Dy3+ | 4, 6–9 | 44 | 1.770(30) | 0.048(50) | 0.0831(17) | 2.47–3.45 | 2.91(12) | 288 |
| Ho3+ | 6, 8, 9 | 34 | 1.759(29) | 0.024(33) | 0.0834(7) | 2.54–3.09 | 2.85(7) | 209 |
| Er3+ | 6–9 | 58 | 1.758(17) | 0.039(41) | 0.0833(10) | 2.61–3.11 | 2.85(7) | 362 |
| Tm3+ | 6, 8, 9 | 26 | 1.750(18) | 0.033(40) | 0.0833(8) | 2.68–3.13 | 2.84(7) | 161 |
| Yb2+ | 4, 6–8 | 20 | 1.831(37) | 0.044(51) | 0.0835(20) | 2.55–3.28 | 3.01(13) | 134 |
| Yb3+ | 6, 7, 9 | 64 | 1.750(18) | 0.043(45) | 0.0837(6) | 2.58–3.11 | 2.82(6) | 390 |
| Lu3+ | 6, 8, 9 | 36 | 1.742(22) | 0.037(44) | 0.0835(7) | 2.57–3.12 | 2.82(8) | 221 |
* Для каждого типа атомов Ln указаны: КЧ – координационное число по отношению к атомам Se; DA – смещение ядра атома Ln из геометрического центра тяжести его ПВД; G3 – безразмерный второй момент инерции ПВД; d(Ln–Se) – длина связей в координационных полиэдрах LnSen, µ – общее число связей Ln–Se. В скобках даны стандартные отклонения. ** На основании имеющихся данных можно считать (см. текст статьи), что указанные сведения для Eu(III), опирающиеся на данные для единственной структуры Eu2Se3 {631660}, являются ошибочными.
Форму КП LnSen определяли с помощью “упрощенных” ПВД, которые не учитывают грани Ln/Z. Каждому геометрическому сорту комплексов LnSen отвечает ПВД, имеющий определенный комбинаторно-топологический тип (КТТ). Строчные числа в символе КТТ указывают число вершин у грани, надстрочные – общее число таких граней. Для всех выявленных КП LnSen (табл. 3) в фигурных скобках указан также топологический тип вершин (ТТВ) соответствующих ПВД. В обозначениях ТТВ первое число указывает ранг вершины v (число ребер полиэдра, пересекающихся в вершине), второе (после слеша) – общее количество таких вершин. Например, запись {3/10} означает, что ПВД (в данном примере пентагональная призма) имеет десять вершин третьего ранга. Поскольку “упрощенные” ПВД дуальны КП (число вершин одного полиэдра равно числу граней другого и наоборот), ТТВ одновременно характеризует тип и число граней КП. В частности, та же запись {3/10} показывает, что дуальный КП (пентагональная бипирамида) имеет десять треугольных граней.
Таблица 3.
Характеристики КП LnXn (X = Se, Te) и соответствующих им “упрощенных” ПВД
| КЧ атома Ln |
Форма КП атома Ln |
ПВД, дуальный КП атома Ln | Комплексы LnSen | Комплексы LnTen [15] |
|||
|---|---|---|---|---|---|---|---|
| КТТ | ТТВ | число атомов Ln |
доля (%) в выборке | число атомов Ln |
доля (%) в выборке |
||
| 4 | Тетраэдр | 34 | {3/4} | 5 | 0.8 | 1 | 0.3 |
| 6 | Октаэдр | 46 | {3/8} | 317 | 49.1 | 209 | 62.0 |
| 7 | Одношапочная тригональная призма |
3245 | {3/6 4/2} | 42 | 6.5 | 7 | 2.1 |
| 7 | Пентагональная бипирамида | 4552 | {3/10} | 22 | 3.4 | – | – |
| 8 | Тригональный додекаэдр | 4454 | {3/12} | 83 | 12.8 | 25 | 7.4 |
| 8 | Двухшапочная тригональная призма | 4652 | {3/10 4/1} | 78 | 12.1 | 7 | 2.1 |
| 8 | Гексагональная бипирамида |
4662 | {3/12} | 21 | 3.3 | – | – |
| 8 | Квадратная антипризма |
48 | {3/8 4/2} | 2 | 0.3 | 7 | 2.1 |
| 8 | Куб | 38 | {4/6} | 1 | 0.2 | 4 | 1.2 |
| 9 | Трехшапочная тригональная призма | 4356 | {3/14} | 56 | 8.7 | – | – |
| 9 | Одношапочная квадратная антипризма | 45 54 | {3/12 4/1} | 18 | 2.8 | 77 | 22.8 |
| 10 | Cфенокорона | 4654 | {3/12 4/2} | 1 | 0.2 | – | – |
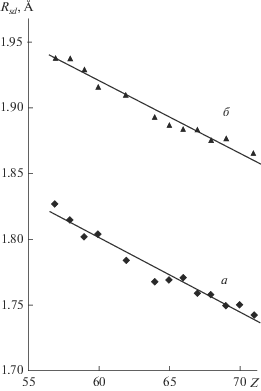
В селенидах, как и в теллуридах [15], для атомов Ln наиболее характерно КЧ = 6 и КП LnX6 (X = Se или Te) в виде октаэдра (табл. 3). Чаще всего в кристаллах селенидов содержатся атомы Ln(III) (в 549 случаях из 646). Атомы Ln(II) встречаются существенно реже (97 атомов в соединениях Sm, Eu и Yb, табл. 2, S1 ). Как уже отмечалось [13–15], надежным дескриптором валентного состояния лантанида может служить объем ПВД (Vvdp) атома Ln или соответствующий ему одномерный аналог – радиус сферического домена (Rsd), поскольку Vvdp = 4π(Rsd)3/3. Наглядным свидетельством является рис. 2, на котором кривая а показывает зависимость Rsd атомов Ln с КЧ = 6 от атомного номера лантанида в изоструктурных кристаллах LnSe. Несмотря на однотипный состав и строение (все LnSe принадлежат к структурному типу NaCl), они резко различаются электрофизическими свойствами. Согласно [10, 32], некоторые из них являются полупроводниками LnIISe, тогда как остальные представляют собой LnIIISe(ē) и поэтому обладают металлической проводимостью. С учетом [13–15] cкачкообразный рост Rsd атомов Ln на кривой а (рис. 2) именно в моноселенидах Sm, Eu или Yb, в согласии с данными [32], позволяет считать их соединениями LnII. В то же время все остальные “металлоподобные” LnSe несомненно являются соединениями LnIII, поскольку для них значения Rsd(Ln) практически совпадают с указанной на рис. 2 пунктирной кривой, которая характеризует зависимость Rsd = f(Z) для атомов Ln(III) с КЧ = 6 в структурах всех остальных селенидов.
Рис. 2.
Зависимости Rsd атомов Ln от их атомного номера Z (для La Z = 57, а для Lu Z = 71). а – Структуры кристаллов LnSe с КЧ = 6 при атмосферном давлении; б – структуры селенидов, содержащих атомы Ln(III) c КЧ = 6 (данные для кривой б не учитывают характеристики атомов Ln в структурах LnSe, использованные при построении кривой а), в – структуры кристаллов LnTe с КЧ = 6 при атмосферном давлении по данным [15].
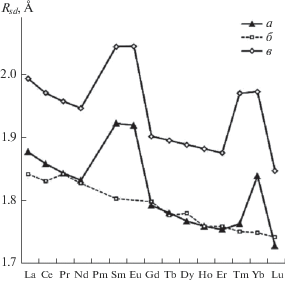
Отметим, что на рис. 2 кривая а по форме практически совпадает с кривой в, которая характеризует зависимость Rsd = f(Z) для атомов Ln с КЧ = 6 в изоструктурных монотеллуридах LnTe [15], которые также принадлежат к структурному типу NaCl. Указанное сходство неудивительно, поскольку большинство монотеллуридов представляет собой LnIIITe(ē) и обладает металлической проводимостью, тогда как к полупроводникам LnIITe относятся только соединения Sm, Eu, Tm и Yb [10, 32]. Единственное существенное различие между кривыми а и в на рис. 2 связано с TmSe, для которого Rsd ближе к состоянию TmIII, а не TmII, как в случае TmTe. По данным квантово-химических расчетов (LSDA и LSDA + U) и спектроскопических измерений [33], промежуточное валентное поведение TmSe, в котором заряд на атоме Tm колеблется между 2+ и 3+, вызвано особенностями зонной структуры кристаллов [32].
Отметим, что при переходе от LnII к LnIII величина Rsd в оксидах [13], селенидах (табл. 2) и теллуридах [15] уменьшается в среднем на 0.115(14), 0.105(21) и 0.105(16) Å соответственно. Поэтому кривая б на рис. 2 построена без учета данных для Eu(III) с КЧ = 6 в кристаллах Eu2Se3 {631660} (табл. 2). Эта структура является единственным изученным примером селенида Eu(III) и, по нашему мнению, нуждается в повторном исследовании, поскольку Rsd (1.908(3) Å) для двух кристаллографически неэквивалентных атомов Eu(III) практически совпадает с установленным для Eu(II) c КЧ = 6 (1.920(2) Å, табл. S1 , рис. 1).
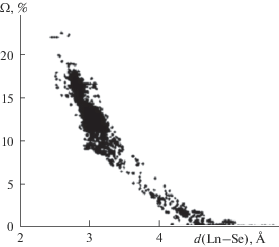
ПВД 646 атомов Ln в селенидах в сумме имеют 7420 граней, 4526 из которых соответствуют связям Ln–Se (табл. 2, S1 ). На зависимости телесных углов (Ω), под которыми грани “видны” из ядра атома Ln или Se, от межатомных расстояний Ln–Se (рис. 3) связям Ln–Se соответствуют грани с Ω в области от 23 до 6% полного телесного угла 4π стерадиан. Остальные грани с Ω < 6% отвечают невалентным взаимодействиям Ln/Z. В роли атомов Z чаще всего выступают атомы Ln или Se (соответственно 1467 и 642 грани). Остальные 785 граней отвечают невалентным контактам Ln/R, где R – внешнесферные катионы, компенсирующие заряд ацидокомплексов [LnpSeq]z–. Безразмерный второй момент инерции (G3), характеризующий степень сферичности ПВД, для 646 атомов Ln в среднем равен 0.0825(17). Смещение ядер атомов Ln из центра тяжести их ПВД (DA) составляет 0.040(41) Å и в пределах σ равно нулю.
ПВД атомов селена
В структурах рассмотренных соединений встречаются атомы селена двух типов. Большинство из них (1209 из 1306) можно рассматривать как ионы Se2–, а остальные 97 – как ионы Se–. ПВД ионов Se2– и Se– в среднем имеют соответственно 16(3) и 14(2) граней. Радиусы соответствующих им сферических доменов Rsd равны 1.88(6) и 1.81(7) Å и совпадают в пределах 2σ. С позиций СМСК можно считать, что примерное постоянство Rsd (или Vvdp) атомов Se2– и Se– обусловлено тем, что во всех случаях они реализуют однотипную устойчивую 8-электронную валентную электронную оболочку. Принципиальное различие ионов Se2– и Se– состоит в том, что ионы Se2– образуют такую оболочку за счет совокупности только гетероатомных химических связей Se–Ln и/или Se–R, тогда как ионы Se– кроме связей Se–Ln обязательно образуют гомоатомные ковалентные связи Se–Se. Отметим также, что Rsd (или Vvdp) ионов Se– меньше, чем Se2–, именно из-за того, что связи Se–Se, как правило, короче связей Se–Ln.
Поскольку КЧ ионов Se2– и Se– в среднем равно 5(1) и 6(1), на один ион приходится соответственно 11 и 8 невалентных взаимодействий Se/Z. Cтепень сферичности ПВД ионов Se2– и Se– принципиально не различается (G3 = 0.0838(21) и 0.0829(22) соответственно). Смещение ядер атомов селена из центра тяжести их ПВД для Se2– и Se– равно соответственно 0.15(11) и 0.13(8) Å и в пределах 2σ равно нулю.
Ионы Se– присутствуют в структурах 47 соединений, причем обычно они сосуществуют с ионами Se2–. Только в структурах EuSe2 [21] и KCe(Se2)2 {67656} [28] содержатся ионы Se–, образующие гантели ${\text{Se}}_{2}^{{2--}}.$ В отличие от ионов Se2–, связанных только с атомами Ln и/или R, ионы Se– обязательно имеют от 1 до 4 связей Se–Se, за счет которых реализуют в селенидах Ln разнообразные по топологии олигомерные (0D), цепочечные (1D) или слоистые (2D) группировки (рис. 1).
Принципиальное различие кристаллохимической роли ионов Se2– и Se– четко проявляется на распределениях (Ω, d) для граней ПВД, которые соответствуют взаимодействиям между атомами селена (рис. 4). Согласно СМСК, в ПВД ионов Se2– все 12212 граней Se/Se (рис. 4а) отвечают только невалентным взаимодействиям. Для граней Se2–/Se2– максимальное Ω(Se–Se) < 13%, расстояния d(Se–Se) лежат в диапазоне 3.04–6.25 Å, а среднее межатомное расстояние (4.0(3) Å) превышает удвоенный ван-дер-ваальсов радиус (∼3.8 Å) селена. В структурах селенидов обычно реализуются внутримолекулярные контакты Se2–/Se2–, для которых ранг граней (РГ) ПВД > 1 (изменяется от 2 до 8). Отметим, что значения РГ указывают минимальное число химических связей, соединяющих атомы Se, ПВД которых имеют общую грань. Межмолекулярные контакты Se2–/Se2–, для которых РГ = 0, реализуются всего в 12 случаях.
Рис. 4.
Зависимость телесных углов Ω (% от 4π ср.) граней ПВД атомов Se от межатомных расстояний d(Se–Se), соответствующих этим граням: 12212 граней Se–Se в 1158 ПВД ионов Se2– (а); 918 граней Se–Se в 97 ПВД ионов Se– (б).
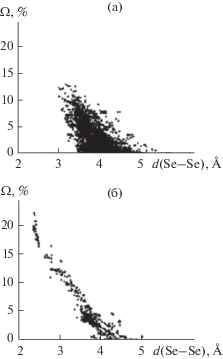
У ПВД 97 ионов Se– имеется 918 граней Se/Se (рис. 4б), ранг которых изменяется от 1 до 4. Как и для ионов Se2–, наиболее многочисленными являются грани c РГ > 1, характеризующие внутримолекулярные невалентные взаимодействия между ионами Se–. Для 773 таких граней (включая 757, 12 и 4 грани соответственно с РГ = 2, 3 и 4) Ω(Se–Se) < 13%, расстояния d(Se–Se) лежат в диапазоне 2.90–5.41 Å (в среднем 3.8(5) Å). Ранг остальных 145 граней равен 1 и, согласно СМСК, все они соответствуют химическим связям Se––Se–. Для “связевых” граней ПВД Ω(Se–Se) > 11%, d(Se–Se) лежат в диапазоне 2.36–3.05 Å (среднее 2.6(2) Å). Отметим, что для 567 граней с d(Se––Se–) < < 3.8 Å (рис. 4б), 145 из которых соответствуют химическим связям, а остальные – специфическим или ван-дер-ваальсовым взаимодействиям, с достоверностью аппроксимации R2 = 0.95 выполняется линейная зависимость:
(1)
$\Omega \left( {{\text{S}}{{{\text{e}}}^{--}}{\kern 1pt} --{\kern 1pt} {\text{S}}{{{\text{e}}}^{--}}} \right) = {\text{45}}.{\text{4}}\left( {\text{4}} \right)--{\text{11}}.{\text{1}}\left( {\text{1}} \right)d\left( {{\text{S}}{{{\text{e}}}^{--}}{\kern 1pt} --{\kern 1pt} {\text{S}}{{{\text{e}}}^{--}}} \right).$По имеющимся данным, гомоатомные связи Se–Se образуются только при дефиците электронодонорных атомов Ln и R в составе веществ. Свидетельством может служить тот факт, что связи Se–Se, возникающие при ассоциации ионов Se–, имеются в структурах комплексов [LnIISe4]4– = = [LnII(Se2–)2(Se2)2–]4–, но отсутствуют в аналогичных по стехиометрическому составу комплексах [LnII(Se2–)4]6–. Такая же ситуация наблюдается и в ряду комплексов [LnIII$\left( {{\text{Se}}_{2}^{{2--}}} \right)$2]––[LnIII(Se2–)2(Se2)2–]3– –[LnIII(Se2–)4]5–, увеличение отрицательного заряда которых на каждом шаге обусловлено превращением (Se2)2– + 2ē → 2Se2–.
Аналогичный эффект наблюдается и в комплексах с отношением Se : Ln = 2. Так, в диселенидах LnII (известный пример – [EuII$\left( {{\text{Se}}_{2}^{{2--}}} \right)$] [20]) присутствуют только ионы Se–, попарно связанные в гантели ${\text{Se}}_{2}^{{2--}}.$ В диселенидах LnIII в равном соотношении сосуществуют ионы Se2– и Se–, поэтому их состав можно упрощенно описать общей формулой [LnIIISe2–(Se–)]. В зависимости от природы LnIII и условий получения кристаллов диселенидов атомы Se– могут образовывать сетки 44 [11], линейные цепи, димеры (Se2)2– или, как в структуре [PrIIISe2] = [Pr4III(Se2–)5(Se3)2–)] {239610} [8], линейные тримеры ${\text{Se}}_{3}^{{2--}}.$ В то же время, в отличие от указанных электронейтральных [LnIIISe2], в аналогичных по составу многочисленных ацидокомплексах [LnIIISe2]– во всех случаях присутствуют только анионы Se2–, половина которых возникла в результате превращения Se– + ē → Se2–.
Кратность связей Se–Se в селенидах Ln
С позиций СМСК, существование линейной зависимости (1) свидетельствует о возможности количественной оценки кратности (ki) связей Se–Se на основании расстояния между атомами селена. В качестве характеристики связи с ki = 1 примем среднее d(Se–Se ) = 2.335(11) Å для 40 кристаллографически разных связей в пяти кристаллографически разных молекулах Se8, присутствующих в структурах α-{2718} [34], β-{24670} [35], γ-{36333} [36] и δ-{418318} [37] модификаций. Как известно, в рамках метода пересекающихся сфер [15] максимальная теоретически возможная длина связи Se–Se равна сумме rs(Se) + Rsd(Se), где rs(Se) – слейтеровский радиус атома Se, а Rsd(Se) – радиус сферического домена атома Sе. Для оценки ki в качестве Rsd(Se) примем округленную с точностью до десятых среднюю величину Rsd 1306 атомов Se (1.9 Å). Поскольку rs(Se) = 1.15 Å [9], связи с ki = 0 соответствует d(Se–Se ) = 3.05 Å. Учитывая, что для одинарной связи d(Se–Se) = = 2.335 Å, и постулируя, что кратность связи линейно уменьшается от 1 до 0 при увеличении ее длины, в общем случае получим:
(2)
$\quad{{k}_{i}}\left( {{\text{Se}}{\kern 1pt} --{\kern 1pt} {\text{Se}}} \right) = {\text{4}}.{\text{3}}--{\text{1}}.{\text{4}}{{d}_{i}}\left( {{\text{Se}}{\kern 1pt} --{\kern 1pt} {\text{Se }}} \right).\quad\quad\quad\quad\quad\quad\quad\quad\quad\quad\quad\quad\quad\quad{\text{ }}$Рассмотрим примеры, свидетельствующие о пригодности уравнения (2) для оценки кратности связей Se–Se. Так, в термодинамически стабильной тригональной модификации элементарного селена {22251} [38] расстояние между соседними атомами в спиральных цепочках –Se–Se –Se– равно 2.373 Å. Согласно (2), для каждой связи Se–Se значение k = 0.98 ∼ 1, что согласуется с классическими представлениями [9, 10]. Похожая ситуация реализуется и для 26 кристаллографически неэквивалентных гантелеподобных анионов ${\text{Se}}_{2}^{{2--}},$ присутствующих в обсуждаемой выборке, в которых d(Se–Se) изменяется от 2.35 до 2.49 Å при среднем k = 0.93(6). В частности, в структурах EuSe2 [21] и KCe(Se2)2 {67656} [28], где d(Se–Se) равно соответственно 2.397 и 2.348 Å, согласно (2), k = 0.94 и 1.01.
V-образные тримеры ${\text{Se}}_{3}^{{2--}}$ с углом SeSeSe ∼103°–107° содержатся в структурах комплексов 7–9 (табл. 1, рис. 1в). В шести кристаллографически неэквивалентных тримерах кратность каждой связи Se–Se в среднем равна 0.89(3) и поэтому для центрального атома тримера среднее k ∼ 1.79(6). В то же время в единственной структуре PrSe2 {239610} [8] (комплекс 7 в табл. 1), содержащей линейные тримеры ${\text{Se}}_{3}^{{2--}}$ с точечной симметрией D2, кратность связей Se–Se понижена до 0.53. В результате для центрального атома тримера (Se3) суммарное k ∼ 1.07. При этом концевые атомы тримера (Se2) образуют по две дополнительные связи c d(Se–Se) ∼ 2.94 Å и k ∼ 0.18 c атомами Se4, благодаря чему для Se2 суммарное k повышается до ∼0.90. Каждый атом Se4 (занимает позиции с точечной симметрией S4) связан с четырьмя атомами Se2 (они образуют квадрат, в центре которого лежит Se4) четырех разных тримеров. Для Se4 суммарное k ∼ 0.72. Размещение атомов Se2–Se4 в структуре PrSe2 напоминает квадратные сетки 44 (рис. 1з), характерные для структур некоторых LnSe2. Искажение сетки 44 в PrSe2 вызвано разной суммарной кратностью связей Se–Sе, образованных атомами Se2, Se3 и Se4 (соответственно k = 0.90, 1.07 и 0.72).
В квадратных сетках 44 почти 20 охарактеризованных структур LnSe2 (пр. гр. P4/nmm, комплексы 6 в табл. 1), суммарное k для атома Se– в среднем равно 1.05(45). Минимальное k (0.30) отвечает LaSe2 {641932}, а максимальное (1.62) – структуре LuSe2 {642598} [39], полученной при 15 кбар. Отметим, что установленное более полувека назад существование идеальных квадратных сеток 44 из атомов Se– в кристаллах LnSe2 вошло в противоречие как с теоретическими представлениями [40], так и с данными ряда электронно-дифракционных и рентгенографических исследований полихалькогенидов Ln, полученными в последние десятилетия [3–5, 8, 41]. Поэтому неудивительно существование обширной группы полиселенидов LnSe2 – δ, в которых имеются квазиквадратные сетки 44, содержащие ионы Se–, Se2– и вакансии. Примером могут служить структуры LnIIISe1.9 (комплексы 2 в табл. 1), в которых сетки 44 содержат квадраты (Se8)8–, образованные четырьмя гантелями (Se2)2– (рис. 1е). Центры квадратов отвечают вакантным позициям в сетке 44, при этом число вакансий (или квадратов (Se8)8–) совпадает с количеством ионов Se2–, занимающих остальные позиции сетки 44. Проведенный анализ показал, что в изученных кристаллах LnIIISe1.9 суммарное значение k для 10 кристаллографически независимых атомов, входящих в состав центросимметричных квадратов (Se8)8–, в среднем равно 1.02(5) и в зависимости от природы Ln изменяется от 0.95 (LaSe1.9 {69730} [42]) до 1.09 (SmSe1.9 {409471} [20]).
Бесконечные цепи из атомов Se– (рис. 1ж) присутствуют в двух селенидах: β-[ErSe2] {631111} [22] (комплекс 4 в табл. 1) и U2La2Se9 {248052} [12] (комплекс 14 в табл. 1). В четырех семействах линейных цепей, имеющихся в этих структурах, d(Se–Se) лежат в диапазоне 2.71–2.81 Å. Согласно (2), для β-[ErSe2] суммарная кратность связей Sе–Se в цепях равна 0.80, а для U2La2Se9 – 0.96, 0.75 и 0.75 для цепей из атомов Se3, Se4 и Se5 соответственно.
Лантанидное сжатие в селенидах Ln
В структурах кристаллов КП LnSen, как правило, искажены, о чем свидетельствует значительная вариация длины связей Ln–Se (табл. 2, S1 ). В согласии с общепринятыми представлениями при фиксированной природе атомов Ln(III) средняя длина связей Ln–Se в целом достаточно закономерно увеличивается с ростом КЧ атома Ln. При этом различие между наиболее длинной и самой короткой связью Ln–Se в охарактеризованных КП LnSen изменяется в широких пределах – от 0.45 (Tm(III)) до 1.00 Å (Gd(III)). В то же время значения Rsd атомов Ln практически не зависят от КЧ и формы КП LnSen. В частности, в обсуждаемых селенидах для атомов Gd(III) с КЧ = 6, 7, 8 и 9 расстояние Rsd = 1.799(19), 1.762(9), 1.762(17) и 1.732(14) Å соответственно, при этом среднее Rsd для 54 кристаллографически разных атомов Gd(III) составляет 1.768(25) Å (табл. 2, S1 ). На фоне значительной вариации длины связей Ln–Se (например, для Gd(III) она в 40 раз превышает σ(Rsd)) среднее значение Rsd, в рамках СМСК характеризующее объем ПВД атома Ln(III), по нашему мнению, можно рассматривать как параметр, практически не зависящий от КЧ.
Как известно, размеры атомов Ln закономерно уменьшаются с ростом атомного номера Z элемента из-за увеличения эффективного заряда ядра атома при заполнении внутренних 4f-электронных оболочек. Имеющиеся кристаллохимические оценки показывают, что общий эффект 4f-, если его характеризовать разностью ионных радиусов первого и последнего элементов ряда, независимо от КЧ атомов Ln(III) составляет ∼0.2 Å [9, 10, 43]. В связи с этим было интересно на примере рассмотренных селенидов проверить возможность использования средних значений Rsd атомов Ln для количественной оценки лантанидного сжатия.
На рис. 5 показана зависимость среднего значения Rsd атомов Ln(III) в 420 селенидах от атомного номера (Z). По данным регрессионного анализа, для комплексов LnSen с ростом Z в ряду от La (Z = 57) до Lu (Z = 71) наблюдается закономерное уменьшение Rsd, которое описывается линейной зависимостью:
(3)
${{R}_{{sd}}}_{{\text{ }}}\left( {{\text{L}}{{{\text{n}}}^{{{\text{III}}}}}{\text{S}}{{{\text{e}}}_{n}}} \right) = {\text{2}}.{\text{139}}--0.00{\text{56}}Z$Рис. 5.
Зависимость среднего значения Rsd атомов Ln(III), образующих КП LnSen (а) или LnTen (б), от атомного номера (Z) лантанида.
c достоверностью аппроксимации R2 = 0.96. Согласно (3), для Eu(III) с Z = 63, надежные сведения о характеристиках ПВД которого отсутствуют, Rsd ∼ 1.786 Å. Учитывая, что в селенидах Rsd Ln(II) в среднем на ∼0.105 Å превышает Rsd Ln(III), Rsd Eu(II) теоретически должно составлять ∼1.891Å, что, на наш взгляд, приемлемо согласуется с имеющейся экспериментальной оценкой 1.874(32) Å (табл. 2).
Для сравнения на рис. 5 показана также линейная зависимость Rsd(Z) для атомов Ln(III) в теллуридах, построенная на основании результатов [15]. Для теллуридов эта зависимость имеет вид:
(4)
${{R}_{{sd{\text{ }}}}}\left( {{\text{L}}{{{\text{n}}}^{{{\text{III}}}}}{\text{T}}{{{\text{e}}}_{n}}} \right) = {\text{2}}.{\text{249}}--0.00{\text{55}}Z$при достоверности аппроксимации R2 = 0.97.
С помощью ПВД интегральный эффект лантанидного сжатия для Ln(III) можно охарактеризовать разностью ΔLn = Rsd(La) – Rsd(Lu). В изученных комплексах LnIIIXn, где Х = О [13], Se (настоящая работа) или Te [15], параметр ΔLn = 0.12, 0.09 и 0.07 Å соответственно.
ЗАКЛЮЧЕНИЕ
Результаты работы подтверждают мнение авторов [12] о том, что в структуре U2La2Se9 {248052}, упомянутой во введении, содержатся атомы Ln(III). Так, для атомов La1 и La2, которые в этом селениде проявляют КЧ = 10 и 8, установленные Rsd (соответственно 1.809 и 1.839 Å) хорошо согласуются со средним значением (1.827(31) Å) для La(III). Однако сделать однозначный вывод о степени окисления атомов урана (III или IV) в U2La2Se9 без надежных справочных данных, подобных указанным в табл. 2, S1 для атомов Ln, невозможно. В то же время полученные нами результаты не противоречат заключению авторов [12], что в структуре U2La2Se9 средний заряд на атомах Se3–Se5, образующих бесконечные цепи, имеет нестандартное значение –1.33.
Показано, что для атомов селена с нулевой степенью окисления (Se0) среднее k = 2 (тригональный Se или полиморфы Se8). Для атомов Se– в среднем k = 1 (например, дианионы ${\text{Se}}_{2}^{{2--}}$), тогда как для атомов Se2–, не способных к образованию связей Se–Se, k = 0. Поскольку в U2La2Se9 для атомов Se3–Se5 соответственно k = 0.96, 0.75 и 0.75 (в среднем 0.82), можно считать, что их формальный заряд (χ) находится в диапазоне –1 < χ < < –2. Принимая, что в указанном интервале χ понижается симбатно k, в общем случае получим χ = k – 2, соответственно средний заряд для атомов Se3–Se5 в структуре U2La2Se9 составляет ‒1.18, а общий равен ∼–3.55. На наш взгляд, этот факт, указывающий на то, что в U2La2Se9, скорее всего, присутствуют атомы U(IV), а не U(III), согласуется с данными [12]. Можно ожидать, что более надежные доказательства указанного утверждения удастся получить с помощью характеристик ПВД при анализе стереохимии актинидов (An) в соединениях, содержащих комплексы AnSen, который мы планируем провести в ближайшее время.
Список литературы
Inorganic crystal structure database. Gmelin-institut fur Anorganische Chemie & FIC. Karlsruhe, 2018.
Cambridge structural database system. Cambridge Crystallographic Data Centre, 2018.
Doert T., Müller C.J. // Elsevier Reference Module in Chemistry, Molecular Sciences and Chemical Engineering. Waltham. MA: Elsevier, 2016. https://doi.org/10.1016/B978-0-12-409547-2.11552-5
Doert T., Graf C., Vasilyeva I.G., Schnelle W. // Inorg. Chem. 2012. V. 51. № 1. P. 282. https://doi.org/10.1021/ic201639f
Böttcher P., Doert T., Arnold H., Tamazyan R. // Z. Kristallogr. 2000. V. 215. № 4. P. 246. https://doi.org/10.1524/zkri.2000.215.4.246
Yin W., Shi Y., Kang B. et al. // J. Solid State Chem. 2014. V. 213. P. 87. https://doi.org/10.1016/j.jssc.2014.01.033
Yin W., Feng K., Wang W. et al. // Inorg. Chem. 2012. V. 51. № 12. P. 6860. https://doi.org/10.1021/ic300604a
Zelenina L.N., Chusova T.P., Podberezskaya N.V. et al. // Struct. Chem. 2015. V. 56. № 4. Р. 673. [Зеленина Л.Н., Чусова Т.П., Подберезская Н.В. и др. // Журн. структур. химии. 2015. Т. 56. № 4. С. 721. https://doi.org/10.15372/JSC20150410]https://doi.org/10.1134/S0022476615040101
Вайнштейн Б.К., Фридкин В.М., Инденбом В.Л. // Современная кристаллография (в 4-х томах). Т. 2. Структура кристаллов. М.: Наука, 1979. С. 83.
Уэллс А. Структурная неорганическая химия. В 3-х т. М.: Мир, 1987–1988. [Wells A.F. Structural Inorganic Chemistry. 5th ed., Oxford University Press. N.Y.: Clarendon Press, 1984.]
Пирсон У. Кристаллохимия и физика металлов и сплавов. Часть 1. М.: Мир, 1977. 429 с. [Pearson W.B. The crystal chemistry and physics of metals and alloys. Wiley: Interscience, 1972.]
Bugaris D.E., Copping R., Tyliszczak T. et al. // Inorg. Chem. 2010. V. 49. № 5. P. 2568. https://doi.org/10.1021/ic902503n
Vologzhanina A.V., Pushkin D.V., Serezhkin V.N. // Acta Crystallogr. 2006. V. 62B. № 5. P. 754. https://doi.org/10.1107/S0108768106018726
Vologzhanina A.V., Pushkin D.V., Serezhkin V.N. // Russ. J. Inorg. Chem. 2006. V. 51. № 5. С. 747. [Вологжанина А.В., Пушкин Д.В., Сережкин В.Н. // Журн. неорган. химии. 2006. Т. 51. № 5. С. 813.]https://doi.org/10.1134/S0036023606050123
Serezhkin V.N., Albakajaji M., Serezhkina L.B. // Russ. J. Phys. Chem. A. 2019. V. 93. № 2. P. 288. [Сережкин В.Н., Албакаджажи М., Сережкина Л.Б. // Журн. физ. химии. 2019. Т. 93. № 2. С. 244. https://doi.org/10.1134/S0036024419020250]
Serezhkin V.N., Mikhailov Yu.N., Buslaev Yu.A. // Russ. J. Inorg. Chem. 1997. V. 42. № 12. P. 1871. [Cережкин В.Н., Михайлов Ю.Н., Буслаев Ю.А. // Журн. неорган. химии. 1997. Т. 42. № 12. С. 203.]
Serezhkin V.N. // Structural Chemistry of Inorganic Actinide Compounds / Eds. Krivovichev S.V. et al. Amsterdam: Elsevier, 2007. P. 31. https://doi.org/10.1016/B978-0-444-52111-8.X5000-5
Serezhkin V.N., Medvedkov Ya.A., Serezhkina L.B., Pushkin D.V. // Russ. J. Phys. Chem. A. 2015. V. 89. № 6. С. 1018. [Сережкин В.Н., Медведков Я.А., Сережкина Л.Б., Пушкин Д.В. // Журн. физ. химии. 2015. Т. 89. № 6. С. 978.]https://doi.org/10.1134/S0036024415060254
Dashjav E., Oeckler O., Doert T. et al. // Angew. Chem. 2000. V. 39. № 11. P. 1987. https://doi.org/10.1002/1521-3773(20000602)39:11<1987::AID-ANIE1987>3.0.CO;2-4
Dashjav E., Doert T., Böttcher P. et al. // Z. Kristallogr. New Cryst. Struct. 2000. V. 215. № 3. P. 337. https://doi.org/10.1515/ncrs-2000-0315
Aitken J.A., Cowen J.A., Kanatzidis M.G. // Chem. Mater. 1998. V. 10. № 12. P. 3928. https://doi.org/10.1021/cm980364e
Haase D.J., Steinfink H., Weiss E.J. // Inorg. Chem. 1965. V. 4. № 4. P. 538. https://doi.org/10.1021/ic50026a020
Benazeth S., Carre D., Laruelle P. // Acta Crystallogr. 1982. V. 38. № 1. P. 37. https://doi.org/10.1107/S056774088200199X
Wang R., Steinfink H. // Inorg. Chem. 1967. V. 6. № 9. P. 1685. https://doi.org/10.1021/ic50055a017
Evenson IV.C.R., Dorhout P.K. // Z. Anorg. Allg. Chem. 2001. V. 627. № 9. P. 2178. https://doi.org/10.1002/1521-3749(200109)627:9<2178::AID-ZAAC2178>3.0.CO;2-S
Forbes S., Tseng Y-C., Mozharivskyj Y. // Inorg. Chem. 2015. V. 54. № 3. P. 815. https://doi.org/10.1021/ic501808y
Geng B., Crerar S.J., Mar A., Albrecht Schmitt T.E. // J. Solid State Chem. 2006. V. 179. № 5. P. 1596. https://doi.org/10.1016/j.jssc.2006.02.017
Sutorik A.C., Kanatzidis M.G. // Angew. Chem. Int. Ed. 1992. V. 31. № 12. P. 1594. https://doi.org/10.1002/anie.199215941
Wu Y.D., Bensch W. // Inorg. Chem. 2009. V. 48. № 7. P. 2729. https://doi.org/10.1021/ic802368j
Evenson IV.C.R., Dorhout P.K. // Inorg. Chem. 2001. V. 40. № 10. P. 2409. https://doi.org/10.1021/ic001248s
Assoud A., Kleinke H. // Solid State Sci. 2010. V. 12. № 5. P. 919. https://doi.org/10.1016/j.solidstatesciences.2010.01.031
Rogers E., Dorenbos P., Van der Kolk E. // New J. Phys. 2011. V. 13. P. 093038. https://doi.org/10.1088/1367-2630/13/9/093038
Antonov V.N., Harmon B.N., Yaresko A.N. // Physica B. 2002. V. 312. P. 373. https://doi.org/10.1016/S0921-4526(01)01308-4
Cherin P., Unger P. // Acta Crystallogr. 1972. V. 28B. № 1. P. 313. https://doi.org/10.1107/S0567740872002249
Marsh R.E., Pauling L., McCullough J.D. // Acta Crystallogr. 1953. V. 6. № 1. P. 71. https://doi.org/10.1107/S0365110X53000168
Foss O., Janickis V. // Dalton Trans. 1980. № 4. P. 624. https://doi.org/10.1039/DT9800000624
Cernosek Z., Růzicka A., Holubová J., Cernosková E. // Main Group Met. Chem. 2007. V. 30. № 5. P. 231. https://doi.org/10.1515/MGMC.2007.30.5.231
Cherin P., Unger P. // Inorg. Chem. 1967. V. 6. № 8. P. 1589. https://doi.org/10.1021/ic50054a037
Webb A.W., Hall H.T. // Inorg. Chem. 1970. V. 9. № 4. P. 843. https://doi.org/10.1021/ic50086a031
Tremel W., Hoffmann R. // J. Am. Chem. Soc. 1987. V. 109. № 1. P. 124. https://doi.org/10.1021/ja00235a021
Malliakas C.D., Iavarone M., Fedor J., Kanatzidis M.G. // J. Am. Chem. Soc. 2008. V. 130. № 11. P. 3310. https://doi.org/10.1021/ja7111405
Grupe M., Urland W. // J. Less-Common Met. 1991. V. 170. № 2. P. 271. https://doi.org/10.1016/0022-5088(91)90328-2
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. Ч. 3. М.: Мир, 1969. С. 592. [Cotton F., Wilkinson G. Advanced Inorganic Chemistry. 2nd ed. Canada. Wiley, Inc (1966)].
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии