Журнал неорганической химии, 2019, T. 64, № 9, стр. 980-983
Теплоемкость и термодинамические функции германатов DyInGe2O7 и HoInGe2O7 в области 350–1000 K
Л. Т. Денисова 1, *, Л. А. Иртюго 1, Ю. Ф. Каргин 2, В. В. Белецкий 1, Н. В. Белоусова 1, В. М. Денисов 1
1 Сибирский федеральный университет, Институт цветных металлов и материаловедения
660041 Красноярск, Свободный пр-т, 79, Россия
2 Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 25.01.2019
После доработки 13.02.2019
Принята к публикации 15.03.2019
Аннотация
Многоступенчатым обжигом стехиометрических смесей исходных оксидов (метод твердофазных реакций) на воздухе в интервале температур 1273–1473 K синтезированы соединения DyInGe2O7 и HoInGe2O7. Методом дифференциальной сканирующей калориметрии измерена высокотемпературная теплоемкость поликристаллических образцов германатов диспрозия-индия и гольмия-индия. На основании экспериментальных данных Cp = f(T) рассчитаны термодинамические свойства исследованных оксидных соединений.
ВВЕДЕНИЕ
Оксидные соединения на основе германия длительное время привлекают внимание как практиков, так и исследователей. В первую очередь это относится к германатам редкоземельных элементов (РЗЭ) [1–12]. Германаты A2Ge2O7 и ABGe2O7 (A и B – редкоземельные и трехвалентные элементы, переходные металлы) могут быть идентифицированы в двух типах кристаллической структуры: тортвейтитоподобной и тортвейтитовой [13]. Например, соединения DyInGe2O7 и HoInGe2O7 имеют тортвейтитоподобную структуру (пр. гр. C2/c) [13]. Германаты Dy2Ge2O7 и Ho2Ge2O7 кристаллизуются в тетрагональной сингонии (пр. гр. P41212) [1, 14–17], а In2Ge2O7 имеет структуру тортвейтита с симметрией, описываемой пр. гр. C2/m [18]. Несмотря на большой интерес к германатам РЗЭ, многие их свойства, в частности термохимические, не изучены. Диаграммы состояния систем Dy2Ge2O7–In2Ge2O7 и Ho2Ge2O7–In2Ge2O7 не построены. В то же время для оптимизации условий синтеза и уточнения фазовых равновесий методами термодинамики необходимы сведения об их термодинамических свойствах, поэтому представляется целесообразным исследовать термодинамические свойства оксидных соединений DyInGe2O7 и HoInGe2O7.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез германатов DyInGe2O7 и HoInGe2O7 проводили методом твердофазных реакций с использованием в качестве исходных компонентов Dy2O3 и Ho2O3 (х. ч.), In2O3 (ос. ч.) и GeO2 (99.999%, ФГУП “Германий”). Стехиометрические смеси предварительно прокаленных при 1173 K исходных оксидов перетирали в агатовой ступке и прессовали в таблетки. Их последовательно обжигали на воздухе при температурах 1273 (40 ч), 1373 (100 ч) и 1473 K (60 ч). Достаточно высокие температуры твердофазного синтеза могут привести к частичному испарению GeO2 [14, 19], поэтому синтез проводили в закрытых тиглях из оксида бериллия, количество добавляемого сверх стехиометрии GeO2 и временной интервал подбирали экспериментально. Контроль фазового состава полученных образцов осуществляли методом рентгенофазового анализа (дифрактометр X'Pert Pro MPD PANalytical, Нидерланды, CuKα-излучение). Дифрактограммы регистрировали с помощью высокоскоростного детектора PIXcel. Параметры решеток синтезированных германатов определяли полнопрофильным уточнением методом минимизации производной разности [20].
Измерения теплоемкости DyInGe2O7 и HoInGe2O7 проводили на приборе STA 449 C Jupiter (Netzsch, Германия). Методика экспериментов подобна описанной в [21–23]. Полученные результаты обрабатывали с помощью пакета аналитических программ Netzsch Proteus Thermal Analysis и лицензионного программного инструмента Systat Sigma Plot 12 (“Systat Software Inc”, США). Ошибка экспериментов не превышала 2%, что характерно для дифференциальных сканирующих калориметров, работающих в области высоких температур.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
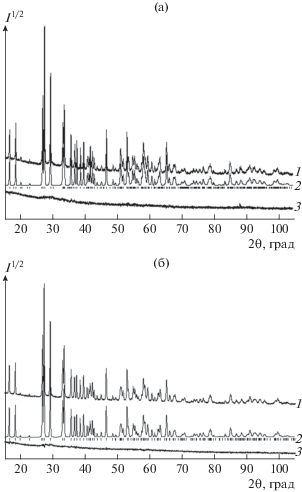
Дифрактограммы полученных германатов диспрозия-индия и гольмия-индия приведены на рис. 1. По нашим данным, параметры элементарных ячеек DyInGe2O7 и HoInGe2O7 (пр. гр. С2/с) соответственно равны: a = 6.8446(2), b = = 8.8625(2), c = 9.8112(2) Å, β = 101.579(1)°, V = = 583.04(3) Å3 и a = 6.8371(2), b = 8.8819(2), c = 9.8218(1) Å, β = 101.724(1)°, V = 584.00(1) Å3. Эти данные удовлетворительно согласуются с результатами [13]. Согласно [13], соединения ABGe2O7 могут кристаллизоваться в четырех разных пространственных группах в зависимости от соотношения ионных радиусов rB/rA. Для rB/rA > 0.80 характерна пр. гр. C2/c, что и реализуется для DyInGe2O7 и HoInGe2O7. Подобная пространственная группа наблюдается и для TbInGe2O7 [13]. Сопоставление ионных радиусов РЗЭ в соединениях с тортвейтитоподобными структурами (TbInGe2O7, DyInGe2O7 и HoInGe2O7) с параметрами элементарной ячейки показывает, что с уменьшением r от 0.923 (Tb3+) до 0.901 Å (Ho3+) параметр a уменьшается от 6.9918 до 6.8371 Å, а с увеличивается от 9.7892 Å до 9.8218 Å. Закономерные изменения в ряду Tb–Dy–Ho наблюдаются для V – от 586.25 до 584.00 Å3 и β – от 101.401° до 101.724°. Параметр b при этом остается практически постоянным в пределах 8.87 ± 0.01 Å. Данные о структуре TbInGe2O7 взяты из работы [13].
Рис. 1.
Рентгенограммы DyInGe2O7 (а) и HoInGe2O7 (б) при комнатной температуре, профили рентгенограмм: 1 – экспериментальный, 2 – расчетный, 3 – разностный; штрихи указывают расчетное положение рефлексов.
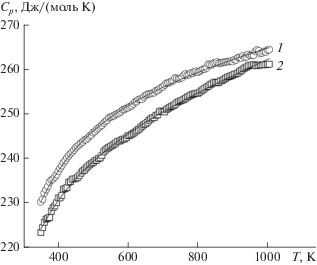
На рис. 2 показаны температурные зависимости теплоемкости DyInGe2O7 и HoInGe2O7, из которых видно, что с ростом температуры значения теплоемкости закономерно увеличиваются, а на зависимостях Cp = f(T) нет экстремумов. По-видимому, это свидетельствует об отсутствии полиморфных превращений в исследованном интервале температур и позволяет описать полученные данные по влиянию температуры на теплоемкость классическим уравнением Майера–Келли [24, 25]:
которое для DyInGe2O7 и HoInGe2O7 имеет соответственно следующий вид:(2)
$\begin{gathered} {{C}_{p}} = (249.44 \pm 0.40) + (18.20 \pm 0.40) \times \\ \times \,\,{{10}^{{--3}}}T--(31.22 \pm 0.42) \times {{10}^{5}}{{T}^{{--2}}}, \\ \end{gathered} $(3)
$\begin{gathered} {{C}_{p}} = (234.30 \pm 0.50) + (30.44 \pm 0.51) \times \\ \times \,\,{{10}^{{--3}}}T--(25.37 \pm 0.48) \times {{10}^{5}}{{T}^{{--2}}}. \\ \end{gathered} $Коэффициенты корреляции для уравнений (2) и (3) равны 0.9993 и 0.9992, а максимальные отклонения от сглаживающих кривых – 0.36 и 0.41%.
На основании уравнений (2) и (3) по известным термодинамическим соотношениям рассчитаны термодинамические функции исследованных германатов (изменения энтальпии и энтропии, приведенной энергии Гиббса) [25]. Результаты приведены в табл. 1 и 2. Из представленных данных следует, что для DyInGe2O7 и HoInGe2O7 при всех исследованных температурах значения Cp не превышают предел Дюлонга–Пти 3Rs, где R – универсальная газовая постоянная, s – число атомов в формульной единице соединения.
Таблица 1.
Термодинамические свойства DyInGe2O7
| T, K | Cp, Дж/(моль K) |
H°(T) – H°(350 K), кДж/моль |
S°(T) – S°(350 K), Дж/(моль K) |
Ф°(Т) – Ф°(350 K), Дж/(моль K) |
|---|---|---|---|---|
| 350 400 450 500 550 600 650 700 750 800 850 900 950 1000 |
230.4 237.3 242.3 246.2 249.2 251.8 254.0 256.0 257.7 259.3 260.8 262.1 263.5 264.7 |
–
11.70
23.70
35.91
48.30
60.83
73.48
86.23
99.07 112.0 125.0 138.1 151.2 164.4 |
–
31.24
59.50
85.23 108.8 130.6 150.9 169.8 187.5 204.2 220.0 234.9 249.1 262.7 |
–
1.99
6.83 13.40 21.02 29.26 37.85 46.60 55.41 64.19 72.90 81.49 89.94 98.24 |
Таблица 2.
Термодинамические свойства HoInGe2O7
| T, K | Cp, Дж/(моль K) |
H°(T) – H°(350 K), кДж/моль |
S°(T) – S°(350 K), Дж/(моль K) |
Ф°(Т) – Ф°(350 K), Дж/(моль K) |
|---|---|---|---|---|
| 350 400 450 500 550 600 650 700 750 800 850 900 950 1000 |
224.2 230.6 235.5 239.4 242.6 245.5 248.0 250.4 252.6 254.7 256.6 258.2 260.4 262.2 |
–
11.38
23.03
34.91
46.96
59.16
71.50
83.97
96.54 109.2 122.0 134.9 147.6 160.9 |
–
30.38
57.83
82.85 105.8 127.0 146.8 165.3 182.6 199.0 214.5 229.2 243.2 256.6 |
–
1.93
6.64 13.03 20.43 28.45 36.80 45.32 53.91 62.47 70.96 79.35 87.60 95.73 |
ЗАКЛЮЧЕНИЕ
Методом дифференциальной сканирующей калориметрии экспериментально измерена зависимость молярной теплоемкости от температуры поликристаллических образцов германатов DyInGe2O7 и HoInGe2O7 в интервале 350–1000 K. Полученные зависимости могут быть описаны классическим уравнением Майера–Келли. На основании полученных экспериментальных зависимостей Cp = f(T) рассчитаны термодинамические свойства (изменения энтальпии и энтропии, приведенная энергия Гиббса) германатов диспрозия-индия и гольмия-индия.
Список литературы
Демьянец Л.Н., Лобачев А.Н., Емельченко Г.А. Германаты редкоземельных элементов. М.: Наука, 1980. 152 с.
Juarez-Arellano E.A., Bucio L., Hernandez J.A. et al. // J. Solid State Chem. 2003. V. 170. P. 418. https://doi.org/10.1016/S0022-4596(02)00134-2
Juarez-Arellano E.A., Bucio L., Ruvalcaba J.L. et al. // Z. Kristallogr. 2002. V. 217. P. 201.
Juarez-Arellano E.A., Rosales I., Oliver A. et al. // Acta Crystallogr. 2004. V. C60. P. i14. https://doi.org/10.1107/S0108270103029056
Chang Y.-S., Lin H.-J., Chai Y.-L. et al. // J. Alloys Compd. 2008. V. 460. P. 421. https://doi.org/10.1016/jjallcom.2007.05.060
Портной К.И., Тимофеева Н.И. Кислородные соединения редкоземельных элементов. М.: Металлургия, 1986. 480 с.
Бондарь И.А., Виноградова В.Н., Демьянец Л.Н. и др. Соединения редкоземельных элементов. Силикаты, германаты, фосфаты, арсенаты, ванадаты. М.: Наука, 1983. 288 с.
Morosan E., Fleitman J.A., Huang Q. et al. // Phys. Rev. B. 2008. V. 77. P. 224423-1. https://doi.org/10.1103/PhysRevB.77.224423
Торопов Н.А., Бондарь И.А., Лазарев А.Н. и др. Силикаты редкоземельных элементов и их аналоги. Л.: Наука, 1971. 230 с.
Ke X., Dahlberg M.L., Morosan E. et al. // Phys. Rev. B. 2008. V. 78. P. 104411-1. https://doi.org/10.1103/PhysRevB78.104411
Subramanian M.A., Sleight A.W. // Handbook Phys Chem. Rare Earth. 1993. V. 16. P. 225.
Leskelä M., Ninistö L. // Handbook Phys Chem. Rare Earth. 1986. V. 8. P. 203.
Juarez-Arellano E.A., Campa-Molina J., Ulloa-Godinez S. et al. // Mater. Res. Soc. Symp. Proc. 2005. V. 848. P. FF6.15.1.
Becker U.W., Felsche J. // J. Less-Comm. Met. 1987. V. 128. P. 269.
Moran D.M., Richardson F.S., Koralewski M. et al. // J. Alloys Compd. 1992. V. 180. P. 171.
Jana Y.M., Ghosh M., Wanklyn B.M. // J. Magn. Magn. Mater. 1998. V. 183. P. 135.
Johnson A.W.S., Preston A.R. // Ultramicroscopy. 1994. V. 55. P. 348.
Gaewdang T., Chaminade J.P., Gravereau P. et al. // Z. Anorg. Allg. Chem. 1994. V. 620. P. 1965.
Глушкова В.Б., Давтян И.А., Келер Э.К. // Изв. АН СССР. Неорган. материалы. 1967. Т. 3. № 1. С. 119.
Solovyov L.A. // J. Appl. Crystallogr. 2004. V. 37. P. 743. https://doi.org/10.1107/S0021889804015638
Denisov V.M., Denisova L.T., Irtyugo L.A. et al. // Russ. Phys. Solid State. 2010. V. 52. № 7. P. 1362. [Денисов В.М., Денисова Л.Т., Иртюго Л.А. и др. // ФТТ. 2010. Т. 52. № 7. С. 1274.]https://doi.org/10.1134/S1063783410070073
Denisova L.T., Irtyugo L.A., Kargin Yu.F. et al. // Inorg. Mater. 2017. V. 53. № 1. P. 93. [Денисова Л.Т., Иртюго Л.А., Каргин Ю.Ф., Белецкий В.В., Денисов В.М. // Неорган. материалы. 2017. Т. 53. № 1. С. 71.]https://doi.org/10.1134/S0020168517010046
Denisova L.T., Irtyugo L.A., Belousova N.V. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. № 3. P. 598. [Денисова Л.Т., Иртюго Л.А., Белоусова Н.В. и др. // Журн. физ. химии. 2019. Т. 93. № 3. С. 476.]https://doi.org/10.1134/S003602441903004X
Maier C.G., Kelly K.K. // J. Am. Chem. Soc. 1932. V. 54. P. 3243.
Чудненко К.В. Термодинамическое моделирование в геохимии: теория, алгоритмы, программное обеспечение, приложения. Новосибирск: Гео, 2010. 287 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии