Журнал неорганической химии, 2020, T. 65, № 1, стр. 92-97
Термодинамические свойства компонентов в системе Ag–Au–Pd
a Институт геохимии им. А.П. Виноградова СО РАН
664033 Иркутск, ул. Фаворского, 1а, Россия
* E-mail: chud@igc.irk.ru
Поступила в редакцию 26.06.2019
После доработки 25.07.2019
Принята к публикации 27.08.2019
Аннотация
Отсутствие согласованных термодинамических данных, описывающих системы Au–Pd, Ag–Pd и Ag–Au–Pd, не позволяет интерпретировать свойства этих типов сплавов. Предложен подход к созданию моделей расчета тройного и бинарных твердых растворов, основанный на едином вычислительном аппарате. Обобщены данные о термодинамических свойствах сплавов Au–Pd и Ag–Pd, полученные из различных экспериментальных работ и расчетных моделей, в которых приводятся термодинамические характеристики при определенных значениях температуры. С использованием формализма Редлиха–Кистера оценены избыточные парциальные энергии Гиббса и активности компонентов тройного твердого раствора в системе Ag–Au–Pd в интервале температур 400–1300 K. Подготовлен алгоритм для создания расчетных модулей в программах моделирования природного минералообразования в системах, содержащих Au, Ag и Pd.
Физико-химическое моделирование равновесного состава сложных гетерогенных систем без учета образования твердых растворов является существенным упрощением реальных процессов [1–4]. Это в полной мере может быть отнесено к изучению генезиса палладистого золота, требующего знания процессов концентрирования Au, Pd, Ag в природных условиях, которые до сих пор остаются дискуссионными. Использование в моделях этих трех элементов как чистых компонентов не позволяет учесть присутствие серебра и палладия в составе самородного золота. Отсутствие термодинамических данных, описывающих системы Au–Pd, Ag–Pd и Ag–Au–Pd, препятствует интерпретации свойств этих типов сплавов [5].
Попытки оценить термодинамические константы в системе Ag–Au–Pd предпринимались в различных экспериментальных работах и расчетных моделях, в которых приводятся термодинамические характеристики при определенных температурах [6–18]. В целом формирование твердых растворов в системе Ag–Au–Pd требует более детального изучения [5].
Цель настоящей работы – уточнение термодинамических констант сплавов Au–Pd, Ag–Pd, Ag–Au–Pd, подготовка алгоритма для создания расчетных модулей в программах моделирования природного минералообразования в системах, содержащих Au, Ag и Pd.
Тройная система Ag–Au–Pd состоит из трех бинарных систем: Ag–Pd, Au–Pd и Ag–Au. Равновесными фазами этих систем являются жидкость, ГЦК-твердый раствор и пар [11, 19, 20]. В системах Ag–Pd и Ag–Au температура ликвидуса плавно понижается от точки плавления палладия (1825 K) и, соответственно, золота (1336 K) до точки плавления серебра (1234 K) [16]. Упорядоченных фаз в этих системах в низкотемпературной области не обнаружено. Для системы Au–Pd [19, 20] подтверждено, что упорядочение происходит в поле фазы твердого раствора в диапазоне двух стехиометрических составов: Au3Pd и AuPd3. Упорядоченная структура AuPd также может существовать при низких температурах (ниже ~ 373 K) [9]. Теоретический расчет предсказывает существование длиннопериодных суперструктур вблизи состава Au70Pd30 и основного состояния Au4Pd2 [21].
(Pd, Au, Ag) представляет собой фазу тройного твердого раствора, в которой Ag, Au и Pd полностью растворимы друг в друге как в расплавленном, так и в твердом состоянии [22]. Тройная система Ag–Au–Pd показывает только двухфазное равновесие – L + (Pd, Au, Ag), но влияние добавок Ag к упорядоченным соединениям Au3Pd и AuPd3 не изучено. Температурная зависимость параметров решетки для этих тройных сплавов является линейной функцией температуры до пределов измерений с небольшим отрицательным отклонением от закона Вегарда. Хотя упорядочение в системе Au–Pd происходит в диапазоне стехиометрических составов Au3Pd и AuPd3, не обнаружено никаких признаков образования сверхрешетки в тройных сплавах, медленно остывающих при температуре 1073 K.
ОПИСАНИЕ МОДЕЛИ
Для оценки термодинамических свойств тройной системы Au–Ag–Pd нами использован подход, основанный на формализме Редлиха–Кистера [23], который по существу идентичен широко известному численному методу Муггиана в расчете термодинамики сплавов [24]. Ранее он был использован нами при изучении твердых растворов Au–Ag–Hg и Au–Ag–Cu [25–27]. В исследуемой тройной системе Au–Ag–Pd существуют три бинарных твердых раствора: Ag1 –xPdx, Au1 –xPdx и Au1 –x–Agх (0 ≤ x ≤ 1) и один тройной твердый раствор Aux1Agx2Pd x3 (x1 = 1 – x2 – x3, 0 ≤ x2 ≤ 1, 0 ≤ x3 ≤ 1, где x1, x2 и x3 – атомные доли металлов соответственно).
Избыточную энергию смешения Гиббса бинарного твердого раствора определяли с использованием формализма Редлиха–Кистера [23]:
(1)
${{G}^{{{\text{ex}}}}} = \sum\limits_i {\sum\limits_{j > i} {{{x}_{i}}{{x}_{j}}\sum\limits_{k = 0}^m {{}^{k}{{L}_{{ij}}}{{{({{x}_{i}} - {{x}_{j}})}}^{k}}} } } ,$Избыточные парциальные энергии Гиббса рассчитывали по уравнениям [24] для бинарных твердых растворов:
для тройных твердых растворов:
(5)
$G_{1}^{{ex}} = {{x}_{2}}({{x}_{2}} + {{x}_{3}}){{L}_{{12}}}--{{x}_{2}}{{x}_{3}}{{L}_{{23}}} + {{x}_{3}}({{x}_{3}} + {{x}_{2}}){{L}_{{31}}},$(6)
$G_{2}^{{ex}} = {{x}_{1}}({{x}_{1}} + {{x}_{3}}){{L}_{{12}}} + {{x}_{3}}({{x}_{3}} + {{x}_{1}}){{L}_{{23}}}--{{x}_{3}}{{x}_{1}}{{L}_{{31}}},$(7)
$G_{3}^{{ex}} = - {{x}_{1}}{{x}_{2}}{{L}_{{12}}} + {{x}_{2}}({{x}_{2}} + {{x}_{1}}){{L}_{{23}}} + {{x}_{1}}({{x}_{1}} + {{x}_{2}}){{L}_{{31}}}.$Активности компонентов твердых растворов оценивали на основе избыточных парциальных энергий Гиббса:
i = 1, 2 (бинарный твердый раствор) или i = 1–3 (тройной твердый раствор).ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Система Au–Pd
Оценка стандартных термодинамических функций жидких и твердых фаз в системе Au–Pd выполнена в [17]. Там же приведены параметры уравнений Редлиха–Кистера для ГЦК-бинарного твердого раствора (Дж/моль):
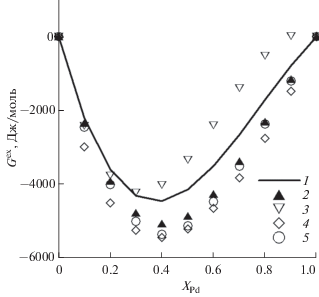
Оценка избыточной энергии Гиббса твердого раствора Au–Pd по данным различных авторов приведена на рис. 1. Расчетные значения Gex для 1300 K по принятому уравнению занимают промежуточное положение между данными [9] и [28].
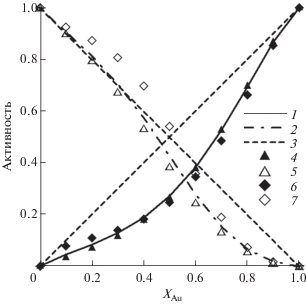
Сопоставление рассчитанных активностей Au и Pd с экспериментальными данными [9, 28] (рис. 2) показывает, что активности золота, по результатам экспериментальных работ, достаточно близки друг к другу при 1300 K и хорошо описываются предлагаемым уравнением. Отклонения от закона Рауля имеют максимальные значения при 0.4 < xAu < 0.7, плавно снижаясь при уменьшении и возрастании xAu за пределами этого интервала.
Активности палладия, по данным [9] и [28], имеют выраженные различия при xAu < 0.7. При этом близость к закону Рауля наблюдается при 0.4 < xAu < 0.6 в данных [9] и при xAu < 0.4 в данных [28]. Предложенное уравнение в целом достаточно хорошо согласуется с данными [28].
Система Ag–Pd
Параметры уравнений Редлиха–Кистера для твердого раствора Ag–Pd в температурном интервале 1000–1200 K были предложены в работе [15] (Дж/моль):
Представление новых экспериментальных данных для T = 450–700 K [16] позволило нам скорректировать полученные зависимости. Расчетные значения параметров уравнений Редлиха–Кистера, по данным [11] и [16] для твердого раствора Ag–Pd (Дж/моль):
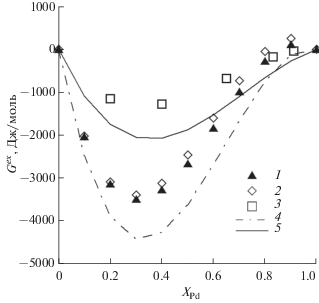
Значения избыточной энергии Гиббса твердого раствора Ag–Pd [11, 15] при 1200 K достаточно хорошо сопоставимы для всех составов твердого раствора, а значения Gex[16] при 600 K имеют существенные отклонения, особенно в интервале 0.2–0.6 XPd (рис. 3). Предложенное нами уравнение, в отличие от экстраполяции уравнения из работы [15] для 600 K, позволяет получить зависимость, более близкую к эксперименту [16].
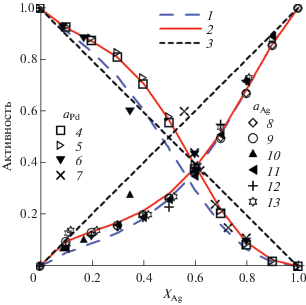
Расчет активностей Ag и Pd, выполненный для 600 и 1200 K, показал достаточно универсальные возможности предложенного уравнения в заданном температурном интервале (рис. 4). Величины активностей при 1200 K, по результатам экспериментов различных авторов, и значения [16] при 600 K мало отличаются, за исключением точки XAg = 0.35, в которой, согласно [16], активность близка к значению, отвечающему закону Рауля. В то же время эта точка отклоняется и от аппроксимирующих кривых активностей, полученных в работе [16].
Отличия активности серебра в твердом растворе Ag–Pd от закона Рауля имеют ту же тенденцию, что и для золота в твердом растворе Au–Pd. Отклонение активности палладия от закона Рауля изменяется от положительного до отрицательного при разных количествах XAg в зависимости от температуры, при этом для 600 K прослеживается приближение активности палладия к закону Рауля при xAg < 0.4.
Система Ag–Au
Обзор экспериментальных и термодинамических данных в бинарной системе Ag–Au приведен в [10]. Золото и серебро образуют непрерывный твердый раствор Au1 –хAgх (х ≤ 1). Мы использовали уравнения расчета термодинамических свойств золотосеребряного твердого раствора [30], отказавшись от предложенных позднее в работе [31], так как они не были подтверждены независимыми экспериментами.
Параметры уравнений Редлиха–Кистера [25], (Дж/моль):
Система Ag–Au–Pd
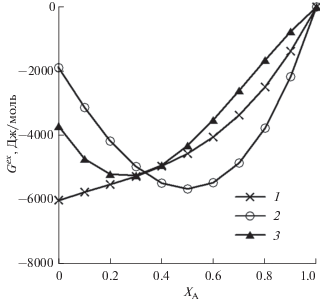
Изменение избыточной энергии Гиббса твердого раствора Ag–Au–Pd при возрастании в сплаве количества xA вдоль линии xB = xC, где A, B, C = = {Ag, Au, Pd}, показано на рис. 5. Если при A = = {Au, Pd} получена параболическая зависимость, подобная той, что определена для бинарных систем Au–Pd и Ag–Pd (рис. 1, 3), то изменение Gex твердого раствора Ag–Au–Pd при увеличении xAg имеет выраженный возрастающий характер. Полученная зависимость Gex = f(xAg) подтверждается данными интегральной избыточной энергии Гиббса реакции (∆rG) в твердотельной гальванической ячейке ЭДС-метода [18].
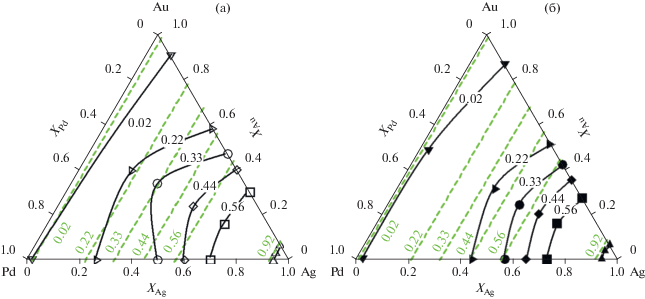
Рис. 5.
Gexтройного твердого раствора Ag–Au–Pd при 650 K. 1 – xA = xAg вдоль линии xAu = xPd; 2 – xA = xAu вдоль линии xAg = xPd; 3 – xA = xPd вдоль линии xAu = = xAg.
Сопоставление расчетной активности Ag в твердом растворе Ag–Au–Pd при 650 K с данными [18] показало отличия в интервале 0 < xAu < 0.7. В работе [18] приведен график линий изоактивности Ag (рис. 6a), на котором показано, что активности Ag в интервале 0 < xAu < 0.328 близки к величинам, полученным в расчете по закону Рауля. Полученная зависимость обоснована активностями в системе Ag–Pd [16], однако, как показано выше, приведенная в этой работе точка XAg = 0.35 находится в противоречии с аппроксимирующей кривой, предложенной в этой же работе. Кроме того, на рисунке [18] отсутствуют активности Ag для значений XAg, близких к нулю. Отсюда возникает вопрос, насколько предложенные зависимости действительны при малых количествах Ag в твердом растворе.
Приведенные значения активностей в бинарных системах Au–Pd и Ag–Pd (рис. 2, 4) свидетельствуют о том, что активности Au и Ag начинают отличаться от закона Рауля при значениях XAu > 0.2 и XAg > 0.2 соответственно. С учетом этих закономерностей полученные нами величины активностей Ag (рис. 6б) имеют более выраженные отрицательные отклонения от закона Рауля для 0.2 < aAu < 0.8, что свидетельствует о более сильных взаимодействиях Au и Pd в пределах этого состава, и только при xAu < 0.1 и xAu > 0.9 эти величины близки друг к другу. Также полученные нами активности Ag в тройном твердом растворе Ag–Au–Pd меньше отличаются от активностей Ag в бинарных системах Ag–Au и Ag–Pd, чем в работе [18].
ЗАКЛЮЧЕНИЕ
Большинство экспериментальных работ с расчетом термодинамических свойств твердых растворов в системе Ag–Au–Pd проводилось при температурах 1200–1300 K. Появление первых сведений для систем Ag–Pd и Ag–Au–Pd, полученных с помощью метода ЭДС в твердотельных гальванических ячейках в температурном интервале от 475 до 675 K [16, 18], позволяет получить более обоснованные оценки термодинамических параметров в области температур 400–800 K. В то же время надежные экспериментальные работы для систем Au–Ag и Au–Pd в этом температурном интервале до сих пор не известны.
Нами предпринята попытка оценить избыточную энергию Гиббса и активности компонентов в системе Ag–Au–Pd с привлечением всей доступной в настоящее время информации. Предложенный подход основан на едином вычислительном аппарате, что позволяет создавать согласованные модели расчета тройного и бинарных твердых растворов. Достоверность предложенных зависимостей гарантируется их хорошим соответствием экспериментальным данным. В дальнейшем расчетные уравнения могут быть использованы для построения термодинамических моделей природного рудообразования.
Список литературы
Авченко О.В., Чудненко К.В., Вах А.С. Анализ минеральных парагенезисов методом минимизации потенциала Гиббса. М.: Геос, 2018. 254 с.
Bychinskii V.A., Fomichev S.V., Chudnenko K.V., Krenev V.A. // Russ. J. Inorg. Chem. 2012. V. 57. № 6. P. 854. https://doi.org/10.1134/S0036023612060083
Krenev V.A., Fomichev S.V., Pechenkina E.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 11. P. 1505. https://doi.org/10.1134/S0036023618110104
Krenev V.A., Pechenkina E.N., Fomichev S.V. // Russ. J. Inorg. Chem. 2019. V. 64. № 5. P. 645. https://doi.org/10.1134/S0036023619050127
Chapman R.J., Leake R.C., Bond D.P.G. et al. // Econ. Geol. 2009. V. 104. P. 563. https://doi.org/10.2113/gsecongeo.104.4.563
Pratt J.N. // Trans. Faraday Soc. 1960. V. 56. P. 975.
Myles K.M. // Acta Metall. 1965. V. 13. P. 109.
Eremenko V.N., Lukashenko G.M., Pritula V.L. // Russ. J. Phys. Chem. 1968. V. 42. P. 346.
Okamoto H., Massalski T.B. // Bull. Alloy Phase Diagr. 1985. V. 6. P. 229.
Okamoto H., Massalski T.B. // Bull. Alloy Phase Diagr. 1983. V. 4. P. 30.
Karakaya I., Thompson W.T. // Bull. Alloy Phase Diagr. 1988. V. 9. P. 237.
Hohn R., Herzig C. // Z. Metallkd. 1986. V. 77. P. 291.
Tanaka T., Gokcen N.A., Hari Kumar K.C. et al. // Z. Metallkd. 1996. V. 87. P. 779.
Raychaudhuri P.K. Mass spectrometric and galvanic cell studies of the thermodynamic properties of solid silver–palladium alloy. PhD Dissertation. Evanston, USA: Northwestern University, 1971. 236 p.
Ghosh G., Kantner C., Olson G.B. // J. Phase Equilibria. 1999. V. 20. P. 295.
Feng D., Taskinen P. // J. Mater. Sci. 2014. V. 49. P. 5790. https://doi.org/10.1007/s10853-014-8310-4
Карева М.А. Фазовые равновесия в системах Pd–Cu–Sn и Pd–Au–Sn: экспериментальное исследование и термодинамический расчет: Автореф. дис. … канд. хим. наук. М., 2016. 24 с. http://www.chem.msu.ru/rus/theses/2016/2016-06-22-kareva/abstract.pdf
Santoso I., Taskinen P. // J. Mater. Sci. 2018. V. 53. № 12. P. 9232. https://doi.org/10.1007/s10853-018-2189-4
Благородные металлы. Справ. изд. / Под ред. Савицкого Е.М. М.: Металлургия, 1984. 592 с.
Диаграммы состояния двойных металлических систем. Т. 1 / Под общ. ред. Лякишева Н.П. М.: Машиностроение, 1996. 992 с.
Sluiter M.H., Colinet C., Pasturel A. // Phys. Rev. B. 2006. V. 73. P. 174 204. https://doi.org/10.1103/PhysRevB.73.174204
Prince A., Gröbner J., Rao Manga V., Kuznetsov V. Silver–Gold–Palladium. Landolt-Börnstein, New Series IV/11B. https://doi.org/10.1007/10916070_6
Redlich O., Kister A.T. // Ind. Eng. Chem. 1948. V. 40. P. 248. https://doi.org/10.1021/ie50458a036
Hillert M. Phase Equilibria, Phase Diagrams and Phase Transformations. Cambridge: Cambridge University Press, 2008. 510 p.
Chudnenko K., Pal’yanova G. // Thermochim. Acta. 2013. V. 572. P. 65. https://doi.org/10.1016/j.tca.2013.08.024
Chudnenko K.V., Pal’yanova G.A. // Russ. Geol. Geophys. 2014. V. 55. P. 349. https://doi.org/10.1016/j.rgg.2014.01.016
Chudnenko K.V., Palyanova G.A. // Appl. Geochem. 2016. V. 66. P. 88. https://doi.org/10.1016/j.apgeochem.2015.12.005
Landolt-Börnstein – Group IV Physical Chemistry. Binary Systems. Springer-Verlag Berlin Heidelberg, 2002. V. 19B1.
Schmahl N.G. // Z. Anorg. Allg. Chem. 1951. V. 266. P. 1.
White J.L., Orr R.L., Hultgren R. // Acta Metall. 1957. V. 5. P. 747. https://doi.org/10.1016/0001-6160(57)90078-0
Осадчий Е.Г., Корепанов Я.И., Ионов К.А. // Вестн. ОНЗ РАН. 2011. Т. 3. NZ6075.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии