Журнал неорганической химии, 2020, T. 65, № 1, стр. 3-7
Синтез и исследование высокотемпературной теплоемкости EuBiGeO5
Л. Т. Денисова a, *, Ю. Ф. Каргин b, Н. А. Галиахметова a, Н. В. Белоусова a, В. М. Денисов a
a Сибирский федеральный университет, Институт цветных металлов и материаловедения
660041 Красноярск, Свободный пр-т, 79, Россия
b Институт металлургии и материаловедения им. А.А. Байкова РАН
119991 Москва, Ленинский пр-т, 49, Россия
* E-mail: antluba@mail.ru
Поступила в редакцию 05.05.2019
После доработки 06.06.2019
Принята к публикации 27.08.2019
Аннотация
Последовательным ступенчатым обжигом стехиометрических смесей исходных оксидов Eu2O3, Bi2O3 и GeO2 в интервале температур 1003–1223 K проведен твердофазный синтез EuBiGeO5. Методом дифференциальной сканирующей калориметрии измерена молярная теплоемкость поликристаллических образцов германата висмута-европия в интервале температур 350–1000 K. Установлено, что экспериментальная зависимость теплоемкости от температуры Cp = f(T) не имеет аномалий и может быть описана уравнением Майера–Келли. Рассчитаны основные термодинамические функции германата висмута-европия (изменения энтальпии, энтропии и энергии Гиббса).
ВВЕДЕНИЕ
Для германатов сложных оксидных соединений общей формулы RxBi2– xGeO5 (R – редкоземельные элементы) сведения весьма ограничены, имеются лишь данные о структуре [1–3], фотолюминесценции [2, 3] и оптических свойствах [3, 4]. Для подобных соединений при x = 2 образуются германаты R2GeO5, а при x = 0 – германат висмута Bi2GeO5. Образование соединений RxBi2 – xGeO5 происходит из стабильных соединений R2GeO5 и метастабильного соединения Bi2GeO5, которого нет на равновесной диаграмме состояния Bi2O3‒GeO2 [5, 6]. Кроме того, для оксоортогерманатов РЗЭ состава 1 : 1 наблюдаются две структурные подгруппы с пограничным элементом тербием [7, 8]. Следует отметить, что сведения о фазовых равновесиях в системах R2GeO5‒Bi2GeO5 отсутствуют. Для термодинамического моделирования синтеза различных сложных оксидных соединений необходимо наличие баз термодинамических данных, которые для соединений RxBi2 – xGeO5 практически отсутствуют. Имеются сведения только для YBiGeO5 [9], GdBiGeO5 [9, 10], SmBiGeO5 [11] и TbBiGeO5, DyBiGeO5 [12], Y0.65Pr0.35BiGeO5, Y0.65Nd0.35BiGeO5 [13].
В настоящей работе впервые исследована высокотемпературная теплоемкость EuBiGeO5 и по этим данным определены термодинамические функции оксидного соединения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
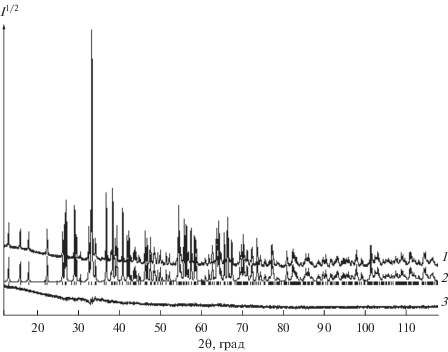
Германат EuBiGeO5 получали методом твердофазного синтеза. Исходные компоненты – оксиды Eu2O3 (х. ч.), GeO2 (99.999%, ФГУП “Германий”) и Bi2O3 (ос. ч. 13-3) – предварительно прокаливали на воздухе при 1173 и 873 K соответственно. Стехиометрические смеси компонентов механически гомогенизировали в агатовой ступке, прессовали в таблетки и обжигали на воздухе последовательно при температурах 1003, 1073, 1173 K (длительность изотермической выдержки при каждой температуре 50 ч) и 1223 K (длительность 100 ч). Отличие условий синтеза EuBiGeO5 от таковых [1‒3] для других соединений RxBi2– xGeO5 заключалось в обжиге при температуре 1003 K (только после этого были получены однофазные образцы). При этой температуре происходит переход α-Bi2O3 → δ-Bi2O3 [6]. Известно, что скорость твердофазного взаимодействия компонентов при подобных превращениях увеличивается (эффект Хэдвала) [14]. Для достижения полноты протекания твердофазного взаимодействия реагентов через каждые 10 ч проводили перетирание образцов с последующим прессованием. Контроль состава полученных образцов осуществляли методом рентгенофазового анализа на дифрактометре X´Pert Pro MPD PANalytical (Нидерланды) в CoKα-излучении. Регистрацию проводили с помощью высокоскоростного детектора PIXcel в интервале углов 2θ = 12°–118° с шагом 0.013°. Полученные результаты показаны на рис. 1. Параметры элементарной ячейки синтезированного однофазного EuBiGeO5 (данные рентгенографического исследования свидетельствуют о том, что в синтезированном образце присутствует только основная фаза) определены путем полнопрофильного уточнения методом минимизации производной разности [15].
Рис. 1.
Рентгенограмма EuBiGeO5 при комнатной температуре: 1 – экспериментальный, 2 – расчетный, 3 – разностный профили рентгенограмм; штрихи указывают расчетные положение рефлексов.
Молярную теплоемкость EuBiGeO5 измеряли на приборе STA 449 C Jupiter (NETZSCH, Германия). Методика экспериментов подобна описанной в [16]. Полученные результаты обрабатывали с помощью пакета программ NETZSCH Proteus Thermal Analysis и лицензионного программного инструмента Systat Sigma Plot 12 (Systat Software Inc, США). Ошибка измерений стандартного вещества (корунда) не превышала 2%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные нами параметры элементарной ячейки EuBiGeO5 в сравнении с результатами [3] приведены в табл. 1. Там же приведены данные для соединений Eu2GeO5 и Bi2GeO5. Видно, что полученные нами значения незначительно (различие составляет <1% и может быть обусловлено разным содержанием примесей в исходных оксидах) превышают данные [3] (Δa = 0.0390 Å (0.73%), Δb = 0.0244 Å (0.16%), Δc = 0.0156 Å (0.14%), ΔV = 4.31 Å3 (0.47%)). Кроме того, можно отметить, что образование EuBiGeO5 из Eu2GeO5 и Bi2GeO5 сопровождается изменением структуры. Подобное наблюдалось и для соединений YBiGeO5, GdBiGeO5 [9], SmBiGeO5 [11], TbBiGeO5, DyBiGeO5 [12].
Таблица 1.
Параметры элементарных ячеек Eu2GeO5, EuBiGeO5 и Bi2GeO5
| Параметр | Eu2GeO5 | EuBiGeO5 | Bi2GeO5 | ||
|---|---|---|---|---|---|
| a, Å | 9.977(7) | 5.3652(4) | 5.4042(1) | 15.69(7) | 15.6979(5) |
| b, Å | 7.136(4) | 15.262(1) | 15.2865(2) | 5.492(8) | 5.4969(1) |
| c, Å | 6.854(4) | 11.2263(9) | 11.2420(1) | 5.383(6) | 5.3848(1) |
| β, град | 115.78(6) | ||||
| V, Å3 | 924.4(1) | 928.72(2) | 464.66(2) | ||
| Пр. гр. | P21/c | Pbca | Pbca | Cmc21 | Cmc21 |
| Источник | [17] | [3] | Наст. работа | [18] | [11] |
Авторами работы [10] установлена корреляция между параметрами элементарной ячейки соединений RxBi2– xGeO5 и ионными радиусами редкоземельных элементов R3+. Эти данные можно представить в виде следующих уравнений:
Коэффициенты корреляции для уравнений (1)‒(4) равны соответственно 0.9915, 0.9438, 0.9923 и 0.9892. Нами установлено, что рассчитанные по уравнениям (1)‒(4) параметры a, b, c и V для EuBiGeO5 хорошо согласуются с экспериментальными значениями. Значения R3+ взяты из [19]. Согласно [1], для соединений Y(Yb)BiGeO5 КЧ Y и Yb равно 7. По-видимому, и для других соединений RBiGeO5 наблюдается аналогичная картина (для Eu3+ ионный радиус равен 1.01 Å).
Зависимость молярной теплоемкости EuBiGeO5 от температуры иллюстрирует рис. 2. Видно, что в интервале температур 350‒1000 K значения Cp закономерно увеличиваются, при этом на графике зависимости Cp = f(T) каких-либо аномалий не наблюдается. Характер зависимости Cp = f(T) позволяет говорить о том, что в этом интервале температур EuBiGeO5 не испытывает полиморфных превращений. Таким образом, полученные экспериментальные данные могут быть с хорошей точностью описаны уравнением Майера‒Келли:
(5)
$\begin{gathered} {{C}_{p}} = \left( {184.0 \pm 0.56} \right) + \left( {35.96 \pm 0.60} \right) \times {{10}^{{--3}}}T-- \\ - \,\,\left( {7.79 \pm 0.60} \right) \times {{10}^{5}}{{T}^{{--2}}}. \\ \end{gathered} $Рис. 2.
Температурная зависимость молярной теплоемкости EuBiGeO5, точки – экспериментальные данные, линия – расчет по уравнению (5).
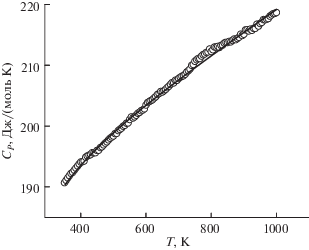
Коэффициент корреляции для уравнения (5) равен 0.9993, а максимальное отклонение экспериментальных точек от сглаживающей кривой составляет 0.7%.
С помощью уравнения (5) рассчитаны величины термодинамических функций EuBiGeO5 в области 350‒1000 K. Результаты расчетов изменения энтальпии, энтропии и энергии Гиббса германата висмута-европия приведены в табл. 2.
Таблица 2.
Термодинамические свойства EuBiGeO5
| T, K | Cp, Дж/(моль K) | H°(T) – H°(350 K), кДж/моль | S°(T) – S°(350 K), Дж/(моль K) | Ф°(Т) – Ф°(350 K), Дж/(моль K) |
|---|---|---|---|---|
| 350 | 190.2 | – | – | – |
| 400 | 193.5 | 9.59 | 25.62 | 1.63 |
| 450 | 196.3 | 19.34 | 48.58 | 5.60 |
| 500 | 198.8 | 29.22 | 69.39 | 10.95 |
| 550 | 201.2 | 39.22 | 88.46 | 17.14 |
| 600 | 203.4 | 49.34 | 106.1 | 23.83 |
| 650 | 205.5 | 59.56 | 122.4 | 30.79 |
| 700 | 207.6 | 69.89 | 137.7 | 37.88 |
| 750 | 209.6 | 80.32 | 152.1 | 45.03 |
| 800 | 211.5 | 90.84 | 165.7 | 52.15 |
| 850 | 213.5 | 101.5 | 178.6 | 59.21 |
| 900 | 215.4 | 112.2 | 190.8 | 66.19 |
| 950 | 217.3 | 123.0 | 202.5 | 73.06 |
| 1000 | 219.2 | 133.9 | 213.7 | 79.81 |
Поскольку измерения теплоемкости EuBiGeO5 ранее не проводились, сравнить полученные нами результаты с данными других авторов не представляется возможным. Можно отметить, что значения Cp для EuBiGeO5 достаточно близки к соответствующим величинам для TmBiGeO5 и YbBiGeO5 [20]. Кроме того, рассчитать Cp можно с использованием различных модельных представлений [21‒24]. Выполненные нами оценки показывают, что из всех методов расчета Cp для EuBiGeO5 при 298 K наиболее близкие к экспериментальному значению (рассчитанному по уравнению (5)) результаты дают метод Неймана–Коппа (‒4.4%) и инкрементный метод Кумока (‒5.3%). Учитывая сложность состава анализируемого соединения, такое совпадение следует признать удовлетворительным. Необходимые для расчетов значения Cp для Eu2O3, Bi2O3 и GeO2 брали из [25, 26], а инкрементов ионов – из [24].
ЗАКЛЮЧЕНИЕ
Германат EuBiGeO5 синтезирован твердофазным методом в интервале температур 1003‒1223 K с использованием в качестве исходных компонентов оксидов Eu2O3, Bi2O3 и GeO2. Методом дифференциальной сканирующей калориметрии измерена высокотемпературная теплоемкость поликристаллических образцов германата висмута-европия в области 350–1000 K. Установлено, что экспериментальная зависимость Cp = f(T) не имеет аномалий и с достаточно хорошей точностью может быть описана уравнением Майера‒Келли. По экспериментальным значениям Cp рассчитаны термодинамические свойства (изменения энтальпии, энтропии и энергии Гиббса) германата висмута-европия.
Список литературы
Cascales C., Campa J.A., Puebla E.G. et al. // J. Mater. Chem. 2002. V. 12. P. 3626. https://doi.org/10.1039/b207638c
Cascales C., Zaldo C. // J. Solid State Chem. 2003. V. 171. P. 262. https://doi.org/10.1016/S0022-4596(02)00173-1
Cascales C., Zaldo C. // Chem. Mater. 2006. V. 18. P. 3742. https://doi.org/10.1021/cm060785t
Baran E.J., Vascales C. // J. Raman Spectrosc. 2002. V. 33. P. 838. https://doi.org/10.1002./jrs.925
Жереб В.П. Метастабильные состояния в оксидных висмутсодержащих системах. М.: МАКС Пресс, 2003. 163 с.
Каргин Ю.Ф., Бурков В.И., Марьин А.А. и др. Кристаллы Bi12MxO20 ± δ со структурой силленита. Синтез, строение, свойства. М.: ИОНХ, 2004. 316 с.
Бондарь И.А., Виноградова Н.В., Демьянец Л.Н. и др. Соединения редкоземельных элементов. Силикаты, германаты, фосфаты, арсенаты, ванадаты. М.: Наука, 1983. 288 с.
Демьянец Л.Н., Лобачев А.Н., Емельченко Г.А. Германаты редкоземельных элементов / Отв. ред. Белов Н.В. М.: Наука, 1980. 152 с.
Denisova L.T., Belousova N.V., Galiakhmetova N.A. et al. // Phys. Solid State. 2017. V. 59. № 5. P. 1047. [Денисова Л.Т., Белоусова Н.В., Галиахметова Н.А. и др. // Физика тв. тела. 2017. Т. 59. № 5. С. 1019.] https://doi.org/10.1134/S1063783417050080
Denisova L.T., Izotov A.D., Kargin Yu.F. et al. // Dokl. Phys. Chem. 2017. V. 473. № 2. P. 58. [Денисова Л.Т., Изотов А.Д., Каргин Ю.Ф. и др. // ДАН. 2017. Т. 473. № 4. С. 449.] https://doi.org/10.1134/S0012501617040029
Denisova L.T., Belousova N.V., Galiakhmetova N.A. et al. // Phys. Solid State. 2017. V. 59. № 8. P. 1683. [Денисова Л.Т., Белоусова Н.В., Галиахметова Н.А. и др. // Физика тв. тела. 2017. Т. 59. № 8. С. 1659.]https://doi.org/10.1134/S106378341708008X
Denisova L.T., Kargin Yu.F., Belousova N.V. et al. // Inorg. Mater. 2017. V. 53. № 10. P. 1086. [Денисова Л.Т., Каргин Ю.Ф., Белоусова Н.В. и др. // Неорган. материалы. 2017. Т. 53. № 10. С. 54.]https://doi.org/10.1134/S0020168517100041
Denisova L.T., Izotov A.D., Kargin Yu.F. et al. // Dokl. Phys. Chem. 2018. V. 483. № 2. P. 145. [Денисова Л.Т., Изотов А.Д., Каргин Ю.Ф. и др. // ДАН. 2018. Т. 483. № 5. С. 514.]https://doi.org/10.1134/S0012501618120011
Третьяков Ю.Д. Твердофазные реакции. М.: Химия, 1978. 360 с.
Solovyov L.A. // J. Appl. Crystallogr. 2004. V. 37. P. 743. https://doi.org/10.1107/S0021889804015638
Denisov V.M., Denisova L.T., Irtyugo L.A. et al. // Phys. Solid State. 2010. V. 52. № 7. P. 1362. [Денисов В.М., Денисова Л.Т., Иртюго Л.А. и др. // Физика тв. тела. 2010. Т. 52. № 7. С. 1274.]
Kato K., Serita M., Kimura S. // Acta Crystallogr. 1979. V. 35B. P. 2201.
Aurivillius B., Lindblom C.-I., Stenson P. // Acta Chem. Scand. 1964. V. 18. № 6. P. 1555.
Shannon R.D. // Acta Crystallogr. Sect. A. 1976. V. 32. P. 751.
Denisova L.T., Belousova N.V., Galiakhmetova N.A. et al. // Phys. Solid State. 2018. V. 60. № 2. P. 267. [Денисова Л.Т., Белоусова Н.В., Галиахметова Н.А. и др. // Физика тв. тела. 2018. Т. 60. № 2. С. 262. https://doi.org/10.21883/FTТ.2018.02.45378.248]https://doi.org/10.1134/S1063783418020099
Кубашевский О., Олкокк С.Б. Металлургическая термохимия. М.: Металлургия, 1982. 392 с.
Моисеев Г.К., Ватолин Н.А., Мапшук Л.А. и др. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ (альтернативный банк данных ACТРА. OWN). Екатеринбург: УрО РАН, 1997. 230 с.
Морачевский А.Г., Сладков И.Б., Фирсова Е.Г. Термодинамические расчеты в химии и металлургии. СПб.: Лань, 2018. 208 с.
Кумок В.Н. // Прямые и обратные задачи химической термодинамики. Новосибирск: Наука, 1987. С. 108.
Laitner J., Chuchvalec P., Sedmidubský D. et al. // Thermochim. Acta. 2003. V. 395. P. 27.
Гордиенко С.П., Феночка Б.В., Виксман Г.Ш. Термодинамика соединений лантаноидов. Киев: Наук. думка, 1979. 376 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


