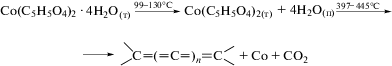Журнал неорганической химии, 2020, T. 65, № 1, стр. 65-72
Термическое разложение кислых карбоксилатов кобальта(II) с анионами ненасыщенных дикарбоновых кислот
С. А. Семенов a, *, В. Ю. Мусатова a, Д. В. Дробот a, Г. И. Джардималиева b
a МИРЭА – Российский технологический университет (Институт тонких химических технологий
имени М.В. Ломоносова)
119454 Москва, пр-т Вернадского, 78, Россия
b Институт проблем химической физики РАН
142432 Московская область, Черноголовка, пр-т Академика Семенова, 1, Россия
* E-mail: srg.semenov@gmail.com
Поступила в редакцию 11.04.2019
После доработки 23.06.2019
Принята к публикации 27.08.2019
Аннотация
Исследовано термическое разложение кислых карбоксилатов кобальта (ККК) с анионами ненасыщенных дикарбоновых кислот методом ТГА/ДТА в сочетании с ДСК-анализом и масс-спектрометрией газообразных продуктов термолиза. Определены температурные интервалы основных стадий термического разложения ККК: 1) дегидратация – 50–225°С; 2) полимеризация дегидратированного карбоксилата – 210–450°С; 3) декарбоксилирование – 370–500°С. Сделан вывод, что перечисленные стадии могут накладываться одна на другую и протекать одновременно.
ВВЕДЕНИЕ
Метод контролируемого термолиза является наиболее простым, эффективным, экономичным и воспроизводимым методом получения металлосодержащих наночастиц [1] и металлополимерных нанокомпозитов типа “ядро–оболочка” [2, 3]. Термическое разложение карбоксилатов металлов привлекает внимание исследователей ввиду как фундаментальных аспектов, так и технологических приложений. Продукты их термолиза представляют интерес в качестве катализаторов, сенсорных и магнитных материалов, керамики и т.д. [4–6], а сами соли ненасыщенных дикарбонововых кислот применяются в качестве покрытий с антибактериальными свойствами и лекарственных веществ [7–9]. Синтетическая стратегия получения многих металлооксидных наноматериалов или, например, квантовых точек базируется на первоначальном генерировании из исходных соединений интермедиатных карбоксилатных комплексов в качестве прекурсора для последующего их термолиза [10, 11].
В работе [12] в результате термолиза гексапропионатоферрата(III) магния получены наночастицы MgFe2O4. Термическим разложением координационных цинксодержащих полимеров, включающих в свой состав N-оксиды никотиновой, пиколиновой и изоникотиновой кислот, синтезированы наночастицы оксида цинка(II) [13]. В результате термолиза триоксалатоферрата(III) калия получены наночастицы оксидов железа [14]. Термолиз терефталата циркония в присутствии N,N-диметилформамида позволил получить композит на основе пористого углерода, содержащего наночастицы диоксида циркония [15]. В работе [16] изучен механизм как изотермического, так и неизотермического разложения γ-MnC2O4 ⋅ 2H2O. Устойчивые водные монодисперсии наночастиц ферритов кобальта и марганца получены путем термолиза соответствующих пивалатных комплексов в среде поливинилпирролидона и триэтиленгликоля [17]. В результате термического разложения ацетата кадмия в присутствии тиомочевины в среде поливинилового спирта (ПВС) получена тонкая пленка нанокомпозита CdS/ПВС [18].
Ранее нами синтезированы и охарактеризованы кислые дикарбоксилаты кобальта(II) (ККК) ненасыщенных дикарбоновых кислот (малеиновой (MalA), итаконовой (ItA), аллилмалоновой (AlMalA), глютаконовой (GlutA), цис,цис-муконовой (MucA)) с использованием термического, элементного анализов и ИК-спектроскопии. Установлено, что в случае ацетилендикарбоновой кислоты образуется цепочечный координационный полимер [19].
Проведен термолиз синтезированных ККК в атмосфере аргона при температуре 335 ± 1°С. Полученные нанокомпозиты исследованы методами просвечивающей и сканирующей электронной микроскопии, рентгенофазового анализа, энергодисперсионного рентгеновского микроанализа, элементного анализа и ИК-спектроскопии [19]. Установлено, что синтезированные металлополимерные нанокомпозиты представляют собой черные порошки, состоящие из двух структурных элементов: в органическую полимерную матрицу, согласно данным РФА, внедрены сферические наночастицы Со3О4 и СоО (структурные типы cF8/2 и hP4/3), а также α-Со (hP2/1) и β-Со (cF4/1) структуры “ядро–оболочка”. Термолиз карбоксилатов (MalA, ADCA, AlMalA, GlutA, MucA) кобальта приводит к образованию СоО (структурный тип cF8/2) и Со3О4 (структурный тип сF56/2), за исключением малеината кобальта, термолиз которого приводит только к образованию СоО. Некоторые полученные композиты содержат помимо перечисленных фаз СоО других структурных типов. Так, композит, полученный в результате термолиза малеината кобальта, содержит СоО (hP4/3), а при использовании глютаконата кобальта был получен продукт, содержащий кроме перечисленных фаз также и СоО (cF8/3). Полученные композиты содержат наряду с оксидными фазами примеси металлического кобальта. Так, композит, полученный в результате термолиза малеината и глютаконата кобальта, помимо перечисленных фаз содержит α‑Со (hP2/1), а продукты термолиза малеината, цис,цис-муконата и глютаконата кобальта содержат ß-Со (cF4/1) [19].
Полуэмпирическим квантово-химическим методом РМ3 рассчитана энтальпия реакции образования ККК ($\Delta H_{{\text{p}}}^{^\circ }$). Определен размер НЧ, установлена связь между средним диаметром НЧ (dcр) и $\Delta H_{{\text{p}}}^{^\circ }$ [19].
Изучены микроструктура и магнитные характеристики полученных нанокомпозитов: максимальная и остаточная намагниченность, коэрцитивная сила [19].
Результаты исследований методами ДТА, ТГ и ДТГ акрилата кобальта, а также ненасыщенных карбоксилатов ряда других переходных металлов приведены в работе [20], кислых малеинатов никеля, марганца, железа и кобальта – в работе [21]. Настоящая работа посвящена исследованию термического разложения ККК методом ТГА/ДТА в сочетании с ДСК-анализом и масс-спектрометрией газообразных продуктов термолиза. Ранее метод ТГА/ДТА в сочетании с ДСК-анализом и масс-спектрометрией был успешно использован для изучения термического разложения ацетилендикарбоксилата цинка [22], цитрата аммония-цинка [23], двойных комплексных соединений, содержащих анион [FeMn(CN)6]2– [24], непредельных дикарбоксилатов никеля [13].
Систематические исследования термолиза непредельных карбоксилатов металлов, опубликованные ранее [2, 3, 25, 26], позволили выявить общность характера их превращений, состоящую в последовательности трех основных макростадий:
1) дегидратации кристаллогидратов мономеров (tтерм < 275°С) с одновременной перестройкой лигандного окружения, сопровождаемой выделением части карбоксилатных лигандов (дегидратация акрилата железа(III) [(Fe3O)(CH2=CHCOO)6 ⋅ ⋅ 3H2O]OH приводит к изменению строения фрагмента Fe3O и способствует процессу отщепления СH2=CHCOO-групп [27]; при дегидратации акрилата кобальта Со(СН2=СНСОО)2 ⋅ Н2О происходит изменение дентатности части СН2=СНСОО-лигандов, которое приводит к неравноценности связей М–О. Далее происходит разрыв слабой связи М–О с образованием радикала СН2=СНСОО· и дальнейшим выделением СО2 и С2Н4 [28]);
2) твердофазной полимеризации перестроившегося дегидратированного мономера (tтерм ≈ ≈ 125–360°С);
3) декарбоксилирования образовавшегося (со)полимера при высоких температурах (tтерм > > 250°С); с последним процессом связано основное газовыделение и потеря массы образцом при термолизе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез кислых карбоксилатов кобальта описан ранее [16]. ДСК-анализ и термогравиметрические измерения выполнены на синхронном термическом анализаторе NETZSCH STA 409 PC/PG с точностью ±0.1°С, объединенном с квадрупольным масс-спектрометром QMS 403CAeolos. Скорость нагрева составляла 10 град/мин, атмосфера – аргон.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Первой стадией термических превращений ККК, в соответствии с [2, 3, 19–21], является дегидратация. В случае кислого итаконата кобальта на кривой ДСК наблюдаются эндотермические пики с минимумами при t = 99.2 и 130.5°С, отвечающие за процесс дегидратации (рис. 1). Необходимо отметить, что исследуемые ККК представляют собой молекулярные комплексы, что было показано ранее на примере кислых малеинатов Со(II) и Fe(II) [26].
Рис. 1.
Данные ТГА, ДСК и масс-спектры СоIt (скорость нагрева 10 град/мин, аргон). Общая потеря массы 56.1%.
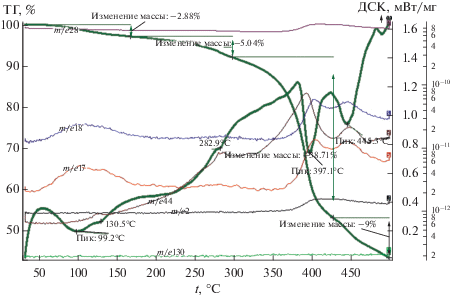
Незначительная потеря массы при температуре 99.2°С связана с удалением остатка адсорбционной воды и сопровождается максимумом на кривой МС (массовое число, m/e = 18, 17). Второй эндотермический пик с минимумом наблюдается при 130.5°С и соответствует потере 0.5 молекулы кристаллизационной воды. По-видимому, одна из молекул воды становится мостиковой. По расчету, удалению четырех молекул воды соответствует потеря массы 18.5%, что происходит до температуры 373°С. Потеря массы на стадии дегидратации составляет 2.9%.
Процессу дегидратации итаконата кобальта при термолизе на воздухе в режиме термоанализа соответствует эндотермический пик с минимумом при температуре 170°С [19]. По данным работы [20], дегидратация акрилата кобальта происходит в интервале температур 140–180°С, а малеината кобальта – 120–160°С.
Следующей стадией термических превращений ККК, в соответствии с [2, 3, 19, 20], является твердофазная полимеризация дегидратированного мономера, которая для итаконата кобальта происходит в интервале температур 283–330°С и сопровождается небольшой потерей массы (3.4%). На кривой ДСК наблюдается экзотермический пик с максимумом при 305°С, относящийся к процессу полимеризации.
Полимеризация акрилата кобальта, согласно [20], происходит при 270°С, а малеината кобальта в диапазоне температур 215–245°С.
Третьей стадией термических превращений ККК является декарбоксилирование образованного полимера до металлосодержащей фазы и безкислородной полимерной матрицы. В соответствии с работами [2, 3, 19, 20], она происходит при температуре >250°C, а согласно [13] – при температуре 290–450°C. На этой стадии происходит основное газовыделение в виде CO, СО2 (кривые с m/e = 28 и 44). На кривой ДСК итаконата кобальта реакции полного декарбоксилирования соответствуют два эндопика с минимумом при 397.1 и 445.3°С (рис. 1), где происходит основное газовыделение в виде СО2. Потеря массы на этой стадии составляет 28.4%. Общая потеря массы составляет 56.1%.
Следует отметить, что в реальных процессах перечисленные стадии часто накладываются одна на другую. Так, при термолизе итаконата кобальта, рассматриваемого в настоящей работе, полимеризация инициирует частичное декарбоксилирование, сопровождающееся выделением СО2, которое начинается уже при температуре 283°С, на что указывает рост кривой МС (массовое число m/e = 44). Из рис. 1 видно, что кривые МС, соответствующие выделению СО и Н2 (массовые числа m/e = 28 и 2 соответственно), симбатны, их рост наблюдается при температуре 380°С. В ходе декарбоксилирования в соответствии со схемой
образуются наночастицы β-Со (структурный тип cF4/1), которые взаимодействуют с СО2 и Н2О с выделением соответственно СО и Н2 начиная с 380°С: Расчет теплового эффекта реакций по уравнению Кирхгоффа в интегральной форме в допущении о независимости теплоемкостей продуктов реакций и исходных веществ от температуры показал, что реакции сопровождаются эндотермическим эффектом ($\Delta H_{{{\text{653(r)}}}}^{^\circ }$ = +52.1 кДж/моль для реакции (2) и $\Delta H_{{{\text{653(r)}}}}^{^\circ }$ = +11.8 кДж/моль для реакции (3)), что свидетельствует о более сложных процессах, протекающих при термолизе.Следует отметить, что, согласно [29], реакция (3) возможна при действии пара на нагретый до красного каления металл, что соответствует 850–900°С. Протекание реакции (3) в наших условиях связано с повышенной реакционной способностью наночастиц кобальта [30].
В случае ацетилендикарбоксилата кобальта (рис. 2) на кривой ДСК наблюдаются два эндотермических пика с минимумами при температурах 86.9 и 195.1°С, отвечающие за процесс дегидратации и лежащие в диапазоне температур 50–210°С (табл. 1). Потеря массы при 86.9°С незначительна и связана с удалением остатка адсорбционной воды. Она сопровождается небольшими максимумами на кривых МС с m/е = 17 и 18. Потеря массы при температуре 195.1°С составляет 7.5%, что соответствует удалению одной кристаллизационной молекулы воды. Это приводит к нестабильности молекулы ацетилендикарбоксилата кобальта и вызывает ее частичное декарбоксилирование. Полное удаление двух молекул воды происходит при температуре 208°С. При 215°С наблюдается максимум на кривой МС с m/e = 26, что говорит о выделении ацетилена и свидетельствует о том, что при данной температуре в связи с нестабильностью молекулы происходит частичное разрушение ацетилендикарбоксилата кобальта. В свою очередь, частичное декарбоксилирование подтверждается наблюдаемыми нами максимумами на кривых МС с m/e = 18, 17, 44 при этой же температуре, которые свидетельствуют о выделении воды и СО2. Потеря массы на стадии дегидратации составляет 19.0%.
Рис. 2.
Данные ТГА, ДСК и масс-спектры СоADC (скорость нагрева 10 град/мин, аргон). Общая потеря массы 64.5%.
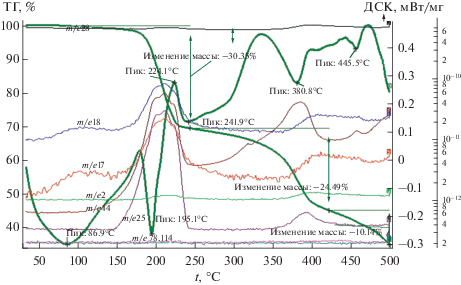
Таблица 1.
Формульный состав и температурные интервалы основных стадий термического превращения карбоксилатов кобальта
| Исходная кислота | Полученный карбоксилат [19] | Стадии термического превращения, °С | ||
|---|---|---|---|---|
| дегидратация | полимеризация | декарбоксилирование | ||
| Малеиновая | Со(С4Н3О4)2 · 5Н2О | 50–220 | 225–275 | 390–485 |
| Итаконовая | Co(C5H5O4)2 · 4H2O | 55–170 | 283–330 | 385–480 |
| Ацетилендикарбоновая | СоС4О4 ⋅ 2Н2О | 50–210 | 210–370 | 370–475 |
| Аллилмалоновая | Со(С6Н7О4)2 ⋅ 4Н2О | 65–225 | 346–382 | 405–500 |
| Цис,цис-муконовая | Со(С6Н5О4)2 · Н2О | 70–170 | 350–450 | 445–500 |
Два экзотермических пика в диапазоне температур 210–370°С с максимумами при 224 и 340°С связаны с полимеризацией дегидратированного полимера. Потеря массы на стадии полимеризации составляет 22.8%.
Следует отметить, что особенности термического поведения анализируемого выше комплекса согласуются с данными работы [31], в которой с помощью квантово-химических расчетов (DFT) оценена энергия дегидратации кристаллогидратов ацетилендикарбоксилатов кобальта и цинка, составляющая 150–200 кДж/моль–1. Показано, что столь большая величина этой энергии может приводить к механохимической активации разрушения кристаллической структуры при их дегидратации и инициировании полимеризации, которая происходит вслед за дегидратацией.
Окончательному декарбоксилированию соответствуют эндотермические пики на кривой ДСК с минимумами при температурах 381 и 455°С. На данной стадии происходит газовыделение в виде СО2 (пики m/е = 44). Потеря массы на данной стадии составляет 18.8%, общая потеря массы – 64.5%.
Ход кривых МС, соответствующих выделению СО и Н2, объясняется протеканием реакций (2) и (3), наблюдается рост выделения этих газов при температурах 215–230 и 380–390°С.
При термолизе ацетилендикарбоксилата кобальта в атмосфере аргона в течение 9 ч при температуре 335°С образуется 99.4% Со3O4 и 0.6% СоО (пр. гр. cF8/2).
В случае кислого аллилмалоната кобальта (рис. 3) на кривой ДСК наблюдается один эндотермический пик с минимумом при 101.9°С (тепловой эффект составляет 515.4 Дж/г), обусловленный дегидратацией, что подтверждается максимумами на МС-кривых с m/e = 17 и 18. Расчеты показывают, что при этой температуре теряется одна молекула воды. Потеря массы на стадии дегидратации составляет 17.4%.
Рис. 3.
Данные ТГА, ДСК и масс-спектры СоAlMal (скорость нагрева 10 град/мин, аргон). Общая потеря массы 61.9%.
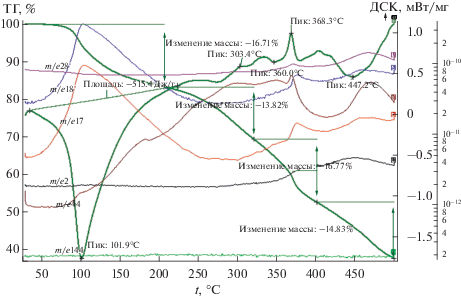
Процессу полимеризации дегидратированного карбоксилата соответствует экзопик на кривой ДСК с максимумом при температуре 368°С. Полимеризация сопровождается максимумами на кривых МС с m/e = 28, 44, 18, 17 и 2, что свидетельствует о выделении СО, СО2, H2O и Н2. Выделение упомянутых газов при данной температуре свидетельствует о том, что полимеризация приводит к нестабильности молекулы аллилмалоната кобальта и инициирует процесс декарбоксилирования. В ходе декарбоксилирования образуются наночастицы металлического кобальта, которые реагируют с Н2О и СО2 в соответствии с реакциями (2) и (3) с выделением СО и Н2. Потеря массы на стадии полимеризации составляет 9.8%.
На кривой ДСК процессу полного декарбоксилирования отвечает эндотермический пик с минимумом при 405–500°С и максимумом на кривой МС с m/e = 44, что связано с выделением СО2. Декарбоксилирование вызывает появление наночастиц кобальта и, согласно реакциям (2), (3), выделение СО и Н2, что сопровождается максимумами на кривых МС с m/e = 28 и 2. Потеря массы на данной стадии составляет 14.1%, общая потеря массы – 61.9%.
При термолизе аллилмалоната кобальта в атмосфере аргона в течение 9 ч при температуре 335°С образуется 18.5% СоO (пр. гр. cF8/2) и 81.5% Co3O4 [16].
В случае кислого малеината кобальта (рис. 4) на кривой ДСК наблюдаются четко выраженный эндотермический пик с минимумом при 131°С и плечом при 171°С (тепловой эффект составляет 688.3 Дж/г) и небольшой пик при 205°С, вызванные дегидратацией, что подтверждается максимумами на кривых МС с m/e = 17 и 18. Расчет показывает, что при температуре 131°С теряются 2.5 молекулы кристаллизационной воды. Дробное число молекул воды объясняется тем, что одна молекула воды становится мостиковой, связывая две молекулы частично дегидратированного карбоксилата.
Рис. 4.
Данные ТГА, ДСК и масс-спектры СоMal (скорость нагрева 10 град/мин, аргон). Общая потеря массы 67.6%.
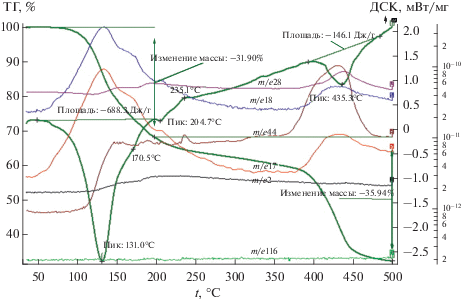
При температуре 131°С наблюдается также рост кривой МС, соответствующей m/e = 44, достигая максимального выделения СО2 при 150°С. Это говорит о том, что дегидратация сопровождается выделением СО2 и частичным декарбоксилированием, которое в свою очередь, приводит к образованию и росту, наночастиц кобальта и протеканию реакций (2) и (3), в результате чего выделяются СО и Н2 (рост кривых МС с m/e = 28 и 2). Потеря массы на стадии дегидратации составляет 34.6%.
Процессу полимеризации частично дегидратированного карбоксилата соответствует экзопик на кривой ДСК с максимумом при 235°С. При этой же температуре наблюдается максимум на кривой МС с m/e = 44, отвечающий за процесс частичного декарбоксилирования. Потеря массы на стадии полимеризации составляет 2.1%.
За процесс полного декарбоксилирования отвечает эндотермический пик с минимумом при 435°С на кривой ДСК (тепловой эффект составляет 146.1 Дж/г), который сопровождается максимумом на кривой МС с m/e = 44, соответствующий выделению СО2. При этой же температуре происходит выделение СО по реакции (2), что подтверждается кривой МС с максимумом, отвечающим m/e = 28. Выделение Н2 (кривая МС с m/e = 2) происходит достаточно равномерно, достигая своего максимального значения при 200°С. Потеря массы на данной стадии составляет 25.0%. Общая потеря массы составляет 67.6%.
При термолизе малеината кобальта в атмосфере аргона в течение 9 ч при температуре 335°С образуется 50.8% СоO (пр. гр. cF8/2), 37.2% CoO (hP4/3), 3.7% α-Co (hP2/1) и 4.7% β-Со (cF4/1) [16].
В случае кислого цис,цис-муконата кобальта (рис. 5) на кривой ДСК наблюдается эндотермический пик с минимумом при 101°С. Расчет показывает, что при этой температуре теряется 0.7 молекул кристаллизационной воды. Потеря воды при этой температуре подтверждается максимумами на кривых МС с m/e = 17 и 18. Потеря массы на стадии дегидратации составляет 8.6%.
Рис. 5.
Данные ТГА, ДСК и масс-спектры СоMuc (скорость нагрева 10 град/мин, аргон). Общая потеря массы 62.4%.
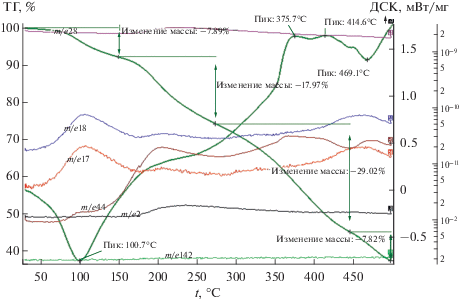
При температуре 101°С наблюдается рост кривой МС, соответствующей m/e = 44, достигая максимального выделения СО2, а также СО и Н2 (m/e = = 28, 2) в диапазоне температур 210–230°С. Это говорит о том, что дегидратация вызывает выделение СО2 вследствие частичного декарбоксилирования, которое, в свою очередь, приводит к росту выделения СО и Н2 и началу образования наночастиц кобальта, сопровождающемуся протеканием реакций (2) и (3).
Полимеризации соответствуют два экзотермических пика с максимумами на кривой ДСК при 376 и 415°С. Полимеризации сопутствует частичное декарбоксилирование, на что указывает выделение СО2 в диапазоне температур 350–450°С, которое сопровождается широким максимумом на кривой МС с m/e = 44. Потеря массы на стадии полимеризации составляет 19.3%.
На кривой ДСК наблюдается эндотермический пик с минимумом при 469.1°С, вызванный полным декарбоксилированием и сопровождаемый максимумом на кривой МС выделения СО2. На стадии декарбоксилирования потеря массы составляет 7.8%. Общая потеря массы составляет 62.7%.
При термолизе цис,цис-муконата кобальта в атмосфере аргона в течение 9 ч при температуре 335°С образуется 82.4% Со3О4, 16.1% СоО (пр. гр. сF8/2) и 1.6% β-Co (cF4/1) [16].
Общая потеря массы для всех образцов лежит в пределах 56.1–67.6%.
Обобщенные данные по температурным интервалам основных стадий термических превращений ненасыщенных дикарбоксилатов кобальта приведены в табл. 1.
ЗАКЛЮЧЕНИЕ
Анализ результатов исследования термического разложения ненасыщенных кислых дикарбоксилатов кобальта позволяет сделать следующие выводы. В процессе термического разложения изученные в настоящей работе карбоксилаты претерпевают три стадии:
1) дегидратации, протекающей в области температур 50–225°С;
2) полимеризации дегидратированного карбоксилата, экзопики с максимумами в области температур 210–450°С;
3) декарбоксилирования, эндопики с минимумами на кривой ДСК и максимумами на кривых МС с m/e = 44 в области температур 370–500°С.
Как видно из полученных данных, перечисленные стадии могут накладываться одна на другую и протекать одновременно.
Кроме того, термическое разложение сопровождается сопутствующими химическими процессами. Например, образующиеся в ходе декарбоксилирования наночастицы металлического кобальта вступают в реакцию с присутствующими в реакционном объеме углекислым газом и водой, образуя при этом оксид кобальта, СО и Н2.
Кроме стадий термического разложения, которые присущи всем изученным карбоксилатам, термолиз конкретных карбоксилатов имеет и индивидуальные особенности. Так, при термолизе ацетилендикарбоксилата кобальта, в отличие от других карбоксилатов, наблюдается выделение ацетилена при температуре 195.1°С, что сопровождается частичным разрушением молекулы ацетилендикарбоксилата кобальта.
Список литературы
Аль Хазраджи А.Х., Крылов А.В., Куликова М.В. и др. // Тонкие химические технологии. 2016. Т. 11. № 6. С. 28.
Pomogailo A.D., Rozenberg A.S., Dzhardimalieva G.I. Russ. Chem. Rev. 2011. T. 80. № 3. C. 257. https://doi.org/10.1070/RC2011v080n03ABEH004079
Помогайло А.Д., Джардималиева Г.И. Металлополимерные гибридные нанокомпозиты. М.: Наука, 2015.
Li Y., Yang X.-Y., Feng Y. et al. // Critical Rev. Solid State Materials Sci. 2012. V. 37. № 1. P. 1. https://doi.org/10.1080/10408436.2011.606512
Malik A.-S., Duncan M.J., Bruce P.G. // J. Mater. Chem. 2003. V. 13. P. 2123.
Frost R.L., Martens W., Adebajo M.O. // J. Therm. Anal. Cal. 2005. V. 81. P. 351.
Ali-Mohamed A.Y. // J. Coord. Chem. 1993. V. 29. № 3. P. 233.
Чук Ф.Т., Колева М., Михайлова С. // Фармация. 1988. Т. 38. С. 16.
Alam K.M., Kaniz F.M., Gulzar A. // Pakistan J. Sci. and Ind. Res. 1987. V. 30. P. 707.
Yu W.W., Qu L., Guo W., Peng X. // Chem. Mater. 2003. V. 15. P. 2854.
Yu W.W., Wang Y.A., Peng X. // Chem. Mater. 2003. V. 15. P. 4300.
Randhawa B.S., Kaur H., Dosanjh H.S., Singh J. // Ceramics International. 2016. V. 42. № 7. P. 8891. https://doi.org/10.1016/j.ceramint.2016.02.142
Marandi F., Hashemi L., Morsali A., Krautscheid H. // Ultrasonics Sonochemistry. 2016. V. 32. P. 86. https://doi.org/10.1016/j.ultsonch.2016.02.022
Saritha A., Raju B., Rao D.N. et al. // Advanced Powder Technology. 2015. V. 26. № 2. P. 349. https://doi.org/10.1016/j.apt.2014.11.005
Liu S.-C., Yue Z.F., Liu Y. // J. Porous Mater. 2015. V. 22. P. 465.
Donkova B., Avdeev G. // J. Therm. Anal. Calorim. 2015. V. 121. P. 567. https://doi.org/10.1007/s10973-015-4590-4
Abdulwahab K.O., Malik M.A., O’Brien P., Timco G.A. // Mater. Sci. Semicond. Process. 2014. V. 27. P. 303. https://doi.org/10.1016/j.mssp.2014.06.052
Saikia D., Saikia P.K., Gogoi P.K. et al. // Mater. Chem. Phys. 2011. V. 131. № 1–2. P. 223. https://doi.org/10.1016/j.matchemphys.2011.09.011
Semenov S.A., Drobot D.V., Musatova V.Yu. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 8. P. 897. https://doi.org/10.1134/S0036023615080161
Pomogailo A.D., Dzhardimalieva G.I., Rozenberg A.S. // J. Nanoparticle Research. 2003. V. 5. P. 497. https://doi.org/10.1023/B:NANO.0000006091.92638.a5
Yudanova L.I., Logvinenko V.A., Sheludyakova L.A. // Russ. J. Inorg. Chem. 2008. V. 53. № 9. P. 1459. https://doi.org/10.1134/S0036023608090180
Shershnev V.A., Dzhardimalieva G.I., Kiryukhin D.P. // Russ. Chem. Bull. 2013. V. 62. № 7. P. 1649. https://doi.org/10.1007/s11172-013-0239-2
Van Werde K., Mondelaers D., Vanhoyland G. et al. // J. Materials Sci. 2002. V. 37. P. 81.
Домонов Д.П., Печенюк С.И., Гостева А.Н. и др. // Вестник ЮУрГУ. Сер. хим. 2014. Т. 6. № 1. С. 5.
Semenov S.A., Musatova V.Yu., Drobot D.V., Dzhardimalieva G.I. // Russ. J. Inorg. Chem. 2018. V. 63. № 9. P. 1217. https://doi.org/10.1134/S0036023618090164
Поролло Н.П., Алиев З.Г., Джардималиева Г.И. и др. // Изв. АН. Сер. хим. 1997. № 2. С. 375.
Розенберг А.С., Александрова Е.И., Джардималиева Г.И. и др. // Изв. АН. Сер. хим. 1993. № 10. С. 1743.
Александрова Е.И., Джардималиева Г.И., Розенберг А.С., Помогайло А.Д. // Изв. АН. Сер. хим. 1993. №2. С. 308.
Гринвуд Н., Эрншо А. Химия элементов. Т. 2. М.: Бином. Лаборатория знаний, 2008. 670 с.
Сергеев Г.Б. Нанохимия. М., 2007.
Volkova N.N., Dzhardimalieva G.I., Krisyuk B.E. et al. // Russ. Chem. Bull. 2016. V. 65. № 8. P. 2025. https://doi.org/10.1007/s11172-016-1547-0
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии