Журнал неорганической химии, 2020, T. 65, № 1, стр. 111-116
Экстракция лантанидов(III) из азотнокислых растворов диоксидом тетрафенилметилендифосфина в присутствии бис[(трифторметил)сульфонил]имидов четвертичных аммониевых оснований
А. Н. Туранов a, *, В. К. Карандашев b
a Институт физики твердого тела РАН
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 2, Россия
b Институт проблем технологии микроэлектроники и особо чистых материалов РАН
142432 Московская обл., Черноголовка, ул. Академика Осипьяна, 6, Россия
* E-mail: turanov@issp.ac.ru
Поступила в редакцию 19.07.2019
После доработки 08.08.2019
Принята к публикации 28.08.2019
Аннотация
Изучено межфазное распределение La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb и Lu между водными растворами HNO3 и растворами диоксида тетрафенилметилендифосфина в 1,2-дихлорэтане, содержащими ионные жидкости с анионом бис[(трифторметил)сульфонил]имида и катионами четвертичных аммониевых оснований. Установлено, что экстракция ионов металлов значительно возрастает в присутствии ионных жидкостей в органической фазе. Определена стехиометрия извлекаемых комплексов, рассмотрено влияние концентрации HNO3 в водной фазе и природы катионной части ионной жидкости на эффективность извлечения ионов металлов в органическую фазу.
ВВЕДЕНИЕ
В основе концепции замкнутого ядерного топливного цикла, предусматривающей переработку отработанного ядерного топлива, лежит селективное выделение содержащихся в нем f-элементов, необходимых для развития ряда отраслей промышленности и ядерной медицины [1]. Экстракционные методы широко используются для извлечения, концентрирования и разделения актинидов и лантанидов. Высокой экстракционной способностью по отношению к этим элементам обладают полидентатные нейтральные фосфорорганические соединения [2–4], в том числе замещенные диоксиды метилендифосфинов [5, 6]. Замена в молекулах этих соединений алкильных заместителей при атомах фосфора на арильные приводит к резкому возрастанию экстракционной способности по отношению к актинидам и лантанидам в азотнокислых средах, что связано с проявлением эффекта аномального арильного упрочнения экстрагируемых комплексов [7].
В последнее время возрос интерес к использованию ионных жидкостей (ИЖ) в экстракционной практике концентрирования и разделения органических и неорганических соединений в качестве несмешивающейся с водой фазы [8–11]. Было показано, что экстракция актинидов и лантанидов(III) растворами диарил(диалкилкарбамоилметил)фосфиноксидов (КМФО) в ИЖ гексафторфосфатах и бис[(трифторметил)сульфонил]имидах 1-алкил-3-метилимидазолиев значительно возрастает по сравнению с экстракцией растворами КМФО в традиционных органических растворителях [12, 13]. Отмечено, что в таких системах для количественного извлечения ионов металлов не требуется значительного избытка ионов ${\text{NO}}_{3}^{ - }$ в водной фазе, что является необходимым условием экстракции этим экстрагентом в традиционных органических растворителях. Примеры использования ИЖ в процессах извлечения и концентрирования лантанидов(III) и актинидов приведены в обзорах [14–20]. Установлено, что для эффективного извлечения лантанидов(III) из растворов HNO3 и HCl достаточно даже относительно небольшой концентрации ИЖ в органическом растворителе, содержащем нейтральные донорно-активные экстрагенты [21–24]. Это позволяет рассматривать ИЖ как активный компонент синергетической смеси.
Использование бис[(трифторметил)сульфонил]имида в качестве анионного компонента ИЖ определяется его высокой гидрофобностью и гидролитической устойчивостью в азотнокислых средах по сравнению с анионом гексафторфосфата [14]. В большинстве опубликованных работ по экстракции ионов металлов в качестве ИЖ использовали в основном ИЖ на основе катионов 1-алкил-3-метилимидазолия. В последнее время вырос интерес к использованию в экстракционной практике ИЖ с катионами четвертичных аммониевых оснований, что связано с их большей доступностью и меньшей токсичностью [25].
Цель настоящей работы – исследование влияния природы катионной части ИЖ на эффективность экстракции лантанидов(III) из азотнокислых растворов растворами диоксида тетрафенилметилендифосфина в органических растворителях. Для этого рассмотрено межфазное распределение ионов Ln(III) между растворами HNO3 и органической фазой, содержащей диоксид тетрафенилметилендифосфина Ph2P(O)CH2P(O)Ph2 и бис[(трифторметил)сульфонил]имиды тетраэтиламмония ([Et4N][Tf2N]), триэтилбензиламмония ([Et3BnN][Tf2N]), тетрабутиламмония ([Bu4N][Tf2N]) и триоктилметиламмония ([Oct3MeN][Tf2N]).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Диоксид тетрафенилметилендифосфина (ТФМДФО) получен согласно [26]. Ионные жидкости [Et4N][Tf2N], [Et3BnN][Tf2N], [Bu4N][Tf2N] и [Oct3MeN][Tf2N] получены по методике [27] обменной реакцией литиевой соли бис[(трифторметил)сульфонил]имида (Sigma-Aldrich) с бромидами тетраэтиламмония, триэтилбензиламмония, тетрабутиламмония и хлорида триоктилметиламмония (Aliquat 336, Sigma-Aldrich) соответственно. В качестве органического растворителя использовали 1,2-дихлорэтан марки “х. ч.” без дополнительной очистки. Растворы ТФМДФО и ИЖ в органическом растворителе готовили по точным навескам. Концентрации ТФМДФО и ИЖ изменялись в диапазоне 3 × 10–4–3 × 10–3 и 0.001–0.1 моль/л соответственно.
Распределение ионов Ln(III) в экстракционных системах изучали на модельных растворах 0.03–7.0 моль/л HNO3. Исходные водные растворы с концентрацией каждого из Ln(III) 2 × 10–6 моль/л готовили растворением соответствующих нитратов в воде с последующим добавлением HNO3 до требуемой концентрации. Используемые реактивы соответствовали марке “х. ч.”.
Опыты по экстракции проводили в пробирках с притертыми пробками при температуре 22 ± 1°С и соотношении объемов органической и водной фаз 1 : 1. Контакт фаз осуществляли на роторном аппарате при перемешивани со скоростью 60 об./мин в течение 1 ч. Предварительно установлено, что этого времени достаточно для установления постоянных значений коэффициентов распределения (D).
Содержание лантанидов(III) в исходных и равновесных водных растворах определяли методом масс-спектрометрии с ионизацией пробы в индуктивно-связанной плазме с использованием масс-спектрометра X-7 (Thermo Electron, США). Содержание элементов в органической фазе определяли по разнице их исходных и равновесных концентраций в водной фазе. Коэффициенты распределения лантанидов (DLn) рассчитывали как отношение их концентраций в равновесных фазах. Погрешность определения коэффициентов распределения не превышала 5%. Концентрацию ионов Tf2N– в равновесных водных растворах определяли атомно-эмиссионным методом с ионизацией пробы в индуктивно-связанной плазме с использованием спектрометра ICAP-61 (Thermo Jarrel Ash, США) по содержанию серы. Концентрацию HNO3 в равновесных водных фазах определяли потенциометрическим титрованием раствором NaOH.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Установлено, что растворы исследованных ИЖ в дихлорэтане не экстрагируют Ln(III) из азотнокислых растворов (величины DLn не превышают 10–2). Однако при экстракции Ln(III) смесями ТФМДФО и ИЖ в дихлорэтане значительно увеличивается извлечение Ln(III) в органическую фазу (рис. 1). Наблюдаемый синергетический эффект может быть связан с вхождением гидрофобных анионов Tf2N– в состав экстрагируемых комплексов в качестве противоионов сольватированных катионов Ln(III), приводящим к увеличению их гидрофобности по сравнению с координационно-сольватированными нитратами Ln(III). Протеканием подобного процесса объясняется значительное увеличение экстракции Ln(III) и Am(III) растворами нейтральных экстрагентов в присутствии гидрофобных пикрат- [28] и тетракис[3,5-бис(трифторметил)фенил]борат-анионов [29] или анионов хлорированного дикарболлида кобальта [30].
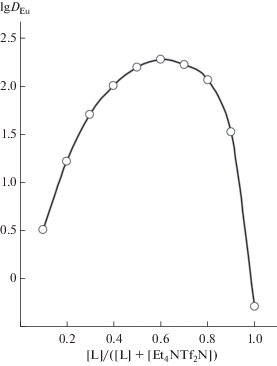
Рис. 1.
Экстракция Eu(III) из растворов 1 моль/л HNO3 изомолярными смесями ТФМДФО и [Et4N][Tf2N] в дихлорэтане в зависимости от их исходного мольного соотношения в органической фазе. [ТФМДФО] + [Et4NTf2N] = 0.002 моль/л.
Величина синергетического эффекта (S) определяется как S = D/(D1 + D2), где D – коэффициент распределения Ln(III) при экстракции смесью ТФМДФО и ИЖ, D1 и D2 – коэффициенты распределения при экстракции индивидуальными компонентами смеси в таких же условиях. В исследованных системах величина S увеличивается в ряду ИЖ [Oct3MeN][Tf2N] < [Bu4N][Tf2N] < < [Et3BnN][Tf2N] < [Et4N][Tf2N] (рис. 2, 3) по мере снижения гидрофобности катиона ИЖ. Ранее отмечалось снижение эффективности экстракции ионов металлов растворами нейтральных донорно-активных экстрагентов в ИЖ на основе катионов 1-алкил-3-метилимидазолия по мере увеличения их гидрофобности при увеличении длины алкильной цепочки в катионе ИЖ [31].
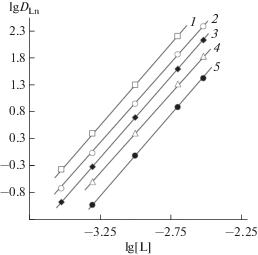
Рис. 2.
Экстракция лантанидов(III) из растворов 1 моль/л HNO3 растворами 0.001 моль/л ТФМДФО в дихлорэтане, содержащем 0.01 моль/л [Et3BnN][Tf2N] (1), [Bu4N][Tf2N] (2), [Oct3MeN][Tf2N] (3), и раствором ТФМДФО в дихлорэтане (4).
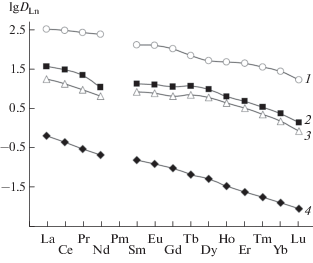
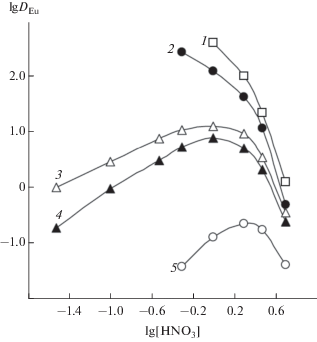
Рис. 3.
Зависимость коэффициентов распределения Eu(III) от концентрации HNO3 в равновесной водной фазе при экстракции растворами 0.001 моль/л ТФМДФО в дихлорэтане, содержащем 0.002 моль/л [Et4N][Tf2N] (1), 0.01 моль/л [Et3BnN][Tf2N] (2), [Bu4N][Tf2N] (3), [Oct3MeN][Tf2N] (4), и в дихлорэтане (5).
При экстракции из раствора 1 моль/л HNO3 величины S увеличиваются в ряду лантанидов(III) от La(III) до Lu(III) (рис. 2) по мере уменьшения ионных радиусов ионов Ln3+ и увеличения их энергии гидратации [32]. По-видимому, замещение в экстрагируемом комплексе анионов ${\text{NO}}_{3}^{ - }$ на более гидрофобные Tf2N– оказывает большее влияние на экстракцию более гидратированных ионов РЗЭ(III). Это приводит к снижению коэффициента разделения La/Lu (βLa/Lu = = DLa/DLu) от 60.3 при экстракции раствором ТФМДФО до 20.4 при экстракции этим экстрагентом в присутствии [Oct3MeN][Tf2N] в органической фазе (рис. 2).
Присутствие ИЖ в органической фазе существенно изменяет характер зависимости эффективности экстракции Ln(III) растворами ТФМДФО от концентрации HNO3 в водной фазе (рис. 3). В присутствии менее гидрофобных ИЖ [Et4N][Tf2N] и [Et3BnN][Tf2N] наблюдается снижение DEu с ростом [HNO3], которое отмечалось ранее и при экстракции растворами ТФМДФО и КМФО в присутствии ИЖ с катионом 1-бутил-3-метилимидазолия (bmimTf2N) [21–24]. Причины такого характера зависимости D–[HNO3] в системах с ИЖ обсуждались в предыдущих работах [33, 34]. Другой характер зависимости DEu–[HNO3] наблюдается в системах с более гидрофобными ИЖ [Oct3MeN][Tf2N] и [Bu4N][Tf2N] (рис. 3). В этом случае DEu возрастает с увеличением [HNO3] до 1 моль/л, что может быть связано с неполным замещением в экстрагируемых комплексах Ln(III) анионов ${\text{NO}}_{3}^{ - }$ на гидрофобные ионы Tf2N–, т.е. участием ионов ${\text{NO}}_{3}^{ - }$ в образовании экстрагируемых комплексов в таких системах. Снижение DEu с дальнейшим ростом [HNO3] связано с уменьшением концентрации свободного экстрагента в органической фазе вследствие соэкстракции HNO3 и HTf2N. Снижение DEu с ростом [HNO3] наиболее заметно в случае менее гидрофобных ИЖ. Из данных рис. 3 видно, что увеличение [HNO3] от 2 до 5 моль/л сопровождается уменьшением DEu в 85, 26 и 16 раз для систем с [Et3BnN][Tf2N], [Bu4N][Tf2N] и [Oct3MeN][Tf2N] соответственно. Это связано с тем, что концентрация ионов Tf2N– в водной фазе увеличивается по мере снижения гидрофобности катиона ИЖ, т.е. соэкстракция HTf2N оказывает менее заметное влияние на экстракцию ионов металлов в присутствии более гидрофобных ИЖ. Отметим, что в отсутствие ИЖ увеличение [HNO3] от 2 до 5 моль/л при экстракции раствором ТФМДФО в дихлорэтане сопровождается снижением DEu только в 3.7 раза.
Известно, что процесс экстракции ионов металлов нейтральными экстрагентами в присутствии ИЖ сопровождается заметным переходом ионов ИЖ в водную фазу [35]. Величины коэффициентов распределения иона Tf2N– между растворами 0.1 моль/л ИЖ в дихлорэтане и раствором 1 моль/л HNO3 возрастают в ряду Et4NTf2N (5.0) < Et3BnNTf2N (19.8) < Bu4NTf2N (302) < < Oct3MeNTf2N (>1000) по мере увеличения гидрофобности катионной части этих ИЖ. В такой же последовательности снижаются потери ИЖ в процессе экстракции.
Несмотря на то, что в системе с [Oct3MeN][Tf2N] эффект синергизма при экстракции лантанидов(III) раствором ТФМДФО из азотнокислых растворов проявляется в меньшей степени, чем в системах с менее гидрофобными [Et4N][Tf2N] и [Et3BnN][Tf2N], а также бис[(трифторметил)сульфонил]имидом 1-бутил-3-метилимидазолия (bmimTf2N) [21, 22], использование [Oct3MeN][Tf2N] позволяет существенно снизить потери этой ИЖ в процессе экстракции. Кроме того, снижение коэффициентов распределения ионов металлов с уменьшением [HNO3] (рис. 3) позволяет значительно упростить процесс их реэкстракции. После экстракции Ln(III) из раствора 3 моль/л HNO3 растворами 0.05 моль/л ТФМДФО и 0.01 моль/л [Oct3MeN][Tf2N] или [Et3BnN][Tf2N] в дихлорэтане была проведена реэкстракция Ln(III) водой. В системе с [Oct3MeN][Tf2N] степень реэкстракции Ln(III) превышает 90%, тогда как в системе с [Et3BnN][Tf2N] Ln(III) практически не переходит в водную фазу. Поэтому далее рассмотрены равновесия при межфазном распределении Ln(III) между растворами HNO3 и органической фазой, содержащей ТФМДФО и [Oct3MeN][Tf2N].
Процесс синергетической экстракции лантанидов(III) из азотнокислых растворов растворами ТФМДФО (L) в присутствии гидрофобной ИЖ [Oct3MeN][Tf2N] (RA) может быть описан уравнением:
(1)
$\begin{gathered} {\text{Ln}}_{{\left( {\text{в}} \right)}}^{{3 + }} + 3{\text{NO}}{{_{3}^{ - }}_{{\left( {\text{в}} \right)}}} + s{{{\text{L}}}_{{\left( {\text{о}} \right)}}} + p{\text{R}}{{{\text{A}}}_{{\left( {\text{о}} \right)}}} \leftrightarrows \\ \rightleftarrows {\text{Ln}}{{{\text{L}}}_{s}}{{({\text{N}}{{{\text{O}}}_{3}})}_{{(3\,\,--\,\,}}}{{_{p}}_{)}}{{{\text{A}}}_{p}}_{{\left( {\text{о}} \right)}} + p{\text{RN}}{{{\text{O}}}_{{3\left( {\text{о}} \right)}}}, \\ \end{gathered} $Рис. 4.
Зависимость коэффициентов распределения La (1), Sm (2), Dy (3), Tm (4) и Lu (5) от концентрации [Oct3MeN][NO3] в дихлорэтане, содержащем 0.001 моль/л ТФМДФО и 0.01 моль/л [Oct3MeN][Tf2N], при экстракции из растворов 1 моль/л HNO3.
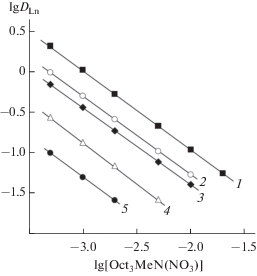
Рис. 5.
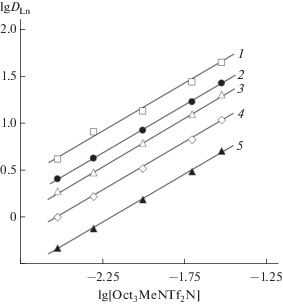
Зависимость коэффициентов распределения Ce (1), Eu (2), Dy (3), Er (4) и Yb (5) от концентрации [Oct3MeN][Tf2N] в дихлорэтане, содержащем 0.001 моль/л ТФМДФО, при экстракции из растворов 1 моль/л HNO3.
Стехиометрическое соотношение Ln(III) : L в комплексах, экстрагируемых в присутствии ИЖ, близко к 1 : 3 (рис. 6), тогда как в отсутствие ИЖ ионы Ln(III) экстрагируются растворами ТФМДФО из азотнокислых растворов в основном в виде комплексов с соотношением Ln(III) : L = 1 : 2 [36]. Повышение сольватного числа в системе с ИЖ связано со слабой координирующей способностью ионов Tf2N– [37], которые находятся, по-видимому, во внешней координационной сфере экстрагируемого комплекса LnL3(NO3)2(Tf2N). Увеличение числа молекул экстрагента, участвующих в образовании экстрагируемых комплексов, приводит к увеличению их гидрофобности, что способствует повышению эффективности экстракции ионов металлов в органическую фазу.
ЗАКЛЮЧЕНИЕ
Показано, что эффективность экстракции лантанидов(III) из азотнокислых растворов растворами ТФМДФО значительно возрастает в присутствии бис[(трифторметил)сульфонил]имидов четвертичного аммониевого основания. Величина синергетического эффекта уменьшается с ростом гидрофобности катиона ИЖ. Однако использование гидрофобной ИЖ [Oct3MeN][Tf2N] позволяет существенно снизить потери ИЖ в процессе экстракции и значительно упростить процесс реэкстракции экстрагированных ионов металлов.
Список литературы
Myasoedov B.F., Kalmykov S.N., Kulyako Yu.M. et al. // Geochem. Int. 2016. V. 54. № 13. P. 1156. https://doi.org/10.1134/S0016702916130115
Alyapychev M.Yu., Babain V.A., Ustynyuk Yu.A. // Russ. Chem. Rev. 2016. V. 85. № 9. P. 943. https://doi.org/10.1070/RCR4588
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev. 2017. V. 46. P. 7229. https://doi.org/10.1039/C7CS00574A
Wilson A.M., Bailey P.J., Tasker P.A. // Chem. Soc. Rev. 2014. V. 43. P. 123. https://doi.org/10.1039/C3CS60275C
Розен А.М., Волк В.И., Вахрушин А.Ю. и др. // Радиохимия. 1999. Т. 41. № 3. С. 205.
Rozen A.M., Krupnov B.V. // Russ. Chem. Rev. 1996. V. 65. № 11. P. 973. https://doi.org/10.1070/RC1996v065n11ABEH000241
Розен А.М., Николотова З.И., Карташева Н.А., Юдина К.С. // ДАН СССР. 1975. Т. 222. № 5. С. 1151.
Visser A.E., Swatloski R.P., Reichert W.M. et al. // Ind. Eng. Chem. Res. 2000. V. 39. P. 3596.
Koel M. // Crit. Rev. Anal. Chem. 2005. V. 35. P. 177. https://doi.org/10.1080/10408340500304016
Zhao H., Xia S., Ma P. // J. Chem. Technol. Biotechnol. 2005. V. 80. P. 1089.
Dietz M.L. // Sep. Sci. Technol. 2006. V. 41. P. 2047.
Nakashima K., Kubota F., Maruyama T. et al. // Anal. Sci. 2003. V. 19. P. 1097. https://doi.org/10.2116/analsci.19.1097
Visser A.E., Rogers R.D. // J. Solid State Chem. 2003. V. 171. P. 109.
Kolarik Z. // Solvent Extr. Ion Exch. 2013. V. 31. P. 24. https://doi.org/10.1080/07366299.2012.700589
Kubota F., Baba Y., Goto M. // Solvent Extr. Res. Dev. Jpn. // 2012. V. 19. P. 17.
Billard I. // Handbook on the Physics and Chemistry of Rare Earths. 2013. V. 43. Ch. 256. P. 213.
Shkrob I.A., Marin T.W., Jensen M.P. // Ind. Eng. Chem. Res. 2014. V. 53. P. 3641. https://doi.org/10.1021/ie4036719
Mohapatra P.K. // Chem. Prod. Proc. Model. 2015. V. 10. P. 135.
Gupta N.K. // J. Molec. Liq. 2018. V. 269. P. 72.
Hawkins C.A., Momen M.A., Dietz M.L. // Sep. Sci. Technol. 2018. V. 53. P. 1820. https://doi.org/1080/01496395.2017.1302478
Turanov A.N., Karandashev V.K., Baulin V.E. // Russ. J. Inorg. Chem. 2008. V. 53. № 6. P. 970. [Туранов А.Н., Карандашев В.К., Баулин В.Е. // Журн. неорган. химии. 2008. Т. 53. № 6. С. 1045.] https://doi.org/10.1134/S0036023608060272
Turanov A.N., Karandashev V.K., Baulin V.E. // Radiochemistry. 2008. V. 50. № 3. P. 266. [Туранов А.Н., Карандашев В.К., Баулин В.Е. // Радиохимия. 2008. Т. 50. № 3. С. 229.] https://doi.org/10.1134/S1066362208030090
Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Радиохимия. 2013. Т. 55. № 4. С. 314.
Turanov A.N., Karandashev V.K., Yarkevich A.N. // Russ. J. Inorg. Chem. 2018. V. 63. № 3. P. 406. [Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Журн. неорган. химии. 2018. Т. 63. № 3. С. 382.] https://doi.org/10.1134/S0036023618030221
Bell T.J., Ikeda Y. // Dalton Trans. 2011. V. 40. P. 10125.
Чаузов В.А., Студнев Ю.Н., Износткова М.Г., Фокин А.В. // Журн. общей химии. 1987. Т. 57. № 1. С. 54.
Bonhote P., Dias A.P., Papageorgiou N. et al. // Inorg. Chem. 1996. V. 35. P. 1168.
Naganawa H., Suzuki H., Tachimori S. et al. // Phys. Chem. Chem. Phys. 2001. V. 3. P. 2509.
Suzuki H., Naganawa H., Tachimori S. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 726.
Rais J., Tachimori S. // J. Radioanal. Nucl. Chem. Lett. 1994. V. 188. № 2. P. 157.
Dai S., Ju Y.H., Barnes C.E. // J. Chem. Soc., Dalton Trans. 1999. P. 1201.
Яцимирский К.Б., Костромина Н.А., Шека З.А. и др. Химия комплексных соединений редкоземельных элементов. Киев: Наук. думка, 1966. 494 с.
Turanov A.N., Karandashev V.K., Baulin V.E. // Solvent Extr. Ion Exch. 2008. V. 26. P. 77. https://doi.org/10.1080/07366290801904871
Turanov A.N., Karandashev V.K., Khvostikov V.A. // Solvent Extr. Ion Exch. 2017. V. 35. P. 461.
Gaillard C., Boltoeva M., Billard I. et al. // Chem. Phys. Chem. 2015. V. 16. P. 2653. https://doi.org/10.1002/cphc.201500283
Туранов А.Н., Карандашев В.К., Баулин В.Е. // Радиохимия. 2001. Т. 43. № 1. С. 66.
Binnemans K. // Chem. Rev. 2007. V. 107. P. 2593. https://doi.org/10.1021/cr050979c
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии