Журнал неорганической химии, 2020, T. 65, № 10, стр. 1371-1376
Оксалатопалладаты(II) цинка(II) и марганца(II) как предшественники биметаллических наноматериалов
И. А. Гаркуль a, *, А. В. Задесенец a, П. Е. Плюснин a, Е. Ю. Филатов a, Т. И. Асанова a, Д. В. Козлов b, С. В. Коренев a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 5, Россия
* E-mail: garkul@niic.nsc.ru
Поступила в редакцию 14.04.2020
После доработки 19.05.2020
Принята к публикации 27.05.2020
Аннотация
Изучены термические свойства [{Zn(H2O)3(PdOx2)}2(μ-H2O)2] · 4H2O и {(μ-Ox)Pd(μ-Ox)Mn(H2O)3}n · · nH2O в различной атмосфере. С Zn в инертной (He) и восстановительной (H2) атмосфере образуется интерметаллид ZnPd, а в окислительной (воздух) – смесь оксидов ZnO и PdO. С Mn в инертной атмосфере образуется смесь MnO и Pd, в окислительной атмосфере происходит более глубокое окисление марганца до Mn3O4, а в восстановительной атмосфере марганец частично восстанавливается и образуется интерметаллид Mn3Pd5. Установлена высокая каталитическая активность Zn-содержащего образца, нанесенного на подложку TiO2, в процессе фотоокисления СО. Данные XAFS-спектроскопии, полученные для модельных катализаторов, позволяют предположить образование наноразмерных частиц палладия в ходе водородного восстановления прекурсоров на носителе.
ВВЕДЕНИЕ
Благородные металлы имеют большое значение в развитии современной промышленности; без их использования невозможно представить такие отрасли, как электроника [1], медицина [2–5], химическое производство. Важную роль благородные металлы играют в катализе. Они применяются в процессах гидрирования [6, 7], для улавливания и окисления CO [8, 9], в реакциях кросс-сочетания [10, 11], а также во многих других каталитических процессах. Востребованы функциональные материалы на основе благородных металлов, а их получение является актуальной задачей современной химии. Отдельного внимания заслуживают биметаллические системы, образованные благородным и неблагородным металлами, так как их взаимное влияние повышает общую каталитическую активность по сравнению с монометаллическим аналогом [12].
При синтезе таких функциональных материалов приходится стакиваться с трудностями, связанными с дисперсностью и гомогенностью частиц, стехиометрией металлов и нанесением наносплава на каталитическую подложку. Одним из весьма действенных решений, позволяющим справляться со всеми перечисленными задачами, является использование координационных соединений, в которых катионная и анионная сферы образованы соответствующими металлами. В большинстве случаев такие соединения можно отнести к двойным комплексным солям (ДКС) при условии, что катион и анион дискретны между собой, что, однако, не наблюдается для прекурсоров, обсуждаемых в этой статье, несмотря на их внешнюю схожесть с ДКС. Выбор обусловлен тем, что в таких предшественниках металлы уже перемешаны друг с другом, и это позволяет легче достичь однофазности продукта. За счет правильного подбора лигандов термическое разложение комплексов протекает при невысоких температурах с образованием частиц высокой дисперсности, что напрямую влияет на каталитическую активность. Конечный состав наносплавов полностью отвечает той стехиометрии, которая задается на этапе подбора прекурсоров, так как в ходе синтеза не происходит потери ни одного из металлов. Для измерения каталитической активности встает задача нанесения образцов на каталитическую подложку, решением которой является подбор лигандов, позволяющий комплексам хорошо растворяться в воде. В этом случае прекурсоры можно легко наносить методом пропитки по влагоемкости.
На сегодняшний день известно много координационных соединений, на основе которых были получены биметаллические системы. В частности, в широком ряду ДКС лигандами катионной сферы выступают азотсодержащие молекулы, такие как NH3 и H2N(CH2)2NH2 [13]. Однако такие соединения обладают низкой растворимостью, что делает невозможным прямое нанесение прекурсора на носитель. Тем не менее из азотсодержащих прекурсоров были успешно получены различные биметаллические системы: [M1(NH3)4][M2(H2O)2Ox2] · 2H2O (Ox = ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{{\text{4}}}^{{{\text{2}} - }};$ M1 = Pd, Pt, M2 = Ni, Zn) [14], [M(NH3)4][CuOx2] · · 3H2O (M = Pd, Pt) [15] и [M(NH3)6][FeOx3] · 3H2O (M = Co, Ir) [16]. При замене азотсодержащих лигандов на воду появляется новая серия соединений, имеющих высокую растворимость, обусловленную аквакатионами, например [M1(H2O)6][M2(NO2)4] · 4H2O (M1 = Ni, Co; M2 = = Pd, Pt) [17]. Однако выбор в качестве лиганда нитрит-иона, обладающего окислительными свойствами, позволяет добиться полного восстановления обоих металлов лишь в восстановительной атмосфере.
Принимая во внимание перечисленные факторы, нами была выбрана комбинация лигандов вода–оксалат для высокой растворимости, обусловленной аквакатионами, и полного восстановления обоих металлов в любой атмосфере благодаря восстановительным свойствам оксалат-иона. В результате получены ДКС состава [Co(H2O)6][PdOx2] · 4H2O и [Ni(H2O)6][PdOx2] · nH2O (n = 2, 4) [12], а также молекулярный комплекс [{Zn(H2O)3(PdOx2)}2(μ-H2O)2] · 4H2O и комплекс полимерного строения {(μ-Ox)Pd(μ-Ox)Mn(H2O)3}n · nH2O, синтез и структура которых подробно описаны ранее [18].
В настоящей работе описаны термические свойства [{Zn(H2O)3(PdOx2)}2(μ-H2O)2] · 4H2O и {(μ-Ox)Pd(μ-Ox)Mn(H2O)3}n· nH2O в восстановительной, окислительной и инертной атмосфере, а также фотокаталитические свойства образующихся биметаллических систем, нанесенных на каталитическую подложку, и проведено исследование образцов с помощью XAFS-спектроскопии. Далее будут использованы сокращения [Zn–Pd] для [{Zn(H2O)3(PdOx2)}2(μ-H2O)2] · 4H2O, [Mn–Pd] для {(μ-Ox)Pd(μ-Ox)Mn(H2O)3}n· nH2O, [Co–Pd] для [Co(H2O)6][PdOx2] · 4H2O и [Ni–Pd] для [Ni(H2O)6][PdOx2] · 4H2O.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Термический анализ проводили c использованием термовесов TG 209 F1 Iris® фирмы NETZSCH. Масса навесок составляла 30–50 мг при точности определения массы 0.1 мкг. Разложение осуществляли в инертной (скорость потока He 60 мл/мин), окислительной (скорость потока O2 10 мл/мин, Ar 40 мл/мин) и восстановительной атмосфере (скорость потока H2 30 мл/мин, He 30 мл/мин) в открытом тигле из α-Al2O3 при скорости нагрева 10 град/мин. Результаты экспериментов обрабатывали с помощью стандартного пакета программного обеспечения Proteus Analysis [19].
Рентгенофазовый анализ поликристаллических образцов синтезированных соединений и продуктов их термолиза проводили на дифрактометре ДРОН-RM4 (CuKα-излучение, графитовый монохроматор, d001 = 3.345 Å, комнатная температура). Образцы готовили растиранием в агатовой ступке в присутствии этанола. Полученную суспензию наносили на полированную сторону стандартной кварцевой кюветы. После высыхания образец представлял собой тонкий ровный слой толщиной ~100 мкм. Образцы продуктов термолиза были приготовлены аналогичным образом, но из-за их возможной гигроскопичности при растирании применяли гексан. В качестве внешнего эталона использовали образец поликристаллического кремния (a = 5.4309 Å), приготовленный аналогичным образом. Регистрацию дифрактограмм проводили в пошаговом режиме (∆2θ = 0.1°) в диапазоне углов 2θ 5°–60° для комплексных соединений и 5°–100° для продуктов термолиза.
Приготовление каталитических образцов Zn−Pd на подложке TiO2. Во всех экспериментах использовали TiO2 Hombifine N (100%-ный анатаз фирмы Sachtleben Chemie GmbH с SBET = 347 м2/г и средним диаметром пор D = 4.9 нм), который предварительно прокаливали на воздухе при 200°C в течение 1 сут, затем измеряли его влагоемкость, которая составила 0.9 мл воды на 0.10 г прокаленного TiO2.
Все образцы, изученные на предмет каталитической активности, готовили единым способом из расчета постоянного содержания палладия 1 мас. %. По методике [19] готовили растворы [Zn–Pd], после этого методом пропитки по влагоемкости растворы комплекса объемом 4.0 мл наносили на высокодисперсный TiO2 (m = 4.40 г), сушили 1 сут на воздухе при комнатной температуре и разлагали при 300°С в атмосфере кислорода, гелия и водорода.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
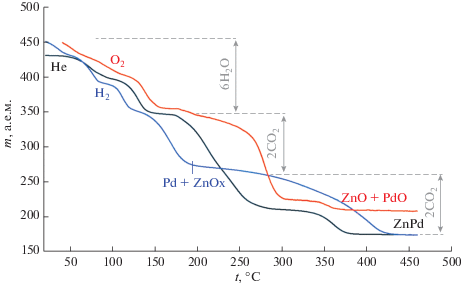
Термические свойства [Zn–Pd]. Термолиз (рис. 1) в инертной атмосфере начинается с дегидратации, которая происходит уже при комнатной температуре, что характерно для всех сольватов. На кривой потери массы наблюдаются ступени, соответствующие гидрату меньшей водности и полностью обезвоженному продукту. Однако, несмотря на их существование, эксперименты по изотермическому выдерживанию образца при разных температурах не привели к получению соединений постоянного стехиометрического состава, обладающих меньшим количеством воды. Увеличение температуры на этом участке влияет лишь на скорость, с которой происходит дегидратация, и эта скорость постепенно замедляется при уменьшающемся количестве остающейся воды. Это можно объяснить сильным взаимодействием последних молекул внутрисферной воды с катионом цинка(II). Несмотря на замедление процесса обезвоживания, выделить полностью безводную соль не удается, поскольку при температуре 150°С уже начинается следующий процесс, скорость которого преобладает над скоростью дегидратации, – восстановление палладия. После 150°С происходит восстановление палладия оксалат-ионом до металлического состояния и частичного восстановления цинка, поскольку масса образца в момент замедления разложения данной ступени (после 250°С) не соответствует потере одного оксалат-иона. На последней стадии восстанавливается оставшаяся часть цинка, который встраивается в решетку металлического палладия с образованием интерметаллида ZnPd. Примечательно, что разложение чистого оксалата цинка в инертной атмосфере происходит до оксида цинка(II), из чего следует, что палладий способствует восстановлению цинка оксалат-ионом.
В атмосфере водорода палладий начинает восстанавливаться уже при комнатной температуре, о чем свидетельствуют данные РФА, подтверждая наличие высокодисперсного палладия. Так, в восстановительной атмосфере дегидратация и восстановление палладия происходят одновременно на начальной стадии. С другой стороны, цинк восстанавливается позднее, чем в инертной атмосфере, и также встраивается в решетку палладия с образованием интерметаллида ZnPd. Следует отметить, что разложение чистого оксалата цинка происходит до образования оксида ZnO даже в атмосфере водорода, однако влияние металлического палладия приводит к полному восстановлению цинка.
Процесс термолиза в окислительной атмосфере начинается с дегидратации, после чего в атмосфере кислорода оксалат-ионы окисляются до CO2 и конечными продуктами в твердой фазе являются оксиды PdO и ZnO.
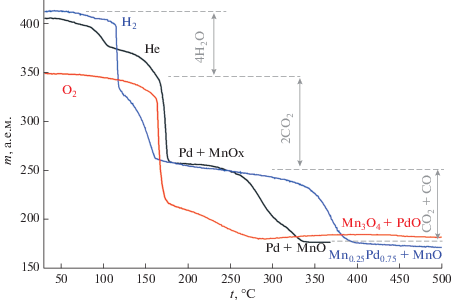
Термические свойства [Mn–Pd]. Общая тенденция термического разложения при смене цинка на марганец сохраняется (рис. 2). Процесс протекает через стадию дегидратации, затем происходит разложение оксалат-иона с восстановлением палладия. Отличие в инертной атмосфере заключается в том, что восстановления марганца не происходит, и конечными продуктами являются металлический палладий и оксид марганца(II).
В атмосфере водорода происходит лишь частичное восстановление марганца, который по аналогии с цинком встраивается в решетку палладия с образованием твердого раствора Mn0.25Pd0.75, а остальная часть неблагородного металла остается в виде оксида MnO. Данный состав твердого раствора на фазовой диаграмме соответствует границе однофазной и двухфазной областей [20]. При полном восстановлении марганца теоретически возможно образование интерметаллида MnPd, однако результатом эксперимента, в котором образец нагревали в атмосфере водорода до 1100°С и выдерживали при этой температуре в течение 8 ч, стало образование интерметаллида Mn3Pd5.
В окислительной атмосфере после дегидратации и восстановления палладия происходит разложение оксалата марганца(II) до оксида MnO, после чего наблюдается увеличение массы, которое объясняется окислением палладия до оксида PdO и окислением MnO до Mn3O4.
Каталитические свойства системы [Zn–Pd]. В ранее опубликованной работе [1] нами были изучены продукты термолиза [Co–Pd] и [Ni–Pd] на подложке TiO2 на предмет активности в процессе фотокаталитического окисления СО кислородом воздуха. Активность в данном случае определялась как скорость уменьшения концентрации СО на начальном этапе.
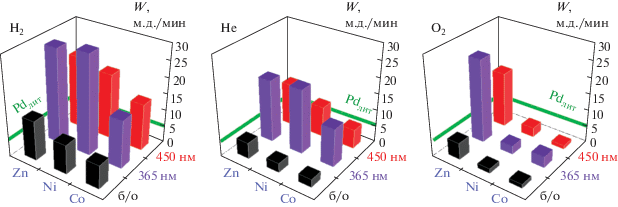
Вслед за биметаллическими системами с Co и Ni аналогичным образом была измерена каталитическая активность образцов с Zn. Эксперименты по фотокаталитическому окислению СО проводили в темноте под действием видимого излучения с λ = 450 нм, а также под действием ультрафиолетового излучения с λ = 365 нм. Данные представлены на рис. 3, более точные значения приведены в табл. 1.
Таблица 1.
Начальные скорости фотокаталитического окисления СО в м.д./мин
| Атмосфера | M−Pd | В темноте | УФ-излучение (365 нм) | Видимое излучение (450 нм) |
|---|---|---|---|---|
| He | Co−Pd | 2.4 | 11.6 | 5.8 |
| Ni−Pd | 2.8 | 19.5 | 9.3 | |
| Zn−Pd | 4.9 | 18.9 | 12.9 | |
| O2 | Co−Pd | 1.2 | 3.4 | 1.1 |
| Ni−Pd | 1.4 | 2.6 | 2.9 | |
| Zn−Pd | 5.1 | 25.2 | 16.8 | |
| H2 | Co−Pd | 7.1 | 14.5 | 14.1 |
| Ni−Pd | 8.8 | 29.9 | 19.8 | |
| Zn−Pd | 12.0 | 28.6 | 22.0 |
В темноте окисление CO на начальном этапе происходит с низкой скоростью на всех образцах. Под действием облучения в видимой области скорость во всех случаях возрастает, причем общая закономерность между образцами сохраняется. В эксперименте под воздействием УФ-облучения начальная скорость на биметаллических образцах в разы выше, чем в присутствии чистого палладия [21]. Исключением стали кислородные образцы с Co и Ni. Их низкая фотокаталитическая активность объясняется пассивацией активного компонента за счет образования оксидных фаз. Высокая фотокаталитическая активность кислородного образца с цинком объясняется фотосенсибилизирующими свойствами оксида цинка [22]. В данной серии наибольшей активностью обладают образцы Zn и Ni, полученные в атмосфере водорода.
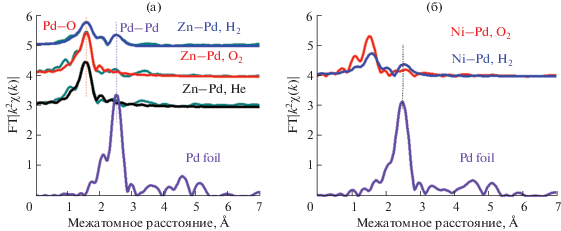
XAFS-спектроскопия образцов. Из-за низкого содержания металлов образцы не удалось проанализировать методом РФА. Поэтому их изучали с помощью XAFS-спектроскопии в области, расположенной выше скачка поглощения и находящейся в интервале от 30 до 2000 эВ относительно порога возбуждения (EXAFS-область).
Как видно из модулей Фурье-преобразований (МФП) EXAFS (рис. 4), водородные образцы заметно отличаются от других образцов M−Pd/TiO2 (M = Zn, Ni). В этих образцах имеется координационная сфера Pd−Pd, а также для них характерно низкое значение координационного числа Pd−O. Это позволяет предположить, что в этих образцах сформировались наночастицы Pd на подложке TiO2, нельзя также исключать поверхностное окисление палладиевых наночастиц.
ЗАКЛЮЧЕНИЕ
Из-за выраженных восстановительных свойств оксалат-иона в случае [Zn–Pd] оба металла полностью восстанавливаются как в атмосфере водорода, так и в атмосфере гелия. В обоих случаях происходит образование интерметаллида ZnPd. В случае [Mn–Pd] неблагородный металл лишь в атмосфере водорода частично восстанавливается с образованием Mn3Pd5. Высокая растворимость исходных комплексов дает возможность получать каталитические образцы путем прямого нанесения прекурсоров непосредственно на подложку. Полученные образцы c Zn на TiO2 проявляют высокую каталитическую активность в процессе окисления CO под действием УФ-излучения. По результатам XAFS-спектроскопии, происходит образование наноразмерных частиц металлического палладия в ходе восстановления образцов на носителе.
Список литературы
Chizhova N.V., Toldina O.V., Mamardashvili N.Z. // Russ. J. Inorg. Chem. 2008. V. 53. P. 1401. https://doi.org/10.1134/S003602360809009X
Shishilov O.N., Stromnova T.A., Churakov A.V. et al. // Russ. J. Inorg. Chem. 2006. V. 51. P. 574. https://doi.org/10.1134/S0036023606040127
Molodkin A.K., Esina N.Y., Tachaev M.V. et al. // Russ. J. Inorg. Chem. 2007. V. 52. P. 1567. https://doi.org/10.1134/S0036023607100166
Tyulyaeva E.Y. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1775. https://doi.org/10.1134/S0036023619140110
Denisov M.S., Dmitriev M.V., Eroshenko D.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 56. https://doi.org/10.1134/S0036023619010054
Yashtulov N.A., Gavrin S.S., Tanasyuk D.A. et al. // Russ. J. Inorg. Chem. 2010. V. 55. P. 174. https://doi.org/10.1134/S0036023610020063
Shishmakov A.B., Mikushina Y.V., Koryakova O.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 864. https://doi.org/10.1134/S0036023619070155
Belousova N.V., Sirotina A.V., Belousov O.V et al. // Russ. J. Inorg. Chem. 2012. V. 57. P. 15. https://doi.org/10.1134/S0036023612010044
Malkov I.V., Krivetskii V.V., Potemkin D.I. et al. // Russ. J. Inorg. Chem. 2018. V. 63. P. 1007. https://doi.org/10.1134/S0036023618080168
Ioni Y.V., Lyubimov S.E., Davankov V.A. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 392. https://doi.org/10.1134/S0036023613040062
Stromnova T.A. // Russ. J. Inorg. Chem. 2008. V. 53. P. 2019. https://doi.org/10.1134/S0036023608130032
Zadesenets A.V., Garkul I.A., Filatov E.Y. et al. // J. Therm. Anal. Calorim. 2019. V. 138. P. 111. https://doi.org/10.1007/s10973-019-08254-0
Sukhikh A.S., Khranenko S.P., Komarov V.Y. et al. // J. Struct. Chem. 2019. V. 60. P. 780. https://doi.org/10.1134/S002247661905010X
Zadesenets A.V., Filatov E.Y., Yusenko K.V. et al. // J. Inorg. Chem. Acta. 2008. V. 361. P. 199. https://doi.org/10.1016/j.ica.2007.07.006
Yusenko K.V., Filatov E.Yu., Vasilchenko D.B. et al. // Z. Kristallogr. 2007. V. 26. P. 289. https://doi.org/10.1524/9783486992540-046
Yusenko K.V., Pechenyuk S.I., Vikulova E.S. et al. // J. Struct. Chem. 2019. V. 60. P. 1062. https://doi.org/10.1134/S0022476619070060
Zadesenets A.V., Filatov E.Y., Plyusnin P.E. et al. // New J. Chem. 2018. V. 42. P. 8843. https://doi.org/10.1039/C8NJ00956B
Garkul I.A., Zadesenets A.V., Korolkov I.V. et al. // J. Struct. Chem. 2020. V. 61. P. 760. https://doi.org/10.26902/JSC_id55417
NETZSCH Proteus Thermal Analysis v.4.8.1. NETZSCH-Gerätebau – Bayern, Germany. 2005.
Massalski T.B. Reference Binary Alloy Phase Diagrams. ASM International, Materials Park, Ohio (1990) 3, P. 2585.
Kolobov N.S., Svintsitskiy D.A., Kozlova E.A. et al. // Chem. Eng. J. 2017. V. 314. P. 600. https://doi.org/10.1016/j.cej.2016.12.018
Markevich I.V., Kushnirenko V.I., Borkovska L.V. et al. // Solid State Commun. 2007. V. 144. P. 236. https://doi.org/10.1016/j.ssc.2007.08.025
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии