Журнал неорганической химии, 2020, T. 65, № 10, стр. 1408-1415
Танталсодержащая биоактивная стеклокерамика: механизм подавления биологической активности стекла 45S5 при его легировании Ta2O5
Д. Н. Грищенко a, *, А. Б. Слободюк a, В. Г. Курявый a, М. А. Медков a
a Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
* E-mail: grishchenko@ich.dvo.ru
Поступила в редакцию 25.03.2020
После доработки 24.04.2020
Принята к публикации 15.05.2020
Аннотация
Представлены способы синтеза рентгеноконтрастного танталсодержащего стекла и стеклокерамики путем допирования биостекла 45S5 оксидом тантала. Биоактивное стекло получено пиролизом смеси органических прекурсоров: тетраэтоксисилана, трибутилфосфата, олеата натрия и олеата кальция. Допирование биостекла оксидом тантала выполнено тремя различными способами. Изучен механизм подавления биологической активности материалов с увеличением содержания Ta2O5. Оценка биоактивности образцов, содержащих 1–40 мас. % Ta2O5, проведена in vitro с помощью модельной среды – SBF-раствора. Полученные образцы исследованы методами ЯМР на ядрах 31Р, РФА, РЭМ и ЭДС. Снижение концентрации кальция в стеклофазе за счет образования нерастворимых кристаллов CaTa2O6 названо основной причиной подавления биоактивности стекол. Образцы, содержащие до 10 мас. % Ta2O5, могут найти применение в современной медицине в качестве материалов, восстанавливающих костную ткань. Рентгеноконтрастное вещество в составе биоматериала позволяет контролировать процесс регенерации костной ткани. Образцы, содержащие более 20 мас. % Ta2O5, не прошли тесты in vitro. Вследствие растворения одной из фаз стеклокерамики в модельном растворе прогноз для использования in vivo таких материалов неблагоприятен.
ВВЕДЕНИЕ
Расширение списка материалов, отвечающих различным задачам современной медицины и максимально удовлетворяющих требованиям конкретного клинического случая, является одним из приоритетных направлений современного медицинского материаловедения. Исследования и разработка материалов для замены или регенерации костной ткани считаются наиболее перспективными. Такие материалы могут быть представлены биостеклами, биокерамикой, стеклокерамикой и композитами. Помимо биоактивных кальций-фосфатных материалов широкое распространение приобрели биоинертные керамические материалы, а также композиты, включающие биоинертную подложку и биоактивное покрытие. Легирование кальций-фосфатной биокерамики оксидами металлов, кремния или бора позволяет дополнительно придавать ей такие свойства, как антимикробная активность [1–3] и рентгеноконтрастность [4].
Оксид тантала используется как биоинертный компонент в составе покрытий титановых имплантов, а также в составе биостекол и биоцементов. В комбинации с фосфатами кальция оксид тантала улучшает прикрепление клеток к биоактивным материалам. В частности, в [5] отмечено, что присутствие Ta2O5 в составе композиционного покрытия на никелиде титана способствует большей адсорбции положительно заряженных белков из питательных сред, а более высокая плотность отрицательного заряда на поверхностях с покрытием гидроксиапатит-Ta2O5 способствует большей адсорбции ионов Ca2+ из SBF-раствора. Таким образом, комбинированное покрытие титановых имплантов благодаря слою из Ta2O5 обеспечивает хорошую устойчивость к коррозии, в то время как биологически активный наружный кальций-фосфатный слой дополнительно повышает биосовместимость in vitro [6]. Кроме того, оксид тантала в составе биоматериалов является рентгеноконтрастным агентом для высокоэффективной рентгеновской компьютерной томографии, что необходимо для визуализации процессов взаимодействия тканей организма с имплантами [7]. Препараты на основе наночастиц оксида тантала перспективны для локальной радиомодификации [8]. Установлено, что они образуют оболочки вокруг ядер клеток и повышают эффективность при лучевой терапии за счет генерации вторичных электронов [9]. Цементы, содержащие оксид тантала, показывают хорошую рентгеноконтрастность и биоактивность [10]. Пористая биоинертная керамика из оксида тантала может быть химически активирована щелочной гидротермальной обработкой. При этом на поверхности такой керамики в среде SBF образуются фосфаты кальция, что подтверждает биоактивность полученных образцов [11]. Обнаружено также, что введение оксида тантала в силикатную стеклокерамику, с одной стороны, улучшает ее механические свойства, а с другой – подавляет биоактивность [12]. Цикл работ [13–15] посвящен получению биоактивных стекол в системе SiO2–ZnO–CaO–SrO–P2O5 путем замещения оксида цинка оксидом тантала. Авторы показали, что введение оксида тантала в сетку стекла делает его рентгеноконтрастным, а также приводит к изменению прочностных характеристик и растворимости. Полученные стекла обладают антибактериальной и противогрибковой активностью и не оказывают токсического действия по результатам теста на цитотоксичность.
Цель настоящей работы – разработка методов получения рентгеноконтрастной танталсодержащей стеклокерамики путем допирования стекла Bioglass 45S5, полученного из органических растворов, оценка биоактивности образцов in vitro, выяснение причин снижения биоактивности стекла с увеличением содержания оксида тантала.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали олеат натрия (C18H33O2Na, 98%), олеат кальция (C36H66O4Ca, 98%), скипидар (сульфатный очищенный для органического синтеза), тетраэтоксисилан (C8H20O4Si, 99.5%), трибутилфосфат (C12H27O4P, 99%), бензол (C6H6, 99.8%), окись тантала (Ta2O5, 99%). Органический раствор для стекла Bioglass 45S5 получали следующим образом. В раствор, содержащий олеат натрия в скипидаре и тетраэтоксисилан, добавляли раствор олеата кальция в скипидаре с бензолом и трибутилфосфатом.
Для допирования биостекла танталом использовали три различных метода.
I. В приготовленный органический раствор, содержащий кальций, кремний, натрий и фосфор, добавляли рассчитанные количества экстракта тантала. Экстракцию тантала проводили следующим образом. Исходную водную фазу готовили сплавлением 0.13 г Ta2O5 и 6 г K2S2O7 при 800°С с последующим выщелачиванием сплава 6%-ным раствором H2C2O4 · 2H2O при нагревании. Экстрагент – 20%-ный бензольный раствор три-н-октиламина, предварительно обработанный 10%-ным водным раствором H2SO4. Полученный экстракт содержал 1.7 г/л тантала. После смешивания всех компонентов проводили отгонку растворителя при температуре 150–200°С. Полученную массу (прекурсор) переносили в тигель и подвергали пиролизу, нагревая в муфельной печи до 1300°С со скоростью 7 град/мин, затем выдерживали при этой температуре в течение 20 мин. После этого образец переносили в камеру отжига с температурой 520–550°С, выдерживали при этой температуре 2 ч, а затем охлаждали до комнатной температуры. Этим способом получены стекла, содержащие 1–4 мас. % Ta2O5.
II. В приготовленный органический раствор, содержащий кальций, кремний, натрий и фосфор, после частичной отгонки растворителя добавляли оксид тантала в необходимых количествах. Принцип получения танталсодержащего стекла – отгонка растворителя, пиролиз, охлаждение – аналогичен способу I. Получены стекла, содержащие 5–40 мас. % Ta2O5.
III. Из органического раствора при 1300°С получено биостекло Bioglass 45S5. Далее готовили смеси, содержащие рассчитанные количества стекла и оксида тантала, тщательно измельчали их и нагревали до 1300°С со скоростью 7 град/мин с выдержкой при этой температуре в течение 20 мин. Получены стекла, содержащие 5–40 мас. % Ta2O5. Содержание компонентов в образцах в пересчете на их оксиды представлено в табл. 1.
Таблица 1.
Состав образцов
| № п/п | Содержание компонентов, мас. % | ||||
|---|---|---|---|---|---|
| Ta2O5 | SiO2 | Na2O | CaO | P2O5 | |
| 1 | 0 | 45 | 24.5 | 24.5 | 6 |
| 2 | 3 | 43.65 | 23.77 | 23.77 | 5.8 |
| 3 | 5 | 42.75 | 23. 28 | 23.28 | 5.7 |
| 4 | 10 | 40.5 | 22.05 | 22.05 | 5.4 |
| 5 | 20 | 36.00 | 19.6 | 19.6 | 4.8 |
| 6 | 30 | 31.5 | 17.15 | 17.15 | 4.2 |
| 7 | 40 | 27 | 14.7 | 14.7 | 3.6 |
Рентгенофазовый анализ (РФА) образцов выполняли на дифрактометре D8 Advance (Bruker AXS, Германия) в CuKα-излучении с графитовым монохроматором. Кристаллические фазы образующихся на разных стадиях синтеза стекол определяли с помощью программы поиска EVA по базе порошковых данных PDF-2. Для исследования качественного и количественного элементарного состава, а также морфологии образцов использовали метод растровой электронной микроскопии (РЭМ). РЭМ-изображения образцов и энергодисперсионные спектры получали на электронном сканирующем микроскопе S5500 Hitachi (Япония). Спектры ЯМР и MAS ЯМР 31P регистрировали на спектрометре Avance AV-300 фирмы Bruker (Германия) при температуре 305 K. Частота вращения образца в MAS-экспериментах составляла 7 кГц. Измерения химических сдвигов (ХС) резонансных линий проводили методом замещения с использованием в качестве стандарта 85%-ной H3PO4 (31P). Ошибка измерения ХС составляла 1.0 м.д. Разложение спектра на компоненты гауссовой формы проводили в самостоятельно разработанной программе с использованием модифицированного метода минимизации Ньютона. Ошибка подгонки кривой не превышала 8% от ее площади.
Биоактивность полученных образцов оценивали in vitro с помощью модельной среды – SBF-раствора. Процедура приготовления SBF-раствора аналогична методу, предложенному в работе [16]. К модельному раствору, полученному растворением в дистиллированной воде соответствующих реагентов (табл. 2), при температуре 37°С приливали раствор HCl до pH 7.4. Раствор по минеральному составу идентичен плазме крови. Образцы выдерживали в растворе в течение 14 и 25 сут в термостате при температуре 37°С. Раствор обновляли каждые 48 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Использование неводных сред позволяет избегать дробной кристаллизации при упаривании растворов и обеспечивает заданный состав продуктов, в частности биологически активных материалов [17, 18]. Для получения биостекол нами ранее разработан метод пиролиза органических растворов [17]. В качестве растворимых в органических растворителях компонентов стекла были использованы тетраэтоксисилан, трибутилфосфат и олеаты натрия и кальция. Отмечен ряд преимуществ получения биостекол этим методом. Он позволяет вводить в стекло допирующие компоненты, изменяющие свойства стекол. Для придания биостеклам рентгеноконтрастных свойств в состав стекла вводят оксиды тяжелых металлов. Их удобно вводить в виде экстрактов в органических растворителях. К сожалению, экстракция тантала из оксалатно-сульфатных растворов не позволяет получать высококонцентрированные экстракты. Это ограничивает возможность получения стекла с содержанием Ta2O5 более 4 мас. %. Для получения биостекол с высоким содержанием тантала мы вводили оксид тантала в прекурсор или готовое стекло.
Ранее [17] нами показано, что образцы с содержанием Ta2O5 до 4 мас. % биоактивны и рентгеноконтрастны. Согласно [12], механические и физические свойства стекла могут быть улучшены добавлением Ta2O5, но при этом снижается биологическая активность материала. Сделан вывод, что Ta2O5 подавляет образование апатита – при добавлении его в образец в количестве 3 мол. % (или 18 мас. %) апатитовый слой не наблюдается при погружении образца в SBF-раствор даже в течение 30 сут. Для выяснения причины подавления биоактивности стекол получены образцы с содержанием оксида тантала до 40 мас. % и исследовано их поведение в SBF-растворе.
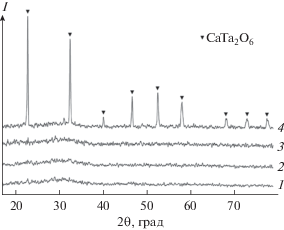
Данные РФА показывают, что пиролиз прекурсора после отгонки растворителя для состава, соответствующего Bioglass 45S5, при 600–1000°С приводит к образованию смеси рентгеноаморфной фазы с кристаллическими фазами различных силикатов натрия и кальция (табл. 3). В отличие от данных, полученных в работах [2, 19], образование гидроксиапатита или оксиапатита в этом температурном интервале не наблюдается. При 1300°С образец становится рентгеноаморфным. На дифрактограммах образцов, содержащих оксид тантала, при температурах 600–1000°С помимо указанных фаз обнаруживается кристаллическая фаза СаTa2O6, но отсутствуют кристаллические фазы фосфатов натрия и кальция (табл. 3, рис. 1). При 1300°С образцы, содержащие <20% Ta2O5, становятся рентгеноаморфными. В образцах с более высоким содержанием Ta2O5 сохраняются кристаллы СаTa2O6, что, очевидно, связано с ограниченной растворимостью танталата кальция в стекле. Разницы в дифрактограммах образцов с одинаковым содержанием оксида тантала, полученных II и III способами, не отмечено.
Таблица 3.
Обжиг прекурсоров при различных температурах
| Состав прекурсора, мас. % | Фазы при обжиге | ||
|---|---|---|---|
| 700°С | 1000°С | 1300°С | |
| 45 SiO2, 24.5 Na2O, 24.5 CaO, 6 P2O5 |
Pентгеноаморфная; Na2CaSi3O8; Na3PO4; Ca2SiO4 · Ca3(PO4)2 |
Pентгеноаморфная; Na2CaSi3O8; Na3PO4; Ca2SiO4 · Ca3(PO4)2 |
Pентгеноаморфная |
| 43.65 SiO2, 23.77 Na2O, 23.77 CaO, 5.8 P2O5, 3 Ta2O5 |
Pентгеноаморфная; Na4Ca(SO4)3; Ca2SiO4; Na4Ca4(Si6O18) |
Pентгеноаморфная; Na4Ca(SO4)3; Ca2SiO4; Na4Ca4(Si6O18); |
Pентгеноаморфная |
| 42.75 SiO2, 23.28 Na2O, 23.28 CaO, 5.7 P2O5, 5 Ta2O5 |
Pентгеноаморфная; Ta2O5; СаTa2O6; Na15.78Ca3(Si6O12) |
Pентгеноаморфная; СаTa2O6; Na2CaSi3O8 |
Pентгеноаморфная |
| 36 SiO2, 19.6 Na2O, 19.6 CaO, 4.8 P2O5, 20 Ta2O5 |
Pентгеноаморфная; Ta2O5; СаTa2O6; Na15.78Ca3(Si6O12) |
Pентгеноаморфная; СаTa2O6; Na6Ca3Si6O18 |
Pентгеноаморфная |
| 31.5 SiO2, 17.5 Na2O, 17.5 CaO, 4.2 P2O5, 30 Ta2O5 |
Pентгеноаморфная; Ta2O5; СаTa2O6; Na15.78Ca3(Si6O12) |
Pентгеноаморфная; СаTa2O6; Na6Ca3Si6O18 |
Pентгеноаморфная; СаTa2O6 |
| 27 SiO2, 14.7 Na2O, 14.7 CaO, 3.6 P2O5, 40 Ta2O5 |
Pентгеноаморфная; СаTa2O6 * | Pентгеноаморфная; СаTa2O6 | Pентгеноаморфная; СаTa2O6 |
Рис. 1.
Дифрактограммы продуктов обжига прекурсора при 1300°С, содержащих 5 (1), 10 (2), 20 (3) и 30 мас. % Ta2O5 (4).
Образцы, содержащие до 10% Ta2O5, прозрачны и однородны (рис. 2а). Образцы с 20%-ным содержанием оксида тантала прозрачны, но выявлено присутствие отдельных кристалов СаTa2O6. Образцы с более высоким содержанием Ta2O5 непрозрачны, состоят из кристаллической фазы, равномерно распределенной в стеклофазе (рис. 2б). Тонкозернистая структура в полученных ситаллах характеризуется наличием кристаллов кубической формы с длиной ребра 0.5–1 мкм. Аналогичный процесс кристаллизации при допировании стекла Bioglass 45S5 оксидом вольфрама показан в работе [4]. Установлено, что образование вольфраматов кальция и натрия начинается при содержании в образце 9 мас. % W (или 11 мас. % WO3).
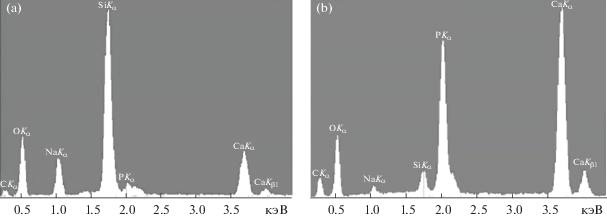
С помощью модельной среды оценивали биоактивность образцов, содержащих от 1 до 40 мас. % оксида тантала. Образец сравнения – стекло, содержащее 0% Ta2O5, полученное из органических растворов (Bioglass 45S5). В энергодисперсионном спектре стекла Bioglass 45S5 содержатся все компоненты: кремний, кислород, натрий, кальций и фосфор (рис. 3а). Энергодисперсионный спектр этого образца после выдержки в модельной среде состоит преимущественно из кальция и фосфора (рис. 3б). Содержание этих элементов по сравнению с кремнием и натрием на поверхности стекла возросло, что свидетельствует об образовании кальций-фосфатного слоя.
После пребывания образцов в модельном растворе в течение 14 сут обнаружено, что на поверхности образца стекла 45S5 образовалось плотное покрытие, имеющее вид растрескавшейся корки (рис. 4а). На поверхности образцов, содержащих 1–5% Ta2O5, образовались неплотные покрытия, имеющие вид островков разного размера (рис. 4б). Энергодисперсионные спектры покрытий соответствуют фосфатам кальция. На остальных образцах кальций-фосфатного покрытия не обнаружено. Установлено, что чем больше содержание оксида тантала в образце, тем меньшую площадь поверхности образца занимает кальций-фосфатное покрытие при прочих равных условиях.
Рис. 4.
Микрофотографии стекла 45S5 (а) и стекла, содержащего 3 мас. % Ta2O5 (б), после пребывания в SBF-растворе в течение 14 сут.

После пребывания в модельном растворе образцов с содержанием 10–40% Ta2O5 в течение 25 сут на поверхности образца, содержащего 10% Ta2O5, наблюдаются отдельные кальций-фосфатные частицы размером ∼1 мкм (рис. 5а). Образец, содержащий 20% Ta2O5, не имеет кальций-фосфатного покрытия. Полученные результаты подтверждают, что биоактивность образцов снижается с увеличением количества Ta2O5 в составе стекла 45S5. Образцы, содержащие 30 и 40 мас. % Ta2O5, после пребывания в SBF-растворе в течение 25 сут значительно изменились. Стеклянная фаза на поверхности образца растворилась, остались кристаллы CaTa2O6 (рис. 5б).
Рис. 5.
Микрофотография стекла после пребывания в SBF-растворе в течение 25 сут образцов, содержащих 10 (а) и 40 мас. % Ta2O5 (б).

Принято считать [20], что биологическая активность стекла 45S5 обусловлена гидролизом силикатной сетки с появлением на поверхности стекла силанольных групп (Si–OH), которые сорбируют ионы кальция из SBF-раствора с последующим формированием слоя гидроксиапатита. Очевидно, что биоактивность не может быть обусловлена только сорбционными свойствами Si–OH-групп, иначе максимальной биоактивностью обладал бы силикагель с высокоразвитой поверхностью. В процессе образования слоя гидроксиапатита на поверхности стекла должны принимать участие катионы кальция и анионы ${\text{РО}}_{{\text{4}}}^{{{\text{3}}--}},$ которые выщелачиваются из стекла при растворении фосфатно-силикатной сетки и создают условия для перенасыщения раствора фосфатами кальция в приповерхностном слое. Одной из возможных причин подавления биоактивности стекол с ростом содержания Ta2O5 может быть замещение Р2О5 и удаление в процессе варки из состава стекол фосфора в виде фосфорного ангидрида, способного возгоняться при достаточно низких температурах. Для проверки этого предположения нами были исследованы спектры ЯМР 31Р.
Спектры ЯМР ВМУ 31P исследованных стекол представляют собой асимметричные двухкомпонентные линии. Соотношение интегральных интенсивностей компонент, их химические сдвиги и общая интенсивность сигнала ЯМР различаются для разных образцов. Как известно, ХС сигналов в спектрах ЯМР 31P фосфатных стекол зависят от степени деполимеризации фосфатных групп [21].
Как видно из рис. 6, как в спектре MAS ЯМР 31P исходного стекла, так и в спектре стекла с танталом наблюдается по два сигнала, соответствующих полностью деполимеризованным группировкам ${\text{РО}}_{{\text{4}}}^{{{\text{3}}--}}$ (P(0), сигналы с большими значениями сдвига) и группировкам P(1), сохраняющим связь P–O–P и входящим в состав фосфатной стекольной сетки. Относительные интегральные интенсивности указанных сигналов в этих стеклах (рис. 6, табл. 4) практически совпадают. Смещение сигнала ЯМР в слабое магнитное поле для стекла, содержащего тантал, вероятно, обусловлено изменением степени полимеризации фосфатных групп. Таким образом, удаление фосфора из стекла с ростом концентрации тантала не подтверждается данными ЯМР и не может являться причиной подавления биоактивности.
Рис. 6.
Спектры ЯМР ВМУ 31P исследованных стекол: биостекло 45S5 + 40% Ta2O5 (1), биостекло 45S5 (2), прекурсор 45S5 + 40%Ta2O5 (3).
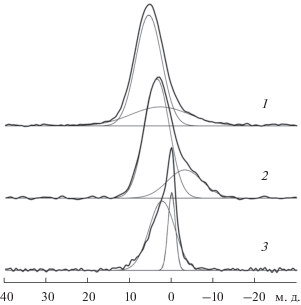
Таблица 4.
Сравнительные удельные интегральные интенсивности (Ио) центрального сигнала, интенсивности (Ик) и химические сдвиги (ХС) компонент спектров ЯМР ВМУ 31P исследованных стекол
| Образец | Ио, % | ХС, м.д. | Ик | ХС, м.д. | Ик |
|---|---|---|---|---|---|
| Биостекло 45S5 | 100 | 3.6 | 74 | –3 | 26 |
| Прекурсор 45S5 + 40 мас. % Ta2O5, полученный при 500°С | 69.02385 | 2.4 | 76 | 0 | 24 |
| Биостекло 45S5 + 40 мас. % Ta2O5, полученное при 1300°С | 98.15484 | 5.6 | 71 | 2.8 | 29 |
Еще одной причиной снижения биологической активности стекол с ростом концентрации тантала может быть выведение из стекла кальция. Как показывают результаты РФА, в процессе замещения SiO2 на Ta2O5 в стекле происходит образование кристаллов CaTa2O6. Процесс образования кристаллической фазы можно представить схемой:
{(SiO2)1 –x, Na2O, CaO, P2O5} + xTa2O5 → → {(SiO2)1 –x, Na2O, P2O5} + хCaTa2O6.
В предельном случае при х → 1 может получиться образец, содержащий фазы танталата кальция и растворимые в воде фосфаты и силикаты натрия.
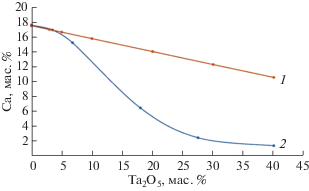
Как следует из данных, приведенных в табл. 1, с ростом содержания оксида тантала в образцах снижается содержание кальция. Необходимо отметить, что в данном случае это общее содержание кальция, присутствующего как в сетке стекла, так и в составе кристаллов CaTa2O6. Содержание кальция только в стекле можно определить с помощью анализа энергодисперсионных спектров образцов. Как видно из рис. 7, при увеличении содержания тантала происходит постепенное снижение концентрации кальция на поверхности стекла за счет выведения катионов кальция из сетки стекла в кристаллическую фазу. В результате этого у образцов с содержанием более 30% Ta2O5 стеклофаза становится растворимой в SBF-растворе (рис. 5б). Таким образом, одной из основных причин подавления биоактивности стекол с увеличением содержания Ta2O5 является постепенное снижение концентрации кальция в стекле за счет образования нерастворимых кристаллов CaTa2O6, в результате чего в поверхностном слое не происходит пересыщения раствора SBF катионами кальция и кальций-фосфатный слой перестает осаждаться на поверхности образца. Образцы, содержащие в составе до 10 мас. % Ta2O5, являются одновременно и рентгеноконтрастными, и биоактивными, а значит, могут применяться в качестве материалов для восстановительной хирургии.
ЗАКЛЮЧЕНИЕ
На основе биостекла 45S5 получены и охарактеризованы методами ЯМР на ядрах 31Р, РФА и РЭМ рентгеноконтрастные стекла и стеклокерамика, содержащие 1–40 мас. % Ta2O5. Проведена in vitro оценка биоактивности полученных образцов с помощью модельной среды (SBF-раствора). Установлен механизм подавления биологической активности стекла с увеличением содержания оксида тантала. Основной причиной подавления биоактивности стекол названо снижение концентрации кальция в стекле за счет образования нерастворимых кристаллов CaTa2O6.
Образцы, содержащие до 10 мас. % Ta2O5, представляют перспективу для современной медицины в качестве материалов для восстановления костной ткани. Рентгеноконтрастное вещество в составе биоматериала дает возможность контролировать процесс регенерации костной ткани.
Список литературы
Tankut A., Dorozhkin S.V., Omer K. et al. // Ceram. Int. 2019. V. 45. № 17. P. 22752. https://doi.org/10.1016/j.ceramint.2019.07.314
Grishchenko D.N., Medkov M.A., Papynov E.K. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. Р. 431. [Грищенко Д.Н., Медков М.А., Папынов Е.К. и др. // Журн. неорган. химии. 2020. Т. 65. № 3. С. 403.] https://doi.org/10.1134/S0036023620030055
Sakthi Prasad S., Itishree Ratha, Tarun Adarsh et al. // J. Mater. Res. 2018. V. 33. № 2. P. 178. https://doi.org/10.1557/jmr.2017.442
Medkov M.A., Grishchenko D.N., Kuryavyi V.G., Slobodyuk A.B. // Glass Ceram. 2018. V. 75. № 7–8. P. 322. [Медков М.А., Грищенко Д.Н., Курявый В.Г., Слободюк А.Б. // Стекло и керамика. 2018. № 8. С. 40.] https://doi.org/10.1007/s10717-018-0079-5
Horandghadim N., Khalil-Allafi J., Urgen M. // Mater. Sci. Eng. C. 2019. V. 102. P. 683. https://doi.org/10.1016/j.msec.2019.05.005
Ying-Sui Sun, Her-Hsiung Huang // J. Alloys Compd. 2018. V. 743. P. 99. https://doi.org/10.1016/j.jallcom.2018.01.340
Oh M.H., Lee N., Kim H. et al. // J. Am. Chem. Soc. 2011. V. 133. № 14. P. 5508. https://doi.org/10.1021/ja200120k
Лукьяненко К.С., Апанасевич В.И., Лагурева А.В. и др. // Тихоокеанский медицинский журн. 2016. № 4. С. 38. https://doi.org/10.17238/PmJ1609-1175.2016.4.38-40
Engels E., Corde S., McKinnon S. et al. // Physica Medica. 2016. V. 32. № 12. P. 1852. https://doi.org/10.1016/j.ejmp.2016.10.024
Zamparini F., Siboni F., Prati C. et al. // Clinical Oral Investigations. 2019. V. 23. P. 445. https://doi.org/10.1007/s00784-018-2453-7
Marques C., Louro L.H.L., Prado da Silva M.H. // Key Eng. Mater. V. 396–398. P. 641. https://doi.org/10.4028/www.scientific.net/KEM.396-398.641
Riaz M., Zia R., Saleemi F. et al. // Mater. Sci. Poland. 2016. V. 34. № 1. P. 13. https://doi.org/10.1515/msp-2016-0013
Alhalawani A., Towler M.R. // Mater. Charact. 2016. V. 114. P. 218. https://doi.org/10.1016/j.matchar.2016.03.004
Alhalawani A.M., Towler M.R. // Mater. Sci. Eng. C. 2017. V. 72. P. 202. https://doi.org/10.1016/j.msec.2016.11.066
Alhalawani A.M., Mehrvara C., Stonec W. et al. // Mater Sci Eng. C. 2017. V. 71. P. 401. https://doi.org/10.1016/j.msec.2016.10.024
Kokubo T., Takadama H. // Biomaterials. 2006. V. 27. № 15. P. 2907. https://doi.org/10.1016/j.biomaterials.2006.01.017
Медков М.А., Грищенко Д.Н., Дмитриева Е.Э., Курявый В.Г. // Химическая технология. 2019. Т. 20. № 7. С. 299. https://doi.org/10.31044/1684-5811-2019-20-7-299-304
Larionov D.S., Kuzina M.A., Evdokimov P.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 312.
Solonenko A.P., Blesman A.I., Polonyankin D.A., Gorbunov V.A. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 993.
Путляев В.И. // Соровский образовательный журн. 2004. Т. 8. № 1. С. 44. https://studylib.ru/doc/2355605/himiya-himiya-sovremennye-biokeramicheskie-materialy
Eckert H. // J. Sol-Gel Sci. Technol. 2018. V. 88. P. 263. https://doi.org/10.1007/s10971-018-4795-7
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии