Журнал неорганической химии, 2020, T. 65, № 11, стр. 1497-1505
Высокотемпературный спин-кроссовер в комплексах клозо-боратов железа(II) с 2,6-бис(бензимидазол-2-ил)пиридином
А. Д. Иванова a, Л. Г. Лавренова a, b, *, Е. В. Коротаев a, С. В. Трубина a, Л. А. Шелудякова a, С. А. Петров c, К. Ю. Жижин d, Н. Т. Кузнецов d
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
c Институт химии твердого тела и механохимии СО РАН
630128 Новосибирск, ул. Кутателадзе, 18, Россия
d Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: ludm@niic.nsc.ru
Поступила в редакцию 17.06.2020
После доработки 24.06.2020
Принята к публикации 26.06.2020
Аннотация
Синтезированы новые координационные соединения железа(II) с 2,6-бис(бензимидазол-2-ил)пиридином (L) и клозо-боратными(2-) анионами состава [FeL2][B10H10] ∙ 2H2O и [FeL2]B12H12 ∙ H2O. Комплексы изучены методами статической магнитной восприимчивости, электронной (спектры диффузного отражения), ИК- и EXAFS-спектроскопии, рентгенофазового анализа. Изучение зависимости μэф(T) в диапазоне температур 80–500 K показало, что в них проявляется высокотемпературный спин-кроссовер 1А1 ⇔ 5Т2.
ВВЕДЕНИЕ
Спин-кроссовер (СКО, спиновый переход) может проявляться в координационных соединениях металлов с электронной конфигурацией 3d4–3d7 в октаэдрическом или псевдооктаэдрическом окружении лигандов определенной силы поля. Изменение спиновой мультиплетности происходит под влиянием изменения внешних условий: температуры, давления, облучения светом определенной длины волны и других факторов. Изучению этого явления посвящен ряд монографий, большое число обзоров и статей [1–9]. Соединения, способные существовать в двух состояниях с достаточно продолжительным временем жизни, перспективны для использования в качестве элементной базы для электронных устройств [3, 10–15]. К одному из классов соединений, в которых наблюдается спин-кроссовер, принадлежат комплексы железа(II) с полиазотсодержащими гетероциклическими лигандами, имеющие октаэдрическое строение координационного полиэдра, узел FeN6. В ряде таких соединений наблюдается термоиндуцированный СКО. Температура и характер спинового перехода в данных комплексах зависят от ряда факторов, в частности, от их структуры, природы лиганда и аниона, присутствия и числа кристаллизационных молекул растворителя, в частности воды, в структуре. Особо следует отметить существенное влияние на температуру СКО анионов, которые в этих комплексах занимают внешнесферное положение.
В данной работе в качестве лиганда для синтеза комплексов выбран 2,6-бис(бензимидазол-2-ил)пиридин (L) (схема 1 ). До начала нашей работы было известно всего несколько соединений железа(II) с L, обладающих СКО, в частности, комплексы перхлората и тетрафенилбората Fe(II) [16, 17]. Нами был получен ряд комплексов Fe(II) с L состава [FeL2]Ai · nH2O (A = ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}},$ ${\text{SiF}}_{{\text{6}}}^{{{\text{2}}--}},$ ${\text{ReO}}_{{\text{4}}}^{--};$ Br–, ${\text{NO}}_{{\text{3}}}^{--},$ ${{{\text{C}}}_{{\text{2}}}}{\text{N}}_{{\text{3}}}^{--};$ i = 1, 2; n = 0.5–2), в которых наблюдается СКО [18, 19]. В продолжение этих работ нами синтезированы и исследованы комплексы железа(II) с L, содержащие кластерные анионы бора [B10H10]2– и [B12H12]2–. Соли кластерных анионов бора перспективны для синтеза биологически активных комплексов, в том числе цитотоксических препаратов [20–24].
Схема 1 . Строение 2,6-бис(бензимидазол-2-ил)пиридина (L).
Ранее нами были синтезированы комплексы железа(II) с рядом полиазотсодержащих лигандов, в частности с 1,2,4-триазолами и трис(пиразол-1-ил)метанами, содержащие в качестве внешнесферных анионов [B10H10]2– и [B12H12]2– [8, 25–27]. В большинстве этих соединений был обнаружен спин-кроссовер. Представлялось целесообразным продолжить исследования в этом направлении. Поиск новых би- и полифункциональных соединений является важной научной задачей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали FeSO4 ∙ 7H2O фирмы Acros Organics, аскорбиновую кислоту “мед.”, 2,6-бис(бензимидазол-2-ил)пиридин фирмы Aldrich, этанол “ректификат”. Все реагенты использовали без дополнительной очистки. Комплексы K2[B10H10] · 2H2O и K2[B12H12] получены по методике [28].
Синтез [FeL2][B10H10] ∙ 2H2O (1), [FeL2][B12H12] ∙ H2O (2). Навеску 0.14 г (0.5 ммоль) соли FeSO4 ∙ 7H2O растворяли в 6 мл дистиллированной воды, подкисленной 0.12 г аскорбиновой кислоты. К полученному раствору при перемешивании добавляли полуторакратный избыток K2[B10H10] ∙ 2H2O (0.17 г, 0.75 ммоль) или K2[B12H12] (0.17 г, 0.75 ммоль) в 5 мл воды. Затем медленно при перемешивании к каждому из полученных растворов прибавляли нагретый раствор 0.31 г (1 ммоль) L в 25 мл этанола. Сразу после смешивания растворов выпадали темно-фиолетовые осадки, которые перемешивали на магнитной мешалке в течение 5 ч. Осадки отфильтровывали, промывали по два раза 1 мл воды и 1 мл этанола, высушивали на воздухе. Выход соединений 1 и 2 составил 95 и 85% соответственно.
| С | H | N | |
| Найдено,%: | 54.5; | 4.4; | 16.6. |
| Для C38H40B10FeN10O2 | |||
| вычислено, %: | 54.8; | 4.8; | 16.8. |
| Найдено, %: | 54.2; | 5.0; | 16.3. |
| Для C38H40B12FeN10O | |||
| вычислено, %: | 54.4; | 4.8; | 16.7. |
Элементный анализ на C, H, N проводили в аналитической лаборатории ИНХ СО РАН на приборе Euro EA 3000 фирмы EuroVector (Италия).
Рентгенофазовый анализ поликристаллических соединений выполнен на дифрактометре ShimadzuXRD 7000 (CuKα-излучение, Ni-фильтр, сцинтилляционный детектор) при комнатной температуре.
Статическую магнитную восприимчивость образцов измеряли методом Фарадея в интервале температур 80–480 K. Температурная стабилизация образца с точностью 1 K во время измерения осуществлялась с помощью ПИД-регулятора DTB9696 фирмы Delta Electronics. Скорость нагрева и охлаждения образцов составляла ~2–3 град/мин. Напряженность внешнего магнитного поля при проведении исследований 7.3 кЭ поддерживали с точностью стабилизации ~2%. Для проведения исследований дегидратированных комплексов изучаемые образцы помещали в открытые кварцевые ампулы, вакуумировали до остаточного давления в измерительной ячейке установки 10‒2 мм рт. ст., затем создавали инертную атмосферу гелия при давлении 5 мм рт. ст. При исследовании соединений, содержащих кристаллизационную воду, образцы запаивали с атмосферным воздухом в кварцевые ампулы. Значения эффективного магнитного момента вычисляли по формуле μэф = ${{\left( {{\text{8}}\chi _{{\text{M}}}^{'}T} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$ где $\chi _{{\text{M}}}^{'}$ – молярная магнитная восприимчивость, исправленная на диамагнитный вклад по схеме Паскаля. Температуры прямого (Тс↑) и обратного (Тс↓) переходов исследованных комплексов были определены исходя из условия d2μэф/dT2 = 0.
ИК-спектры поглощения снимали на ИК-Фурье-спектрометрах Scimitar FTS 2000 в области 4000–400 см–1 и Vertex 80 в области 400–100 см–1. Образцы готовили в виде суспензий в вазелиновом и фторированном маслах и полиэтилене.
Спектры диффузного отражения (СДО) Кубелки–Мунка регистрировали на сканирующем спектрофотометре UV-3101 РС фирмы Shimadzu при комнатной температуре.
Мессбауэровские спектры комплексов измеряли при температуре 295 K на спектрометре NP-610 с источником 57Co (Rh).
Рентгеновские спектры поглощения в районе FeK-края получены в стандартном режиме “на просвет образца” в диапазоне 800 эВ выше края поглощения (7112 эВ) с использованием двойного кристалла-монохроматора Si (111). Исследования выполнены на 8 канале источника ВЭПП-3, ЦСТИ ИЯФ СО РАН. Измерения для [FeL2][B10H10] · 2H2O проводили при двух температурах: Т ~ 300 K (соединение в низкоспиновом (НС) состоянии) и T = 450 K (соединение в высокоспиновом (ВС) состоянии). Для [FeL2][B12H12] · H2O измерение выполнено только при комнатной температуре. При нагреве образец помещали в печь, открытую с обоих концов, температуру контролировали хромель-алюмелевой термопарой. Осциллирующая часть (χ(k)) спектра поглощения получена с использованием программы VIPER, моделирование проводили в программе EXCURV для нефильтрованных (исходных) спектров в приближении многократного рассеяния целой молекулы без учета кластерных анионов бора. При моделировании структуры лиганда (L) для уменьшения количества варьируемых параметров не учитывались бензольные кольца, которые вследствие структурной удаленности от центрального атома железа оказывают слабое влияние на форму EXAFS-спектра. Процедура моделирования была проведена в диапазоне волновых векторов Δk = 3.0–13 Å–1 со взвешивающим коэффициентом w = k3 и значением фактора амплитудного подавления $S_{0}^{2}$ = 1.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексы [FeL2][B10H10] ∙ 2H2O и [FeL2][B12H12] ∙ H2O выделяли из системы вода/этанол при концентрации Fe2+ ~ 0.15 моль/л и стехиометрическом соотношении Fe : L. В качестве восстановителя и слабоподкисляющего реагента использовали аскорбиновую кислоту. На первой стадии синтеза получали раствор клозо-бората железа(II) из водного раствора FeSO4 с использованием полуторакратного избытка солей K2[B10H10] ∙ 2H2O или K2[B12H12]. На второй стадии проводили реакцию полученных растворов с этанольным раствором лиганда. Комплексы выделяются с высоким выходом (80–90%).
В табл. 1 приведены основные колебательные частоты L и комплексов 1, 2. В высокочастотной области спектров комплексов (3460–3630 см–1) проявляются полосы валентных колебаний O–H. В спектре L в области 3400–2800 см–1 расположены широкие полосы валентных колебаний NH-групп, включенных в водородные связи. В спектрах комплексов полосы ν(NH) становятся более узкими и проявляются при 3210, 3183 см–1 (1) и 3274 см–1 (2). Смещение полос ν(NH) в высокочастотную область и более четкое их проявление по сравнению со спектром L, вероятно, связаны с ослаблением водородных связей при переходе от лиганда к комплексам. В диапазоне 2500–2400 см–1 проявляются полосы валентных колебаний B–H. Положение полос в области колебаний колец в спектрах комплексов 1, 2 заметно изменяется по сравнению со спектром L, что указывает на координацию атомов азота гетероциклов к железу(II). Это подтверждается и характером спектров 1, 2 в низкочастотной области. Здесь обнаруживаются полосы при 280 см–1, отсутствующие в спектре лиганда, которые можно отнести к валентным колебаниям M–N.
Таблица 1.
Основные колебательные частоты (см–1) в спектрах L и комплексов 1, 2
| Соединение | Отнесение | ||
|---|---|---|---|
| L | 1 | 2 | |
| 3460 | 3630 3594 3513 |
ν(O–H) | |
| 3173 3150 |
3210 3183 |
3274 | ν(N–H) |
| 3070 | 3077 3054 |
3077 3048 |
ν(C–H) |
| 2463 2435 |
2485 2405 |
ν(B–H) | |
| 1601 1589 1574 1541 1489 |
1609 1591 1528 1486 |
1610 1591 1530 1488 |
Rкольца |
| – | 280 | 280 | ν(M–N) |
В СДО комплексов 1 и 2 в видимой и ближней инфракрасной областях присутствуют две широкие полосы поглощения при 537 и 755 нм (1); 510 и 709 нм (2). Полосы в интервале 500–540 нм с максимумами при 537 (1) и 510 (2) см–1 можно отнести к d–d-переходу 1A1 → 1T1 в сильном искаженно-октаэдрическом поле лигандов. Положение этих полос типично для низкоскоспиновых октаэдрических комплексов железа(II) с азотсодержащими лигандами, имеющих хромофор FeN6 [4, 26]. Полосы поглощения в интервале 700–760 нм с максимумами при 755 (1) и 709 нм (2) относятся к d–d-переходу 5Т2 → 5Е в высокоспиновых октаэдрических комплексах Fe(II) с азотсодержащими лигандами. Для этих форм комплексов νВС = ΔВС. Рассчитаны значения параметров расщепления для 1, 2 с использованием следующих приближений: νНС = ΔНС – C + 86B2/ΔНС; ΔВС ≈ 19B; С = 4.41В [29–31] (табл. 2). Сравнение значений параметров расщепления для трех классов изучаемых нами соединений – комплексов Fe(II) с 1,2,4-триазолами [4], трис(пиразол-1-ил)метанами [4] и 2,6-бис(бензимидазол-2-ил)пиридином ([19] и эта работа) показывает, что последний является лигандом более сильного поля по сравнению с 1,2,4-триазолами, в то время как значения параметров расщепления ΔНС и ΔВС в комплексах с трис(пиразол-1-ил)метанами и 2,6-бис(бензимидазол-2-ил)пиридином близки.
Таблица 2.
Рассчитанные значения B, C и параметров расщепления ΔВС и ΔНС комплексов 1, 2
| Комплекс | ν(1A1 → 1T1), см–1 | ν(5Т2 → 5Е) = ΔВС, см–1 | B, см–1 | С, см–1 | ΔНС, см–1 |
|---|---|---|---|---|---|
| 1 | 1.86 × 104 | 1.32 × 104 | 697 | 3.07 × 103 | 1.96 × 104 |
| 2 | 1.96 × 104 | 1.41 × 104 | 742 | 3.27 × 103 | 2.06 × 104 |
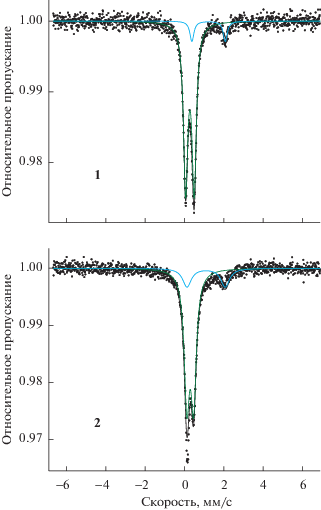
Мессбауэровские спектры комплексов (рис. 1) представляют собой суперпозицию линий, относящихся к НС- и ВС-состояниям атомов железа(II). В результате обработки спектров находили химический сдвиг δ (относительно α-Fe) и квадрупольное расщепление ε для каждой из форм (табл. 3). В обоих случаях основной является НС-форма с более низкими значениями δ и ε, при этом значение αВС для комплекса с анионом [B12H12]2– почти в два раза выше, чем для комплекса с анионом [B10H10]2–.
Таблица 3.
Параметры мессбауэровских спектров комплексов 1, 2
| Комплекс | δ, мм/c | ε, мм/c | Г1,2, мм/c | αВС |
|---|---|---|---|---|
| [FeL2][B10H10] ∙ 2H2O (1) | 0.272 (НС) 1.223 (ВС) |
0.435 1.698 |
0.266 0.245 |
10.4 |
| [FeL2][B12H12] ∙ H2O (2) | 0.289 (НС) 1.094 (ВС) |
0.344 1.939 |
0.350 0.531 |
19.2 |
| Погрешность | ±0.001 | ±0.002 | ±0.010 |
Отличие мессбауэровских спектров синтезированных в настоящей работе соединений железа(II) с анионами [B10H10]2– и [B12H12]2– от изученных ранее комплексов состава [FeL2]Ai (A = ${\text{SO}}_{{\text{4}}}^{{{\text{2}}--}},$ ${\text{SiF}}_{{\text{6}}}^{{{\text{2}}--}},$ ${\text{ReO}}_{{\text{4}}}^{--};$ Br–; ${\text{NO}}_{{\text{3}}}^{--};$ ${{{\text{C}}}_{{\text{2}}}}{\text{N}}_{{\text{3}}}^{--};$ i = 1, 2) [18, 19] заключается в наличии в спектрах при 295 K линий ВС-форм железа(II). В спектрах ранее изученных комплексов только в одном случае при комнатной температуре присутствуют линии ВС-формы. Величины параметров δ и ε для НС-форм комплексов 1, 2 находятся в той же области значений, что и для ранее изученных соединений. Однако тенденция в поведении параметров (увеличение ε при увеличении δ), которую мы выявили ранее, для комплексов с кластерными анионами бора не наблюдается. Обращает на себя внимание еще одна особенность мессбауэровских спектров комплексов 1 и 2: линии квадрупольного дублета для ВС-формы комплекса с анионом [В10Н10]2– узкие, а для комплекса с анионом [В12Н12]2– более широкие. Это говорит о том, что ВС-форма, появляющаяся при спин-кроссовере, в первом случае является хорошо окристаллизованной, а во втором случае находится в слабоокристаллизованном состоянии.
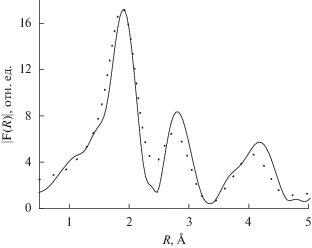
На рис. 2 приведены FeK XANES-спектры, измеренные при 300 K: [FeL2][B10H10] · 2H2O – сплошная линия, [FeL2][B12H12] · H2O – кружки; при 520 K [FeL2][B12H12] · H2O – пунктирная линия. Для образца, измеренного при T = 450 K и находящегося в высокоспиновом состоянии (пунктирная линия), наблюдается сдвиг края поглощения в область высоких энергий, что свидетельствует об увеличении положительного заряда на атоме железа. На рис. 3 и 4 приведены модули Фурье-преобразования экспериментальных FeK EXAFS-спектров (k2χ(k)) без учета фазового сдвига комплексов 1, 2. Как видно из рис. 3, модули Фурье-преобразования для образцов комплексов 1, 2 совпадают между собой с учетом погрешности измерения. Это свидетельствует о том, что структурные параметры ближайшего окружения ионов железа(II) аналогичны, поэтому для моделирования спектров EXAFS для этих двух соединений использовали одну и ту же модель. При нагреве [FeL2][B10H10] · 2H2O до температуры 450 K (высокоспиновое состояние) не происходит принципиальных изменений в структуре окружения атома железа (рис. 4), не наблюдается сдвигов максимумов, означающих изменение соответствующих межатомных расстояний. Можно отметить только уменьшение амплитуды максимумов за счет увеличения температурной части фактора Дебая. На рис. 5 и в табл. 4 приведены структурные данные для координационного узла, полученные в процессе моделирования спектра EXAFS комплекса [FeL2][B12H12] · H2O. Точность определения параметров из данных EXAFS: межатомные расстояния ±1% (для ближайшей сферы окружения). На рис. 6 приведены модули Фурье-преобразования экспериментального (сплошная линия) и модельного (пунктирная линия) FeK EXAFS-спектров (k2χ(k)) комплекса [FeL2][B12H12] · H2O. Измерения выполнены при комнатной температуре.
Рис. 2.
FeK XANES-спектры, измеренные при 300 K: [FeL2][B10H10] · 2H2O – сплошная линия, [FeL2][B12H12] · H2O – кружки; при 450 K: [FeL2][B12H12] · H2O – пунктирная линия.
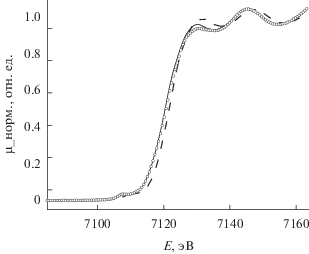
Рис. 3.
Модули Фурье-преобразования экспериментальных FeK EXAFS-спектров (k2χ(k)) без учета фазового сдвига комплексов [FeL2][B10H10] · 2H2O (сплошная линия) и [FeL2][B12H12] · H2O (кружки). Измерения выполнены при комнатной температуре.
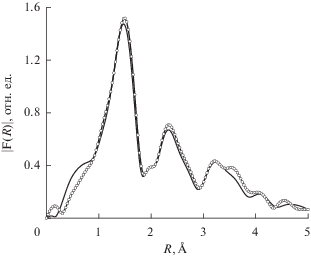
Рис. 4.
Модули Фурье-преобразования экспериментальных FeK EXAFS-спектров (k2χ(k)) без учета фазового сдвига комплекса [FeL2][B12H12] · H2O. Измерения выполнены при комнатной температуре (сплошная линия) и при T = 450 K (пунктирная линия).
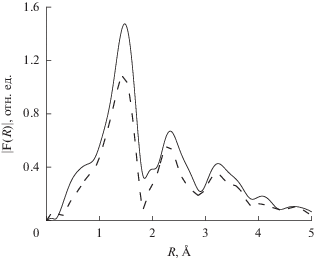
Рис. 5.
Структура координационного узла, полученная в процессе моделирования спектра EXAFS комплекса [FeL2][B12H12] · H2O.
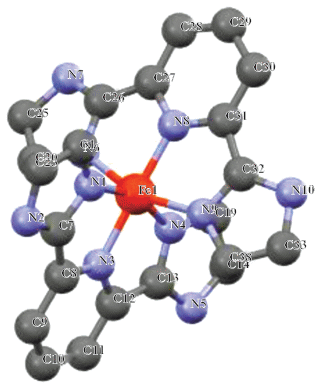
Таблица 4.
Некоторые длины связей и валентные углы в структуре комплекса [FeL2][B12H12] · H2O по данным EXAFS
| Связь | d, Å | Угол | ω, град |
|---|---|---|---|
| Fe(1)–N(8) | 1.90 | N(1)Fe(1)N(8) | 102.9 |
| Fe(1)–N(1) | 1.95 | N(1)Fe(1)N(6) | 93.3 |
| Fe(1)–N(9) | 1.98 | N(1)Fe(1)N(9) | 93.6 |
| Фактор Дебая–Валлера σ2(Fe–N), Å2 | 0.009; T = 300 K | ||
| 0.014; T = 450 K | |||
| FEXAFSa | 1.6 | ||
аFEXAFS = $\sum\nolimits_i^N {w_{i}^{2}{{{\left( {\chi _{i}^{{\exp }}(k) - \chi _{i}^{{th}}(k)} \right)}}^{2}}} ,$ wi = $\frac{{k_{i}^{n}}}{{\sum\nolimits_i^N {k_{i}^{n}\left| {\chi _{j}^{{\exp }}(k)} \right|} }}.$ FEXAFS – индекс, характеризующий качество моделирования. Точность определения параметров из данных EXAFS: межатомные расстояния ±1% (для ближайшей сферы окружения), парциальные координационные числа ±10–20%.
Рис. 6.
Модули Фурье-преобразования экспериментального (сплошная линия) и модельного (пунктирная линия) FeK EXAFS-спектров (k2χ(k)) комплекса [FeL2][B12H12] · H2O. Измерения выполнены при комнатной температуре.
Результаты исследования статической магнитной восприимчивости изучаемых соединений представлены на рис. 7, 8. Оба изученных комплекса в эмпирически подобранных температурных диапазонах стабильности комплексов демонстрируют спин-кроссовер как при наличии кристаллизационной воды, так и в дегидратированном состоянии. Температуры прямого и обратного переходов представлены в табл. 5.
Рис 7.
Температурные зависимости μэф (а, б) и d2μэф /dT2 (в, г) для [FeL2][B10H10] · 2H2O и [FeL2][B12H12] · H2O соответственно.
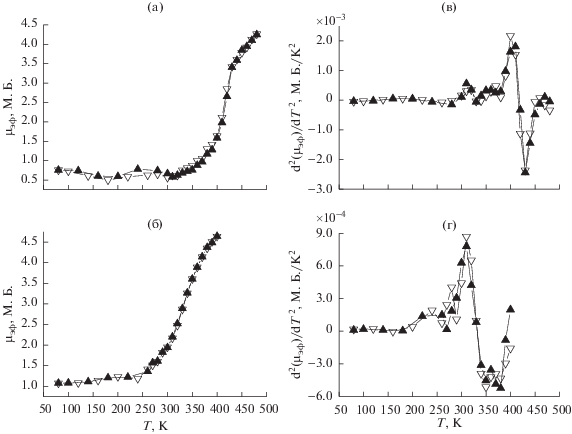
Рис. 8.
Температурные зависимости μэф (а, б) и d2μэф/dT2 (в, г) для дегидратированных комплексов [FeL2][B10H10] и [FeL2][B12H12] соответственно.
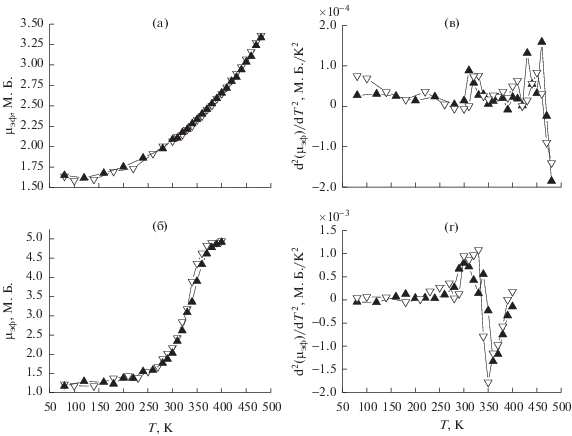
Таблица 5.
Температуры прямого (Tc↑) и обратного (Tc↓) переходов для комплексов [FeL2]A · nH2O
| Соединение | Tc↑, K | Tc↓, K | ΔTc, K |
|---|---|---|---|
| [FeL2][B10H10] · 2H2O | 419 | 416 | 3 |
| [FeL2][B12H12] · H2O | 332 | 332 | 0 |
| [FeL2][B10H10] | 468 | 463 | 5 |
| [FeL2][B12H12] | 347 | 336 | 11 |
В случае комплексов, содержащих кристаллизационную воду, в высокоспиновой форме достигаются значения μэф = 4.5–4.7 М.Б., что несколько ниже теоретического значения 4.9 М.Б. В низкоспиновой форме для данных соединений наблюдаются значения остаточного μэф = 0.5–1.0 М.Б.. Переход от соединения [FeL2][B10H10] · 2H2O к [FeL2][B12H12] · H2O сопровождается снижением температур кроссовера на ~80 K и исчезновением гистерезиса (ΔTc) для прямого и обратного переходов.
При дегидратации комплексов наблюдается увеличение максимальной температуры переходов и остаточного магнитного момента в низкоспиновом состоянии до величин μэф = 1.2–1.6 М.Б. Сохраняется тенденция к уменьшению температур СКО при переходе от [FeL2][B10H10] к [FeL2][B12H12]. При этом для [FeL2][B10H10] в температурном диапазоне стабильности достигаются значения μэф = 3.3 М.Б. При удалении молекул кристаллизационной воды также наблюдается увеличение/появление гистерезиса для прямого и обратного переходов в изучаемых комплексах (табл. 5).
Результаты исследования полученных комплексов и сравнение с литературными [16, 17] и ранее полученными нами данными [18, 19] показывают, что комплексы [FeL2][B10H10] ∙ 2H2O и [FeL2][B12H12] ∙ H2O имеют октаэдрическое строение координационного полиэдра. Два лиганда координируются к иону железа(II) тридентатно-циклическим способом двумя атомами азота имидазольных циклов и атомом азота пиридина с образованием координационного узла FeN6.
ЗАКЛЮЧЕНИЕ
Синтезированы новые комплексы клозо-боратов железа(II) c 2,6-бис(бензимидазол-2-ил)пиридином состава [FeL2][B10H10] ∙ 2H2O и [FeL2][B12H12] ∙ H2O. Проведенные исследования показали, что как исходные соединения, так и их дегидратированные аналоги обладают термоиндуцированным спин-кроссовером 1А1 ⇔ 5Т2, причем температуры СКО существенно зависят от состава внешнесферного аниона: значения Тс [FeL2][B10H10] ∙ 2H2O и [FeL2][B10H10] значительно выше, чем Тс [FeL2][B12H12] ∙ H2O и [FeL2][B12H12].
Список литературы
Spin Crossover in Transition Metal Compounds I–III / Eds. Gutlich P., Goodwin H. Springer, 2004. 233 p.
Halcrow M.A. Spin-Crossover Materials Properties and Applications. Wiley&Sons, 2013. 562 p.
Kahn O., Krober J., Jay C. // Adv. Mater.1992. V. 4. P. 718.
Lavrenova L.G., Shakirova O.G. // Eur. J. Inorg. Chem. 2013. P. 670.
Shatruk M., Phan H., Chrisostomo B.A., Suleimenova A. // Coord. Chem. Rev. 2015. V. 289–290. P. 62.
Feltham H.L.C., Barltrop A.S., Brooker S. // Coord. Chem. Rev. 2017. V. 344. P. 26.
Scott H.S., Staniland R.W., Kruger P.E. // Coord. Chem. Rev. 2018. V. 362. P. 24.
Shakirova O.G., Lavrenova L.G., Bogomyakov A.S. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 7. P. 786. [Шакирова О.Г., Лавренова Л.Г., Богомяков А.С. и др. // Журн. неорган. химии. 2015. Т. 60. № 7. С. 869.]
Frolova E.N., Ivanova T.A., Turanova O.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 8. P. 1012. [Фролова Е.Н., Иванова Т.А., Туранова О.А. и др. // Журн. неорган. химии. 2018. Т. 63. № 8. С. 974.]
Gamez P., Costa J.S., Quesada M., Aromi G. // Dalton Trans. 2009. P. 7845.
Hayami S., Holmes S.M., Halcrow M.A. // J. Mater. Chem. C. 2015. V. 3. P. 7775.
Matsuda M., Isozaki H., Tajima H. // Chem. Lett. 2008. V. 37. № 3. P. 374.
Muller R.N., Elst V., Laurent S. // J. Am. Chem. Soc. 2003. V. 125. P. 8405.
Letard J.-F., Daro N., Aymonier C. et al. EP Pat. 2 391 631. 2011.
Bousseksou A., Vieu C., Letard J.-F. et al. EU Pat. 1430552. 2004.
Boča M., Jameson R.F., Linert W. // Coord. Chem. Rev. 2011. V. 255. P. 290.
Boča R., Baran P., Boča M. et al. // Inorg. Chim. Acta. 1998. V. 278. P. 190.
Лавренова Л.Г., Дюкова И.И., Коротаев Е.В. и др. // Журн. неорган. химии. 2020. Т. 65. № 1. С. 34.
Ivanova A.D., Korotaev E.V., Komarov V.Yu. et al. // New J. Chem. 2020. V. 44. № 15. P. 5834.
Сиваев И.Б., Брегадзе В.И., Кузнецов Н.Т. // Изв. АН. Сер. хим. 2002. № 8. С. 1256.
Hawthorne M.F. // Molecular Medicine Today. 1998. V. 4. № 4. P. 174.
Zhu Y., Lin Y., Zhu Y.Z. et al. // J. Nanomaterials. 2010. V. 2010. Art. 409320.
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2017. V. 62. № 13. P. 1673.
Korolenko S.E., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 5. P. 297.
Shakirova O.G., Lavrenova L.G., Ikorskiy V.N. et al. // Chem. Sust. Dev. 2002. V. 10. P. 757. [Шакирова О.Г., Лавренова Л.Г., Икорский В.Н. и др. // Химия в интересах устойчивого развития. 2002. Т. 10. С. 795.]
Bushuev M.B., Lavrenova L.G., Shvedenkov Yu.G. et al. // Russ. J. Coord. Chem. 2008. V. 34. № 3. P. 190. [Бушуев М.Б., Лавренова Л.Г., Шведенков Ю.Г. и др. // Коорд. химия. 2008. Т. 34. № 3. С. 195.]
Shakirova O.G., Daletskii V.A., Lavrenova L.G. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 6. P. 650. [Шакирова О.Г., Далецкий В.А., Лавренова Л.Г. и др. // Журн. неорган. химии. 2013. Т. 58. № 6. С. 739.]
Miller H.C., Muetterties E.L. // Inorg. Synth. 1967. V. 10. P. 81.
Ливер Э. Электронная спектроскопия неорганических соединений. М.: Мир, 1987.
Hauser A. // Top Curr. Chem. 2004. V. 233. P. 49.
Sugano S., Tanabe Y., Kamimura H. Multiplets of transition – metal ions in crystals. N.Y.: Academic Press Pure and Applied Physics, 1970. 331 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии