Журнал неорганической химии, 2020, T. 65, № 11, стр. 1544-1549
Фазовые равновесия в системе BaS–In2S3
А. В. Кертман a, *, А. В. Русейкина a
a Тюменский государственный университет
625003 Тюмень, ул. Семакова, 10, Россия
* E-mail: akertman@utmn.ru
Поступила в редакцию 04.04.2020
После доработки 15.06.2020
Принята к публикации 20.06.2020
Аннотация
Установлено, что система BaS−In2S3 эвтектического типа с инконгруэнтно плавящимися соединениями состава BaIn2S4 и Ba2In2S5, на основе α-модификации In2S3 существует ограниченная область твердого раствора. Соединения BaIn2S4 и Ba2In2S5 плавятся инконгруэнтно при температурах 1330 и 1497 K, кристаллизуются в ромбической сингонии с параметрами элементарной ячейки а = = 2.181, b = 2.165, с = 1.311 нм (пр. гр. Fddd) и а = 1.317, b = 1.272, с = 1.178 нм (пр. гр. Pbca) соответственно. Микротвердость соединений Н = 2470 МПа для BaIn2S4 и 2250 МПа для Ba2In2S5. Координаты эвтектики между BaIn2S4 и In2S3 составляют 76 мол. % In2S3, Tпл = 1190 K. Растворимость BaS в α-In2S3 при 1070 K достигает 2 мол. % BaS. С уменьшением температуры растворимость ВаS в α-In2S3 закономерно уменьшается и при 870 K составляет 1 мол. % BaS.
ВВЕДЕНИЕ
В системах AS–In2S3 при эквимолярном соотношении исходных сульфидов образуются соединения состава AIn2S4 (A = Mg, Ca, Sr, Ba), которые обладают практически значимыми оптическими и электрофизическими свойствами и используются в качестве материалов инфракрасной и нелинейной оптики [1–5].
Известно [6], что в системе BaS−In2S3 существует соединение состава BaIn2S4, плавящееся конгруэнтно при температуре 1335 K. Между BaIn2S4 и исходными соединениями образуются эвтектические смеси с координатами 66 мол. % BaS–34 мол. % In2S3, Тпл = 1278 K и 27.5 мол. % BaS–72.5 мол. % In2S3, Тпл = 1193 K. Соединение BaIn2S4 кристаллизуется в ромбической сингонии типа EuGa2S4 [7] с параметрами элементарной ячейки (э. я.) а = 2.18, b = 2.15, c = 1.32 нм [6]; а = 2.1789(2), b = 2.1650(7), c = 1.3108(3) нм, Z = 32, пр. гр. Fddd [1]. Соединение состава Ba2In2S5 авторами [6] не обнаружено.
Химико-препаративным методом при соотношении исходных компонентов 2BaS : In2S3 получено соединение состава Ba2In2S5 ромбической сингонии типа Pb2Ga2S5 с параметрами э. я. а = = 1.3167(6), b = 1.2723(6), c = 1.1784(5) нм [8] и а = = 1.2687(8), b = 1.1737(8), c = 1.3138(9) нм, Z = 8, пр. гр. Pbca [9]. Характер и температура плавления соединения Ba2In2S5 неизвестны.
Сульфид бария BaS плавится конгруэнтно при температуре 2430 K, кристаллизуется в кубической сингонии типа NaCl с параметром э. я. а = = 0.6388 нм, пр. гр. Fm$\overline 3 $m [10]. Соединение In2S3 плавится конгруэнтно при температуре 1360 [11] и 1370 K [3–5].
О кристаллической структуре и полиморфизме фазы In2S3 в литературе нет однозначного суждения. Авторы [12, 13] описывают существование двух модификаций: низкотемпературной α-In2S3, кристаллизующейся в кубической сингонии типа сфалерита с параметром э. я. а = 0.5360 нм и переходящей при 573 K в тетрагональную β-модификацию с параметрами э. я. а = 0.762 и с = 3.232 нм (пр. гp. I41/amd), которая существует до 1023 K. Данные о полиморфизме In2S3 от 1023 K до температуры плавления в указанных источниках отсутствуют.
Согласно [14–18], In2S3 образует низкотемпературную узкогомогенную модификацию тетрагональной сингонии, которая около 691 K распадается по перитектической реакции β-In2S3 ↔ In3 –xS4 + + L(S). Высокотемпературная модификация γ-In2S3 ромбической сингонии существует от 1023 K до температуры дистектического плавления при 1371 K. Между этими модификациями существует соединение In3 –xS4 с широкой областью гомогенности со структурой обращенной шпинели (пр. гр. Fd$\overline 3 $m), плавящееся по перитектической реакции.
В работах [19–21] авторы предложили свое обозначение трех полиморфных модификаций In2S3, существующих в системе In–S. Низкотемпературная β-модификация тетрагональной сингонии (а = 0.76231(4), с = 3.2358(3) нм, пр. гp. I41/amd) при 717 ± 5 K переходит в кубическую среднетемпературную модификацию α-In2S3 (а = 1.08315(2) нм, пр. гр. Fd$\overline 3 $m), которая, в свою очередь, при температуре 1084 K переходит в высокотемпературную модификацию γ-In2S3 тригональной (гексагональной по данным [20, 21]) сингонии (а = = 0.38656(2), с = 0.91569(5) нм, пр. гp. P$\overline 3 $m1 [19]).
Несмотря на неоднозначность литературных данных, следует отметить, что, вероятнее всего, авторы [14–21] ведут речь об одной и той же структурно одинаковой кубической фазе – α-In2S3, или In3 –xS4, которые представлены на диаграммах In–S разной областью гомогенности, а низкотемпературная тетрагональная фаза β-In2S3 является “сверхструктурой” вышеуказанной кубической фазы. В настоящей работе использованы обозначения полиморфных модификаций In2S3, принятые в [19–21].
Целью работы является изучение фазовых равновесий и построение Т–х-диаграммы системы BaS−In2S3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для построения фазовой диаграммы системы BaS−In2S3 использовали бинарные сульфиды BaS и In2S3, синтезированные по стандартным методикам [10–13]. Идентификацию синтезированных сульфидов проводили с помощью химического и рентгенофазового анализа. В пределах погрешности химического анализа (±0.2 мас. %) синтезированные сульфиды имеют стехиометрический состав. Методом рентгенофазового анализа (РФА) подтверждена их однофазность. Полученный In2S3 кристаллизуется в среднетемпературной α-модификации кубической сингонии с параметром э. я. а = 1.0729 нм [5].
Для построения фазовой диаграммы системы BaS−In2S3 синтезировано 16 образцов различного химического состава. Литые образцы получены плавлением смесей порошков бинарных сульфидов, помещенных в графитовые тигли, в парах серы. После плавления полученные образцы подвергали гомогенизирующему отжигу в вакуумированных до остаточного давления 0.13–0.013 Па и запаянных кварцевых ампулах. Отжиг проводили в муфельной печи по двум изотермическим сечениям при температурах 1070 и 870 K, которые задавали с точностью ±5 K терморегулятором “Термолюкс”. Время отжига образцов, определенное экспериментально путем контроля параметров э. я. образцов и их микротвердости, составляло 700 и 1000 ч соответственно.
Дифференциальный термический анализ (ДТА) проводили на установке с термопарой ВР 5/20 при скорости нагрева образца 15 град/мин и нахождении пробы образца в вакуумированной и запаянной кварцевой ампуле с погрешностью 0.4% от измеряемой величины. Объем ампулы составлял <2 × 10–7 м3. Проба занимала 3/4 объема ампулы. Визуальный термический анализ (ВТА) выполняли на термопаре ПП-1 при нахождении пробы в молибденовом тигле. Погрешность определения температуры составляла 0.7% от измеряемой величины. Порошковые рентгенографические данные получены на рентгеновских дифрактометрах ДРОН-3М и ДРОН-6 в CuKα-излучении (Ni-фильтр), шаг сканирования составлял 0.03° (2θ), время экспозиции – 2 с. Параметры э. я. в отожженных образцах для веществ с кубической сингонией определены с точностью ±0.0001 нм, а с более низкой сингонией – с точностью ±0.001 нм с помощью программного комплекса PDWin 4.0 и рентгенометрической картотеки PDF-4 с использованием профилирования рефлексов. Микроструктурный анализ (МСА) проводили на полированных и протравленных шлифах на металлографическом микроскопе МЕТАМ ЛВ 31, дюрометрический анализ (ДМА) – на микротвердомере ПМТ-3М методом Виккерса с погрешностью определения величины микротвердости 5–7%, нагрузка на индентор составляла 0.02 кг.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
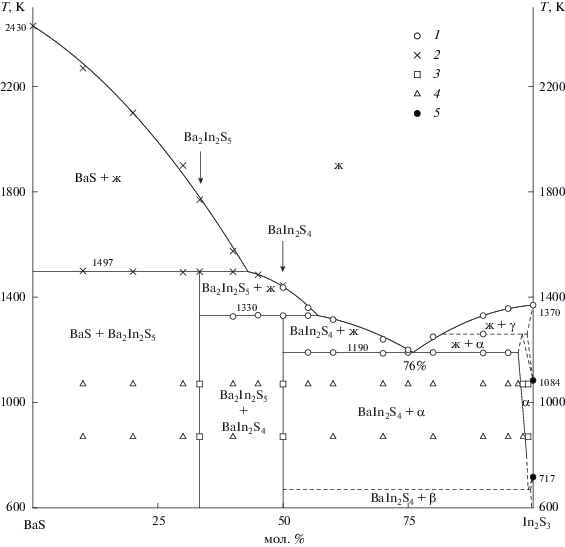
В системе BaS–In2S3, построенной от 870 K, протекает сложное химическое взаимодействие, которое приводит к образованию двух инконгруэнтно плавящихся соединений стехиометрического состава BaIn2S4 и Ba2In2S5, эвтектики между соединениями BaIn2S4 и α-In2S3 и ограниченного твердого раствора на основе α-In2S3 (рис. 1).
Рис. 1.
Фазовая диаграмма системы BaS–In2S3: 1 – результаты ДТА, 2 – ВТА. Состояние образцов по результатам РФА и МСА: 3 – однофазный, 4 – двухфазный, 5 – данные [19].
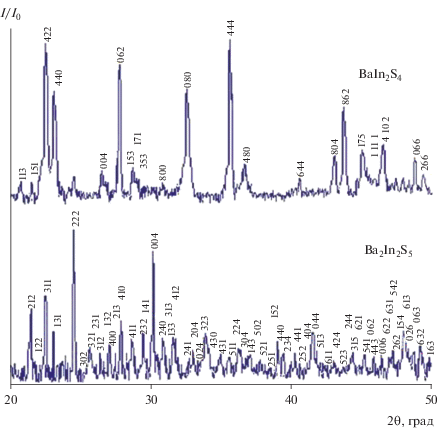
Соединение BaIn2S4 образуется при эквимолярном соотношении исходных сульфидов и кристаллизуется в ромбической сингонии с параметрами элементарной ячейки а = 2.181, b = 2.165, с = = 1.311 нм (пр. гр. Fddd). Химическое взаимодействие между сульфидами бария и индия в соотношении 2BaS : In2S3 приводит к образованию соединения формульного состава Ba2In2S5. На рентгенограмме образца состава 66.66 мол. % BaS и 33.33 мол. % In2S3 присутствуют рефлексы, относящиеся к структуре фазы Ba2In2S5, которая кристаллизуется в ромбической сингонии с параметрами э. я. a = 1.317, b = 1.272, с = 1.178 нм. Рефлексов посторонних фаз на рентгенограммах (рис. 2) отожженных образцов вышеуказанных составов не обнаружено, а сами рентгенограммы идентичны рентгенограммам BaIn2S4 и Ba2In2S5, представленным в [1, 6, 22] и [9] соответственно.
Рис. 2.
Рентгенограммы образцов состава BaIn2S4 (ромбическая сингония) и Ba2In2S5 (ромбическая сингония), закаленных от 1070 K (дифрактометр ДРОН-6, CuKα-излучение, Ni-фильтр).
Фазы BaIn2S4 и Ba2In2S5 устойчивы во всем температурном интервале от 870 K до температур инконгруэнтного плавления, которые составляют 1330 K по данным ДТА (рис. 3) и ВТА и 1497 K по данным ВТА соответственно. Соединение Ba2In2S5 термически более устойчиво, чем BaIn2S4, это можно объяснить большей степенью ионности химической связи в соединении Ba2In2S5 за счет увеличения мольной доли наиболее основного компонента BaS.
Рис 3.
Дифференциальные термические зависимости образцов системы BaS–In2S3. Состав образцов выражен в мол. % In2S3.
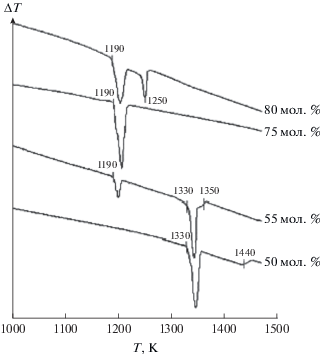
На инконгруэнтное плавление фаз указывает микроструктура плавленых образцов и характер взаимного расположения линий ликвидуса и солидуса. На линии ликвидуса в области составов 33.33 и 50 мол. % In2S3 отсутствует дистектическая точка. Термограммы образцов данных составов имеют характерные эндотермические пики, вызванные началом плавления большей части пробы. При проведении ВТА данных образцов визуально фиксируется быстрое и одновременное плавление основной части пробы, а оставшиеся кристаллы постепенно плавятся в интервале температур.
Микроструктура плавленых и отожженных двухфазных образцов составов 10, 20 и 30 мол. % In2S3 представляет собой сочетание первично выпавших из расплава овальных кристаллов BaS серо-коричневого цвета (Н = 1200 МПа), расположенных в светло-коричневом однородном поле фазы Ba2In2S5 (Н = 2250 МПа). На микроструктуре плавленого образца состава 66.66 мол. % BaS и 33.33 мол. % In2S3 наблюдается небольшое количество фазы BaS, находящейся между зернами фазы Ba2In2S5. После гомогенизирующего отжига данного образца следы фазы BaS исчезают. В образцах состава 40 и 45 мол. % In2S3 в равновесии находятся фазы BaIn2S4 и Ba2In2S5. Фазы различаются по цвету и значениям микротвердости. В отличие от фазы Ba2In2S5, фаза BaIn2S4 светло-серого цвета, Н = 2470 МПа. Неотожженный образец эквимолярного состава BaS : In2S3 содержит небольшое количество примесной фазы Ba2In2S5, исчезающей после гомогенизирующего отжига.
Заметного изменения положения рефлексов структур, параметров э. я. (рис. 4) и значений микротвердости (рис. 5) сопряженных фаз BаS, Ba2In2S5 и BaIn2S4 в двухфазных образцах составов 0–33.33 мол. % In2S3 и 33.33–50 мол. % In2S3 не обнаружено, что свидетельствует об отсутствии взаимной растворимости фаз.
Рис. 4.
Зависимость параметров э. я. фаз от состава в системе BaS–In2S3. BaS – кубическая структура типа NaCl; BaIn2S4 – ромбическая структура типа EuGa2S4; Ba2In2S5 – ромбическая структура типа Pb2Ga2S5; α-In2S3 – кубическая структура типа шпинели.
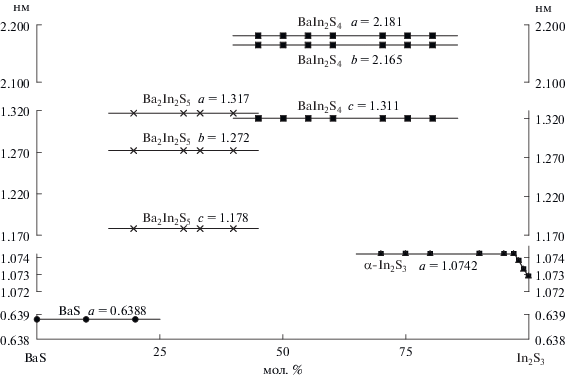
Рис. 5.
Зависимость состав–микротвердость образцов системы BaS–In2S3, закаленных от 1070 K. Нагрузка 0.02 кг.
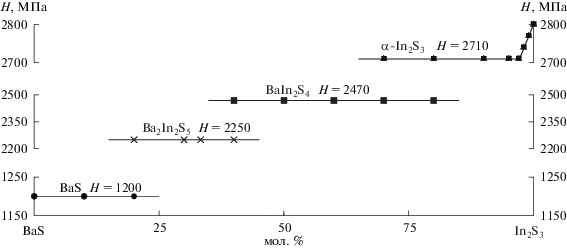
В области составов от 50 до 98 мол. % In2S3 при температурах отжига 1070 и 870 K в равновесии находятся фазы BaIn2S4 и α-In2S3. Эвтектический характер этой области составов определен из анализа микроструктуры образцов и взаимного положения ветвей ликвидуса, пересекающихся в эвтектической точке. На микроструктуре образцов данной двухфазной области наблюдается светло-серое поле фазы ВaIn2S4 (Н = 2470 МПа) и мелкие зерна эвтектики, а после эвтектического состава морфология эвтектики меняется: наблюдается светло-желтое поле крайнего состава твердого раствора на основе α-In2S3 (Н = 2710 МПа) и эвтектика. Координаты эвтектической точки приняты равными 76 мол. % In2S3 и 1190 K.
На основе α-In2S3 образуется узкая область твердого раствора, ограниченность которого подчиняется правилу Юм–Розери. Величина растворимости определена при изучении фазового состава образцов, содержащих 95, 97, 98 и 99 мол. % In2S3, отожженных и закаленных от 1070 и 870 K. При 1070 K в α-In2S3 растворимость достигает 2 мол. % ВaS. На микроструктуре образцов состава 99 и 98 мол. % In2S3 наблюдается однородное светло-желтое поле твердого раствора на основе фазы α-In2S3, а в образце состава 97 мол. % In2S3 появляется небольшое количество зерен второй светло-серой фазы. Внедрение больших по размеру ионов Ba2+ в катионные позиции в α-фазе (r(Ba2+)/r(In3+) = 1.5 [23]) вызывает увеличение параметров кубической э. я. α-In2S3 от а = 1.0729 до 1.0742 нм (ΔV = +0.0045 нм3) (рис. 4). Увеличение объема кубической элементарной ячейки α-фазы приводит к закономерному уменьшению микротвердости образцов от 2800 до 2710 МПа (ΔН = –90 МПа) (рис. 5), что согласуется с законом Вегарда. С уменьшением температуры растворимость ВаS в α-In2S3 закономерно уменьшается и при 870 K составляет 1 мол. % BaS.
В связи с полиморфизмом соединения In2S3 вполне возможно образование узких областей гомогенности на основе β- и γ-In2S3, которые нанесены на фазовую диаграмму штриховыми линиями. В настоящей работе при выбранных температурах отжига образцов твердые растворы на основе β- и γ-In2S3 не зафиксированы. Для построения более точной картины фазовых равновесий вблизи координаты In2S3 и определения областей гомогенности на основе β- и γ-In2S3 требуются дополнительные исследования.
Список литературы
Hong K.J., Jeong T.S., Youn C.J. // J. Cryst. Growth. 2016. V. 433. P. 13. https://doi.org/10.1016/j.jcrysgro.2015.09.027
Moldovyan N.A. // Inorg. Mater. 1992. V. 23. № 3. P. 670.
Кертман А.В. // Журн. неорган. химии. 2017. Т. 62. № 9. С. 1249. [Kertman A.V. // Russ. J. Inorg. Chem. 2017. V. 62. № 9. P. 1240. https://doi.org/10.1134/S003602361709008X]https://doi.org/10.7868/S0044457X17090161
Кертман А.В., Носов И.И., Андреев О.В. // Журн. неорган. химии. 2002. Т. 47. № 1. С. 132. [Kertman A.V., Nosov I.I., Andreev O.V. // Russ. J. Inorg. Chem. 2002. V. 47. № 1. P. 126.]
Кертман А.В. // Журн. неорган. химии. 2019. Т. 64. № 1. С. 93. [Kertman A.V. // Russ. J. Inorg. Chem. 2019. V. 64. № 1. P. 130. https://doi.org/10.1134/S0036023619010133]https://doi.org/10.1134/S0044457X19010136
Hidaka C., Goto M., Kubo M., Takizawa T. // J. Cryst. Growth. 2005. V. 275. P. e439. https://doi.org/10.1016/j.jcrysgro.2004.11.016
Chi Y., Guo Sh.-P., Xue H.-G. // RSC Adv. 2017. V. 7. P. 5039. https://doi.org/10.1039/c6ra25283d
Eisenmann B., Hofmann A. // Z. Anorg. Allg. Chem. 1990. V. 580. № 1. P. 151.
Gao W., Wu K., Lai K. et al. // Z. Anorg. Allg. Chem. 2015. V. 641. № 7. P. 1329. https://doi.org/10.1002/zaac.201500113
Кертман А.В., Шальнева Н.В. // Журн. неорган. химии. 2016. Т. 61. № 1. С. 115. [Kertman A.V., Shal’neva N.V. // Russ. J. Inorg. Chem. 2016. V. 61. № 1. P. 109. https://doi.org/10.1134/S0036023616010101]https://doi.org/10.7868/S0044457X16010104
Stubbs M.X., Schule Y.A., Tornpson A.Y. et al. // J. Am. Chem. Soc. 1952. V. 74. P. 1441.
Медведева 3.С. Халькогениды элементов III Б подгруппы Периодической системы. М.: Наука, 1968. 216 с.
Steigmann G.A., Sutherland H.H., Goodyear J. // Acta Crystallogr. 1965. V. 19. P. 967.
Наумов А.В., Сергеева А.В., Семенов В.Н. // Неорган. материалы. 2017. Т. 53. № 6. С. 570. [Naumov A.V., Sergeeva A.V., Semenov V.N. // Inorg. Mater. 2017. V. 53. № 6. P. 560. https://doi.org/10.1134/S0020168517060127]https://doi.org/10.7868/S0002337X17060124
Косяков А.В., Завражнов А.Ю., Наумов А.В. // Неорган. материалы. 2010. Т. 46. № 4. С. 398. [Kosyakov A.V., Zavrazhnov A.Yu., Naumov A.V. // Inorg. Mater. 2010. V. 46. № 4. P. 343.]
Наумов А.В., Сергеева А.В., Семенов В.Н. // Неорган. материалы. 2015. Т. 51. № 12. С. 1299. [Naumov A.V., Sergeeva A.V., Semenov V.N. // Inorg. Mater. 2015. V. 51. № 12. P. 1205. https://doi.org/10.1134/S0020168515110060]https://doi.org/10.7868/S0002337X15110068
Завражнов А.Ю., Наумов А.В., Аноров П.В. и др. // Неорган. материалы. 2006. Т. 42. № 12. С. 1420. [Zavrazhnov A.Yu., Naumov A.V., Anorov P.V. et al. // Inorg. Mater. 2006. V. 42. № 12. P. 1294.]
Косяков А.В., Завражнов А.Ю., Наумов А.В., Сергеева А.В. // Вестник ВГУ. Серия: Химия, Биология, Фармация. 2009. № 2. С. 28.
Pistor P., Merino Alvarez J.M., Leon M. et al. // Acta Crystallogr. B. Struct. Sci. Cryst. Eng. Mater. 2016. V. 72. Pt. 3. P. 410. https://doi.org/10.1107/S2052520616007058
Li T., Zhang S., Meng S. et al. // Royal Soc. Chem. 2017. V. 7. P. 6457. https://doi.org/10.1039/c6ra28560k
Rodrigues-Hernandez P.E., Nieto-Zepeda K.E., Guillen-Cervantes A. et al. // Chalcogenide Letters. 2017. V. 14. № 8. P. 331.
Jeong K., Hong K. // J. Korean Cryst. Growth Cryst. Technol. 2015. V. 25. № 5. P. 183. https://doi.org/10.6111/JKCGCT.2015.25.5.173
Shannon R.D. // Acta Crystallogr. 1976. V. A32. P. 751.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


