Журнал неорганической химии, 2020, T. 65, № 11, стр. 1449-1460
Макропористые магнитные оксиды железа и их композиты для жидкофазного каталитического окисления
Е. К. Папынов a, b, *, А. Д. Номеровский a, А. С. Азон a, В. О. Главинская a, И. Ю. Буравлев a, b, А. В. Огнев a, А. С. Самардак a, А. Н. Драньков a, С. Г. Красицкая a, И. Г. Тананаев a, c, d
a Дальневосточный федеральный университет
690091 Владивосток, ул. Суханова, 8, Россия
b Институт химии ДВО РАН
690022 Владивосток, пр-т 100-летия Владивостока, 159, Россия
c Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119991 Москва, Ленинский пр-т, 31, корп. 4, Россия
d Озерский технологический институт – филиал НИЯУ МИФИ
456780 Озерск, пр-т Победы, 48, Россия
* E-mail: papynov@mail.ru
Поступила в редакцию 05.06.2020
После доработки 18.06.2020
Принята к публикации 20.06.2020
Аннотация
Предложен способ получения макропористых магнитных оксидов железа и их железо-алюминатных композитов, обеспечивающих эффективное жидкофазное каталитическое окисление. Материалы получены методом золь-гель синтеза в результате смешивания прекурсоров металлов с раствором коллоидного темплата на основе силоксан-акрилатной эмульсии. В работе исследована пористая структура и магнитные свойства композитов в зависимости от температуры и величины магнитного поля. Продемонстрировано влияние режимов термической обработки на фазовый состав, пористость и каталитические свойства получаемых материалов. Результаты исследования подкреплены данными растровой электронной микроскопии, рентгенофазового анализа, ядерного гамма-резонанса и низкотемпературной адсорбции азота. Показано, что введение ионов алюминия в процессе темплатного синтеза позволяет сохранить пористую структуру материалов при высокотемпературной обработке, что улучшает каталитические свойства и существенным образом оказывает влияние на магнитные характеристики получаемых магнитных композитов.
ВВЕДЕНИЕ
Современные каталитические технологии жидкофазного окисления представляют основу процессов очистки сточных, производственных и бытовых вод от опасных органических загрязнителей высокой токсичности, не подвергающихся естественному биологическому разложению [1, 2]. Преимущества этих технологий обусловлены низкими эксплуатационными расходами, экологической безопасностью, а также эффективностью удаления таких сложных загрязнителей, как металлоорганические комплексы с радионуклидами, образующиеся в составе технических вод атомных электростанций [3]. В этом случае, согласно работам [4, 5], окислительный катализ является одним из наиболее конструктивных решений переработки жидких радиоактивных сред с использованием оксидных катализаторов. Указанные исследования показывают, что вне зависимости от эффективности имеющихся катализаторов окисления всегда сохраняется потребность в разработке новых каталитически активных оксидных систем с более высокими служебными характеристиками, чем аналоги.
Например, среди известных катализаторов вызывают интерес оксиды железа, которые являются перспективной альтернативой из-за их низкой токсичности, высокой распространенности и экологически благоприятных характеристик. Дополнительным преимуществом, обусловленным наличием собственного магнитного момента, является простота извлечения из жидкофазной системы с использованием внешнего магнитного поля [6]. Существуют различные кристаллические структуры оксида железа: магнетит (Fe3O4), гематит (α-Fe2O3), β-Fe2O3, маггемит (γ-Fe2O3) и вюстит (FeO). Среди этих кристаллических структур гематит является наиболее стабильным состоянием оксида железа в условиях окружающей среды [7]. Широкое применение α-Fe2O3 обусловлено его превосходными физическими и химическими свойствами, которые могут проявляться в образцах с различной морфологией, размером частиц, а также в композитных структурах, что особенно важно при создании эффективных гетерогенных катализаторов окисления.
Кроме химически активного оксидного состава эффективность селективных катализаторов в значительной степени определяется их пористой структурой [4, 5]. При этом существует ряд трудностей в процессе синтеза пористых оксидов. Во-первых, сложность формирования пористой структуры с узким распределением пор по размерам (>100 нм), так как большинство применяемых темплатирующих агентов обеспечивают получение материалов с размерами пор 2–50 нм. Важно отметить, что если размер наночастиц эффективных катализаторов на основе благородных металлов составляет, как правило, 2–10 нм, то для придания магнитных свойств материалам в большинстве случаев требуется создать в матрице кластеры с размерами от нескольких десятков до сотен нанометров. Во-вторых, необходимо отметить сложности, связанные с отсутствием установленных корреляций условия синтеза–структура–функциональные свойства для ряда систем, что не позволяет проводить направленный синтез материалов с заранее заданным комплексом структурных характеристик и специфических свойств материалов определенного химического состава.
Из огромного разнообразия методов синтеза неорганических систем предпочтение отдается лишь тем, которые позволяют контролировать и управлять структурой на стадии ее формирования. В частности, следует отметить золь-гель технологию с элементами темплатного синтеза, которая обеспечивает получение неорганических соединений требуемого состава, в том числе оксидных материалов [8, 9], и позволяет сформировать пористую структуру с заданными параметрами за счет введения коллоидных темплатов определенного размера и формы, как было показано нами ранее для оксидов вольфрама, молибдена и кобальта [4, 5, 10]. В качестве темплатов могут выступать мицеллы поверхностно-активных веществ [11], эмульсии типа “масло в воде” [12], блочные амфифильные полимеры [13] и многое другое [8].
Таким образом, цель настоящей работы – получение с помощью оригинального золь-гель (темплатного) синтеза макропористых магнитных материалов на основе оксидов железа и их композитных форм в составе с алюминием, исследование состава, структуры, магнитных характеристик и каталитических свойств полученных материалов для дальнейшего применения в процессе жидкофазного окислительного катализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. Для темплатного синтеза использовали промышленную силоксан-акрилатную эмульсию марки “КЭ 13-36” (содержание твердой фазы 50%, средний размер частиц 160 нм) производства ООО “Астрохим” (Электросталь), частицы которой имеют четкую сферическую форму и средний размер 160 нм, хлорид железа (FeCl3 ⋅ ⋅ 6H2O) марки “х. ч.”, нитрат алюминия (Al(NO3)3 ⋅ ⋅ 9H2O) “ч. д. а.” и моноалюминат натрия (NaAlO2) “ч. д. а.”.
Методика синтеза
Синтез пористых неорганических материалов осуществляли по следующей схеме.
Оксиды железа. К 10 мл промышленной силоксан-акрилатной эмульсии добавляли 100 мл дистиллированной воды (соотношение 1 : 10), затем при перемешивании приливали 22 мл раствора хлорида железа (С(Fe) = 46 мг/мл) и далее по каплям добавляли 60 мл 1н NaOH до образования геля гидратированного оксида железа коричневого цвета (pH раствора 6–7). Полученный раствор выдерживали на магнитной мешалке в течение 30 мин, после чего отстаивали, затем отфильтровывали образовавшийся осадок на бумажном фильтре “синяя лента”, тщательно промывали дистиллированной водой и выдерживали в сушильном шкафу при температуре 100°С в течение 2 ч до полного удаления избыточной влаги и образования ксерогеля гидроксида железа.
Cмешанные железо-алюминатные оксидные системы. К разбавленному раствору эмульсии (1 : 10) добавляли 10 мл раствора нитрата алюминия или алюмината натрия (С(Al) = 7.2 мг/мл) и тщательно перемешивали. Образование геля гидратированных оксидов контролировали изменением pH раствора: в случае нитрата алюминия в пределах 6–7, в случае алюмината натрия не ниже 3. Дальнейшие стадии аналогичны таковым при синтезе вышеописанных оксидов железа: фильтрование, промывание, сушка.
Завершающей стадией формирования оксидной основы и, соответственно, структуры конечных материалов является удаление органического темплата методом термической деструкции, которое осуществляли путем температурной обработки ксерогелей в трубчатой печи марки RSR-B 120/500/11 (Nabertherm GmbH, Германия) в атмосфере воздуха при различных температурах (500, 900, 1000°С) с постоянной скоростью нагрева 5 град/мин и временем выдержки 1 ч.
Характеристика методов исследования. Идентификацию полученных образцов осуществляли с помощью рентгенофазового анализа (РФА, CuKα‑излучение, Ni-фильтр, средняя длина волны λ = 1.5418 Å, диапазон углов съемки 10°–80°, шаг сканирования 0.02°, скорость регистрации спектров 5 град/мин) на многоцелевом рентгеновском дифрактометре Дрон-3 (Россия). Мессбауэровскую спектроскопию проводили на спектрометре Ms-1104Em (Россия). Анализ поверхности и пористости твердых тел проводили методом физической адсорбции на приборе Tristar (Micromeritics GmbH, США). Изображения поверхности образцов были получены с помощью растровой электронной микроскопии (РЭМ) на микроскопе Ultra 55 (Carl Zeiss, Германия) с полевым эмиссионным катодом при ускоряющем напряжении 1–5 кВ и токе пучка I ≈ 100 пА. РЭМ-изображения были получены при напряжении 5–15 кВ для обратнорассеянных электронов во время сканирования поверхности. Магнитные характеристики исследовали на вибромагнетометре LakeShore 7401 VSM (Lake Shore Cryotronics, Inc, США). Каталитические свойства исследовали по отношению к жидкофазному окислению тиазинового красителя перекисью водорода в присутствии оксидных материалов путем спектрофотометрического определения оптической плотности раствора красителя на приборе UV mini-1240 (Shimadzu, Япония).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
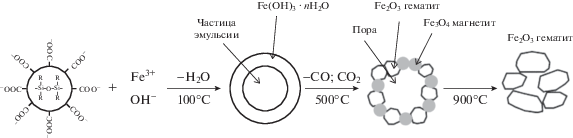
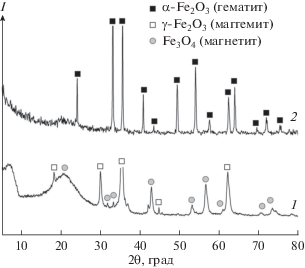
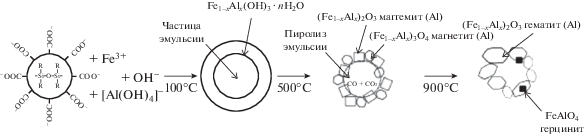
Синтез материалов на основе оксида железа. Общая схема темплатного золь-гель синтеза пористых оксидов железа представлена на рис. 1, из которого видно, что в условиях температурной обработки ксерогеля при 500°С происходит выгорание органической части эмульсии с образованием углекислого газа и окиси углерода. Соотношение между этими газами зависит от скорости нагрева композитного материала. Согласно данным РФА (рис. 2), в качестве твердой фазы образуются частицы маггемита и магнетита. Повышение температуры термообработки до 900°С приводит к формированию гематита.
Рис. 2.
Дифрактограммы материалов на основе оксидов железа, полученных темплатным синтезом при температурах прокаливания 500 (1) и 900°С (2).
Более подробную информацию о химическом составе и структурных характеристиках материалов дают мессбауэровские спектры. В образце, полученном прокаливанием при 500°С (рис. 3а), преобладает секстиплет, соответствующий магнетиту (Fe3O4) и демонстрирующий асимметричную тонкую магнитную структуру.
Рис. 3.
Мессбауэровские спектры образцов оксидов железа, полученных темплатным синтезом при прокаливании: а – 500°С; б – 900°С.
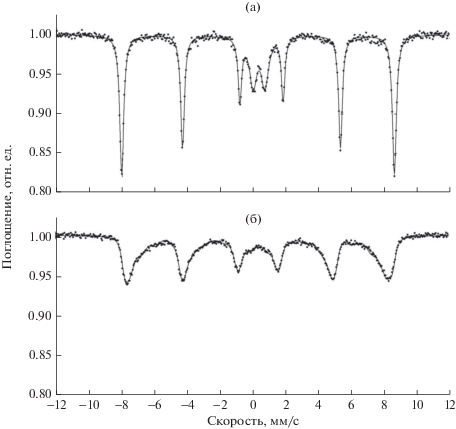
Спектр образца, прокаленного при 900°C, имеет секстиплет и центральный дублет. Секстиплет соответствует магнитоупорядоченной фазе гематита. По сравнению с образцами, отожженными при 500°С, степень уширения полос значительно уменьшилась, а амплитуда выросла почти в 3 раза. Центральный дублет соответствует суперпарамагнитной фазе, в которой могут находится наночастицы α-Fe2O3 диаметром до 15 нм [14]. Концентрация таких частиц мала, поэтому они не оказывают заметного влияния на сорбционные свойства.
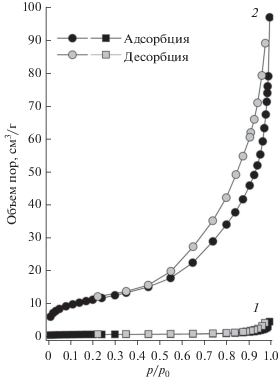
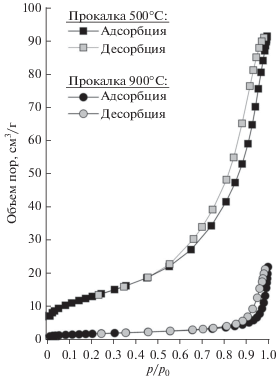
Влияние температуры в процессе удаления темплата отражается не только на химическом составе синтезируемых материалов, но и кардинально влияет на структурные характеристики пористых оксидов железа. Так, в условиях низкотемпературной сорбции азота было установлено, что образцы, полученные при температурной обработке ксерогелей свыше 500°С, имеют низкую величину удельной поверхности и объема пор (рис. 4), что свидетельствует о разрушении пористой структуры оксида железа.
Рис. 4.
Изотермы низкотемпературной сорбции азота на образцах пористых оксидов железа, прокаленных при 500°С (Sуд = 47.3 м2/г) и 900°С (Sуд = 6.2 м2/г).
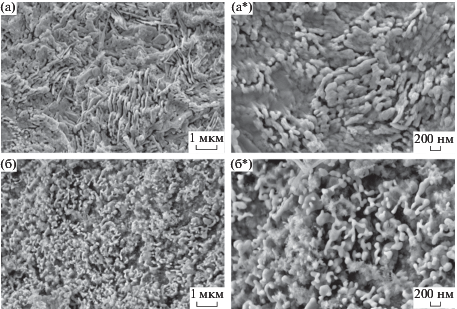
Данный факт объясняется возможным высокотемпературным ростом частиц при переходе магнетит–гематит, что наглядно подтверждают РЭМ-изображения, представленные на рис. 5.
Рис. 5.
РЭМ-изображения материалов на основе оксидов железа, полученных темплатным синтезов при температуре прокаливания 500 (а) и 900°С (б).

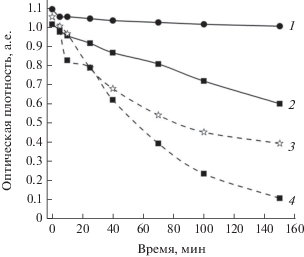
При оценке каталитических свойств полученных материалов, где основополагающим процессом является реакция Фентона [15], на примере жидкофазного окисления тиазинового красителя (метиленового синего) было показано, что преобладание гематитовой фазы и отсутствие пористой структуры в образце, полученном термообработкой при 900°С, негативно сказываются на его каталитической способности. Причина этого заключается в меньшей скорости окисления (рис. 6, кривая 1) по сравнению с образцом, обработанным при 500°С (рис. 6, кривая 2).
Рис. 6.
Каталитическое окисление метиленового синего в присутствии макропористых оксидов железа, полученных при различных температурах прокаливания: 1 – α-Fe2O3 (гематит), 900°С; 2 – смесь γ-Fe2O3 (маггемит) и Fe3O4 (магнетит), 500°С; 3 – Fe2O3–Al2O3, 900°C; 4 – катализ при 500°С в присутствии материала 3.
Очевидно, что использование такого материала для катализа весьма ограниченно. В связи с этим было проведено исследование влияния добавок алюминия на химический состав, структуру и, соответственно, каталитические свойства оксидов железа, получаемых темплатным синтезом.
Синтез смешанных железо-алюминатных оксидных систем. На рис. 7 и 8 представлены схемы получения композитных железо-алюминатных пористых материалов, где в качестве прекурсора алюминия, вводимого на стадии образования золя в момент гидролиза хлорида железа в присутствии эмульсии, использовали в первом случае нитрат алюминия, а во втором – алюминат натрия.
Рис. 7.
Схема темплатного синтеза смешанных оксидов железа и алюминия (прекурсор алюминия – нитрат алюминия Al(NO3)3 · 9H2O).
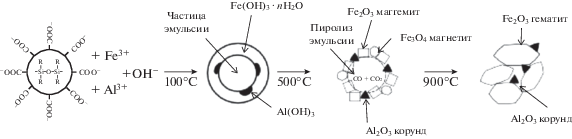
Рис. 8.
Схема темплатного синтеза смешанных оксидов железа и алюминия (прекурсор алюминия – алюминат натрия (NaAlO2).
При синтезе пористых оксидов железа по схеме (рис. 7), основанной на введении в систему нитрата алюминия совместно с хлоридом железа при определенных условиях, образование гидратированных оксидов железа и алюминия происходит при изменении pH раствора от кислого к щелочному (pH не более 7). Однако в этом случае наблюдается разделение гидроксидных фаз металлов. После прокаливания таких материалов на дифрактограммах видны отдельные соединения железа и алюминия (рис. 9). Вероятно, в композитной матрице существуют области с высоким содержанием как алюминия, так и железа.
Рис. 9.
Дифрактограммы композитных материалов на основе оксидов железа и алюминия, полученных темплатным синтезом по схеме рис. 7, при различных температурах прокаливания: 1 – 100, 2 – 500, 3 – 900°С.
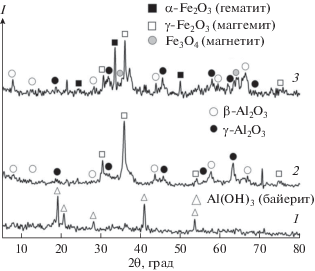
Реализация другой схемы (рис. 8) приводит к образованию гомогенного железо-алюминатного геля (далее ксерогеля), термообработка которого формирует фазы оксидов железа с включенным алюминием. Варьирование температурных условий позволяет изменять химический состав материалов (рис. 10). Так, при прокаливании в пределах 100°С наблюдается отсутствие кристаллической фазы в материале, а с повышением температуры формируются различные формы оксидов железа, наличие алюминатных фаз не просматривается. Это, по-видимому, связано с тем, что алюминий в оксиде железа присутствует не в виде отдельного оксида, а равномерно распределен в объеме оксида железа в качестве добавки, его присутствие можно зафиксировать при термообработке свыше 1000°С, когда образуются твердые растворы гематита и герцинита (железная шпинель FeAlO4) [16]. Дифрактограммы этих материалов приведены на рис. 10.
Рис. 10.
Дифрактограммы композитных материалов на основе оксидов железа и алюминия, полученных темплатным синтезом по схеме рис. 8, при различных температурах прокаливания: 1 – 100; 2 – 500; 3 – 1000°С.
Следует отметить, что исходные прекурсоры (алюминат натрия, нитрат алюминия) не играют определяющей роли в направлении протекания синтеза тех или иных составов смешанных оксидов железа и алюминия. Ключевую роль играют порядок и скорость введения реагентов, а также рН раствора в момент добавления реактивов.
Основываясь на экспериментальных данных о структурных параметрах оксидных систем, следует отметить, что пористая структура материалов, получаемых по схеме рис. 7 на стадии высокотемпературной обработки материала, аналогична таковой при синтезе индивидуальных окисленных форм железа, рассмотренных выше. В этом случае наблюдается полное разрушение (спекание) пористых областей материала в момент перехода магнетит–гематит с очень низким значением (~2–3 м2/г) удельной поверхности образца (рис. 11, кривая 1).
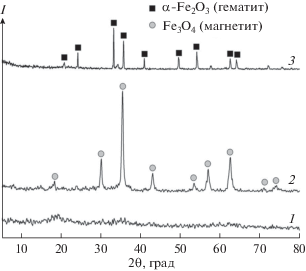
Однако осуществление синтеза по схеме рис. 8, где в материале отсутствует фаза оксидов алюминия (рис. 10), позволяет сохранить пористую структуру материалов, получаемых обработкой при 900°С, по сравнению с синтезом по схеме рис. 7 – удельная поверхность остается практически такой же высокой, как у низкотемпературных образцов (рис. 11, кривая 2). Этот факт подтверждается РЭМ-изображениями (рис. 12), на которых видно, что структура образца (б, б*), полученного по схеме на рис. 8, сохраняется, в отличие от образца (а, а*), полученного по схеме на рис. 7.
Как видно из приведенных мессбауэровских спектров (рис. 13, 14), образцы смешанных оксидов железа-алюминия, полученные по различным схемам, значительно отличаются друг от друга. При этом результаты РФА не всегда совпадают с результатами мессбауэровской спектроскопии. Так, РФА обнаруживает в образце только магнетит (рис. 10, кривая 2, образец после прокаливания при 500°С). Тогда как из мессбауэровских спектров следует, что при температуре 500°С в образце кроме маггемита проявляется вклад от гематита. После отжига при 900°С линии магнитного секстиплета усиливаются, что свидетельствует об увеличении вклада от гематита. Во всех спектрах присутствует суперпарамагнитный дуплет.
Рис. 13.
Мессбауэровские спектры образцов смешанных оксидов железа-алюминия, полученных темплатным синтезом по схеме на рис. 7. Температура прокаливания: а1 – 100; а2 – 300; а3 – 500; а4 – 900; а5 – 1000°С.
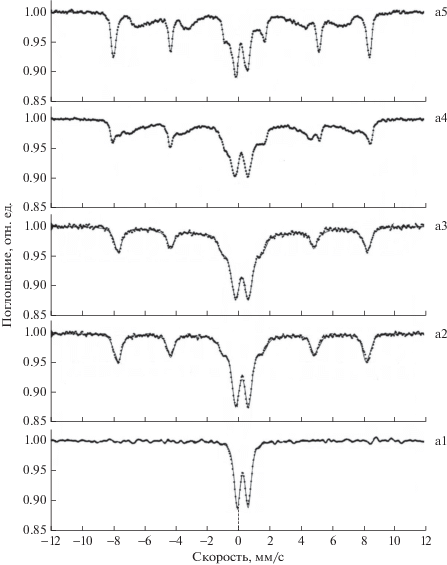
Рис. 14.
Мессбауэровские спектры образцов смешанных оксидов железа-алюминия, полученных темплатным синтезом по схеме на рис. 8. Температура прокаливания: б1 – 300; б2 – 500; б3 – 800; б4 – 900°С.
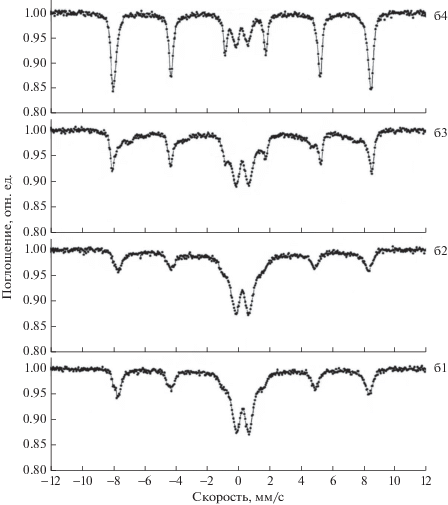
В спектрах (Fe1 –xAlx)2O3, полученного темплатным синтезом по схеме рис. 8, наблюдается интерполяция секстиплета и дуплета (рис. 14). Дуплет характеризует вклад от ультрадисперсной фазы, который уменьшается с повышением температуры прокаливания. На РЭМ-изображении (рис. 12б, 12б*) видны крупные наночастицы диаметром >50 нм и наноразмерная макропористая структура, вклад от которой проявляется в мессбауэровских спектрах. Улучшение гомогенности фазового состава после перехода магнетит–гематит и кристаллической структуры оксидов при прокаливании делает линии спектра более четкими.
Исследование магнитных свойств материалов
Для управления магнитными полями концентрацией создаваемых каталитических материалов были исследованы магнитные свойства полученных оксидов железа, в частности, температурные зависимости намагниченности образцов и гистерезисные свойства.
Образцы оксида железа. Согласно полученным данным, вид температурной зависимости намагниченности образца оксида железа, полученного прокаливанием при 500°С, свидетельствует о том, что образец состоит из двух ферримагнитных фаз (рис. 15а). Сопоставление экспериментальных данных по намагниченности позволяет предположить, что в образце имеются крупные частицы маггемита (γ-Fe2O3) с температурой Кюри Tc ~ 860 K, что соответствует Тс массивного материала [17] и мелкодисперсной фазы c Tc = 570 K, которая характерна для наночастиц γ-Fe2O3 и Fe3O4 со средним диаметром <10 нм [18].
Рис. 15.
Температурные (а) и полевые зависимости (б) намагниченности макропористого оксида железа, полученного прокаливанием при 500°С (γ-Fe2O3 – маггемит, Fe3O4 – магнетит). Измерения M = f(T) проводили в поле H = 5000 Э.
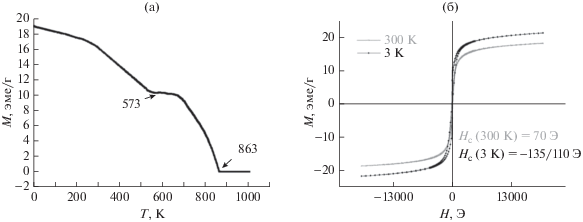
Полученные полевые зависимости намагниченности данного образца показали наличие гистерезиса при комнатной температуре. Увеличение Нс при низких температурах свидетельствует о суперпарамагнитном вкладе в процессы перемагничивания (рис. 15б). Намагниченность насыщения равна ~20 эме/г, что в 4.5 ниже, чем у магнетита. По-видимому, это связано с пористой структурой материала.
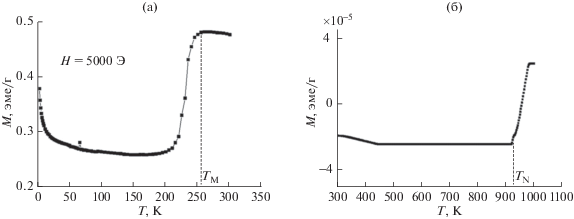
Совершенно иначе обстоит дело с оксидом железа α-Fe2O3, прокаленным при 900°С: на температурных зависимостях намагниченности образца можно выделить две характерные точки: TМ ≈ ≈ 256 K и TN ≈ 940 K (рис. 16). Эти температуры практически совпадают с температурой Морина TM = 263 K (–10°С) и температурой Нееля TN = = 948 K (675°С) для объемного гематита [19, 20]. Уменьшение критических температур обусловлено малым размером частиц [21]. Незначительный рост намагниченности при приближении к температуре 3 K является проявлением суперпарамагнитного вклада наночастиц α-Fe2O3.
Рис. 16.
Температурные зависимости намагниченности макропористого оксида железа, полученного прокаливанием при 900°С, в поле H = 5000 Э.
Форма петли магнитного гистерезиса, полученной при температуре Т = 300 K, свидетельствует о наличии низко- и высококоэрцитивных компонент. Первая компонента обусловлена суперпарамагнитным вкладом малых наночастиц. Высокое значение Нс определяется закреплением намагниченности в процессе когерентного вращения на дефектах, так как однодоменное состояние является энергетически выгодным для частиц гематита размером до 20 мкм [22]. Широкий диапазон значений коэрцитивной силы (от сотен до нескольких тысяч эрстед) обусловлен разбросом размеров микрочастиц. При этом узкие максимумы на дифрактограммах (рис. 2) свидетельствуют о поликристаллической структуре частиц α-Fe2O3 с размером зерна ~100 нм [23]. При низких температурах мы наблюдаем петлю гистерезиса только от суперпарамагнитной фазы (рис. 17). Сдвиг петли гистерезиса при 3 K в область отрицательных полей свидетельствует о наличии обменно-смещенного антиферромагнитного взаимодействия. В обоих случаях (Т = 3 и 300 K) намагниченность не достигает насыщения.
Рис. 17.
Полевые зависимости намагниченности макропористого оксида железа, полученного прокаливанием при 900°С (α-Fe2O3 – гематит).
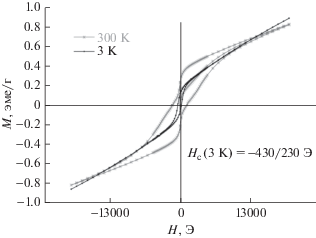
Смешанный железо-алюминатный композитный материал. Вид температурной зависимости, представленной на рис. 18, говорит о ферро-ферримагнитной природе образца, представляющего собой пористый смешанный железо-алюминатный композитный материал, полученный по схеме рис. 7 в условиях термообработки при 900°С.
Рис. 18.
Температурные (а) и полевые зависимости (б) намагниченности макропористого железо-алюминатного композитного материала, полученного прокаливанием при 900°С. Измерения M = f(T) проводили в поле H = 5000 Э.
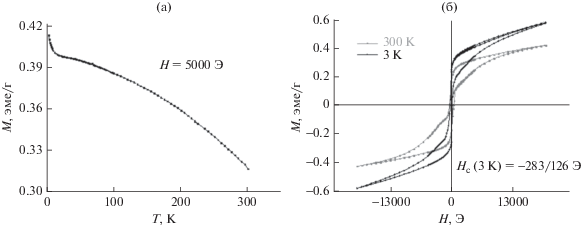
На петлях магнитного гистерезиса есть вклады от двух фаз: низко- и высококоэрцитивной (рис. 18б). Причины их появления аналогичны рассмотренным выше. Сложный вид петли гистерезиса сохраняется и при низкой температуре. Сдвиг петли гистерезиса при 3 K в область отрицательных полей свидетельствует о наличии обменного взаимодействия типа антиферромагнетик/ферро-ферримагнетик вследствие присутствия гематита.
Таким образом, можно сделать вывод о том, что введение ионов алюминия в процессе темплатного синтеза макропористых оксидов железа не только позволяет сохранить пористую структуру материалов при высокотемпературной обработке, что улучшает каталитические свойства (рис. 6, кривые 3 и 4), но и существенным образом влияет на магнитные свойства получаемых оксидов железа (рис. 18).
ЗАКЛЮЧЕНИЕ
Исследованный в работе способ темплатного синтеза смешанных железо-алюминатных оксидных систем позволяет получать пористые материалы с эффективными магнитными и каталитическими свойствами. Установлено, что каталитические свойства материалов, синтезированных из железо-алюминатных оксидных систем, превосходят свойства материалов, полученных синтезом из оксида железа. Введение ионов алюминия в процессе темплатного синтеза макропористых оксидов железа позволяет сохранить пористую структуру материалов при высокотемпературной обработке, что улучшает каталитические свойства и существенным образом влияет на магнитные свойства получаемых оксидов железа при неизменной удельной поверхности образцов, столь же высокой, как и у образцов, прокаленных при низкой температуре.
Список литературы
Thuy U.T.D., Liem N.Q., Parlett C.M.A. et al. // Catal. Commun. 2014. V. 44. P. 62. https://doi.org/10.1016/j.catcom.2013.07.030
Saranya M., Ramachandran R., Samuel E.J.J. et al. // Powder Technol. 2015. V. 279. P. 209. https://doi.org/10.1016/j.powtec.2015.03.041
Avramenko V.A., Voit A.V., Dmitrieva E.E. et al. // Dokl. Chem. 2008. V. 418. № 1. P. 19. https://doi.org/10.1134/S0012500808010072
Papynov E.K., Palamarchuk M.S., Mayorov V.Y. et al. // Solid State Sci. 2017. V. 69. P. 31. https://doi.org/10.1016/j.solidstatesciences.2017.05.005
Papynov E.K., Mayorov V.Y., Palamarchuk M.S. et al. // Mater. Charact. 2014. V. 88. P. 42. https://doi.org/10.1016/j.matchar.2013.12.003
Ambashta R.D., Sillanpää M. // J. Hazard. Mater. 2010. V. 180. № 1–3. P. 38. https://doi.org/10.1016/j.jhazmat.2010.04.105
Santhosh C., Malathi A., Dhaneshvar E. et al. // Iron Oxide Nanomaterials for Water Purification, Elsevier Inc., 2018 https://doi.org/10.1016/B978-0-12-813926-4.00022-7
Guglielmi M., Kickelbick G., Martucci A. // Sol-Gel Nanocomposites, Springer, New York, 2014. https://doi.org/10.1007/978-1-4939-1209-4
Simonenko T.L., Ivanova V.M., Simonenko N.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1753. https://doi.org/10.1134/S0036023619140080
Papynov E.K., Drankov A.N., Tkachenko I.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 820. https://doi.org/10.1134/S0036023620060157
Wang W., Pang Y., Hodgson S.N.B. // Microporous Mesoporous Mater. 2009. V. 121. № 1–3. P. 121. https://doi.org/10.1016/j.micromeso.2009.01.014
Zhao D., Huo Q., Feng J. et al. // J. Am. Chem. Soc. 1998. V. 120. № 24. P. 6024. https://doi.org/10.1021/ja974025i
Partap S., Hebb A.K., Ur Rehman I. et al. // Polym. Bull. 2007. V. 58. № 5–6. P. 849. https://doi.org/10.1007/s00289-006-0724-y
Gabbasov R., Polikarpov M., Cherepanov V. et al. // J. Magn. Magn. Mater. 2015. V. 380. P. 111. https://doi.org/10.1016/j.jmmm.2014.11.032
Fenton H.J.H. // J. Chem. Soc. Trans. 1894. V. 65. P. 899.
Turnock A.C., Eugster H.P. // J. Petrol. 1962. V. 3. № 3. P. 533. https://doi.org/10.1093/petrology/3.3.533
Néel L. // Anneles des Phys. 1948. V. 12. № 3. P. 137.
Никифоров В.Н., Игнатенко А.Н., Ирхин В.Ю. // Журн. эксперим. и теорет. физики. 2017. V. 151. № 2. P. 356.
Morin F.J. // Phys. Rev. 1950. V. 78. № 6. P. 819. https://doi.org/10.1103/PhysRev.78.819.2
Amin N., Arajs S. // Phys. Rev. B 1987. V. 35. № 10. P. 4810. https://doi.org/10.1103/PhysRevB.35.4810
Kubániová D., Kubíčková L., Kmječ T. et al. // J. Magn. Magn. Mater. 2019. V. 475. P. 611. https://doi.org/10.1016/j.jmmm.2018.11.126
Dunlop D.J. // Phys. Earth Planet. Inter. 1981. V. 26. № 1–2. P. 1. https://doi.org/10.1016/0031-9201(81)90093-5
Vallina B., Rodriguez-Blanco J.D., Brown A.P. et al. // J. Nanoparticle Res. 2014. V. 16. № 3. P. 2322. https://doi.org/10.1007/s11051-014-2322-5
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии