Журнал неорганической химии, 2020, T. 65, № 11, стр. 1516-1521
Синтез и строение производных тетрафенилвисмута(V) Ph4BiCl, [Ph4Bi DMSO-O][PtBr3 DMSO-S] и [Ph4Bi]2[PtCl6]
В. В. Шарутин a, О. К. Шарутина a, В. С. Сенчурин a, *
a Южно-Уральский государственный университет (Национальный исследовательский университет)
454080 Челябинск, пр-т Ленина, 76, Россия
* E-mail: senvl@rambler.ru
Поступила в редакцию 24.03.2020
После доработки 03.06.2020
Принята к публикации 05.06.2020
Аннотация
Продуктом взаимодействия хлорида тетрафенилвисмута Ph4BiCl (I), синтезированного дефенилированием пентафенилвисмута соляной кислотой, с гексабромоплатинатом калия (2 : 1 мольн.) в воде после перекристаллизации из диметилсульфоксида является S-диметилсульфоксидотрибромоплатинат О-диметилсульфоксидотетрафенилвисмута [Ph4Bi DMSO-O][PtBr3 DMSO-S] (II). Перекристаллизация из ацетонитрила комплекса, полученного из I и гексахлороплатината калия, дает гексахлороплатинат тетрафенилвисмута [Ph4Bi]2[PtCl6] (III). Структуры I−III исследованы методом РСА. Координационный полиэдр атомов висмута в I и II (в кристалле присутствуют два типа кристаллографически независимых ионов) – искаженная тригональная бипирамида с гетероатомами в аксиальных положениях, аксиальные углы CBiCl и CBiО составляют 175.8(1)° и 177.4(3)°, 177.3(4)° соответственно; расстояния Bi−Cl равны 2.912(2) Å (I), Bi−О – 2.78(1) и 2.76(1) Å (II); в экваториальной плоскости связи Bi−C и углы CBiC составляют соответственно 2.204(4)−2.224(4) Å и 113.42(16)°−123.35(15)° в I, 2.170(13)−2.181(12), 2.155(12)−2.187(13) Å и 110.9(4)°−123.8(4)°, 111.0(4)°−123.3(5)° в II. Катион III имеет конфигурацию искаженного тетраэдра, связи Bi−C изменяются в интервале 2.199(4)−2.231(4) Å, а углы CBiC − в интервале 102.6(2)°−126.5(2)°. Атомы платины в анионах II тетракоординированы, транс-углы BrPtBr и SPtBr варьируются в диапазоне 176.51(11)°−177.62(6)°; связи Pt–Br составляют 2.402(3)−2.424(3) Å, расстояния Pt–S равны 2.200(4) и 2.182(4) Å. В центросимметричных октаэдрических анионах III транс-углы ClPtCl составляют 180°, цис-ClPtCl – 88.71(6)°−91.29(6)°; связи Pt–Cl – 2.329(2)−2.3350(18) Å.
ВВЕДЕНИЕ
Известно, что галогениды тетраорганиламмония, -фосфония и -стибония как источники катионов находят широкое применение в качестве реагентов для синтеза новых комплексных соединений. Однако использование с этой целью галогенидов тетраорганилвисмутония ограничено, поскольку они, как правило, лабильны. В литературе описаны производные висмута(V) общей формулы Ar4BiX, содержащие карбоксилатные [1], сульфонатные [1–4], ароксидные [5–7] и другие лиганды Х [8–13]. Наиболее устойчивыми среди указанных соединений висмута являются ионные комплексы с катионом [Ar4Bi]+ и анионами с низкой основностью, такие как аренсульфонаты [14, 15] и тетрафторобораты [16–19]. Имеются единичные примеры комплексов с катионом [Ph4Bi]+ и металлсодержащими анионами [Bi4I16]4− [20] и [Bi5I18]3− [21]. Между тем соединения сурьмы, способные генерировать тетраарилстибониевый катион, эффективно используются в синтезе комплексов золота, платины [22], осмия [23], иридия [24] и палладия [25].
В настоящей работе синтезированы и структурно исследованы новые комплексы платины S-диметилсульфоксидотрибромоплатинат О-диметилсульфоксидотетрафенилвисмута [Ph4 Bi DMSO-O][PtBr3 DMSO-S] и гексахлороплатинат тетрафенилвисмута [Ph4Bi]2[PtCl6], а также получен и структурно охарактеризован хлорид тетрафенилвисмута Ph4BiCl.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворители марки “х.ч.” и “ос.ч.”, а также соляную кислоту марки “х. ч.” (Вектон) использовали без дополнительной очистки. Пентафенилвисмут синтезировали по методике [26], гексахлороплатинат и гексабромоплатинат калия – по методикам, описанным в [27].
Ph4BiCl (I). Навеску 3 г (5.05 ммоль) пентафенилвисмута растворяли в 20 мл ацетона и при перемешивании добавляли двукратный избыток (0.9 мл) 36%-ного раствора HCl. После удаления растворителя мелкокристаллический осадок растворяли в воде при комнатной температуре, отфильтровывали и испаряли растворитель при комнатной температуре. Выход неокрашенных кристаллов соединения I с tпл = 84°С составил 1.34 г (48%).
ИК-спектр (ν, см–1): 3059, 3042, 2986, 1562, 1470, 1433, 1325, 1302, 1184, 1157, 1055, 1045, 1011, 989, 727, 694, 683, 646, 444.
[Ph4Bi ∙ DMSO-O][PtBr3 ∙ DMSO-S] (II). Навеску 475 мг (0.86 ммоль) хлорида тетрафенилвисмута растворяли в 15 мл воды и при перемешивании добавляли раствор 324 мг (0.43 ммоль) гексабромоплатината калия в 10 мл воды. Выпавший осадок отфильтровывали, высушивали и растворяли в 4 мл ДМСО. Раствор концентрировали, получили 320 мг (67%) светло-коричневых кристаллов соединения II с tразл = 155°С.
ИК-спектр (ν, см−1): 3048, 2995, 2911, 1616, 1566, 1472, 1435, 1111, 1018, 991, 729, 685, 438.
[Ph4Bi]2[PtCl6] (III). По аналогичной методике из хлорида тетрафенилвисмута и гексахлороплатината калия с последующей перекристаллизацией из ацетонитрила синтезировали гексахлороплатинат тетрафенилвисмута (III) (выход 64%). Получены кристаллы желтого цвета, которые после перекристаллизации из ацетонитрила имели tразл = 107°С.
ИК-спектр (ν, см−1): 3065, 3046, 3026, 1560, 1472, 1437, 1329, 1188, 1161, 1055, 1009, 989, 729, 687, 648, 438.
ИК-спектры комплексов I−III регистрировали на ИК-Фурье-спектрометре Shimadzu IRAffinity-1S в таблетках KBr в области 4000−400 см–1.
РСА монокристаллов I−III проводили на дифрактометре Bruker D8 Quest при 293 K. При расшифровке структур использовали программы SMART и SAINT-Plus [28], SHELXL/PC [29] и OLEX2 [30].
Кристаллы соединения I неокрашенные, C24H20ClBi (M = 552.83); моноклинные, пр. гр. P21/n при 293.15 K, a = 10.648(7), b = 14.903(7), c = = 13.484(6) Å, α = 90.00°, β = 92.234(19)°, γ = = 90.00°, V = 2138.1(19) Å3, Z = 4, ρвыч = 1.717 г/см3; μ = 8.375 мм–1, F(000) = 1056.0. Измерено 82013 отражений, из них 7812 независимых (Rint = 0.0789) и 5204 наблюдаемых отражения [I ≥ 2σ(I)], 235 параметров уточнения: R1 = 0.0421, wR2 = 0.0704.
Кристаллы соединения II красно-коричневые, C28H32O2S2Br3PtBi (M = 1108.46); моноклинные, пр. гр. P21 при 293.15 K, a = 10.229(15), b = 12.11(3), c = 25.73(4) Å, α = 90.00°, β = 90.27(5)°, γ = 90.00°, V = 3187(9) Å3, Z = 4, ρвыч = 2.310 г/см3; μ = = 13.816 мм–1, F(000) = 2056.0. Измерено 20035 отражений, из них 7166 независимых (Rint = = 0.0458) и 6663 наблюдаемых отражения [I ≥ ≥ 2σ(I)], 675 параметров уточнения: R1 = 0.0291, wR2 = 0.0610.
Кристаллы соединения III желтые, C48H40Cl6PtBi2 (M = 1442.55); триклинные, пр. гр. P$\bar {1}$ при 293.15 K, a = 10.115(6), b = 10.240(8), c = = 12.325(7) Å, α = 100.71(3)°, β = 92.72(2)°, γ = = 110.61(3)°, V = 1165.2(13) Å3, Z = 1, ρвыч = 2.056 г/см3; μ = 10.903 мм–1, F(000) = 674.0. Измерено 74 324 отражения, из них 8890 независимых (Rint = = 0.0715) и 5862 наблюдаемых отражения [I ≥ ≥ 2σ(I)], 259 параметров уточнения: R1 = 0.0483, wR2 = 0.1005.
Полные таблицы координат атомов, длин связей и валентных углов структур I−III депонированы в Кембриджском банке структурных данных (№ 1 965 533 (I), 1 922 961 (II), 1 974 383 (III); deposit@ccdc.cam.ac.uk; http://www.ccdc.cam.ac.uk).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Производные пентафенилвисмута общей формулы Ph4BiX (X = Cl, Br, I, Ph4B, CN, NO2) впервые были получены Виттигом [26], однако хлорид тетрафенилвисмута (I), устойчивый только при низких температурах, не был структурно охарактеризован. Нам удалось дефенилированием пентафенилвисмута соляной кислотой в ацетоне с последующей перекристаллизацией из воды выделить I в виде неокрашенных кристаллов, пригодных для рентгеноструктурного анализа:
Комплекс II синтезирован нами из I и гексабромоплатината калия (2 : 1 мольн.). После смешения водных растворов реагентов наблюдали образование осадка, который отфильтровывали, сушили и растворяли в диметилсульфоксиде. Как установлено в результате рентгеноструктурных исследований, перекристаллизация сопровождалась внедрением молекулы диметилсульфоксида в координационную сферу атома висмута, восстановлением Pt4+ до Pt2+, а также лигандным обменом одного из бромид-ионов на молекулу ДМСО в анионе:
Отметим, что попытка получить из ацетонитрила кристаллы, пригодные для РСА, не привела к успеху.
Реакция I с гексахлороплатинатом калия в воде привела к образованию комплекса III, при последующей перекристаллизации которого из ацетонитрила не происходило изменения состава и структуры как катиона, так и аниона:
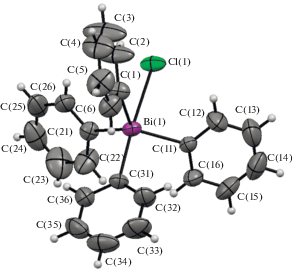
По данным РСА, атом висмута в I имеет искаженную тригонально-бипирамидальную координацию (рис. 1).
Сумма углов в экваториальной плоскости составляет 355.25°, аксиальный угол C(1)Bi(1)O(31) равен 175.80(11)°; в экваториальных положениях находятся фенильные лиганды (углы CBiC 113.42(16)°, 118.48(15)° и 123.35(15)°), в аксиальных располагаются четвертый фенильный заместитель и атом хлора. Атом висмута отклоняется на 0.28 Å в направлении аксиально расположенного атома углерода, вследствие чего углы ClBiC(1,11,21)экв < 90°: 85.50(12)°, 80.60(11)° и 82.20(12)°, напротив, валентные углы С(31)аксBiC(1,11,21)экв составляют 98.00(16)°, 95.50(15)° и 98.44(16)°. Расстояния Bi–Cэкв (2.204(4), 2.212(4) и 2.224(4) Å) меньше, чем Bi‒Cакс (2.248(4) Å). Длина связи Bi–Cl (2.9116(19) Å) превышает сумму ковалентных радиусов атомов висмута и хлора (2.50 Å) [31]. Аналогичное удлинение связи Bi–Br по сравнению с суммой ковалентных радиусов наблюдается в бромиде тетрафенилвисмута, где расстояние Bi–Br (3.1387 Å) значительно превышает сумму ковалентных радиусов атомов висмута и брома (2.68 Å) [32].
В кристалле комплекса II (рис. 2) присутствуют два типа кристаллографически независимых катионов и анионов. Координационный полиэдр атома висмута – тригональная бипирамида; молекула диметилсульфоксида координирована атомом кислорода на центральный атом.
Рис. 2.
Общий вид соединения [Ph4Bi DMSO-O][PtBr3 DMSO-S] (II) (показана одна пара кристаллографически независимых типов катионов и анионов).
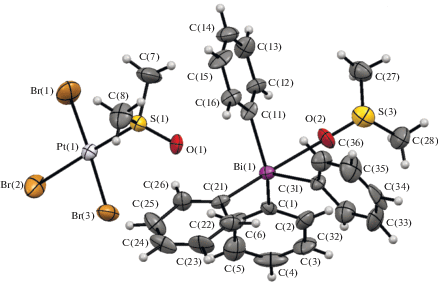
Аксиальный угол С(21)Bi(1)O(3) равен 177.4(5)° (С(61)Bi(2)O(4) 177.3(5)°, далее в скобках приведены соответствующие значения для катиона Bi(2)). Суммы валентных углов СBiС в псевдоэкваториальных плоскостях составляют 348.0(4)° (347.9(5)°). Аксиальная связь С(21)−Bi(1) 2.189(13) Å (С(61)−Bi(2) 2.221(12) Å) длиннее экваториальных связей С(1,11,31)−Bi(1): 2.170(13), 2.181(12), 2.187(12) Å (С(41,51,71)−Bi(2) 2.155(12), 2.187(13), 2.187(11) Å). Расстояние Bi(1)⋅⋅⋅O(3), равное 2.78(1) Å (Bi(2)⋅⋅⋅O(4) 2.76(1) Å), существенно меньше суммы ван-дер-ваальсовых радиусов (3.59 Å) [33]. Координационное число атома платины в анионе равно 4, причем сульфоксидный лиганд координируется на атом платины посредством атома серы. Углы цис-SPtBr составляют 87.90(15)°, 94.26(15)° (88.02(15)°, 94.14(15)°, здесь и далее в скобках приведены соответствующие значения для аниона Pt(2)); цис-BrPtBr – 88.59(13)°, 89.22(13)° (88.61(13)°, 89.20(13)°); транс-BrPtBr и транс-SPtBr – 177.64(6)°, 176.51(11)° (177.62(6)°, 176.73(11)°); длины связей Pt–Br изменяются в интервале 2.402(3)−2.424(3) Å (2.411(3)−2.422(3) Å). Длины связей Pt–S равны 2.200(4) Å (2.182(4) (13) Å) и близки к аналогичным расстояниям (2.219 Å) в других структурно охарактеризованных комплексах с анионом [PtBr3 DMSO-S]– [34, 35], но меньше суммы ковалентных радиусов элементов (2.41 Å) [29]. Следует отметить, что в аммониевых и фосфониевых комплексах с анионом [Pt Br5 DMSO-S]– связь Pt–S длиннее – 2.332(3)−2.3398(18) Å [36].
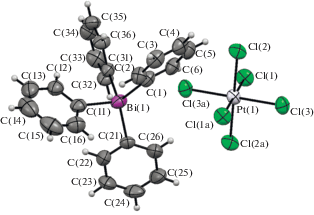
В комплексе III (рис. 3) углы CBiC в тетраэдрическом катионе изменяются в интервале 102.6(2)°−126.5(2)°; длины трех связей Bi–C(1,11,21) совпадают в пределах допустимой погрешности эксперимента (2.208(6), 2.202(7), 2.199(4) Å), четвертая связь Bi–C(31) длиннее – 2.231(4) Å.
Координация атома платины в центросимметричном анионе III близка к идеальной октаэдрической, транс-углы ClPtCl составляют 180°, цис-углы ClPtCl попарно равны: 88.71(6)°, 89.15(8)°, 89.81(7)°, 90.19(7)°, 90.85(8)° и 91.29(6)°. Длины связей Pt–Cl(1,2,3) (2.3317(17), 2.3350(18) и 2.329(2) Å) меньше суммы ковалентных радиусов элементов (2.38 Å) [31].
Контактов между атомами висмута катионов и атомами хлора и кислорода анионов в структурах II, III не наблюдается.
Структурная организация в кристаллах I−III обусловлена водородными связями Bi–Cl⋅⋅⋅Н–C (2.80−2.94 Å) (I), Pt–Br⋅⋅⋅Н–C (2.85−3.05 Å), S=O⋅⋅⋅Н–CAr (2.47−2.70 Å) (II) и Pt–Cl⋅⋅⋅Н–C (2.77−2.95 Å) (III).
Таким образом, структурно охарактеризован хлорид тетрафенилвисмута, в кристалле которого удлинение координационной связи Bi–Cl составляет 16.4% по сравнению с суммой ковалентных радиусов атомов. По реакции обмена между хлоридом тетрафенилвисмута и гексабромоплатинатом или гексахлороплатинатом калия в воде впервые синтезированы комплексы платины с висмутсодержащими катионами. Перекристаллизация гексабромоплатината тетрафенилвисмута из диметилсульфоксида сопровождается восстановлением платины до Pt2+ и внедрением молекулы диметилсульфоксида в координационную сферу металлов в катионе и анионе, при этом КЧ атома висмута увеличивается до 5, а КЧ платины уменьшается до 4. Перекристаллизация из ацетонитрила не приводит к структурным изменениям комплексов.
Список литературы
Abramovitch R.A., Barton D.H.R., Finet J.-P. // Tetrahedron. 1988. V. 44. № 11. P. 3039. https://doi.org/10.1016/S0040-4020(01)85938-X
Sharutin V.V., Egorova I.V., Ivanenko T.K. et al. // Russ. J. Coord. Chem. 2003. V. 29. № 5. P. 317. https://doi.org/10.1023/A:1023619616897
Sharutin V.V., Egorova I.V., Ivanenko T.K. et al. // Russ. J. Coord. Chem. 2003. V. 29. № 7. P. 468. https://doi.org/10.1023/A:1024722812183
Sharutin V.V., Egorova I.V., Pakusina A.P. et al. // Russ. J. Coord. Chem. 2007. V. 33. № 3. P. 168. https://doi.org/10.1134/S1070328407030037
Hoppe S., Whitmire K.H. // Organometallics. 1998. V. 17. № 7. P. 1347. https://doi.org/10.1021/om970760r
Sharutin V.V., Egorova I.V., Tsiplukhina T.V. // Russ. J. Gen. Chem. 2004. V. 74. № 2. P. 310. https://doi.org/10.1023/B:RUGC.0000025525.32960.4c
Sharutin V.V., Egorova I.V., Sharutina O.K. et al. // Russ. J. Coord. Chem. 2008. V. 34. № 2. P. 85. https://doi.org/10.1134/S1070328408020024
Yamamoto Y., Ohdoi K., Chen X. et al. // Organometallics. 1993. V. 12. № 8. P. 3297. https://doi.org/10.1021/om00032a060
Suzuki H., Ikegami T., Azuma N. // J. Chem. Soc., Perkin Trans. 1. 1997. P. 1609. https://doi.org/10.1039/A700379J
Chen X., Ohdoi K., Yamamoto Y., Akiba K. // Organometallics. 1993. V. 12. № 5. P. 1857. https://doi.org/10.1021/om00029a047
Matano Y., Begum S.A., Miyamatsu T., Suzuki H. // Organometallics. 1999. V. 18. № 26. P. 5668. https://doi.org/10.1021/om990597v
Ooi T., Goto R., Maruoka K. // J. Am. Chem. Soc. 2003. V. 125. № 35. P. 10494. https://doi.org/10.1021/ja030150k
Park G., Brock D.J., Pellois J.-P., Gabbaï F.P. // Chem. 2019. V. 5. № 8. P. 2215. https://doi.org/10.1016/j.chempr.2019.06.013
Barton D.H.R., Charpiot B., Dau E.T.H. et al. // Helv. Chim. Acta. 1984. V. 67. № 2. P. 586. https://doi.org/10.1002/hlca.19840670227
Sharutin V.V., Sharutina O.K., Egorova I.V. et al. // Russ. Chem. Bull. 1999. V. 42. № 12. P. 2325. https://doi.org/10.1007/BF02498282
Matano Y., Suzuki T., Shinokura T., Imahori H. // Tetrahedron Lett. 2007. V. 48. № 16. P. 2885. https://doi.org/10.1016/j.tetlet.2007.02.085
Matano Y., Suzuki T., Iwata T. et al. // Bull. Chem. Soc. Jpn. 2008. V. 81. № 12. P. https://doi.org/10.1246/bcsj.81.1621
Hassan A., Breeze S.R., Courtenay S. et al. // Organometallics. 1996. V. 15. № 25. P. 5613. https://doi.org/10.1021/om960641w
Matano Y., Shinokura T., Yoshikawa O., Imahori H. // Org. Lett. 2008. V. 10. № 11. P. 2167. https://doi.org/10.1021/ol8005453
Sharutin V.V., Egorova I.V., Klepikov N.N. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 11. P. 1768. https://doi.org/10.1134/S0036023609110126
Sharutin V.V., Egorova I.V., Klepikov N.N. et al. // Russ. J. Inorg. Chem. 2009. V. 54. № 1. P. 52. https://doi.org/10.1134/S0036023609010124
Sharutin V.V., Senchurin V.S., Fastovets O.A. et al. // Russ. J. Coord. Chem. 2008. V. 34. № 5. P. 367. https://doi.org/10.1134/S1070328408050096
Sharutin V.V., Sharutina O.K., Senchurin V.S., Pel’kov P.A. // Russ. J. Inorg. Chem. 2016. V. 61. № 2. P. 183. https://doi.org/10.1134/S0036023616020200
Sharutin V.V., Sharutina O.K., Senchurin V.S., Somov N.V. // Russ. J. Inorg. Chem. 2016. V. 61. № 8. P. 969. https://doi.org/10.1134/S0036023616080143
Sharutin V.V., Senchurin V.S., Sharutina O.K. // Russ. J. Inorg. Chem. 2013. V. 58. № 5. P. 969. https://doi.org/10.1134/S0036023613050203
Wittig G., Clauß K. // Lieb. Ann. 1952. V. 578. № 1. P. 136. https://doi.org/10.1002/jlac.19525780116
Синтез комплексных соединений металлов платиновой группы / Справочник / Отв. ред. Черняев И.И. М.: Мир, 1964. 340 с.
Bruker (1998). SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA.
Bruker (1998). SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339. https://doi.org/10.1107/S0021889808042726
Cordero B., Gomez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. P. 2832. https://doi.org/10.1039/B801115J
Senchurin V.S., Sharutin V.V., Sharutina O.K // Russ. J. Inorg. Chem. 2020. V. 65. № 3. P. 323. https://doi.org/10.1134/S0036023620030122
Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. № 19. P. 5806. https://doi.org/10.1021/jp8111556
Kwang Ha // Z. Kristallogr.-New Cryst. Struc. 2014. V. 229. № 2. P. 161. https://doi.org/10.1515/ncrs-2014-0090
Ndinguri M.W., Fronczek F.R., Marzilli P.A. et al. // Inorg. Chim. Acta. 2010. V. 363. № 8. P. 1796. https://doi.org/10.1016/j.ica.2010.02.027
Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Coord. Chem. 2011. V. 37. № 11. P. 854. https://doi.org/10.1134/S1070328411100113
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии