Журнал неорганической химии, 2020, T. 65, № 11, стр. 1527-1534
Термодинамика парообразования в системе Li2O–Ta2O5. Стандартные энтальпии образования танталатов лития
К. Г. Сморчков a, Н. А. Грибченкова a, А. С. Алиханян a, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: alikhan@igic.ras.ru
Поступила в редакцию 15.06.2020
После доработки 26.06.2020
Принята к публикации 30.06.2020
Аннотация
Эффузионным методом Кнудсена с масс-спектральным анализом газовой фазы исследованы процессы парообразования в системе Li2O–Ta2O5 в интервале температур 1570–1860 K. Установлено, что насыщенный пар над системой во всем диапазоне составов конденсированной фазы состоит из атомов лития, молекул кислорода и оксида лития Li2O. Рассчитаны абсолютные величины парциальных давлений и построено р–х-сечение полной р–Т–х-фазовой диаграммы при T = 1753 K. Экспериментальные данные позволили по 2-му и 3-му законам термодинамики рассчитать стандартные энтальпии ряда гетерофазных реакций и стандартные энтальпии образования танталатов лития: ${{\Delta }_{f}}H_{{{\text{298}}}}^{^\circ }$(Li3TaO4) = –2074.6 ± 62.9 кДж/моль, ${{\Delta }_{f}}H_{{{\text{298}}}}^{^\circ }$(LiTaO3) = –1403.5 ± 57.4 кДж/моль, ${{\Delta }_{f}}H_{{{\text{298}}}}^{^\circ }$(LiTa3O8) = –3466.4 ± 47.3 кДж/моль. На основании р–х-сечения фазовой диаграммы оценены активности компонентов при T = 1473 K и стандартная энтальпия образования гептатанталата лития ${{\Delta }_{f}}H_{{{\text{298}}}}^{^\circ }$(Li7ТаО6) = –3383.0 кДж/моль.
ВВЕДЕНИЕ
Танталаты и ниобаты лития – одни из самых интересных и перспективных полифункциональных материалов в электронике. LiNbO3 и LiTaO3 представляют наибольший интерес среди соединений, образующихся в системах Li2O–Nb2O5 и Li2O–Ta2O5. Эти смешанные оксиды являются сегнетоэлектриками и обладают уникальной комбинацией электрооптических, акустических, пьезоэлектрических, пироэлектрических и нелинейных оптических показателей, что делает их подходящими материалами для применения в акусто- и оптоэлектронике, оптике и лазерной технике, системах связи и автоматики и т.д. [1–13]. На основе LiTaO3 создан и запатентован материал твердого электролита для литий-ионных перезаряжаемых батарей [14]. Танталаты и ниобаты лития стехиометрии Li2O : Ta(Nb)2O5 = 1 : 3 исследованы в меньшей степени. Перспективы использования подобных соединений в качестве анодного материала в литий-ионных батареях связаны с двухэлектронным переходом М5+ → М3+, благодаря которому может быть достигнута высокая емкость батареи [15]. Показано, что LiNb3O8 является фотокатализатором восстановления воды до водорода в УФ-свете, а комбинация с танталатом меди имеет активность в видимом свете [16]. Недавно появилось сообщение, что кристаллический гептатанталат лития Li7TaO6 [17], согласно теоретическим расчетам, должен характеризоваться высокой литий-ионной проводимостью. Часто синтез танталатов лития в виде объемных монокристаллов или тонких пленок [18–21] содержит высокотемпературную стадию, когда процессами сублимации уже нельзя пренебрегать, поэтому весьма актуальны исследования процессов парообразования в системе Li2O–Ta2O5. Для создания литий-ионных аккумуляторов с определенными электрическими и емкостными характеристиками на основе танталатов лития необходимы знания термодинамических характеристик всех смешанных оксидов, образующихся в этой системе. В связи с этим нами выполнены высокотемпературные исследования процессов парообразования и термодинамических свойств системы Li2O–Ta2O5 во всем диапазоне составов эффузионным методом Кнудсена с масс-спектральным анализом газовой фазы на приборе МС-1301. В работе использовали платиновые эффузионные камеры с отношением площади испарения к площади эффузии ~250. Нагрев камеры Кнудсена осуществляли электронной бомбардировкой, температуру измеряли оптическим пирометром ЭОП-66 с точностью ±5°С.
По данным работ [22–25], в квазибинарной системе Li2O–Ta2O5 образуется пять сложных оксидов: Li7TaO6 (7 : 1), Li5TaO5 (5 : 1), Li3TaO4 (3 : 1), LiTaO3 (1 : 1) и LiTa3O8 (1 : 3), находящихся в равновесии до 900°С с шестью гетерогенными областями: [Li2O + Li7TaO6 ] (I), [Li7TaO6 + Li5TaO5] (II) и [Li5TaO5 + Li3TaO4 ] (III), [Li3TaO4 + LiTaO3] (IV), [ LiTaO3 + LiTa3O8] (V) и [LiTa3O8 + L-Ta2O5] (VI). Выше этой температуры соединение (5 : 1) неустойчиво, и оставшиеся четыре соединения разделены пятью гетерогенными областями: [Li7TaO6 + Li3TaO4], [Li3TaO4 + LiTaO3], [LiTaO3 + + LiTa3O8], [LiTa3O8 + L-Ta2O5], причем в температурном интервале 600–1800°С наблюдается заметная растворимость (до 5 мол. % Li2O) оксида лития в оксиде тантала. Необходимо отметить, что соединение (1 : 1) характеризуется широкой областью гомогенности – от 52 до 48 мол. % Li2O. Работы по изучению термодинамики сублимации этой системы не проводились, в то время как парообразование индивидуальных оксидов подробно описано в многочисленных исследованиях [26–34]. Согласно этим работам, процесс парообразования оксида лития протекает конгруэнтно, насыщенный пар состоит из молекул Li2O, Li, О2 и незначительного количества молекул LiO, а сублимация оксида тантала Ta2O5 происходит инконгруэнтно с переходом в газовую фазу молекул TaO, TaO2 в интервале температур 2000–2300 K [35, 36]. Более низкая летучесть оксида тантала по сравнению с оксидом лития позволяет рассматривать систему Li2O–Тa2O5 в процессе парообразования в интервале температур 1500–1800 K в рамках двухкомпонентной системы:
(1)
$N({\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}) + N({\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{5}}) = 1.$Нами были исследованы процессы сублимации образцов систем Li2O–Ta2O5 составов 95, 80, 70, 50, 40, 30, 18, мол. % Ta2O5, синтез которых проводили отжигом гомогенизированных смесей чистого оксида тантала и карбоната лития в платиновых тиглях на воздухе при T = 1373 K в течение 60 ч. Чистоту и фазовый состав синтезированных образцов контролировали c помощью рентгенофазового и рентгенофлуоресцентного анализа. Образец, содержащий 5 мол. % Ta2O5, готовили разложением гомогенизированной смеси оксида тантала и карбоната лития в эффузионной камере Кнудсена непосредственно в ходе масс-спектрального эксперимента.
Масс-спектральный анализ показал, что процесс парообразования системы Li2O–Ta2O5 сопровождается переходом в газовую фазу только оксида лития в виде молекул Li2O, О2 и атомов лития. Присутствие в насыщенном паре металлического лития затрудняет проведение длительных экспериментов парообразования из-за растворения его в платине (материал эффузионной камеры) [37], искажения состава насыщенного пара и, как следствие, невозможности использования метода изотермического испарения [38] для определения абсолютных величин парциальных давлений компонентов насыщенного пара. В связи с этим абсолютные величины парциального давления атомов лития над составом 5 мол. % Ta2O5 и гетерогенными областями [Li3TaO4 + LiTaO3] (IV), [LiTaO3 + + LiTa3O8] (V), [LiTa3O8 + L-Ta2O5] (VI) были найдены по интенсивностям ионного тока ${{I}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}$ в масс-спектре газовой фазы в начальной стадии парообразования при кратковременной изотермической сублимации этих систем и коэффициенту чувствительности ${{k}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}$ масс-спектрометра. Этот коэффициент был предварительно рассчитан по экспериментальным данным сублимации чистого Li2O в течение 30 мин и его известным термодинамическим характеристикам (величинам парциальных давлений и стандартным энтальпиям сублимации) [29–34]. Найденный таким образом коэффициент ${{k}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}$ оказался равным ${{k}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}$ = 1.02 × 10–4 мм рт. ст./(В Т). В качестве примера на рис. 1 приведена изотерма сублимации системы IV начального состава 70 мол. % Li2O. Как видно из рисунка, сублимация этой системы в течение 4 ч сопровождается падением интенсивности ионного тока ${{I}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}$ более чем в полтора раза. Поэтому для расчета величины парциального давления лития
(2)
${{р}_{{{\text{Li}}}}} = {{k}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}{{I}_{{{\text{L}}{{{\text{i}}}^{{\text{ + }}}}}}}Т,$Рис. 1.
Изменение интенсивности ионного тока Li+ в процессе парообразования системы Li2O–Ta2O5 начального состава 70 мол. % Li2O при T = 1753 K. Горизонтальная пунктирная линия – принятое значение ионного тока Li+ в течение первых 30 мин парообразования.
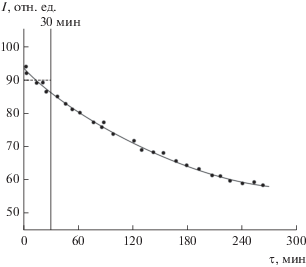
Была использована средняя величина ионного тока, измеренная в первые 30 мин парообразования системы. Аналогичным образом рассчитывали величины парциальных давлений лития над гетерогенными областями V, VI и над составом 95 мол. % Li2O (табл. 1). Величины парциальных давлений молекул Li2O и О2 экспериментально не определяли из-за большого приборного фона на массах m/z = 30D и 32D, а рассчитывали согласно реакции конгруэнтной сублимации оксида лития (3) в условиях эффузионного эксперимента, когда состав конденсированной фазы (состав летучего компонента Li2O) равен составу газового потока, покидающего эффузионную камеру:
(3)
${{({{{{р}_{{{\text{Li}}}}}} \mathord{\left/ {\vphantom {{{{р}_{{{\text{Li}}}}}} {\surd {{М}_{{{\text{Li}}}}}}}} \right. \kern-0em} {\surd {{М}_{{{\text{Li}}}}}}})} \mathord{\left/ {\vphantom {{({{{{р}_{{{\text{Li}}}}}} \mathord{\left/ {\vphantom {{{{р}_{{{\text{Li}}}}}} {\surd {{М}_{{{\text{Li}}}}}}}} \right. \kern-0em} {\surd {{М}_{{{\text{Li}}}}}}})} {\left( {{{{{р}_{{{{{\text{О}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{р}_{{{{{\text{О}}}_{{\text{2}}}}}}}} {\surd {{М}_{{{{{\text{О}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {\surd {{М}_{{{{{\text{О}}}_{{\text{2}}}}}}}}}} \right)}}} \right. \kern-0em} {\left( {{{{{р}_{{{{{\text{О}}}_{{\text{2}}}}}}}} \mathord{\left/ {\vphantom {{{{р}_{{{{{\text{О}}}_{{\text{2}}}}}}}} {\surd {{М}_{{{{{\text{О}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {\surd {{М}_{{{{{\text{О}}}_{{\text{2}}}}}}}}}} \right)}} = {\text{4}},$Таблица 1.
Величины парциальных давлений компонентов газовой фазы над системой Li2O–Ta2O5, T = 1753 K
| Состав конденсированной фазы | Условие сублимации | Давление компонентов пара, атм | Общее давление | Активность | |||
|---|---|---|---|---|---|---|---|
| рLi | ${{p}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}}$ | ${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ | ${{a}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}}$ | ${{a}_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{5}}}}}$ | |||
| (Li2O) | Кнудсен Замкнутый объем |
3.2 × 10–4 3.73 × 10–4 |
2.49 × 10–4 2.49 × 10–4 |
1.71 × 10–4 0.93 × 10–4 |
7.4 × 10–4 7.15 × 10–4 |
1 | 0 |
| (95 мол. % Li2O) | Кнудсен Замкнутый объем |
2.09 × 10–4 2.4 × 10–4 |
0.85 × 10–4 0.85 × 10–4 |
1.12 × 10–4 6.1 × 10–5 |
4.06 × 10–4 3.0 × 10–4 |
0.34 | – |
| [Li3TaO4 + LiTaO3] | Кнудсен Замкнутый объем |
4.41 × 10–6 2.19 × 10–6 |
5.53 × 10–9 5.53 × 10–9 |
2.34 × 10–6 5.46 × 10–7 |
6.75 × 10–6 2.73 × 10–6 |
2.2 × 10–5 | 0.08 |
| [LiTaO3 + LiTa3O8] | Кнудсен Замкнутый объем |
1.52 × 10–6 0.79 × 10–6 |
0.39 × 10–10 0.39 × 10–10 |
0.81 × 10–6 0.20 × 10–6 |
2.01 × 10–6 0.99 × 10–6 |
0.16 × 10–6 | 0.88 |
| [LiTa3O8 + L-Ta2O5] | Кнудсен Замкнутый объем |
0.53 × 10–6 0.62 × 10–6 |
0.28 × 10–10 0.28 × 10–10 |
0.28 × 10–6 0.15 × 10–6 |
0.81 × 10–6 0.77 × 10–6 |
0.11 × 10–6 | 1 |
и величине константы равновесия [29–34] газофазной реакции (4):
(4)
${\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}\left( {\text{г}} \right) = 2{\text{Li}}\left( {\text{г}} \right) + 0.5{{{\text{О}}}_{{\text{2}}}}.$В табл. 1 приведены результаты этих расчетов. Там же представлены значения величин парциальных давлений при сублимации оксида лития в замкнутом объеме, когда в процессе парообразования выполняется условие равенства составов газовой и конденсированной фаз:
(5)
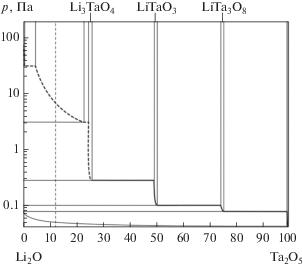
${{{{р}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}}} \mathord{\left/ {\vphantom {{{{р}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}}} {{{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}}}} \right. \kern-0em} {{{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}}} = {\text{4}}.$По найденным таким образом величинам парциальных давлений было построено р–х-сечение полной р–Т–х-фазовой диаграммы системы Li2O–Ta2O5 (рис. 2).
Рис. 2.
р-х-Сечение фазовой диаграммы Li2O–Ta2O5, T = 1753 K. Вертикальная пунктирная линия соответствует составу конденсированной фазы 83.0 ± 1.0 мол. % Li2O.
Исследованием температурной зависимости интенсивности ионного тока ${{I}_{{{\text{L}}{{{\text{i}}}^{ + }}}}}$ в области составов 100–95 мол. % Li2O в интервале температур 1575–1695 K по уравнению изобары химической реакции методом наименьших квадратов рассчитали стандартную энтальпию сублимации атомов лития из кристаллического оксида лития, средняя величина которой из пяти независимых экспериментов оказалась равной ${{\Delta }_{r}}Н_{Т}^{0}$(Li(г)) = 340.4 ± ± 7.3 кДж/моль, что на 21.4 ± 12.1 кДж/моль меньше известных литературных значений [29–34]. Поэтому в дальнейшем при определении энтальпий различных гетерофазных реакций по второму закону термодинамики эту поправку принимали во внимание.
Для определения стандартных энтальпий образования танталатов лития были рассчитаны энтальпии следующих гетерофазных реакций:
(6)
${\text{L}}{{{\text{i}}}_{{\text{3}}}}{\text{Ta}}{{{\text{O}}}_{{\text{4}}}}\left( {{\text{тв}}} \right) = {\text{LiTa}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) + 2{\text{Li}}\left( {\text{г}} \right) + 0.5{{{\text{О}}}_{2}},$(7)
${\text{3LiTa}}{{{\text{O}}}_{{\text{3}}}}\left( {{\text{тв}}} \right) = {\text{LiT}}{{{\text{a}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{8}}}}\left( {{\text{тв}}} \right) + {\text{2Li}}\left( {\text{г}} \right) + 0.5{{{\text{О}}}_{2}},$(8)
${\text{LiT}}{{{\text{a}}}_{{\text{3}}}}{{{\text{O}}}_{{\text{8}}}}\left( {{\text{тв}}} \right) = {\text{1}}{\text{.5T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}\left( {{\text{тв}}} \right) + {\text{Li}}\left( {\text{г}} \right) + {\text{0}}{\text{.25}}{{{\text{О}}}_{{\text{2}}}}.$Определение энтальпий реакций (6)–(8) было выполнено по 2-му и 3-му законам термодинамики. При определении по 2-му закону исследовали температурные зависимости величин, пропорциональных константам равновесий реакций (6)–(8), записанные в силу конгруэнтной сублимации оксида лития в виде k*(6, 7) = $I_{{{\text{L}}{{{\text{i}}}^{ + }}}}^{{{\text{2}}.{\text{5}}}}$ T2.5 и k*(8) = = $I_{{{\text{L}}{{{\text{i}}}^{ + }}}}^{{{\text{1}}{\text{.25}}}}$ Т1.25. Расчет стандартных энтальпий реакций (6)–(8) выполняли по уравнению изобары химической реакции методом наименьших квадратов (табл. 2).
Таблица 2.
Стандартные энтальпии гетерофазных реакций, кДж/моль
| Интервал температур, K | ||
|---|---|---|
| 1681–1858 | 1700–1820 | 1650–1860 |
| Значения энтальпии реакций | ||
| Δr$H_{T}^{0}$ (6) | Δr$H_{T}^{0}$ (7) | Δr$H_{T}^{0}$ (8) |
| 1018.5 | 1045.5 | 511.8 |
| 918.5 | 969.3 | 501.75 |
| 946.0 | 1016.0 | 584.3 |
| 959.3 | 1038.5 | 499.4 |
| 909.3 | 1023.5 | 574.8 |
| – | 969.5 | – |
| – | 982.8 | – |
| – | 948.3 | – |
| – | 1028.8 | – |
| – | 988.0 | – |
| – | 1010.5 | – |
| – | 1037.0 | – |
| Среднее значение | ||
| 950.3 ± 44.5 | 1015.5 ± 36.3 | 534.4 ± 41.5 |
Относительно высокие ошибки в определении стандартных энтальпий гетерофазных реакций связаны в основном с экспериментальными проблемами, которые возникают при исследовании процессов парообразования оксидов и оксидных систем, содержащих в газовой фазе кроме молекул оксидов и кислорода еще и атомы металлов. Единственно возможными материалами эффузионных камер при подобных высокотемпературных исследованиях могут быть платина, иридий и т.п. Однако эти материалы интенсивно растворяют металлы газовой фазы [37, 39, 40] и тем самым изменяют (уменьшают) значения их парциальных давлений в течение всего времени сублимации, что приводит к неконтролируемым искажениям экспериментальных термодинамических характеристик процессов парообразования. Уменьшить искажения при определении энтальпий парообразования в подобного рода экспериментах можно снижением времени при исследовании температурной зависимости интенсивности ионных токов и частой заменой платиновых или иридиевых (что весьма проблематично) эффузионных камер.
Пересчет энтальпий реакций (6)–(8) для температуры 298.15 K был выполнен по известным теплоемкостям: $с_{р}^{^\circ }$(Liгаз) = 20.79 Дж/(моль K) [38], $с_{р}^{^\circ }$(О2газ) = 29.35 Дж/(моль K) [41], $с_{р}^{^\circ }$(Li2Отв) = = 54.09 Дж/(моль K) [41], $с_{р}^{^\circ }$(Ta2O5тв) = = 134.81 Дж/(моль K) [41], $с_{р}^{^\circ }$(LiTaO3тв) = = 191.25 Дж/(моль K) [42] и теплоемкостям смешанных оксидов, рассчитанным по правилу Неймана–Kоппа: $с_{р}^{^\circ }$(Li3TaO4тв) = {$с_{р}^{^\circ }$(LiTaO3тв) + + $с_{р}^{^\circ }$(Li2Отв)} = 155.34 Дж/(моль K), $с_{р}^{^\circ }$(LiTa3O8тв) = = {$с_{р}^{^\circ }$(LiTaO3тв) + $с_{р}^{^\circ }$(Ta2O5тв)} = 236.06 Дж/(моль K) в предположении их независимости от температуры. Значения стандартных энтальпий этих реакций, пересчитанные к температуре 298.15, приведены в табл. 3. Стандартные энтальпии гетерофазных реакций (6)–(8) были рассчитаны также по 3-му закону термодинамики. При расчете были использованы экспериментально найденные абсолютные величины парциальных давлений атомов лития и молекул кислорода при T = 1753 K (табл. 1), известные значения энтропий компонентов этих реакций при T = 298.15 K: S°(Liгаз) = = 138.7 Дж/(моль K) [41], S°(Li2Отв) = = 37.89 Дж/(моль K) [41], S°(О2газ) = = 205.03 Дж/(моль K) [41], S°(Та2О5тв) = = 143.09 Дж/(моль K) [41] и энтропии смешанных оксидов, рассчитанные по инкрементам Латимера [41, 43]: S°(Li3TaO4тв) = 138.7 Дж/(моль K), S°(LiTaO3тв) = 93.7 Дж/(моль K), S°(LiTa3O8тв) = = 236.8 Дж/(моль K). Найденные таким образом стандартные энтальпии реакций (6)–(8) равны: ${{\Delta }_{r}}Н_{{{\text{1753}}}}^{^\circ }$(6) = 1041.1 ± 44.3 кДж/моль, ${{\Delta }_{r}}Н_{{{\text{1753}}}}^{^\circ }$(7) = = 1080.8 ± 50.5 кДж/моль, ${{\Delta }_{r}}Н_{{{\text{1753}}}}^{^\circ }$(8) = 562.4 ± ± 38.3 кДж/моль. В табл. 3 приведены значения энтальпий, пересчитанные к температуре 298.15 K. Ошибка в определении энтальпий по 3-му закону термодинамики связана в основном с точностью определения констант равновесия и оценки изменения энтропий гетерофазных реакций. Термодинамический анализ показал, что вклад этих факторов примерно равнозначный. Некоторую неопределенность в определении величин энтальпий этих реакций как по 2-му, так и по 3-му закону вносит тот факт, что в данном исследовании не учитывалась заметная растворимость оксида лития (до 5 мол. % Li2О) в оксиде тантала и наличие широкой области гомогенности (45–50 мол. % Li2О) соединения LiTaO3 [23, 24]. В этой же таблице приведены рекомендованные значения энтальпий реакций (6)–(8), полученные как среднеарифметические из величин, рассчитанных по 2-му и 3-му законам термодинамики. Связано это с тем, что в данной экспериментальной работе трудно отдать предпочтение какому-либо методу при определении значений энтальпий. Суммарная ошибка для рекомендованных значений рассчитана по закону сложения случайных величин.
Таблица 3.
Стандартные энтальпии гетерофазных реакций
| Реакция | Δr$H_{{298}}^{^\circ }$, кДж/моль | ||
|---|---|---|---|
| 2-ой закон | 3-ий закон | рекомендованное значение | |
| (6) | 947.2 ± 44.5 | 1037.8 ± 44.4 | 992.5 ± 62.9 |
| (7) | 1032.7 ± 36.3 | 1098.0 ± 44.4 | 1065.4 ± 57.4 |
| (8) | 542.8 ± 41.5 | 570.8 ± 22.7 | 556.8 ± 47.3 |
Используя рекомендованные значения энтальпий реакций (6)–(8) и известные литературные данные по стандартным энтальпиям образования: ${{\Delta }_{f}}Н_{{{\text{298}}}}^{^\circ }$(Та2О5тв) = –2047.2 кДж/моль [41], ${{\Delta }_{f}}Н_{{{\text{298}}}}^{^\circ }$(Liгаз) = 160.7 кДж/моль [41], ${{\Delta }_{f}}Н_{{{\text{298}}}}^{^\circ }$(Li2Отв) = –598.7 кДж/моль [41], по закону Гесса рассчитали стандартные энтальпии образования танталатов лития из элементов и простых оксидов (табл. 4).
Найденная в работе величина стандартной энтальпии образования танталата лития состава 1 : 1 хорошо согласуется с известными литературными данными, что может служить подтверждением корректности выполненных нами исследований. Здесь необходимо отметить, что точность расчета стандартных энтальпий образования танталатов лития из простых оксидов подобным методом достаточно низкая. Это связано с самой методикой расчета, где определяемая малая величина (энтальпия образования смешанного оксида из простых оксидов) рассчитывается как алгебраическая сумма нескольких больших величин (значения стандартных энтальпий образования из элементов). Поэтому расчет стандартных энтальпий образования танталатов лития из простых оксидов был выполнен исходя из выражения энергии Гиббса образования танталатов лития из простых оксидов [45]:
(9)
$n{\text{L}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{{\text{тв}}}}} + m{\text{Т}}{{{\text{а}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{5тв}}}}} = n{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}m{\text{Т}}{{{\text{а}}}_{{\text{2}}}}{{{\text{О}}}_{{{\text{5тв}}}}},$(10)
${{\Delta }_{f}}G_{T}^{^\circ }(n{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}mТ{{а}_{{\text{2}}}}{{О}_{{{\text{5тв}}}}}) = RT{\text{ln}}a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{n}a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{m}$(11)
${{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}}a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{1.5}}} \right)}_{{{\text{VI}}}}} = {\text{ }}{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}}} \right)}_{{{\text{VI}}}}} = {\text{ }}{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}}a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{1.5}}} \right)}_{{\text{V}}}},$(12)
${{\left( {a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{1.5}}} \right)}_{{\text{V}}}} = {{{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}}} \right)}}_{{{\text{VI}}}}}} \mathord{\left/ {\vphantom {{{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}}} \right)}}_{{{\text{VI}}}}}} {{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}}} \right)}}_{{\text{V}}}},}}} \right. \kern-0em} {{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}}} \right)}}_{{\text{V}}}},}}$(13)
${{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{1.5}}} \right)}_{{\text{V}}}} = {{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{1.5}}} \right)}_{{{\text{IV}}}}},$(14)
${{\left( {a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{1.5}}} \right)}_{{{\text{IV}}}}} = {{{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}} \right)}}_{{\text{V}}}}} \mathord{\left/ {\vphantom {{{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}} \right)}}_{{\text{V}}}}} {{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}}} \right)}}_{{{\text{IV}}}}}.}}} \right. \kern-0em} {{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{0.5}}} \right)}}_{{{\text{IV}}}}}.}}$Рассчитанные значения активности оксида тантала в областях [LiTaO3 + LiTa3O8] (V) и [Li3TaO4 + LiTaO3] (IV) и экспериментально найденные активности оксида лития (табл. 1) позволили определить стандартные энергии Гиббса танталатов лития, а знание абсолютных энтропий простых оксидов лития [41], тантала [41] и смешанных, оцененных по Латимеру (см. выше), дало возможность определить энтальпии танталатов лития из простых оксидов (табл. 5). Ошибка в определении значений энтальпий, рассчитанных таким образом, связана с оценкой энтропии сложных оксидов и принятым нами условием независимости изменения энтропии реакции образования танталатов лития из простых оксидов от температуры. Пересчет значений энтальпий образования к температуре 298 K выполняли аналогично пересчету значений энтальпий реакций (6)–(8).
Рассчитанная данным методом энтальпия образования LiTaO3 из простых оксидов хорошо согласуется с известными литературными данными, что свидетельствует о хорошей точности определения значений термодинамической активности компонентов ${{a}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}},$ ${{a}_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}}$ (табл. 1).
В заключение отметим, что выполненные нами исследования по определению величин парциальных давлений, активности компонентов газовой и конденсированной фаз позволили оценить изменения величины общего давления в области составов 5–25 мол. % Та2О (рис. 2, пунктирная линия), построить р–х-сечение полной фазовой диаграммы и для состава 83 ± 1 мол. % Li2O рассчитать величины парциальных давлений ${{р}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}}$ = 0.15 × 10–5 атм, рLi = 4.03 × 10–5 атм, ${{р}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ =2.26 × 10–5 атм и активность оксида лития ${{a}_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}}$ = 6.02 × 10–3 при Т = 1753 K. Далее, приняв во внимание, что активность компонентов слабо зависит от температуры, можно записать выражения:
(15)
$\begin{gathered} {{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}} \right)}_{{{\text{IV(1753 K)}}}}} \approx {\text{ }}{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}} \right)}_{{{\text{IV(1473 K)}}}}} = \\ = {{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}} \right)}_{{{\text{II(Т1473 K)}}}}}, \\ \end{gathered} $(16)
$a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}\left( {{\text{II}}} \right)}}^{{0.5}} = {{{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}} \right)}}_{{{\text{IV(1473 K)}}}}}} \mathord{\left/ {\vphantom {{{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}} \right)}}_{{{\text{IV(1473 K)}}}}}} {{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}}} \right)}}_{{{\text{II(1473 K)}}}}}}}} \right. \kern-0em} {{{{\left( {a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{1.5}}} \right)}}_{{{\text{II(1473 K)}}}}}}}$(17)
$3.5{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}} + 0.5{\text{Т}}{{{\text{а}}}_{{\text{2}}}}{{{\text{О}}}_{5}} = {\text{L}}{{{\text{i}}}_{{\text{7}}}}{\text{Ta}}{{{\text{O}}}_{{\text{6}}}},$(18)
${{\Delta }_{f}}G_{{{\text{1473}}\,{\text{К}}}}^{0}\left( {{\text{L}}{{{\text{i}}}_{{\text{7}}}}{\text{Ta}}{{{\text{O}}}_{{\text{6}}}}{\text{, тв}}} \right) = RT\ln a_{{{\text{L}}{{{\text{i}}}_{{\text{2}}}}{\text{O}}}}^{{3.5}} \times a_{{{\text{T}}{{{\text{a}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{5}}}}}}^{{0.5}}.$По известным энтропиям оксидов лития, тантала и рассчитанной по Латимеру энтропии гептатанталата лития вычислили стандартную энтальпию образования и энтальпию образования из оксидов Li7TaO6 (табл. 4, 5). Использование в наших расчетах правила Неймана–Коппа не позволяет учесть зависимость значения энтальпии образования гептатанталата лития от температуры.
Найденные в данном исследовании термодинамические характеристики танталатов лития и построенное р–х-сечение фазовой диаграммы системы Li2O–Та2О5 необходимы при синтезе высокоэффективных оптоэлектронных функциональных материалов, для создания и разработки литий-ионных аккумуляторов нового поколения. Например, знание стандартных энтальпий и энергий Гиббса образования танталатов лития позволяет определить оптимальные концентрации легирующих добавок Nb, Bi, Zr или Ca для увеличения ионной проводимости Li7TaO6. Можно также отметить, что фазовая диаграмма Li2O–Та2О5 и термодинамические характеристики танталатов лития являются необходимой информацией для синтеза танталосиликатного стекла [18] на основе трехкомпонентной системы Li2O–Та2О5–SiO2, которое характеризуется уникальными оптическими, механическими и химическими свойствами. Тонкие пленки танталатов лития, такие как LiTaO3 и LiTa3O8, обладают интересными физико-химическими свойствами, получение и использование которых связаны с высокими температурами. В этих работах первостепенное значение приобретают исследования высокотемпературных р–х-, р–Т-фазовых диаграмм, без которых невозможно очертить условия высокотемпературного синтеза и эксплуатации этих функциональных материалов.
ЗАКЛЮЧЕНИЕ
Выполнен расчет термодинамических свойств танталатов лития по 2-му и 3-му законам термодинамики. Известно, что данные, полученные по 3-му закону, характеризуются более высокой точностью, если известны абсолютные величины констант равновесий и энтропии участников равновесно протекающих реакций. Иногда удается достаточно хорошо оценить или по молекулярным константам рассчитать необходимые значения энтропий. Часто исследователь сталкивается с ситуацией, когда отсутствуют необходимые для расчета данные по абсолютным энтропиям, тогда термодинамические характеристики определяют по 2-му закону термодинамики, т.е. по исследованию зависимости константы равновесия или величине, пропорциональной константе равновесия, от температуры. Однако в данной работе, как отмечалось выше, использовали оба метода расчета. Связано это с тем, что полученные нами экспериментальные данные по исследованию температурной зависимости константы равновесия реакций (6)–(8) содержат постоянную систематическую ошибку, связанную с постоянным падением интенсивности ионного тока лития (парциального давления атомов лития) за счет его растворения в материале эффузионной камеры (рис. 1). Подобное явление приводит к неопределенности в определении энтальпии реакций (6)–(8) не менее 5–10%. Расчет этих энтальпий по 3-му закону также не позволяет достаточно строго рассчитать их значения, так как в литературе отсутствуют значения абсолютных энтропий танталатов лития (за исключением LiТаО3), которые были оценены нами по Латимеру. Следует подчеркнуть, что в расчетах не учитывали зависимость изменения энтропии реакции от температуры. Все это совместно с точностью определения констант равновесия позволяет оценить ошибку в значениях энтальпий реакций (6)–(8) не менее 5%. Пересчет значений энтальпий гетерофазных реакций, рассчитанных по 2-му и 3-му законам термодинамики, к температуре 298 K выполняли в одном и том же приближении. Учитывая вышесказанное, отдать предпочтение какому-либо методу сложно, и рекомендованные значения энтальпий гетерофазных реакций были получены как среднеарифметические из величин по 2-му и 3-му законам термодинамики.
Список литературы
Chikh-Touami H., Kremer R., Lee H. J. et al. // J. Optics (United Kingdom). 2017. V. 19. № 6. P. 065 503. https://doi.org/10.1088/2040-8986/aa67b8
Gomi M., Kataoka T., Hayashi J. et al. // Jpn. J. Appl. Phys. 2017. V. 56 (7S1). P. 07JD13. https://doi.org/10.7567/JJAP.56.07JD13
Liu X., Kitamura K., Terabe K. // Appl. Phys. Lett. 2006. V. 89. P. 15.
Gopalan K.K., Janner D., Nanot S. et al. // Adv. Opt. Mater. 2017. № 5. P. 1. https://doi.org/10.1002/adom.201600723
Michailow W., Schülein F.J.R., Möller B. et al. // Appl. Phys. Lett. 2017. V. 110. P. 23 505. https://doi.org/10.1063/1.4973862
Sima W., Han R., Yang Q. et al. // IEEE Transactions on Industrial Electronics. 2017. V. 64. № 9. P. 7323. https://doi.org/10.1109/TIE.2017.2708037
Bartasyte A., Margueron S., Baron T. et al. // Adv. Mater. Interfaces. 2017. 1600998. https://doi.org/10.1002/admi.201600998
Fu C., Quan A.J., Luo J.T. et al. // Appl. Phys. Lett. 2017. V. 110. P. 1. https://doi.org/10.1063/1.4982073
Fang X., Wei D., Wang Y. et al. // Appl. Phys. Lett. 2017. V. 110. P. 111105. https://doi.org/10.1063/1.4978669
Hansen M.C., Krylov A., Tyukavina A. // Int. Conference on Recent Trends in Physics. 2016 (ICRTP2016). J. Phys. Conf. 2016. Ser. 755. P. 11001. https://doi.org/10.1088/1742-6596/755/1/011001
Yanga X., Linb S., Decai Mab D. et al. // Ceram. Int. 2020. V. 46. P. 1178. https://doi.org/org/10.1016/j.ceramint.2019.09.088
Si M., Wang D., Zhao R.Y. et al. // Adv. Sci. 2020. V. 7. P. 1902538. https://doi.org/10.1002/advs.201902538
Wang M., Shi H., Ma T. et al. // Smart Mater. Struct. 2020. V. 29. P. 045004. https://doi.org/10.1088/1361-665X/ab7110
Asano T., Komori T. Entire solid lithium secondary battery. US Pat, US9379415B2. 2016.
Jian Z., Lu X., Fang Z. et al. // Electrochem. Commun. 2011. V. 13. P. 1127. https://doi.org/10.1016/j.elecom.2011.07.018
Sahoo P.P., Maggard P.A. // Inorg. Chem. 2013. V. 52. P. 4443. https://doi.org/10.1021/ic302649s
Kahle L., Cheng X., Tobias Binninger T. et al. // Solid State Ionics. 2020. V. 347. April. https://doi.org/10.1016/j.ssi.2020.115226
Tan L., Mauro J.C., Peng J. et al. // J. Am. Ceram. Soc. 2019. V. 102. P. 185. https://doi.org/10.1111/jace.15910
Djohan N., Estrada R., Sari D. et al. // IOP Conf. Series: Earth and Environmental Science. 2017. V. 54. P. 012 093. https://doi.org/10.1088/1755-1315/54/1/012093
Liua X., Terabeb K.K. // Appl. Phys. Lett. 2006. V. 89. P. 142906. https://doi.org/10.1063/1.2357556
Subasri R., Sreedharan O.M. // Mater. Lett. 1997. V. 30. P. 289. https://doi.org/10.1016/S0167-577X(96)00210-8
Allemann J.A., Xia Y., Morriss R.E. et al. // J. Mater. Res. Sep. 1996. V. 11. № 9. P. 2376. https://doi.org/10.1557/JMR.1996.0301
Roth R., Parker H., Brower W., Waring J. // Fast Ion Transport in Solids, Solid State Batteries and Devices / Ed. van Gool W. Amsterdam: North Holland Publishing Co., 1973. 217 p.
Phase Diagrams for Ceramists / Eds. Levin E.M., McMurdie H.F. Westerville, 1975. V. III. 86 p.
Roth R.S., Parker H.S., Brower W.S., Minor D. Alkali oxide – tantalum oxide and Alkali oxide – niobium oxide ionic conductors by prepared for National Aeronautics and Space Administration contract C-29933C. National Bureau of Standards. Washington. D.C., 1974. P. 25.
Berkowitz J., Chapka W.A., Blue G.D. et al. // J. Phys. Chem. 1959. V. 63. № 5. P. 644. https://doi.org/10.1021/j150575a002
Hildendrand D.L., Hall W.F., Porter N.D. // J. Phys. Chem. 1963. V. 39. № 2. P. 296. https://doi.org/10.1063/1.1734245
White D., Seshadry K.S., Dever D.F. et al. // J. Phys. Chem. 1963. V. 39. № 10. P. 2463. https://doi.org/10.1063/1.1734049
Kudo H., Wu C.H., Ihle H.R. // J. Nucl. Mater. 1978. V. 78. № 2. P. 380. https://doi.org/10.1016/0022-3115(78)90460-9
Ikeda Y., Ito H., Matsumoto G. et al. // J. Mass Spectrom. Soc. Jpn. 1979. V. 27. № 4. P. 263. https://doi.org/10.5702/massspec1953.27.263
Kimura H., Asano M., Kubo K. // Bull. Inst. Atom. Energy Kyoto Univ. 1980. V. 58. P. 50.
Wu C.H., Kudo H., Ihle H.R. // J. Chem. Phys. 1979. V. 70. № 4. P. 1815. https://doi.org/10.1063/1.437656
Kimura H., Asano M., Kubo K. // J. Nucl. Mater. 1980. V. 92. № 2, 3. P. 221. https://doi.org/10.1016/0022-3115(80)90106-3
Ikeda Y., Tamaki M., Matsumoto G. et al. // Spectrochim. Acta, Part B: Atomic Spectroscopy. 1982. V. 37. № 8. P. 647. https://doi.org/10.1016/0584-8547(82)80077-3
Inghram M.G., Chapka W.A., Berkowitz J. // J. Phys. Chem. 1957. V. 27. № 2. P. 569. https://doi.org/10.1063/1.1743770
Krikorian O.H., Carpenter J.H. // J. Phys. Chem. 1965. V. 69. № 12. P. 4399. https://doi.org/10.1021/j100782a503
Хансен М., Андерко К. Структура двойных сплавов. M.: Изд-во по черной и цветной металлургии. 1962. Т. 2. 1488 с.
Сидоров Л.Н., Коробов М.В., Журавлева Л.В. Масс-спектральные термодинамические исследования. М.: Изд-во Моск. ун-та, 1985. 308 с.
Gribchenkova N.A., Steblevsky A.V., Alikhanyan A.S. // J. Chem. Thermodynamics. 2017. V. 1151. P. 6. https://doi.org/10.1016/j.jct.2017.07.009
Gribchenkova N.A., Alikhanyan A.S. // 2019. V. 77 877. P. e82. https://doi.org/10.1016/j.jallcom.2018.11.136
Киреев В.А. Методы практических расчетов в термодинамике химических реакций. М.: Химия, 1970. 520 с.
База данных ТКВ. (http://www.chem.msu.ru/cgi-bin/tkv.pl)
Latimer W.M. // J. Am. Chem. Soc. 1951. V. 73. P. 1480. https://doi.org/10.1021/ja01148a021
Sahu S.K., Zlotnik S., Navrotskya A. et al. // J. Mater. Chem. V. 2015. № 3. P. 7691. https://doi.org/10.1039/c5tc01308a
Searcy A. // Adv. Pap. An Int. Symp. – High Temp. Technol. N.-Y., 1959. P. 255.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


