Журнал неорганической химии, 2020, T. 65, № 12, стр. 1683-1690
Фазовые равновесия в системах K+, Na+//H${\text{CO}}_{{\text{3}}}^{--},$ HCOO––H2O и K+, Na+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O при 25°С
О. С. Кудряшова a, b, А. М. Елохов a, c, *, Е. Э. Гарбуз a, Ю. А. Распопова a
a Естественнонаучный институт Пермского государственного национального исследовательского университета
614990 Пермь, ул. Генкеля, 4, Россия
b Пермский государственный аграрно-технологический университет им. Д.Н. Прянишникова
614099 Пермь, ул. Петропавловская, 23, Россия
c Пермский государственный национальный исследовательский университет
614990 Пермь, ул. Букирева, 15, Россия
* E-mail: elhalex@yandex.ru
Поступила в редакцию 09.06.2020
После доработки 13.07.2020
Принята к публикации 21.07.2020
Аннотация
В работе впервые исследованы фазовые равновесия в четырехкомпонентных взаимных водно-солевых системах K+, Na+//${\text{HCO}}_{{\text{3}}}^{--},$ HCOO––H2O и K+, Na+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O при 25°С. На основании теоретического расчета установлено, что в системах стабильными парами солей являются формиат калия и карбонат или гидрокарбонат натрия. Анализ полученных фазовых диаграмм показал, что максимальными по величине являются поля кристаллизации карбоната или гидрокарбоната натрия, минимальным – поле кристаллизации формиата калия. Теоретически обоснован процесс получения насыщенных растворов формиата калия из формиата натрия и карбоната или гидрокарбоната калия.
ВВЕДЕНИЕ
Формиат калия вследствие крайне низких температур кристаллизации его водных растворов находит широкое применение в качестве компонента противогололедных материалов [1, 2], хладоносителей [3], буровых растворов [4], противоморозных добавок в бетоны, строительные смеси [5] и реагентов, предотвращающих смерзание угля [6]. Преимуществом его использования является низкая коррозионная активность в отношении различных конструкционных материалов и высокая растворимость в воде. В сельском хозяйстве формиат калия может использоваться в качестве удобрения или кормовой добавки [7, 8].
Показана возможность использования формиата калия как сырья для производства водорода на палладиевом катализаторе [9] и каталитического гидрирования фенола до циклогексанона [10], а также промотора медного катализатора для синтеза метанола из синтез-газа [11].
Традиционным способом получения формиата калия является прямой синтез с использованием в качестве сырья муравьиной кислоты, ее эфиров, формальдегида или монооксида углерода, а также гидроксида, карбоната или гидрокарбоната калия [9, 12]. Указанные методы имеют ряд недостатков, в том числе использование высоких температур и давления, высокая скорость коррозии оборудования вследствие применения кислот, низкий выход продукта или его недостаточная чистота. Предложены методы каталитического гидрирования гидрокарбонатов [13] и дегидрирования метанола в щелочной среде [14]. Конверсионное получение растворов формиата калия возможно при взаимодействии растворов сульфата, карбоната калия или их смеси с формиатом кальция [15], а также формиата натрия и сульфата калия [16].
Настоящая работа посвящена исследованию фазовых равновесий в четырехкомпонентных взаимных системах K+, Na+//${\text{HCO}}_{{\text{3}}}^{--},$ HCOO––H2O и K+, Na+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O и обоснованию процесса конверсионного получения формиата калия из формиата натрия и карбоната или гидрокарбоната калия.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали формиаты натрия и калия, безводные карбонаты натрия и калия, гидрокарбонаты натрия и калия квалификации “ч. д. а.”, дистиллированную воду ($n_{{\text{D}}}^{{{\text{25}}}}$ = 1.3325).
Фазовые равновесия и состав равновесных твердых фаз исследовали изотермическим методом сечений Р.В. Мерцлина [17] и прогностическим методом [18]. В качестве физического свойства выбран показатель преломления жидкой фазы, который измеряли на рефрактометре ИРФ-454Б. Растворимость солей и их смесей в воде определена с точностью 0.5 мас. %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Соли, образующие исследуемые четырехкомпонентные взаимные системы в водных растворах, связаны следующими химическими реакциями:
(1)
${\text{NaHCOO}} + {\text{KHC}}{{{\text{O}}}_{3}} \leftrightarrows {\text{KHCOO}} + {\text{NaHC}}{{{\text{O}}}_{3}},$(2)
${\text{2NaHCOO}} + {{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}} \leftrightarrows 2{\text{KHCOO}} + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{3}}.$По результатам расчета произведений растворимости солей [19], равновесие при 25°С смещено в сторону образования формиата калия и карбоната или гидрокарбоната натрия.
Фазовые равновесия в пяти оконтуривающих системах изучены ранее [20–22]. Трехкомпонентные системы NaНСOO−KHCOO−H2O, K2CO3–KHCOO–H2O [20] и NaHCO3–KHCO3–H2O [21] являются системами простого эвтонического типа. Формиаты натрия и калия, а также гидрокарбонаты натрия и калия кристаллизуются в виде безводных солей, карбонат калия – в виде сесквигидрата. В системе NaHCOO–Na2CO3–H2O [22] обнаружены области кристаллизации безводного формиата натрия, декагидрата и безводного карбоната натрия, в системе Na2CO3–K2CO3–H2O [21] – декагидрата карбоната натрия, сесквигидрата карбоната калия и твердых растворов карбонатов натрия и калия (Na, K)CO3 ∙ 6H2O.
Фазовые равновесия в системах NaHCOO–K2CO3−H2O, NaHCOO–KHCO3–H2O, КHCOO–Na2CO3–H2O и KHCOO–NaHCO3–H2O, являющихся диагональными разрезами исследуемых систем, изучены впервые.
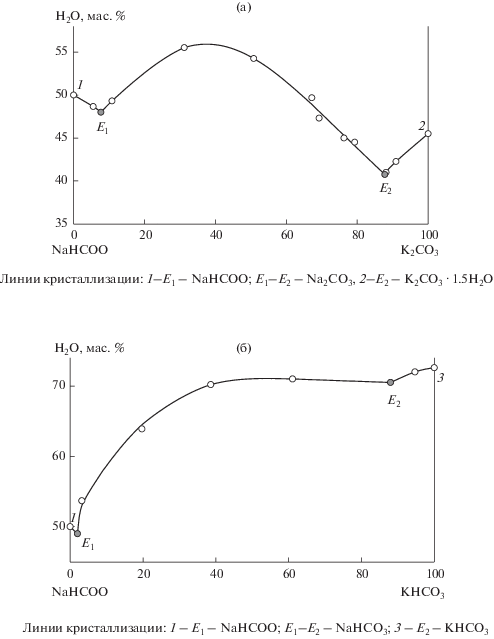
В диагональном разрезе NaHCOO–K2CO3−H2O кроме областей кристаллизации безводного формиата натрия и сесквигидрата карбоната калия присутствует область кристаллизации безводного карбоната натрия (рис. 1а), а в разрезе NaHCOO–KHCO3–H2O помимо областей кристаллизации формиата натрия и гидрокарбоната калия наблюдается область кристаллизации гидрокарбоната натрия (рис. 1б). Наличие областей кристаллизации карбоната и гидрокарбоната калия, являющихся продуктами обменных реакций (1) и (2), свидетельствует о возможности получения формиата калия из формиата натрия и карбоната или гидрокарбоната калия.
Рис. 1.
Изотермы растворимости систем K2СO3–NaHCOO–H2O (а, линии кристаллизации: 1 – Е1 – NaHCOO; E1–E2 – Na2CO3, 2 – Е2 – K2CO3 ∙ 1.5H2O) и KHСO3–NaHCOO–H2O (б, линии кристаллизации: 1 – E1 – NaHCOO; E1–E2 – NaHCO3; 3 – E2 – KHCO3).
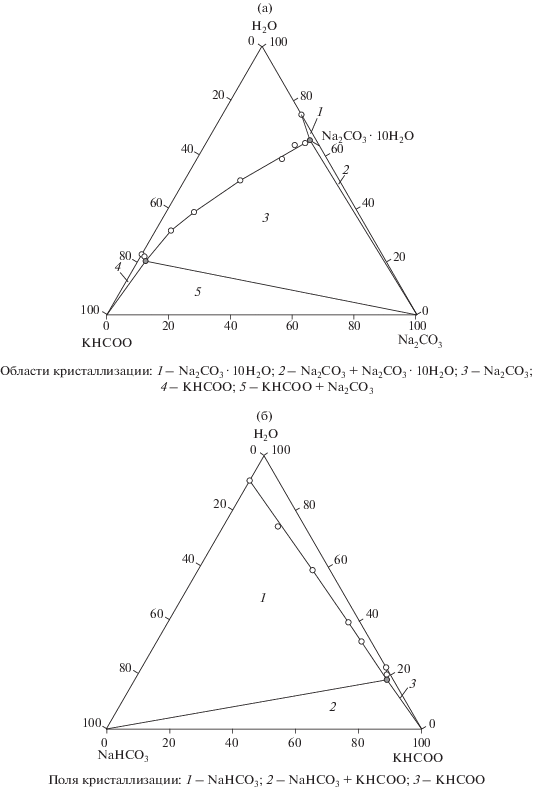
Бóльшую часть фазовой диаграммы разреза KHCOO–Na2CO3−H2O занимает область кристаллизации безводного карбоната натрия, области кристаллизации формиата калия и декагидрата карбоната натрия незначительны (рис. 2а). Диагональный разрез KHCOO–NaHCO3–H2O является системой простого эвтонического типа. Область кристаллизации формиата калия значительно меньше, чем гидрокарбоната натрия, что указывает на высаливающий эффект формиата калия в отношении гидрокарбоната натрия (рис. 2б).
Рис. 2.
Фазовые диаграммы систем Na2СO3–KHCOO–H2O (а, области кристаллизации: 1 – Na2СO3 ∙ 10H2O; 2 – Na2СO3 + Na2СO3 ∙ 10H2O; 3 – Na2СO3; 4 – КHCOO; 5 – KHCOO + Na2СO3) и NaHСO3–KHCOO–H2O (б, поля кристаллизации: 1 – NaHCO3; 2 – NaHCO3 + KHCOO; 3 – KHCOO).
Изучение оконтуривающих систем, диагональных разрезов и разрезов, проходящих через вершины пирамиды состава, отвечающие солям и воде, и точки на сторонах солевого квадрата, позволило построить перспективные проекции фазовых диаграмм четырехкомпонентных систем Na+, K+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O и Na+, K+//${\text{HCO}}_{{\text{3}}}^{--},$ HCOO––H2O (рис. 3, табл. 1, 2).
Рис. 3.
Перспективные проекции фазовых диаграмм четырехкомпонентных систем Na+, K+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O (а) и Na+, K+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O (б).
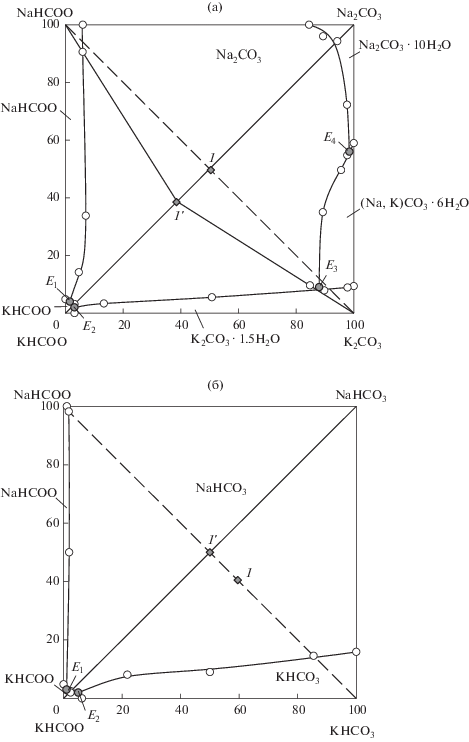
Таблица 1.
Состав насыщенных растворов четырехкомпонентной взаимной системы K+, Na+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O
| Состав насыщенного раствора, мас. % | Солевой состав раствора, мас. % | $n_{{\text{D}}}^{{25}}$ | Твердая фаза | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| NaHCOO | KHCOO | K2CO3 | Na2CO3 | H2O | NaHCOO | KHCOO | K2CO3 | Na2CO3 | ||
| 46.1 | 0.0 | 0.0 | 2.9 | 51.0 | 94.0 | 0.0 | 0.0 | 6.0 | 1.3990 | NaHCOO + Na2CO3 |
| 44.0 | 4.9 | 0.0 | 3.1 | 48.0 | 84.6 | 9.4 | 0.0 | 6.0 | 1.3980 | NaHCOO + Na2CO3 |
| 15.9 | 39.4 | 0.0 | 4.3 | 40.5 | 26.6 | 66.2 | 0.0 | 7.1 | 1.4005 | NaHCOO + Na2CO3 |
| 7.2 | 64.8 | 0.0 | 3.5 | 24.5 | 9.5 | 85.8 | 0.0 | 4.6 | 1.4190 | NaHCOO + Na2CO3 |
| 3.8 | 78.9 | 0.0 | 1.3 | 16.0 | 4.5 | 94.0 | 0.0 | 1.5 | 1.4300 | KHCOO + NaHCOO + Na2CO3 |
| 4.0 | 79.0 | 0.0 | 0.0 | 17.0 | 4.8 | 95.2 | 0.0 | 0.0 | 1.4230 | KHCOO + NaHCOO |
| 0.0 | 77.5 | 0.0 | 2.5 | 20.0 | 0.0 | 96.9 | 0.0 | 3.1 | 1.4230 | KHCOO + Na2CO3 |
| 0.0 | 77.0 | 1.6 | 2.4 | 19.0 | 0.0 | 95.0 | 2.0 | 3.0 | 1.4220 | KHCOO + K2CO3 ∙ 1.5H2O + Na2CO3 |
| 0.0 | 77.5 | 2.5 | 0.0 | 20.0 | 0.0 | 96.9 | 3.1 | 0.0 | 1.4215 | K2CO3 ∙ 1.5H2O + KHCOO |
| 0.0 | 65.3 | 7.3 | 2.5 | 25.0 | 0.0 | 87.0 | 9.7 | 3.3 | 1.4165 | Na2CO3 + K2CO3 ∙ 1.5H2O |
| 0.0 | 33.0 | 28.4 | 3.6 | 35.0 | 0.0 | 50.8 | 43.8 | 5.5 | 1.4150 | K2CO3 ∙ 1.5H2O + Na2CO3 |
| 0.0 | 9.0 | 44.6 | 5.7 | 40.8 | 0.0 | 15.2 | 75.2 | 9.6 | 1.4230 | K2CO3 ∙ 1.5H2O + Na2CO3 |
| 0.0 | 6.6 | 42.9 | 5.5 | 45.0 | 0.0 | 12.0 | 78.0 | 10.0 | 1.4250 | K2CO3 ∙ 1.5H2O + Na2CO3 + KNaCO3 ∙ 6H2O |
| 0.0 | 5.7 | 45.9 | 4.4 | 44.0 | 0.0 | 10.2 | 82.0 | 7.9 | 1.4200 | KNaCO3 ∙ 6H2O + K2CO3 ∙ 1.5H2O |
| 0.0 | 1.2 | 52.8 | 5.0 | 41.0 | 0.0 | 2.0 | 89.5 | 8.4 | 1.4270 | KNaCO3 ∙ 6H2O + K2CO3 ∙ 1.5H2O |
| 0.0 | 0.0 | 48.4 | 5.0 | 46.6 | 0.0 | 0.0 | 90.6 | 9.4 | 1.4290 | KNaCO3 ∙ 6H2O + K2CO3 ∙ 1.5H2O |
| 0.0 | 5.0 | 24.9 | 16.2 | 54.0 | 0.0 | 10.9 | 54.0 | 35.1 | 1.4090 | Na2CO3 + KNaCO3 ∙ 6H2O |
| 0.0 | 1.7 | 17.5 | 18.8 | 62.0 | 0.0 | 4.4 | 46.0 | 49.6 | 1.3975 | Na2CO3 + KNaCO3 ∙ 6H2O |
| 0.0 | 0.8 | 15.8 | 20.1 | 63.3 | 0.0 | 2.3 | 43.0 | 54.7 | 1.3980 | Na2CO3 + KNaCO3 ∙ 6H2O |
| 0.0 | 0.5 | 14.5 | 19.0 | 66.0 | 0.0 | 1.5 | 42.5 | 56.0 | 1.3990 | Na2CO3 ∙ 10H2O + Na2CO3 + KNaCO3 ∙ 6H2O |
| 0.0 | 0.0 | 15.8 | 22.7 | 61.5 | 0.0 | 0.0 | 41.0 | 59.0 | 1.3980 | Na2CO3 ∙ 10H2O + Na2CO3 |
| 0.0 | 0.8 | 8.5 | 24.2 | 66.5 | 0.0 | 2.3 | 25.4 | 72.2 | 1.3950 | Na2CO3 ∙ 10H2O + Na2CO3 |
| 0.0 | 2.0 | 0.0 | 33.0 | 65.0 | 0.0 | 5.7 | 0.0 | 94.3 | 1.4020 | Na2CO3 ∙ 10H2O + Na2CO3 |
| 1.8 | 1.6 | 0.0 | 28.6 | 68.0 | 5.7 | 5.0 | 0.0 | 89.4 | 1.3850 | Na2CO3 ∙ 10H2O + Na2CO3 |
| 4.3 | 0.0 | 0.0 | 23.2 | 72.5 | 15.5 | 0.0 | 0.0 | 84.5 | 1.3825 | Na2CO3 ∙ 10H2O + Na2CO3 |
Таблица 2.
Состав насыщенных растворов четырехкомпонентной взаимной системы K+, Na+//${\text{HCO}}_{{\text{3}}}^{--},$ HCOO––H2O
| Состав насыщенного раствора, мас. % | Солевой состав раствора, мас. % | $n_{{\text{D}}}^{{25}}$ | Твердая фаза | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| NaHCOO | KHCOO | KHCO3 | NaHCO3 | H2O | NaHCOO | KHCOO | KHCO3 | NaHCO3 | ||
| 49.7 | 0.0 | 0.0 | 0.6 | 49.7 | 98.9 | 0.0 | 0.0 | 1.1 | 1.3900 | NaHCO3 + NaHCOO |
| 49.3 | 0.9 | 0.0 | 0.9 | 49.0 | 96.5 | 1.8 | 0.0 | 1.8 | 1.3915 | NaHCO3 + NaHCOO |
| 25.3 | 26.2 | 0.0 | 1.0 | 47.5 | 48.2 | 49.9 | 0.0 | 1.9 | 1.3945 | NaHCOO + NaHCO3 |
| 1.5 | 74.7 | 0.0 | 0.8 | 23.0 | 2.0 | 97.0 | 0.0 | 1.0 | 1.4240 | NaHCOO + NaHCO3 + KHCOO |
| 4.0 | 79.0 | 0.0 | 0.0 | 17.0 | 4.8 | 95.2 | 0.0 | 0.0 | 1.4230 | KHCOO + NaHCOO |
| 2.1 | 74.9 | 0.0 | 1.0 | 22.0 | 2.7 | 96.0 | 0.0 | 1.3 | 1.4250 | KHCOO + NaHCO3 |
| 0.0 | 80.0 | 0.0 | 2.0 | 18.0 | 0.0 | 97.6 | 0.0 | 2.4 | 1.4290 | NaHCO3 + KHCOO |
| 0.0 | 77.9 | 0.2 | 1.9 | 20.0 | 0.0 | 97.4 | 0.3 | 2.4 | 1.4250 | KHCOO + KHCO3 |
| 0.0 | 75.0 | 5.0 | 0.0 | 20.0 | 0.0 | 93.8 | 6.3 | 0.0 | 1.4190 | KHCOO + KHCO3 |
| 0.0 | 78.9 | 2.5 | 1.7 | 17.0 | 0.0 | 95.0 | 3.0 | 2.0 | 1.4330 | KHCOO + NaHCO3 + KHCO3 |
| 0.0 | 30.9 | 5.4 | 3.2 | 60.5 | 0.0 | 78.2 | 13.7 | 8.1 | 1.3750 | NaHCO3 + KHCO3 |
| 2.6 | 15.2 | 0.0 | 15.2 | 67.0 | 7.9 | 46.1 | 0.0 | 46.1 | 1.3700 | KHCO3 + NaHCO3 |
| 0.0 | 4.3 | 20.9 | 4.3 | 70.5 | 0.0 | 14.6 | 70.8 | 14.6 | 1.3655 | KHCO3 + NaHCO3 |
| 0.0 | 0.0 | 24.5 | 4.6 | 70.9 | 0.0 | 0.0 | 84.1 | 15.9 | – | KHCO3 + NaHCO3 |
Бóльшую часть солевого квадрата системы Na+, K+//${\text{CO}}_{{\text{3}}}^{{{\text{2}}--}},$ HCOO––H2O занимает область кристаллизации безводного карбоната натрия. Области кристаллизации декагидрата карбоната натрия, твердых растворов (Na,K)CO3 ∙ 6H2O, сексвигидрата карбоната калия и безводного формиата натрия значительно меньше (рис. 3а). В системе Na+, K+//${\text{HCO}}_{{\text{3}}}^{--},$ HCOO––H2O максимальная область кристаллизации у безводного гидрокарбоната натрия. Гирокарбонат калия и формиат натрия также кристаллизуются в безводном состоянии (рис. 3б). Термогравиметрическими исследованиями доказано, что в указанных тройных и четверных взаимных системах формиат натрия кристаллизуется в виде безводной соли, а не кристаллогидрата состава NaHCOO · 2H2O. Область кристаллизации формиата калия в обеих системах незначительна вследствие его максимальной растворимости из всех солей, образующих системы. Растворы, состав которых отвечает точкам Е1–Е4, являются конгруэнтно насыщенными. Фазовые диаграммы изученных четырехкомпонентных взаимных систем подобны. Формиат натрия обладает высаливающим и дегидратирующим действием в отношении карбоната и гидрокарбоната натрия. Поскольку гидрокарбонат натрия менее растворим, высаливающая способность формиата натрия в отношении его выше.
Полученные экспериментальные данные позволили теоретически обосновать процесс получения формиата калия из формиата натрия и карбоната или гидрокарбоната калия. В качестве критерия оптимизации параметров процесса принята концентрация формиата калия в образующемся растворе.
Анализ фазовых диаграмм показал, что выход солей будет максимальный в том случае, если состав маточного раствора будет соответствовать составу эвтонического раствора E1 или E2. Практически это условие будет соблюдено, если после протекания процесса конверсии состав образующейся смеси будет соответствовать точке на стабильной диагонали системы. Используя уравнения реакций (1) и (2), можно рассчитать, что из смесей с соотношением формиата натрия и карбоната или гидрокарбоната калия, отвечающим точкам 1, образуются смеси с соотношением формиата калия и карбоната или гидрокарбоната натрия, соответствующие точкам 1', которые располагаются на стабильных диагоналях систем (рис. 3).
Оптимальное содержание воды в реакционных смесях установлено на основании фазовых диаграмм стабильных диагоналей KHCOO–Na2CO3–H2O и KHCOO–NaHCO3–H2O (рис. 2). Максимальной концентрации формиата калия в маточном растворе после отделения карбоната или гидрокарбоната калия соответствует точка 1', лежащая на пересечении луча кристаллизации H2O–1' и предельной ноды области кристаллизации карбоната или гидрокарбоната калия. Маточный раствор после отделения соли натрия при условии количественного протекания обменной реакции содержит 77.0–80.0 мас. % формиата калия и 2.0–2.5 мас. % примесей карбоната или гидрокарбоната натрия и может быть использован без дальнейшей переработки. Упаривание не позволяет отделить примесь солей натрия, так как полученный раствор является эвтоническим и при его выпаривании кристаллизуется смесь формиата калия и карбоната или гидрокарбоната натрия.
Вследствие большого количества твердой фазы, образующейся в результате процесса конверсии, и сложностей удаления маточного раствора с кристаллов карбоната или гидрокарбоната натрия без промывки в лабораторных условиях необходимо увеличить концентрацию воды в исходной смеси относительно расчетного значения, что приведет к снижению содержания формиата калия в маточном растворе и увеличению степени его загрязнения солью натрия. Концентрационные параметры процесса следует выбирать исходя из используемого технологического оборудования и области дальнейшего использования полученного формиата калия.
ЗАКЛЮЧЕНИЕ
Проведенные исследования показали принципиальную возможность получения растворов формиата калия из формиата натрия и карбоната или гидрокарбоната калия конверсионным способом. Теоретический анализ показал, что использование карбоната или гидрокарбоната калия в качестве одной из исходных солей практически не влияет на концентрацию формиата калия в полученных насыщенных растворах.
Список литературы
Фролова Е.А., Кондаков Д.Ф., Николаев В.В. и др. // Химическая технология. 2014. Т. 15. № 8. С. 449.
Данилов В.П., Фролова Е.А., Кондаков Д.Ф. и др. // Химическая технология. 2011. Т. 12. № 3. С. 134.
Гаравин В.Ю. // Холодильный бизнес. 2007. № 4. С. 12.
Нацепинская А.М., Фефелов Ю.В., Карасев Д.В. и др. // Нефть и газ. 2004. № 5. С. 55.
Семенов В.С. // Строительные материалы. 2011. № 5. С. 16.
Гущин А.А., Мирошников А.М., Ермаков А.Ю. // Горный информационно-аналитический бюллетень (научно-технический журн.). 2016. № 3. С. 256.
Htoo J. K., Molares J. // J. Animal Sci. 2012. V. 90. № 4. P. 346.
Roach T., Bame G. Environmentally-friendly high potassium-content liquid fertilizer and uses for the fertilizer. Pat. 9771306 USA. 2017.
Onsager O.T., Brownrigg M.S.A., Lødeng R. // Int. J. Hydrogen Energy. 1996. V. 21. № 10. P. 883.
Patil R.D., Sasson Y. // Appl. Catalysis A: General. 2015. V. 499. P. 227.
Zhao T.S., Yoneyama Y., Fujimoto K. et al. // Chem. Lett. 2007. V. 36. № 6. P. 734.
Gurkaynak M.A., Uzun I. Production of potassium format. Pat. 6849764 USA. 2005.
Wiener H., Blum J., Feilchenfeld H. et al. // J. Catalysis. 1988. V. 110. № 1. P. 184.
Liu Q., Wu L., Gülak S. et al. // Angewandte Chemie International Edition. 2014. V. 53. № 27. P. 7085.
Meyers R.A. Production of potassium format from potassium sulfate. Pat. 4327070 USA. 1982.
Кудряшова О.С., Матвеева К.Р., Бабченко Н.А., Глушанкова И.С. // Башкирский химический журн. 2012. Т. 19. № 3. С. 29.
Журавлев Е.Ф., Шевелева А.Д. // Журн. неорган. химии. 1960. Т. 5. № 11. С. 2630.
Мазунин С.А. // Вестник Пермского университета. Сер. Химия. 2012. № 2. С. 73.
Кудряшова О.С., Матвеева К.Р., Бабченко Н.А. // Современные проблемы науки и образования. 2012. № 5. С. 336.
Кудряшова О.С., Елохов А.М., Горденчук А.Д., Лукманова Л.М. // Вестник Пермского университета. Сер. Химия. 2018. Т. 8. № 2. С. 112.
Коган В.Б., Фридман В.Г., Кафаров В.В. Справочник по растворимости. М.–Л., 1969. Т. 3. Кн. 2. С. 644.
Кудряшова О.С., Елохов А.М., Горденчук А.Д., Лукманова Л.М. // Вестник Тверского университета. Сер. Химия. 2018. № 4. С. 42.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


