Журнал неорганической химии, 2020, T. 65, № 12, стр. 1643-1650
О некоторых аналогиях в неорганической химии (памяти А.А. Пасынского)
И. Б. Сиваев *
Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: sivaev@ineos.ac.ru
Поступила в редакцию 08.05.2020
После доработки 30.07.2020
Принята к публикации 31.07.2020
Аннотация
На основании сравнения спектральных данных диметилсульфониевых производных полиэдрических гидридов бора и диметилсульфидных комплексов пентагалогенидов тантала и ниобия выявлена аналогия между льюисовской кислотностью квазибориниевых катионов, образующихся при отрыве гидрид-иона от полиэдрических гидридов бора, и пентагалогенидов ниобия и тантала.
Одной из отличительных черт Александра Анатольевича Пасынского было его научное любопытство и желание докопаться до сути проблемы. Студенты младших курсов, как правило, боялись его вопросов при защите курсовых, а вот заполучить его в качестве оппонента хорошо сделанной диссертационной работы было большой удачей – всегда были гарантированы нестандартный взгляд на проблему и интересные вопросы, часто дающие толчок новым исследованиям. Один из вопросов, который обычно возникал при защите диссертаций, посвященных химии производных полиэдрических гидридов бора, был следующий: “Поскольку полиэдрические гидриды бора способны образовывать “комплексы” с различными донорными молекулам (аминами, сульфидами, эфирами, нитрилами), можно ли их рассматривать в качестве своеобразных аналогов переходных металлов?” И действительно, такие производные хорошо известны практически для всех типов анионных полиэдрических гидридов бора [1–11]. Более того, эти производные обычно вступают в реакции, характерные для комплексов переходных металлов с аналогичными лигандами, такие как нуклеофильное раскрытие тетрагидрофуранового цикла [12–15] или присоединение к тройной связи нитрилов [16–18]. Действительно, реакции нуклеофильного раскрытия циклических оксониевых производных [19–24] и присоединения к нитрилиевым производным [25–29] полиэдрических гидридов бора хорошо известны. Как правило, ответ в таких случаях сводился к тому, что полиэдрические гидриды бора представляют собой трехмерные ароматические системы [30, 31], и поэтому их производные должны рассматриваться как аналоги известных высокореакционных органических соединений, таких как оксониевые [32] или нитрилиевые [33] соли, а их устойчивость объясняется сильным электронодонорным эффектом борного остова [34]. Следует отметить, что с точки зрения органической химии это вполне корректная формулировка, однако она не дает ответа на вопрос, заданный с точки зрения координационной химии, в рамках которой образование комплексов можно рассматривать как взаимодействие переходных металлов (кислот Льюиса) с лигандами (основаниями Льюиса). На самом деле вопрос заключается в следующем: могут ли борные кластеры выступать в качестве кислот Льюиса и какова сила этих кислот по сравнению с известными металлокомплексами? Ответ на первую часть этого вопроса вполне очевиден. После отрыва гидридного атома водорода полиэдрические гидриды бора превращаются в квазибориниевые катионы, в которых атом бора имеет незаселенную p-орбиталь, а его формальный положительный заряд, в отличие от классических бориниевых катионов, где он стабилизируется через образование таутомерных форм с переносом заряда на соседний атом азота [35, 36], “нейтрализуется” отрицательным зарядом борного кластера. Эти квазибориниевые катионы являются интермедиатами в реакциях электрофильно-индуцируемого нуклеофильного замещения и сильными кислотами Льюиса [37]. Однако на вторую часть вопроса, касающуюся относительной силы этих кислот по сравнению с известными металлокомплексами, получить ответ нет так просто.
Наиболее известным методом сравнительной оценки силы кислот Льюиса, в основе которого лежит использование данных ЯМР-спектроскопии, является метод Гутманна–Бекетта, основанный на изменении химического сдвига ЯМР 31P триэтилфосфиноксида Et3PO при его комплексообразовании с кислотами Льюиса. Первоначально этот подход был использован Гутманном для количественного описания электрофильного характера растворителей [38], а затем предложен Бекеттом для оценки льюисовской кислотности борных соединений [39]. Позже этот метод был использован для сравнительной оценки силы кислот Льюиса на основе кремния [40], иода [41] и ряда солей металлов [42]. К сожалению, этот подход нельзя использовать для сравнительной оценки льюисовской кислотности квазибориниевых катионов на основе полиэдрических гидридов бора ввиду отсутствия удобных способов получения их соответствующих производных (в настоящее время описано лишь одно такое производное с заместителем Et3PO [43]). По этой же причине невозможно использование других основанных на данных спектроскопии ЯМР известных методов сравнительной оценки силы кислот Льюиса, таких как изменение химических сдвигов отдельных сигналов в спектрах ЯМР 1H кротонового альдегида [44] или в спектрах ЯМР 2H пиридина или хинолизидина [45, 46] при их комплексообразовании с кислотами Льюиса. Поэтому возникает потребность в создании шкалы льюисовской кислотности, основанной на использовании легкодоступных производных полиэдрических гидридов бора.
Ранее было показано, что химический сдвиг α-атомов водорода в спектрах ЯМР 1H “связанных” с борными кластерами оснований Льюиса (SMe2, O(CH2CH2)2O, NH2CH2Ph, NH=CHPh) зависит от электронного эффекта борного фрагмента (рис. 1) и, таким образом, может рассматриваться в качестве индикатора льюисовской кислотности фрагмента (рис. 2) [34].
Рис. 1.
Химические сдвиги α-атомов водорода в спектрах ЯМР 1H различных производных полиэдрических гидридов бора ([B10] = [B10H10]2–, [B12] = [B12H12]2–, [CB11] = [CB11H12]–, [nido-Cb] = [7,8-C2B9H12]–, [CoCb2] = [3,3'-Co(1,2-C2B9H11)2]–).
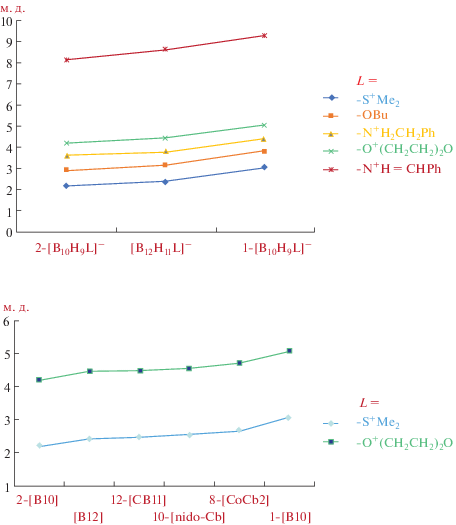
Рис. 2.
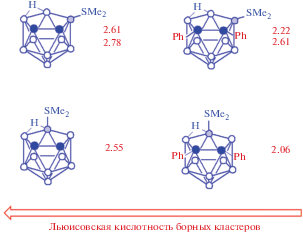
Относительная кислотность Льюиса квазибориниевых катионов различных полиэдрических гидридов бора.
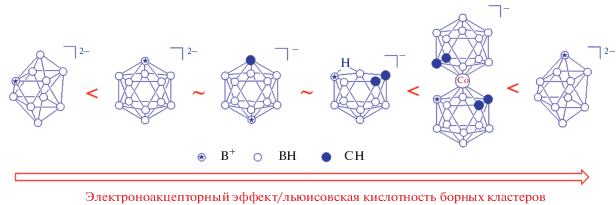
Построенный на основании спектральных данных ряд льюисовской кислотности квазибориниевых катионов, производных от различных полиэдрических гидридов бора, хорошо согласуется с реакционной способностью их производных. Например, 1,4-диоксановое производное бис(дикарболлид) кобальта раскрывается под действием трифенилфосфина или диметилсульфида при комнатной температуре, в то время как для раскрытия цикла соответствующего производного нидо-карборана требуется кипячение в ацетонитриле, а аналогичные производные клозо-декаборатного и клозо-додекаборатного анионов вообще не реагируют с такими слабыми нуклеофилами [47].
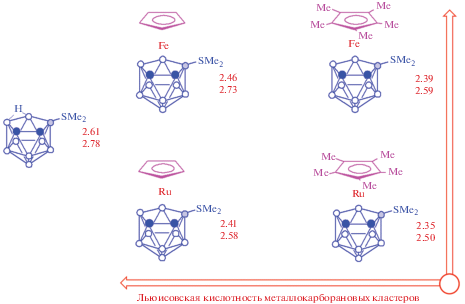
Позже подробный анализ спектров ЯМР 1H производных 9- и 10-диметилсульфидных производных нидо-карборана и металлокарборанов на их основе (табл. 1) показал, что химические сдвиги метильных групп в них чувствительны как к введению экзополиэдрических заместителей (рис. 3), так и к внедрению в борный остов атомов переходных металлов (при этом они отражают даже незначительную разницу в льюисовской кислотности Fe2+ и Ru2+ [61, 62], Rh3+ и Ir3+ [63]) (рис. 4), замене π-лигандов при атоме металла или модификации циклопентадиенильного лиганда, в то время как аналогичная модификация аренового лиганда практически на них не влияет.
Таблица 1.
Химические сдвиги сигналов SMe2-группы в спектрах ЯМР 1H диметилсульфониевых производных нидо-карборанов и металлокарборанов, а также в некоторых комплексах X3B ‧ SMe2
| Соединение | Химсдвиг SMe2-группы, м.д. | Растворитель | Источник |
|---|---|---|---|
| 9-Me2S-7,8-C2B9H11 | 2.62, 2.80 2.61, 2.79 |
CDCl3 CDCl3 |
[48] [49] |
| 10-Me2S-7,8-C2B9H11 | 2.55 2.56 |
CDCl3 CDCl3 |
[48] [50] |
| 7,8-Ph2-9-Me2S-7,8-C2B9H9 | 2.22, 2.61 | CDCl3 | [51] |
| 7,8-Ph2-10-Me2S-7,8-C2B9H9 | 2.06 | CDCl3 | [52] |
| CpRu(9-Me2S-7,8-C2B9H10) | 2.41, 2.58 | CD2Cl2 | [53] |
| Cp*Ru(9-Me2S-7,8-C2B9H10) | 2.35, 2.50 | CD2Cl2 | [53] |
| CpFe(9-Me2S-7,8-C2B9H10) | 2.46, 2.73 | CD2Cl2 | [54] |
| Cp*Fe(9-Me2S-7,8-C2B9H10) | 2.39, 2.59 | CD2Cl2 | [54] |
| [(C6H6)Ru(9-Me2S-7,8-C2B9H10)]PF6 | 2.70, 2.80 | Ацетон-d6 | [55] |
| [(1,3,5-C6H3Me3)Ru(9-Me2S-7,8-C2B9H10)]PF6 | 2.73, 2.80 | Ацетон-d6 | [55] |
| [(C6H6)Ru(10-Me2S-7,8-C2B9H10)]PF6 | 2.63 | Ацетон-d6 | [56] |
| [(C6H6)Fe(9-Me2S-7,8-C2B9H10)]PF6 | 2.78, 2.95 | Ацетон-d6 | [57] |
| [(1,3,5-C6H3Me3)Fe(9-Me2S-7,8-C2B9H10)]PF6 | 2.82, 2.96 | Ацетон-d6 | [57] |
| [(C6H6)Rh(9-Me2S-7,8-C2B9H10)](BF4)2 | 2.91, 2.91 | Нитрометан-d3 | [58] |
| [(1,3,5-C6H3Me3)Rh(9-Me2S-7,8-C2B9H10)](BF4)2 | 2.92, 2.92 | Нитрометан-d3 | [58] |
| [(C6H6)Ir(9-Me2S-7,8-C2B9H10)](BF4)2 | 2.86, 2.86 | Нитрометан-d3 | [58] |
| [(1,3,5-C6H3Me3)Ir(9-Me2S-7,8-C2B9H10)](BF4)2 | 2.91, 2.87 | Нитрометан-d3 | [58] |
| (C6F5)3B ‧ SMe2 | 2.17 | CDCl3 | [59] |
| F3B ‧ SMe2 | 2.25 | CDCl3 | [60] |
| Cl3B ‧ SMe2 | 2.49 | CDCl3 | [60] |
| Br3B ‧ SMe2 | 2.57 | CDCl3 | [60] |
| I3B ‧ SMe2 | 2.56 | CDCl3 | [60] |
Следует отметить, что данный подход также можно использовать и для оценки льюисовской кислотности других борных соединений, например галогенидов бора [60], где он дает результаты, сравнимые с широко используемым методом Гутманна–Бекетта [37].
Очевидно, что аналогичным образом на основе спектральных данных комплексов с подобными лигандами можно было бы оценить льюсовскую кислотность активных металлокомплексных фрагментов и сравнить ее с льюисовской кислотностью частиц, образующихся при отрыве гидрид-иона от полиэдрических гидридов бора. При кажущейся простоте этой задачи следует иметь в виду, что полиэдрические гидриды бора имеют жесткую структуру, которая сохраняется в ходе реакций замещения, в то время как координационная сфера металла может претерпевать различные изменения, такие как замена лигандов или изменение координационного числа металла. Помимо этого необходимо, чтобы ион металла мог образовывать сравнительно устойчивые комплексы с таким слабо координирующимся лигандом, как диметилсульфид, и являлся диамагнитным, что требуется для ЯМР-спектральных исследований. Поэтому решение этой задачи, достаточно далекой от химии полиэдрических гидридов бора, никогда не являлось одной из первоочередных целей нашей работы, но постоянно находилось в зоне внимания.
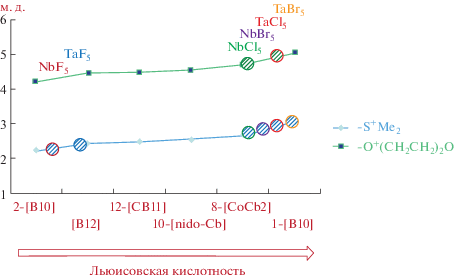
Наше внимание привлекли галогенидные комплексы ниобия и тантала MX5(SMe2) (M = = Nb, Ta; X = F, Cl, Br). Оказалось, что химические сдвиги сигналов SMe2-группы в спектрах ЯМР 1H фторидных комплексов ниобия и тантала близки к химическим сдвигам диметилсульфониевых производных клозо-декаборатного и клозо-додекаборатного анионов, а химический сдвиг SMe2-лиганда в комплексе NbCl5(SMe2) – к химическому сдвигу SMe2-заместителя в производном бис(дикарболлид)кобальта [64–67] (рис. 5). Полученная корреляция также совпадает с имеющимися в литературе спектральными характеристиками комплексов MCl5(1,4-dioxane) (M = Nb, Cl) [68].
Рис. 5.
Химические сдвиги Me2S-группы в спектрах ЯМР 1H производных полиэдрических гидридов бора и галогенидов ниобия и тантала ([B10] = [B10H10]2–, [B12] = [B12H12]2–, [CB11] = [CB11H12]–, [nido-Cb] = [7,8-C2B9H12]–, [CoCb2] = = [3,3'-Co(1,2-C2B9H11)2]–).
Еще одним индикатором подобия льюисовской кислотности квазибориниевых катионов различных полиэдрических гидридов бора и галогенидов ниобия и тантала являются спектры ЯМР 31P комплекса TaCl5(O=PPh3) (58.1 м.д.) [69] и соответствующего производного бис(дикарболлид)кобальта [8-Ph3PO-8'-I-3,3'-Co(1,2-C2B9H10)2] (53.2 м.д.) [70], свидетельствующие о несколько большей кислотности пентахлоридного комплекса тантала и хорошо согласующиеся с предложенной выше шкалой относительной льюисовской кислотности.
Следует также отметить подобие химического поведения комплексов ниобия и тантала и соответствующих производных полиэдрических гидридов бора. Так, фторидные комплексы MF5(THF) (M = Nb, Cl) представляют собой стабильные соединения [68, 71], в то время как аналогичные хлоридные комплексы неустойчивы и в присутствии избытка тетрагидрофурана реагируют с раскрытием цикла [68]. Сходная картина наблюдается и в случае тетрагидрофурановых производных клозо-декаборатного [2-B10H9(THF)]– [72] и клозо-додекаборатного [B12H11(THF)]– [73] анионов, которые хорошо известны, однако аналогичный аксиально замещенный изомер клозо-декаборатного аниона [1-B10H9(THF)]– и тетрагидрофурановое производное бис(дикарболлид)кобальта не могут быть получены из-за полимеризации тетрагидрофурана [74]. Еще одной чертой, свойственной и пентагалогенидам ниобия и тантала, и квазибориниевым катионам, образующимся при отрыве гидрид-иона от полиэдрических гидридов бора, является невозможность существования в силу своей высокой реакционной способности в виде дискретных молекул. Так, в пентагалогенидных комплексах ниобия и тантала атом металла в действительности является гексакоординированным за счет образования галогенидных мостиков, при этом фторидные комплексы представляют собой тетрамеры, а хлоридные и бромидные – димеры [75]. Аналогичным образом при формальном отрыве гидрид-иона от клозо-декаборатного и клозо-додекаборатного аниона в отсутствие сильных нуклеофилов образуются димеры [B20H18]2– [76, 77] и [B24H23]3– [78, 79] соответственно.
И, если вернуться к началу, то непосредственным толчком, подтолкнувшим к написанию этой статьи, послужила фотография на форзаце второго издания воспоминаний Александра Николаевича Несмеянова “На качелях века” [80], где фотография молодого Саши Пасынского – Александра Анатольевича Пасынского, отдавшего немало лет своей научной жизни ИНЭОСу, находится в клетке ниобия элементоорганической системы А.Н. Несмеянова (рис. 6). “Бывают странные сближенья…”
Список литературы
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. № 6. P. 679. https://doi.org/10.1135/cccc20020679
Sivaev I.B., Kulikova N.Yu., Nizhnik E.A. et al. // J. Organomet. Chem. 2008. V. 693. № 3. P. 519. https://doi.org/10.1016/j.jorganchem.2007.11.027
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Hamilton E.J.M., Leung H.T., Kultyshev R.G. et al. // Inorg. Chem. 2012. V. 51. № 4. P. 2374. https://doi.org/10.1021/ic2023709
Klyukin I.N., Kubasov A.S., Limarev I.P. et al. // Polyhedron. 2015. V. 101. P. 215. https://doi.org/10.1016/j.poly.2015.09.025
Kubasov A.S., Turishev E.S., Polyakova I.N. et al. // J. Organomet. Chem. 2017. V. 828. P. 106. https://doi.org/10.1016/j.jorganchem.2016.11.035
Sivaev I.B., Bregadze V.I. // Collect. Czech. Chem. Commun. 1999. V. 64. № 5. P. 783. https://doi.org/10.1135/cccc19990783
Dash B.P., Satapathy R., Swain B.R. et al. // J. Organomet. Chem. 2017. V. 849–850. P. 170. https://doi.org/10.1016/j.jorganchem.2017.04.006
Bakardjiev M., El Anwar S., Bavol D. et al. // Molecules. 2020. V. 25. № 4. P. 814. https://doi.org/10.3390/molecules25040814
Брегадзе В.И., Тимофеев С.В., Сиваев И.Б., Лобанова И.А. // Успехи химии. 2004. Т. 73. № 5. С. 470. [Bregadze V.I., Timofeev S.V., Sivaev I.B., Lobanova I.A. // Russ. Chem. Rev. 2004. V. 73. № 5. P. 433.] https://doi.org/10.1070/RC2004v073n05ABEH000868
Breen T.L., Stephan D.W. // Inorg. Chem. 1992. V. 31. № 19. P. 4019. https://doi.org/10.1021/ic00045a032
Metters O.J., Forrest S.J.K., Sparkes H.A. et al. // J. Am. Chem. Soc. 2016. V. 138. № 6. P. 1994. https://doi.org/10.1021/jacs.5b12536
Avens L.R., Barnhart D.M., Burns C.J., McKee S.D. // Inorg. Chem. 1996. V. 35. № 2. P. 537. https://pubs.acs.org/doi/10.1021/ic9505211
Travia N.E., Monreal M.J., Scott B.L., Kiplinger J.L. // Dalton Trans. 2012. V. 41. № 48. P. 1451. https://doi.org/10.1039/C2DT31676E
Kukushkin V.Yu., Pombeiro A.J.L. // Chem. Rev. 2002. V. 102. № 5. P. 1771. https://doi.org/10.1021/cr0103266
Kukushkin V.Yu., Pombeiro A.J.L. // Inorg. Chim. Acta. 2005. V. 358. № 1. P. 1. https://doi.org/10.1016/j.ica.2004.04.029
Бокач Н.А., Кукушкин В.Ю. // Успехи химии. 2005. Т. 74. № 2. С. 164. [Bokach N.A., Kukushkin V.Yu. // Russ. Chem. Rev. 2005. V. 74. № 2. P. 153.] https://doi.org/10.1070/RC2005v074n02ABEH000979
Semioshkin A.A., Sivaev I.B., Bregadze V.I. // Dalton Trans. 2008. № 8. P. 977. https://doi.org/10.1039/b715363e
Sivaev I.B., Bregadze V.I. // Boron Science: New Technologies and Applications / Ed. Hosmane N.S. Boca Raton: CRC Press, 2012. P. 623. https://doi.org/10.1201/b11199
Prikaznov A.V., Shmal’ko A.V., Sivaev I.B. et al. // Polyhedron 2011. V. 30. № 9. P. 1494. https://doi.org/10.1016/j.poly.2011.02.055
Приказнов А.В., Ласькова Ю.Н., Семиошкин А.А. и др. // Изв. АН. Сер. хим. 2011. № 8. С. 2501. [Prikaznov A.V., Las’kova Yu.N., Semioshkin A.A. et al. // Russ. Chem. Bull. 2011. V. 60. № 8. P. 2250.] https://doi.org/10.1007/s11172-011-0392-4
Кубасов А.С., Матвеев Е.Ю., Ретивов В.М. и др. // Изв. АН. Сер. хим. 2014. № 1. С. 187. [Kubasov A.S., Matveev E.Yu., Retivov V.M. et al. // Russ. Chem. Bull. 2014. V. 63. № 1. P. 187.] https://doi.org/10.1007/s11172-014-0412-2
Imperio D., Muz B., Azab A.K. et al. // Eur. J. Org. Chem. 2019. № 43. P. 7228. https://doi.org/10.1002/ejoc.201901412
Stogniy M.Yu., Erokhina S.A., Sivaev I.B., Bregadze V.I. // Phosphorus, Sulfur Silicon Relat. Elem. 2019. V. 194. № 10. P. 983. https://doi.org/10.1080/10426507.2019.1631312
Stogniy M.Yu., Erokhina S.A., Anisimov A.A. et al. // Polyhedron. 2019. V. 174. P. 114170. https://doi.org/10.1016/j.poly.2019.114170
Stogniy M.Yu., Erokhina S.A., Suponitsky K.Yu. et al. // J. Organomet. Chem. 2020. V. 909. P. 121111. https://doi.org/10.1016/j.jorganchem.2020.121111
Zhdanov A.P., Nelyubin A.V., Klyukin I.N. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 7. P. 841. https://doi.org/10.1134/S0036023619070180
Нелюбин А.В., Клюкин И.Н., Жданов А.П. и др. // Журн. неорган. химии. 2019. Т. 64. № 12. С. 1263. [Nelyubin A.V., Klyukin I.N., Zhdanov A.P. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 12. P. 1499.] https://doi.org/10.1134/S003602361912012X
King R.B. // Chem. Rev. 2001. V. 101. № 5. P. 1119. https://doi.org/10.1021/cr000442t
Chen Z., King R.B. // Chem. Rev. 2005. V. 105. № 10. P. 3613. https://doi.org/10.1021/cr0300892
Forsyth C.J., Murray T.J. // Science of Synthesis: Hoyben-Weyl Methods of Molecular Transformations. Vol. 37. Compounds with One Saturated Carbon-Heteroatom Bond / Ed. Forsyth S.J. Stuttgart: Georg Thieme Verlag KG, 2008. P. 631. https://doi.org/10.1055/b-0035-118648
van Dijk T., Slootweg J.C., Lammertsm K. // Org. Biomol. Chem. 2017. V. 15. № 48. P. 10134. https://doi.org/10.1039/C7OB02533E
Sivaev I.B., Prikaznov A.V., Anufriev S.A. // J. Organomet. Chem. 2013. V. 747. P. 254. https://doi.org/10.1016/j.jorganchem.2013.04.001
Kölle P., Nöth H. // Chem. Rev. 1985. V. 85. № 5. P. 399. https://doi.org/10.1021/cr00069a004
Piers W.E., Bourke S.C., Conroy K.D. // Angew. Chem. Int. Ed. 2005. V. 44. № 32. P. 5016. https://doi.org/10.1002/anie.200500402
Sivaev I.B., Bregadze V.I. // Coord. Chem. Rev. 2014. V. 270–271. P. 75. https://doi.org/10.1016/j.ccr.2013.10.017
Gutmann V. // Coord. Chem. Rev. 1976. V. 18. № 2. P. 225. https://doi.org/10.1016/S0010-8545(00)82045-7
Beckett M.A., Strickland G.C., Holland J.R., Varma K.S. // Polym. Commun. 1996. V. 37. № 20. P. 4629. https://doi.org/10.1016/0032-3861(96)00323-0
Liberman-Martin A.L., Bergman R.G., Tilley T.D. // J. Am. Chem. Soc. 2015. V. 137. № 16. P. 5328. https://doi.org/10.1021/jacs.5b02807
Kannan R., Kumar S., Andrews A.P. et al. // Inorg. Chem. 2017. V. 56. № 16. P. 9391. https://doi.org/10.1021/acs.inorgchem.7b01243
Jennings J.J., Wigman B.W., Armstrong B.M., Franz A.K. // J. Org. Chem. 2019. V. 84. № 24. P. 15845. https://doi.org/10.1021/acs.joc.9b02107
Kosenko I.D., Lobanova I.A., Godovikov I.A. et al. // J. Organomet. Chem. 2012. V.721–722. P. 70. https://doi.org/10.1016/j.jorganchem.2012.05.045
Childs R.F., Mulholland D.L., Nixon A. // Can. J. Chem. 1982. V. 60. № 6. P. 801. https://doi.org/10.1139/v82-117
Hilt G., Nödling A. // Eur. J. Org. Chem. 2011. № 35. P. 7071. https://doi.org/10.1002/ejoc.201101307
Hilt G., Pünner F., Möbus J. et al. // Eur. J. Org. Chem. 2011. № 30. P. 5962. https://doi.org/10.1002/ejoc.201101029
Shmal’ko A.V., Stogniy M.Yu., Kazakov G.S. et al. // Dalton Trans. 2015. V. 44. № 21. P. 9860. https://doi.org/10.1039/C5DT01293G
Plešek J., Janoušek Z., Heřmánek S. // Collect. Czech. Chem. Commun. 1978. V. 43. № 11. P. 2862. https://doi.org/10.1135/cccc19782862
Grüner B., Holub J., Plešek J. et al. // Dalton Trans. 2007. № 42. P. 4859. https://doi.org/10.1039/B709526K
Tutusaus O., Teixidor F., Núñez R. et al. // J. Organomet. Chem. 2002. V. 657. № 1–2. P. 247. https://doi.org/10.1016/S0022-328X(02)01541-3
Rosair G.M., Welch A.J., Weller A.S., Zahn S.K. // J. Organomet. Chem. 1997. V. 536–537. P. 299. https://doi.org/10.1016/S0022-328X(96)06740-X
Dunn S., Garrioch R.M., Rosair G.M. et al. // Collect. Czech. Chem. Commun. 1999. V. 64. № 6. P. 1013. https://doi.org/10.1135/cccc19991013
Кудинов А.Р., Петровский П.В., Мещеряков В.И., Рыбинская М.И. // Изв. АН. Сер. хим. 1999. № 7. С. 1368. [Kudinov A.R., Petrovskii P.V., Meshcheryakov V.I., Rybinskaya M.I. // Russ. Chem. Bull. 1999. V. 48. № 7. P. 1356.] https://doi.org/10.1007/BF02495304
Кудинов А.Р., Мещеряков В.И., Петровский П.В., Рыбинская М.И. // Изв. АН. Сер. хим. 1999. № 1. С. 177. [Kudinov A.R., Meshcheryakov V.I., Petrovskii P.V., Rybinskaya M.I. // Russ. Chem. Bull. 1999. V. 48. № 1. P. 176.] https://doi.org/10.1007/BF02494424
Кудинов А.Р., Перекалин Д.С., Петровский П.В., Гринцелев-Кутузов Г.В. // Изв. АН. Сер. хим. 2002. № 10. С. 1775. [Kudinov A.R., Perekalin D.S., Petrovskii P.V., Grintselev-Knyazev G.V. // Russ. Chem. Bull. 2002. V. 51. № 10. P. 1928.] https://doi.org/10.1023/A:1021373106780
Planas J.G., Viñas C., Teixidor F. et al. // Eur J. Inorg. Chem. 2005. № 20. P. 4193. https://doi.org/10.1002/ejic.200500470
Логинов Д.А., Виноградов М.М., Старикова З.А., Кудинов А.Р. // Изв. АН. Сер. хим. 2013. № 5. С. 1262. [Loginov D.A., Vinogradov M.M., Starikova Z.A., Kudinov A.R. // Russ. Chem. Bull. 2013. V. 62. № 5. P. 1262.] https://doi.org/10.1007/s11172-013-0174-2
Corsini M., Losi S., Grigiotti E. et al. // J. Solid State Electrochem. 2007. V. 11. № 12. P. 1643. https://doi.org/10.1007/s10008-007-0324-2
Lancaster S.J., Hughes D.L. // Dalton Trans. 2003. № 9. P. 1779. https://doi.org/10.1039/B300552F
Okio C.K.Y.A., Levason W., Monzittu F.M., Reid G. // J. Organomet. Chem. 2017. V. 848. P. 232. https://doi.org/10.1016/j.jorganchem.2017.08.004
Bruce M.I., Costuas K., Davin T. et al. // Organometallics. 2005. V. 24. № 16. P. 3864. https://doi.org/10.1021/om050293a
Zhang J., Guo S.-Z., Dong Y.-B. et al. // Inorg. Chem. 2017. V. 56. № 2. P. 1001. https://doi.org/10.1021/acs.inorgchem.6b02809
Zhang L., Meggers E. // Acc. Chem. Res. 2017. V. 50. № 2. P. 320. https://doi.org/10.1021/acs.accounts.6b00586
Merbach A., Bünzli J.C. // Helv. Chim. Acta. 1972. V. 55. № 2. P. 580. https://doi.org/10.1002/hlca.19720550231
Good R., Merbach A.E. // Helv. Chim. Acta. 1974. V. 57. № 4. P. 1192. https://doi.org/10.1002/hlca.19740570430
Jura M., Levason W., Ratnani R. et al. // Dalton Trans. 2010. V. 39. № 3. P. 883. https://doi.org/10.1039/B916336K
Benjamin S.L., Hyslop A., Levason W., Reid G. // J. Fluor. Chem. 2012. V. 137. P. 77. https://doi.org/10.1016/j.jfluchem.2012.02.014
Marchetti F., Pampaloni G., Zacchini S. // Inorg. Chem. 2008. V. 47. № 1. P. 365. https://doi.org/10.1021/ic7012254
Marchetti F., Pampaloni G., Zacchini S. // Eur. J. Inorg. Chem. 2008. № 3. P. 453. https://doi.org/10.1002/ejic.200700911
Bregadze V.I., Kosenko I.D., Lobanova I.A. et al. // Organometallics. 2010. V. 29. № 21. P. 5366. https://doi.org/10.1021/om100385m
Marchetti F., Pampaloni G., Zacchini S. // J. Fluor. Chem. 2010. V. 131. № 1. P. 21. https://doi.org/10.1016/j.jfluchem.2009.09.014
Bernard R., Cornu D., Perrin M. et al. // J. Organomet. Chem. 2004. V. 689. № 16. P. 2581. https://doi.org/10.1016/j.jorganchem.2004.05.014
Sivaev I.B., Semioshkin A.A., Brellochs B. et al. // Polyhedron. 2000. V. 19. № 6. P. 627. https://doi.org/10.1016/S0277-5387(00)00293-X
Tarrés M., Viñas C., Cioran A.M. et al. // Chem. Eur. J. 2014. V. 20. № 48. P. 15808. https://doi.org/10.1002/chem.201403424
Marchetti F., Pampaloni G. // Chem. Commun. 2012. V. 48. № 5. P. 635. https://doi.org/10.1039/C1CC14592D
Hawthorne M.F., Shelly K., Li F. // Chem. Commun. 2002. № 6. P. 547. https://doi.org/10.1039/B110076A
Авдеева В.В., Малинина Е.А., Гоева Л.В., Кузнецов Н.Т. // Докл. Акад. наук. 2017. Т. 474. № 6. С. 700. [Avdeeva V.V., Malinina E.A., Goeva L.V., Kuznetsov N.T. // Dokl. Chem. 2017. V. 474. № 2. P. 141.] https://doi.org/10.1134/S0012500817060052
Volkov O., Hu C., Kölle U., Paetzold P. // Z. Anorg. Allg. Chem. 2005. V. 631. № 10. P. 1909. https://doi.org/10.1002/zaac.200500149
Авдеева В.В., Малинина Е.А., Белоусова О.Н. и др. // Журн. неорган. химии. 2011. Т. 56. № 4. С. 564. [Avdeeva V.V., Malinina E.A., Belousova O.N. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 4. P. 524.] https://doi.org/10.1134/S003602361104005X
Несмеянов А.Н. На качелях века. М.: Москвоведение, 2018. 480 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии