Журнал неорганической химии, 2020, T. 65, № 12, стр. 1633-1642
Синтез и структурное исследование 2D-координационных полимеров Zn(II), Cd(II) и Mn(II) на основе ди-м-аминобензоилглиоксима
Д. Уреке a, b, А. Рижа b, И. Булхак a, Э. Коропчану b, *, П. Боурош c
a Институт химии
MD-2028 Кишинев, ул. Академий, 3, Молдова
b Тираспольский государственный университет
MD-2069 Кишинев, ул. Г. Яблочкина, 5, Молдова
c Институт прикладной физики
MD-2028 Кишинев, ул. Академий, 5, Молдова
* E-mail: coropceanu.eduard@ust.md
Поступила в редакцию 28.05.2020
После доработки 16.07.2020
Принята к публикации 27.07.2020
Аннотация
Конденсацией м-аминобензойной кислоты с дихлорглиоксимом получен новый диоксим – ди-м-аминобензоилглиоксим (DmabaH4) (I), а на его основе синтезированы координационные 2D-полимеры {[Zn(DmabaH2)(H2O)(dmf)] ∙ dmf}n (II), {[Cd(DmabaH2)(H2O)2] ∙ 0.5dmf ∙ 4H2O}n (III) и {[Mn(DmabaH2)(H2O)(dmf)] ∙ dmf}n (IV). Состав и структура новых соединений Zn(II), Cd(II) и Mn(II) определены различными физико-химическими методами, в том числе методом рентгеноструктурного анализа (CIF files CCDC № 2 004 634 (II), 2 004 635 (III), 2 004 636 (IV)). В соединениях II–IV DmabaH4 выступает в качестве мостикового лиганда, который координируется тетрадентатно как дианион к трем ионам металлов, используя донорный набор атомов N2O2. Этот лиганд координируется к одному атому металла двумя атомами азота диоксимного фрагмента бидентатно-хелатным способом, образуя пятичленные металлоциклы, а к двум другим – монодентатно, используя два атома кислорода, принадлежащих карбоксильным группам двух бензойных фрагментов. Координационные полиэдры атомов металла в II–IV достроены до октаэдра атомами кислорода dmf и молекул воды, донорный набор атомов – N2O4.
ВВЕДЕНИЕ
Синтез новых органических молекул, перспективных для использования в качестве полидентатных лигандов, остается важным направлением, которое позволяет разнообразить как состав, так и молекулярную и кристаллическую архитектуру новых координационных соединений. Введение дополнительных фрагментов, содержащих донорные атомы, в состав известных органических лигандов создает благоприятные предпосылки для проявления новых возможностей их координации и получения координационных полимеров с определенными способами упаковки соединений в кристаллах и, что очень важно, с заданными свойствами. Получение координационных полимеров с полезными свойствами – стратегическая цель современного химического синтеза, которая позволяет применить фундаментальные знания на практике [1–4]. Хотя исследования виц-диоксимов и его соединений, в основном с переходными металлами, начаты еще в 50-е годы XX в. [5], они до сих пор остаются перспективными. Был получен ряд координационных соединений на основе диоксимов, в которых наблюдается эволюция от моно- и би- к полиядерным комплексам, в которых функцию мостиковых лигандов выполняют дополнительные органические молекулы, такие как дипиридин [6–9], поликарбоновые [10–13] или неорганические анионы [14, 15]. Хотя в Кембриджском банке структурных данных [16] описано большое количество моно- и полиядерных комплексов на основе виц-диоксимов, получение новых лигандов этого класса остается перспективным для диверсификации состава и структуры координационных соединений. Получены и исследованы бис- и трис-комплексы с 1,2-бис(фениламино)-, 1,2-бис(3-аллиламино)- и 1,2-бис(5,6,7,8-тетрагидронафтален-1-иламино)глиоксиматом [17], диоксимы с заместителями 1,2-бис(2-(морфолино)этиламино)- и 1,2-бис(гексиламино) и их координационные соединения [18–20], комплексы с S,S'-бис(2-aцетофенон)дитиоглиоксимом или с (E,E)-диоксимом с хиноксалином [21, 22]. Подобные комплексы с объемными лигандами могут служить и для создания пористых материалов вследствие образования в кристаллических структурах полостей различной размерности [19].
Нами ранее были получены биядерные комплексы Zn(II) и Mn(II) с дианилинглиоксимом (1,2-бис(фениламино)глиоксимом, DAnH2), полученным конденсацией дихлорглиоксима c анилином, а также удалось получить кристаллы этого лиганда в виде гидратных солей [DAnH3]ClO4 [23]. Однако особое значение в синтезе новых диоксимов имеют не только органические заместители, которые образуют их “крылья”, но и функциональные группы последних, которые могут увеличить координационные возможности лигандов. В результате конденсацией м-аминобензойной кислоты с дихлорглиоксимом нам удалось получить новый диоксим – ди-м-аминобензоил-глиоксим (DmabaH4) (I), а на его основе – координационные полимеры {[Zn(DmabaH2)(H2O)(dmf)] ∙ ∙ dmf}n (II), {[Cd(DmabaH2)(H2O)2] ∙ 0.5dmf ∙ 4H2O}n (III) и {[Mn(DmabaH2)(H2O)(dmf)] ∙ dmf}n (IV). Состав и структура новых соединений Zn(II), Cd(II) и Mn(II) были определены различными физико-химическими методами, в том числе рентгеноструктурным анализом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез ди-м-аминобензоилглиоксима (DmabaH4) (I). Дихлорглиоксим массой 0.31 г (0.002 моль) и м-аминобензойную кислоту массой 0.55 г (0.004 моль) растворяли в 10 мл CH3OH. Смесь перемешивали в течение 15 мин, затем к ней добавляли 0.21 г (0.002 моль) Na2CO3. К полученному желтовато-белому осадку добавляли 3 мл воды и перемешивали смесь в течение 2 ч, после чего осадок отфильтровывали через воронку Шотта. Полученное вещество сушили на воздухе при комнатной температуре до постоянной массы. Выход ~62%.
ИК-спектр (ν, см–1): 3727 (сл), 3629 (сл), 3381 (сл), 3068 (сл), 2898 (сл), 2833 (сл), 2790 (сл), 2683 (сл), 2556 (сл), 1694 (оч. с), 1637 (ср), 1608 (ср), 1585 (ср), 1474 (с), 1448 (ср)), 1413 (ср), 1352 (сл), 1308 (ср), 1294 (сл), 1275 (с), 1238 (ср), 1217 (с), 1117 (сл), 1086 (сл), 982 (ср), 973 (ср) ), 941 (с), 903 (сл), 886 (сл), 818 (ср), 753 (с), 717 (ср), 691 (с), 683 (ср), 672 (сл), 665 (сл), 597 (оч. сл), 565 (сл), 530 (сл), 512 (сл), 482 (сл), 432 (оч. сл), 408 (сл).
Синтез {[Zn(DmabaH2)(H2O)(dmf)] ∙ dmf}n (II). К механической смеси 0.072 г (0.2 ммоль) DmabaH4 и 0.044 г (0.2 ммоль) Zn(CH3COO)2 ∙ 2H2O добавляли 5 мл dmf, 17 мл метанола и 1.5 мл воды и наблюдали образование студенистой суспензии, которая растворялась при добавлении к теплому раствору 6 капель HClO4. Раствор нагревали еще 5–7 мин, затем его фильтровали и фильтрат оставляли на воздухе при комнатной температуре для кристаллизации. Через 11 сут образовывались блочные бесцветные кристаллы, которые отфильтровывали, промывали два раза метанолом, диэтиловым эфиром и сушили на воздухе до постоянной массы.
ИК-спектр (ν, см–1): 3449 (сл), 3381 (сл), 3220 (ср), 3159 (сл), 2977 (сл), 2943 (сл), 2826 (сл), 2028 (сл), 1650 (с), 1604 (ср), 1499 (ср), 1462 (ср), 1443 (ср), 1409 (ср), 1377 (с), 1307 (ср), 1278 (ср), 1253 (ср), 1061 (оч. с), 1013 (с), 932 (сл), 884 (сл), 818 (ср), 763 (ср), 719 (сл), 687 (с), 665 (сл), 624 (ср), 566 (сл), 507 (сл), 459 (сл).
| C | Н | N | Zn | |
|---|---|---|---|---|
| Найдено, %: | 44.95; | 4.88; | 14.15; | 11.13. |
| Для C22H28N6O9Zn | ||||
| вычислено, %: | 45.10; | 4.82; | 14.35; | 11.16. |
Синтез {[Cd(DmabaH2)(H2O)2] ∙ 0.5dmf ∙ 4H2O}n (III). К механической смеси 0.072 г (0.2 ммоль) DmabaH4 и 0.052 г (0.2 ммоль) Cd(CH3COO)2 ∙ ∙ 2H2O добавляли 5 мл dmf, 15 мл метанола и ~1.5 мл воды. Наблюдали образование студенистой суспензии, которая растворялась при добавлении к теплому раствору 4 капель HClO4. Раствор нагревали в течение еще 5–7 мин, затем его фильтровали и фильтрат оставляли для кристаллизации при комнатной температуре. Через 9 сут образовывались ромбические бесцветные кристаллы, которые отфильтровывали, промывали три раза метанолом, диэтиловым эфиром и сушили на воздухе до постоянной массы.
ИК-спектр (ν, см–1): 3496 (сл), 3305 (сл), 3203 (сл), 2974 (сл), 2936 (сл), 2811 (сл), 1646 (оч. с), 1618 (ср), 1591 ( ср), 1536 (ср), 1464 (ср), 1438 (ср), 1380 (с), 1307 (сл), 1283 (сл), 1253 (сл), 1078 (оч. с), 1013 (ср), 940 (сл), 870 (сл), 840 (сл), 801 (сл), 770 (ср), 730 (ср), 689 (сл), 665 (сл), 621 (сл), 511 (сл), 486 (сл), 434 (сл), 420 (сл).
| C | Н | N | Cd | |
|---|---|---|---|---|
| Найдено, %: | 34.33; | 4.39; | 10.25; | 18.31. |
| Для C17.5H27N4.5O12.5Cd | ||||
| вычислено, %: | 34.30; | 4.44; | 10.29; | 18.34. |
Синтез {[Mn(DmabaH2)(H2O)(dmf)] ∙ dmf}n (IV). К механической смеси 0.072 г (0.2 ммоль) DmabaH4 и 0.05 г (0.2 ммоль) Mn(CH3COO)2 ∙ 4H2O добавляли 5 мл dmf, 12 мл CH3OH и 1.5 мл H2O. После растворения веществ образовывался желто-белый осадок. Смесь нагревали до 60–70°С и добавляли 3 капли HClO4, после чего осадок растворялся. Образовавшийся раствор перемешивали в течение 5–7 мин, фильтровали и оставляли на воздухе при комнатной температуре для кристаллизации. Через 5 сут образовывались блочные кристаллы желтового цвета, которые отфильтровывали, промывали два раза метанолом, диэтиловым эфиром и сушили на воздухе до постоянной массы.
ИК-спектр (ν, см–1): 3374 (сл), 3175 (сл), 2931 (сл), 1649 (оч. с), 1545 (ср), 1503 (ср), 1487 (сл), 1465 (сл), 1438 (ср), 1388 (оч. с), 1294 (сл), 1279 (сл), 1254 (сл), 1226 (сл), 1159 (сл), 1149 (сл), 1096 (оч. с), 1065 (ср), 994 (с), 945 (с), 915 (сл), 875 (сл), 869 (сл), 816 (сл), 772 (ср), 760 (ср), 728 (с), 695 (с), 672 (оч. с), 661 (оч. с), 644 (сл), 624 (сл), 529 (сл), 507 (сл), 482 (сл), 436 (сл), 421 (сл), 410 (сл).
| С | Н | N | Mn | |
|---|---|---|---|---|
| Найдено, %: | 45.82; | 4.07; | 14.89; | 9.14. |
| Для C22H28N6O9Mn | ||||
| вычислено, %: | 45.91; | 4.90; | 14.61; | 9.55. |
ИК-спектры регистрировали на спектрометрах Perkin–Elmer 100 FT-IR при 4000–400 см–1 (суспензия в вазелиновом масле) и ATR при 4000–650 см–1.
Спектры ЯМР регистрировали на спектрометре Bruker при 400.13 МГц для 1H и 100.61 МГц для 13C в DMSO-d6 с использованием TMS в качестве внутреннего эталона. Химические сдвиги (δ), измеренные в миллионных долях (м.д.), относятся к остаточному пику недейтерированного растворителя (2.49 м.д. для 1H и 39.70 м.д. для 13C).
РСА. Экспериментальные данные для соединений II–IV получены при комнатной температуре (293(2) K) на дифрактометре Xсalibur Е (МоKα‑излучение, графитовый монохроматор). Параметры элементарной ячейки, уточненные по всему массиву, и остальные экспериментальные данные получены c использованием комплекса программ CrysAlis Oxford Diffraction [24]. Структура соединений решена прямыми методами и уточнена методом наименьших квадратов в анизотропном полноматричном варианте для неводородных атомов (SHELX-97) [25]. Позиции атомов водорода сольватных молекул воды определены из разностного синтеза Фурье, для остальных рассчитаны геометрически. Все атомы Н уточнены изотропно в модели “жесткого тела” c Uэф = 1.2Uэкв или 1.5Uэкв соответствующих атомов O, N и C. Характеристики эксперимента и уточнения структуры соединений II–IV приведены в табл. 1, избранные межатомные расстояния и валентные углы – в табл. 2 , геометрические параметры водородных связей (ВС) – в табл. 3. Позиционные и тепловые параметры атомов соединений II–IV депонированы в КБСД (CIF files CCDC № 2 004 634 (II), 2004635 (III), 2 004 636 (IV)); deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Таблица 1.
Кристаллографические данные и характеристики эксперимента для соединений II–IV
| Параметры | Значение | ||
|---|---|---|---|
| II | III | IV | |
| Эмпирическая формула | C22H28N6O9Zn | C17.5H27CdN4.5O12.5 | C22H28MnN6O9 |
| M | 585.87 | 612.83 | 575.44 |
| Сингония | Mоноклинная | Ромбическая | Mоноклинная |
| Пр. гр. | P21/c | Pbcn | P21/c |
| Параметры элементарной ячейки | |||
| a, Å | 10.7100(3) | 19.1582(11) | 10.7304(5) |
| b, Å | 20.8726(7) | 13.2517(6) | 20.7785(15) |
| c, Å | 12.1886(4) | 20.5981(10) | 12.3733(8) |
| α, град | 90 | 90 | 90 |
| β, град | 110.812(4) | 90 | 111.246(6) |
| γ, град | 90 | 90 | 90 |
| V, Å3 | 2546.96(14) | 5229.4(5) | 2571.3(3) |
| Z | 4 | 8 | 4 |
| ρ(выч), г/см3 | 1.528 | 1.557 | 1.486 |
| μ, мм–1 | 1.027 | 0.901 | 0.576 |
| F(000) | 1216 | 2492 | 1196 |
| Размеры кристала, мм | 0.25 × 0.15 × 0.10 | 0.2 × 0.03 × 0.02 | 0.3 × 0.12 × 0.07 |
| Область θ, град | 3.30–25.50 | 2.90–25.05 | 3.292–25.25 |
| Интервалы индексов отражений | –12 ≤ h ≤ 12, –25 ≤ k ≤ 16, –9 ≤ l ≤ 14 |
–15 ≤ h ≤ 22, –15 ≤ k ≤ 10, –24 ≤ l ≤ 22 |
–12 ≤ h ≤ 11, –24 ≤ k ≤ 16, –8 ≤ l ≤ 14 |
| Число измеренных/независимых рефлексов (Rint) | 10 631/4729 (0.0414) |
11 072/4586 (0.0867) |
9176/4628 (0.0595) |
| Число рефлексов с I > 2σ(I) | 3491 | 2475 | 2611 |
| Полнота съемки, % | 99.8 (θ = 25.24°) | 99.1 (θ = 25.05°) | 99.6 (θ = 25.24°) |
| Число уточняемых параметров | 347 | 318 | 350 |
| GOOF | 1.002 | 1.000 | 1.003 |
| R-факторы (I > 2σ(I)) | R1 = 0.0484, wR2 = 0.1029 |
R1 = 0.0666, wR2 = 0.1185 |
R1 = 0.0592, wR2 = 0.0594 |
| R-факторы (по всему маcсиву) | R1 = 0.0737, wR2 = 0.1135 |
R1 = 0.1449, wR2 = 0.1385 |
R1 = 0.1223, wR2 = 0.1195 |
| Δρmax, Δρmin, e Å–3 | 0.430, –0.410 | 0.770, –0.512 | 0.382, –0.298 |
Таблица 2.
Межатомные расстояния (d) и валентные углы (ω) в координационных полиэдрах соединений II–IV
| Связь | II (М = Zn) | III (M = Cd) | IV (M = Mn) |
|---|---|---|---|
| d, Å | |||
| M(1)–N(1) | 2.227(2) | 2.319(6) | 2.245(3) |
| M(1)–N(2) | 2.135(3) | 2.390(6) | 2.308(3) |
| M(1)–O(1w) | 2.145(2) | 2.305(6) | 2.202(3) |
| M(1)–O(1D)/O(2w) | 2.192(3) | 2.307(5) | 2.214(3) |
| M(1)–O(3)#2/#1 | 2.023(2) | 2.233(5) | 2.054(3) |
| M(1)–O(6)#1/#2 | 1.986(2) | 2.217(5) | 2.077(3) |
| Угол | ω, град | ||
| N(1)MN(2) | 74.98(10) | 69.0(2) | 72.58(12) |
| N(1)MO(1w) | 84.42(10) | 90.2(2) | 92.99(12) |
| N(1)MO(1D)/O(2w) | 89.11(11) | 94.5(2) | 87.39(14) |
| N(1)MO(3)#2/#1 | 169.85(10) | 96.2(2) | 165.78(11) |
| N(1)MO(6)#1/#2 | 96.40(10) | 170.2(2) | 93.56(12) |
| N(2)MO(1w) | 94.19(10) | 87.7(2) | 84.65(12) |
| N(2)MO(1D)/O(2w) | 88.44(11) | 92.2(2) | 88.91(13) |
| N(2)MO(3)#2/#1 | 96.33(10) | 165.3(2) | 93.76(12) |
| N(2)M O(6)#1/#2 | 169.96(9) | 101.1(2) | 165.39(13) |
| O(1w)MO(1D)/O(2w) | 172.12(10) | 175.0(2) | 173.08(13) |
| O(1w) MO(3)#2/#1 | 91.10(10) | 91.9(2) | 89.56(13) |
| O(1w)MO(6)#1/#2 | 90.01(10) | 89.1(2) | 91.63(12) |
| O(1D)/O(2w)MO(3)#2/#1 | 96.00(11) | 89.5(2) | 88.33(14) |
| O(1D)/O(2w)MO(6)#1/#2 | 86.25(11) | 86.0(2) | 95.23(13) |
| O(3)#2/#1MO(6)#1/#2 | 92.70(9) | 93.6(2) | 100.35(11) |
Таблица 3.
Геометрические параметры внутри- и межмолекулярых водородных связей в структуре II–IV
| Контакт D–H∙∙∙A | Расстояние, Å | Угол DHA, град |
Преобразование симметрии для А | ||
|---|---|---|---|---|---|
| D–H | H∙∙∙A | D∙∙∙A | |||
| II | |||||
| O(1)–H(1)∙∙∙O(5) | 0.82 | 1.90 | 2.695(3) | 163 | x – 1, y, z |
| O(2)–H(2)∙∙∙O(4) | 0.82 | 1.83 | 2.615(3) | 160 | x – 1, –y + 1/2, z – 1/2 |
| N(4)–H(4)∙∙∙O(2D) | 0.86 | 2.05 | 2.873(4) | 159 | x, y, z |
| O(1w)–H(1)∙∙∙O(5) | 0.85 | 1.99 | 2.825(3) | 166 | x – 1, –y + 1/2, z – 1/2 |
| O(1w)–H(2)∙∙∙O(4) | 0.87 | 2.05 | 2.920(3) | 175 | x – 1, y, z |
| III | |||||
| O(1)–H(1)∙∙∙O(4) | 0.82 | 1.79 | 2.599(7) | 168 | x, –y + 1, z – 1/2 |
| O(2)–H(2)∙∙∙O(5) | 0.82 | 1.86 | 2.660(7) | 164 | –x + 1, –y + 1/2, z – 1/2 |
| N(3)–H(3)∙∙∙O(5w) | 0.86 | 2.13 | 2.922(8) | 154 | x – 1/2, y + 1/2, –z + 1/2 |
| N(4)–H(4)∙∙∙O(6w) | 0.86 | 2.18 | 2.888(8) | 140 | –x + 1/2, y – 1/2, z |
| O(1w)–H(1)∙∙∙O(3w) | 0.72 | 2.04 | 2.743(8) | 165 | –x + 1/2, y – 1/2, z |
| O(1w)–H(2)∙∙∙O(5) | 0.81 | 1.95 | 2.729(7) | 161 | x, –y + 1, z – 1/2 |
| O(2w)–H(1)∙∙∙O(4) | 0.83 | 1.95 | 2.781(7) | 179 | –x, y, –z + 1/2 |
| O(2w)–H(2)∙∙∙O(1D) | 0.86 | 1.98 | 2.84(2) | 179 | –x + 1, –y + 1/2, z – 1/2 |
| O(3w)–H(1)∙∙∙O(4) | 0.90 | 2.03 | 2.923(9) | 174 | x, –y + 1, z – 1/2 |
| O(3w)–H(2)∙∙∙O(2) | 0.89 | 2.22 | 3.109(9) | 178 | –x + 1/2, y + 1/2, z |
| O(4w)–H(1)∙∙∙O(1D) | 0.91 | 1.75 | 2.63(2) | 162 | x, y, z |
| O(4w)–H(2)∙∙∙O(6) | 0.90 | 2.06 | 2.953(9) | 172 | x, y, z |
| O(5w)–H(1)∙∙∙O(4w) | 0.81 | 1.88 | 2.691(8) | 178 | x, y, z |
| O(6w)–H(1)∙∙∙O(4w) | 0.89 | 2.12 | 3.002(10) | 178 | –x + 1/2, y + 1/2, z |
| O(6w)–H(2)∙∙∙O(3w) | 0.98 | 2.20 | 3.174(10) | 178 | x, y, z |
| IV | |||||
| O(1)–H(1)∙∙∙O(5) | 0.82 | 1.87 | 2.670(4) | 165 | x + 1, –y + 1/2, z + 1/2 |
| O(2)–H(2)∙∙∙O(4) | 0.82 | 1.99 | 2.783(4) | 163 | x + 1, y, z |
| N(4)–H(1)∙∙∙O(2D) | 0.86 | 2.67 | 3.229(5) | 124 | x, –y + 1/2, z – 1/2 |
| O(1w)–H(1)∙∙∙O(4) | 0.86 | 2.03 | 2.812(5) | 152 | x + 1, –y + 1/2, z + 1/2 |
| O(1w)–H(2)∙∙∙O(5) | 0.86 | 2.16 | 2.874(4) | 140 | x + 1, y, z |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ИК-спектре DmabaH4 присутствует слабое поглощение в виде двух широких полос при 3727 и 3629 см–1, которыe относятся к колебаниям ν(ОН) оксимных групп [26]. Очень узкую полосу средней интенсивности при 3381 см–1 следует отнести к первому обертону колебаний ν(С=О) [27]. Широкая интенсивная и сложная полоса в области 3290–2930 см–1 отвечает колебаниям ν(ОН), ν(NН) и ν(CН). В области 2900–2500 см–1 проявляется группа из шести полос поглощения, обусловленная в основном колебаниями связанной карбоксильной группы и характерная для карбоновых кислот [28]. Самая интенсивная полоса спектра проявляется при 1694 см–1 и относится к ν(С=О) [28, 29], а плечо на низкочастотной стороне этой полосы при 1671 см–1 – к ν(C=N). Полоса поглощения амида II для вторичных амидов проявляется при 1637 cм–1, а полосы, характерные для бензольного кольца, – при 1608, 1585, 1481 и 1447 см–1. Полосу поглощения высокой интенсивности при 1275 см–1 можно отнести к ν(С–О)/δ(О–Н) [29], а полосу средней интенсивности при 941 см–1 – к ν(N–O) [26]. Внеплоскостные деформационные колебания С–Н в случае 1,3-замещенного бензольного кольца для изолированного атома водорода проявляются при 819 см–1, а для трех смежных атомов водорода – при 753 см–1 [30]. Наличие полосы ν(NH) и отсутствие интенсивной полосы ν(C–Cl) при 800–850 см–1 [30] показывают, что конденсация между дихлорглиоксимом и м-аминобензойной кислотой произошла и продукт не является смесью веществ.
В ИК-спектрах соединений II–IV присутствуют полосы колебаний ν(OH) оксимных групп при 3449 (II), 3496 (III) и 3374 см–1 (IV), а также ν(N–H) при 3220 (II), 3203 (III) и 3175 см–1 (IV). Сложные по контуру интенсивные полосы поглощения в интервале 1700–1580 см–1 могут быть рассмотрены как результат перекрывания полос колебаний ν(C=N)оксим в виде плеча на высокочастотной стороне интенсивной полосы, ν(C=O)dmf и νаs(СОО–). Интенсивные полосы поглощения νs(СОО–) наблюдаются в интервале 1377–1388 см–1.
В ИК-спектрах соединений II–IV, в отличие от спектра некоординированного диоксима, в области 1150–1000 см–1 проявляются очень интенсивные и широкие полосы поглощения, относящиеся к ν(C–O) или к ν(C–O) + δ(O–H) [29].
Деформационные внеплоскостные колебания ν(C–Н) бензольного кольца, характеризующие тип замещения (1,3-), проявляются для изолированного и трех смежных атомов водорода: 818 и 763 (II), 821 и 769 (III), 817 и 762 (IV) см–1 соответственно [29, 30].
В спектре ЯМР 1Н DmabaH4 присутствуют 4 мультиплетных сигнала в области 6.88–7.42 м.д., принадлежащие ароматическому кольцу. Сигнал при 8.38 м.д. принадлежит атому водорода группы NH, а сигнал при 10.61 м.д. – атому водорода оксимной группы. В спектре ЯМР 13C присутствуют сигналы в области 120.69–128.99 м.д., принадлежащие третичным атомам углерода в ароматическом кольце. С использованием комбинированных спектров HSQC и HMBC полученные сигналы были отнесены: 167.71 м.д. – к атому углерода карбоновой группы, 142.91 м.д. – к атому углерода оксимной группы и 140.39 м.д. – к четвертичному атому углерода ароматического кольца.
В протонном спектре соединения II помимо сигналов атомов водорода диоксимного лиганда наблюдаются сигналы атомов водорода dmf (2.71, 2.87 и 7.92 м.д.) в соотношении 1 : 1 к лиганду DmabaH2. Сигнал атома водорода оксимной группы претерпевает смещение в сильном поле на 0.79 м.д. по сравнению со спектром свободного лиганда. В углеродном спектре этого соединения химические смещения сигнала атомов углерода не превышают 3 м.д. по сравнению со спектром свободного лиганда. В протонном спектре соединения III наблюдается незначительное смещение сигнала ароматического кольца на ~0.03 м.д. по сравнению со спектром свободного лиганда, но более значительному смещению (на 0.2 м.д.) подвергается сигнал оксимной группы. В углеродном спектре соединения III по сравнению со спектром свободного лиганда значительные сдвиги сигналов не наблюдаются. В спектрах соединений II и III присутствуют одиночные сигналы в диапазоне 31.27–36.47 м.д. с разницей в 0.1 м.д., относящиеся к метильным группам dmf.
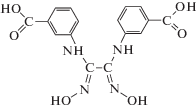
В новом гетерофункциональном диоксиме DmabaH4 (I), полученном конденсацией м-аминобензойной кислоты с дихлорглиоксимом, к оксимным донорным атомам N2O2, которые могут участвовать в образовании координационных связей, добавились атомы кислорода карбоксильных групп аминобензойных фрагментов. Такое расположение двух карбоксильных групп в DmabaH4 (схема) предполагает его использование в качестве мостиковых лигандов и возможность получения как полиядерных координационныx соединений, так и координационных полимеров без вовлечения дополнительных мостиковых лигандов.
Схема 1. Структурная формула молекулы DmabaH4.
На основе I синтезированы три новых координационных полимера переходных металлов Zn(II), Cd(II) и Mn(II) состава {[Zn(Dma baH2)(H2O)(dmf)] ∙ dmf}n (II), {[Cd(DmabaH2)(H2O)2] ∙ 0.5dmf ∙ 4H2O}n (III) и {[Mn(DmabaH2)(H2O)(dmf)] ∙ dmf}n (IV).
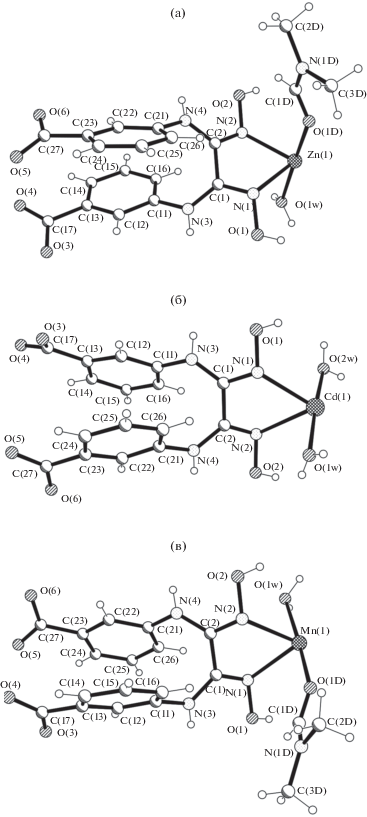
Соединения II и IV кристаллизуются в моноклинной пр. гр. P21/с, а соединение III – в ромбической пр. гр. Pbcn (табл. 1). В независимой части элементарных ячеек II–IV находятся по одному атому металла и одному лиганду DmabaH2 в общих положениях, молекулы воды и dmf в разных соотношениях. Часть последних координируется к комплексообразователю (рис. 1а–1в), часть находится в кристалле в виде кристаллизационных молекул. Лиганд (DmabaH2)2– вовлечен в образование соединения как дианион, при этом депротонируются лишь карбоксильные группы. Лиганд (DmabaH2)2– в II–IV координируется к атомам металла тетрадентатно, используя донорный набор N2O2. При этом, если к одному атому метала он координируется двумя атомами азота диоксимного фрагмента бидентатно-хелатно, образуя пятичленные металлоциклы, то к двум другим атомам металла – монодентатно через два атома кислорода, принадлежащих карбоксильным группам двух различных бензойных фрагментов. Таким образом, (DmabaH2)2– в II–IV вовлечен в образование комплексов как мостиковый лиганд, формируя в кристалле координационные 2D-полимеры. Окружение каждого атома металла в II–IV образовано донорным набором N2O2 трех лигандов (DmabaH2)2–, и эти атомы находятся в экваториальной плоскости октаэдрического координационного полиэдра. Дополняют формирование полиэдров Zn(II), Cd(II) и Mn(II) два атома кислорода, принадлежащие в II и IV одной молекуле воды и одной – dmf, а в III – двум молекулам воды. В результате октаэдрические координационные полиэдры атомов металла в II–IV образованы одинаковым набором донорных атомов N2O4. Значения межатомных расстояний М–O в II–IV находятся в интервалах 1.986(2)–2.192(2), 2.217(5)–2.307(5) и 2.054(3)–2.202(3) Å соответственно, расстояния M–N равны 2.135(3) и 2.227(3)/2.319(6), 2.390(6)/2.245(3) и 2.308(3) Å соответственно (табл. 2 ).
Рис. 1.
Строение независимых фрагментов координационных полимеров Zn(II) (а), Cd(II) (б) и Mn(II) (в) с нумерацией атомов (соединения II–IV соответственно).
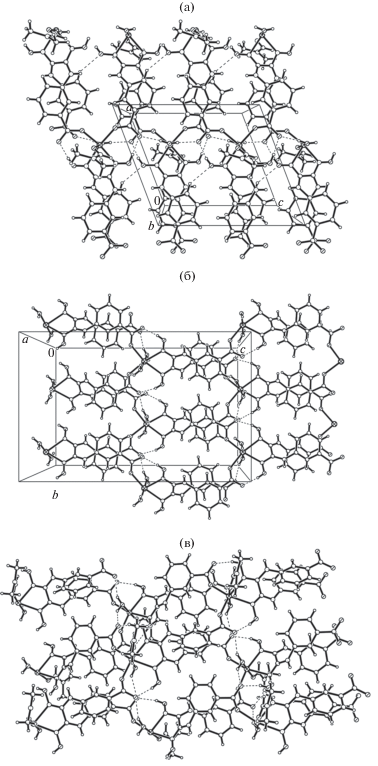
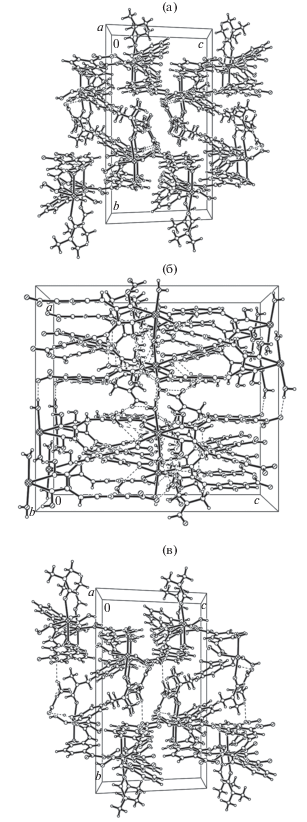
В кристаллах II–IV обнаружена система внутри- и межмолекулярных водородных связей. Во всех трех соединениях можно выделить внутримолекулярные ВС O(оксим)–H∙∙∙O(карб), образующие два семичленных псевдометаллоцикла, стабилизирующие слои координационных полимеров (рис. 2а–2в, табл. 3). При этом координированные молекулы воды как в II, так и в IV одинаково образуют по две внутримолекулярные ВС O(w)–H∙∙∙O(карб), а в III также обнаружены две подобные связи O(w)–H∙∙∙O(карб), образованные обеими координированными молекулами воды O(1w) и O(2w). В результате в слоях координационных полимеров II–IV можно выделить цепочки, сформированные внутримолекулярными ВС O(оксим)–H∙∙∙O(карб) и O(w)–H∙∙∙O(карб). В изоморфных кристаллах II и IV кристаллизационные молекулы dmf связаны с полимерным каркасом межмолекулярными ВС N–H∙∙∙O, в которых донором протона выступает группа NH лиганда (DmabaH2)2– (рис. 3а, 3в, табл. 3). В III, который отличается от II и IV и количеством координированных и кристаллизационных молекул воды (соотношение металл : кристаллизационные молекулы воды = 1 : 4), последние играют важную роль в образовании кристаллической структуры (рис. 3б, табл. 3). В кристалле III кристаллизационные молекулы воды O(3w)–O(6w) связаны как с координационным полимером Cd(II) межмолекулярными ВС O(w)–H∙∙∙O(w) и N–H∙∙∙O(w), в которых донорами протонов выступают обе координированные молекулы воды и обе аминогруппы –NH лиганда (DmabaH2)2–, так и между собой ВС O(w)–H∙∙∙O(w), a молекулы dmf связаны с полимерным каркасом и кристаллизационными молекулами воды подобными межмолекулярными ВС O(w)–H∙∙∙O.
Таким образом, введение в диоксим фрагментов, содержащих функциональные донорные группы, увеличило дентатность лиганда, а их расположение по отношению к оксимной группе привело к изменению функции самого лиганда. В результате, если классические нейтральные диоксимы и диоксимат-анионы координируются к атомам металла в основном N,N-бидентатно-хелатным способом, то новый ди-м-аминобензоилглиоксим вовлечен в образование соединений переходных металлов Zn(II), Cd(II) и Mn(II) как мостиковый лиганд.
Список литературы
Yaghi O.M., Davis C.E., Li G., Li H. // J. Am. Chem. Soc. 1997. V. 119. № 12. P. 2861. https://doi.org/10.1021/ja9639473
Janiak Ch. // Dalton Trans. 2003. № 14. P. 2781. https://doi.org/10.1039/b305705b
Perry J.J., Perman J.A., Zaworotko M.J. // Chem. Soc. Rev. 2009. V. 38. № 5. P. 1400. https://doi.org/10.1039/b807086p
Yang W., Lin X., Blake A.J. et al. // Inorg. Chem. 2009. V. 48. № 23. P. 11067. https://doi.org/10.1021/ic901429u
Чугаев Л.А. // Избр. тр. М.: Изд-во АН СССР, 1954. Т. 1. 639 с.
Coropceanu E., Rija A., Lozan V. et al. // Cryst. Growth Des. 2016. V. 16. № 2. P. 814. https://doi.org/10.1021/acs.cgd.5b01402
Coropceanu E.B., Croitor L., Wicher B. et al. // Inorg. Chim. Acta. 2009. V. 362. P. 2151. https://doi.org/10.1016/j.ica.2008.09.047
Croitor L., Coropceanu E.B., Siminel A.V. et al. // Cryst-EngComm. 2012. V. 14. № 10. P. 3750. https://doi.org/10.1039/c2ce00020b
Coropceanu E., Croitor L., Siminel A. et al. // Polyhedron. 2016. V. 109. P. 107. https://doi.org/10.1016/j.poly.2016.01.043
Croitor L., Coropceanu E., Duca Gh. et al. // Polyhedron. 2017. V. 129. P. 9. https://doi.org/10.1016/j.poly.2017.03.026
Endres H., Knieszner A. // Acta Crystallogr. 1984. V. C40. № 5. P. 770. https://doi.org/10.1107/S0108270184005679
Belombe M.M., Nenwa J., Kouamo J.S.T.W. et al. // Acta Crystallogr. 2012. V. C68. № 5. P. m131. https://doi.org/10.1107/S0108270112016435
Kawata S., Kitagawa S., Machida H. et al. // Inorg. Chim. Acta. 1995. V. 229. № 1-2. P. 211. https://doi.org/10.1016/0020-1693(94)04247-S
Croitor L., Coropceanu E.B., Siminel A.V. et al. // Cryst. Growth Des. 2011. V. 11. № 8. P. 3536. https://doi.org/10.1021/cg200465f
Endres H., Nothe D., Rossato E., Hatfield W.E. // Inorg. Chem. 1984. V. 23. № 22. P. 3467. https://doi.org/10.1021/ic00190a008
Allen F.H. // Acta Crystallogr. 2002. V. B58. № 3–1. P. 380. https://doi.org/10.1107/s0108768102003890
Yuksel F., Gurek G., Durmus M. et al. // Inorg. Chim. Acta. 2008. V. 361. № 1. P. 2225. https://doi.org/10.1016/j.ica.2007.11.019
Durmus M., Ahsen V., Luneau D., Pecaut J. // Inorg. Chim. Acta. 2004. V. 357. № 1. P. 588. https://doi.org/10.1016/j.ica.2003.05.004
Gumus G., Ahsen V., Lebrun C. et al. // New J. Chem. 2004. V. 28. № 2. P. 177. https://doi.org/10.1039/b307783g
Yuksel F., Gumus G., Gurol I. et al. // Dalton Trans. 2008. № 2. P. 241. https://doi.org/10.1039/B707930C
Kabay N., Altunbaş A.K., Misir M.N., Gok Y. // J. Incl. Phenom. Macrocycl. Chem. 2012. V. 74. № 1–4. P. 285. https://doi.org/10.1007/s10847-012-0114-z
Ocak U., Kantekin H., Gok Y., Misir M.N. // New J. Chem. 2003. V. 27. № 8. P. 1251. https://doi.org/10.1039/b207693b
Уреке Д., Булхак И., Рижа А. и др. // Коорд. химия. 2019. Т. 45. № 12. С. 720. [Ureche D., Bulhac I., Rija A. et al. // Russ. J. Coord. Chem. 2019. V. 45. № 12. P. 843. https://doi.org/10.1134/S107032841912008X]
CrysAlis RED, O.D.L. Version 1.171.34.76, 2003.
Sheldrick G.M. // Acta Crystallogr. 2008. V. A64. № 1. P. 112. https://doi.org/10.1107/S0108767307043930
Гордон А., Форд Р. Спутник химика – Физико-химические свойства, методики, библиография / Пер. с англ. Розенберга Е.Л. и Коппель С.И. М.: Мир, 1976. 541 с.
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Р. Инфракрасная спектроскопия органических и природных соединений. СПб.: СПбГЛТА, 2007. 29 с.
Тарасевич Б.Н. ИК спектры основных классов органических соединений. Справочные материалы. М., 2012. 54 с.
Беллами Л. Инфракрасные спектры сложных молекул / Пер. с англ. под ред. Пентина Ю.А. М.: Изд-во иностр. литер., 1963. 592 с.
Наканиси К. Инфракрасные спектры и строение органических соединений / Пер. с англ. под ред. Мальцева А.А. М.: Мир, 1965. 216 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии