Журнал неорганической химии, 2020, T. 65, № 2, стр. 147-153
Водородсорбционные свойства интерметаллидов La3 – xMgxCo9 (х = 1.2, 1.5, 2)
В. Б. Сон a, *, Б. П. Тарасов a
a Институт проблем химической физики РАН
142432 Московская обл., Черноголовка, пр-т Академика Семенова, 1, Россия
* E-mail: son@icp.ac.ru
Поступила в редакцию 15.04.2019
После доработки 31.07.2019
Принята к публикации 27.09.2019
Аннотация
Магнийсодержащие интерметаллические соединения типа AB3 нередко обладают повышенной, по сравнению с соединениями типа АВ5, водородсорбционной емкостью и являются перспективными материалами для металлогидридных аккумуляторов и компрессоров водорода, а также для никель-металлогидридных перезаряжаемых источников тока. Для определения влияния замены лантана на магний в интерметаллиде LaCo3 с целью возможного повышения водородсорбционных свойств получены и изучены интерметаллические соединения La3– xMgxCo9 (x = 1.2, 1.5, 2). Исследованы водородсорбционные свойства сплавов при температурах 303–343 K и давлениях 0.1–25 атм, показано образование двух гидридных фаз. Установлено, что максимальная емкость по водороду составляет 0.62 ± 0.08 мас. % для La1.8Mg1.2Co9, 0.30 ± 0.03 мас. % для La1.5Mg1.5Co9 и 0.75 ± 0.09 мас. % для LaMg2Co9. Показано, что объем элементарных ячеек при гидрировании увеличивается на 13.8% для La1.8Mg1.2Co9 и 16.5% для LaMg2Co9. Построены кривые поглощения водорода интерметаллидами и проведен сравнительный анализ полученных данных.
ВВЕДЕНИЕ
Для компактного и безопасного хранения и компримирования водорода часто применяется металлогидридный способ, основанный на обратимом гидрировании интерметаллических соединений, особенно типов АВ5, АВ3 и АВ2 [1–4]. Соединения этих типов используются и в никель-металлогидридных аккумуляторах [5–7]. Наибольший интерес вызывают интерметаллиды типа АВ3, так как их удельная емкость на 25% больше, чем у соединений типа АВ5 [8–11]. Гидридные фазы соединений редкоземельных металлов (А) с металлами триады железа (В) типа АВ3, по данным различных авторов, могут содержать больше водорода, чем гидриды на основе сплавов типа АВ5 [1, 12–15].
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
Типичный представитель интерметаллидов типа АВ3 – LaNi3 – образует гидридную фазу LaNi3H5 с содержанием водорода 1.8 мас. %, в то время как в гидриде LaNi5H6.6 – 1.5 мас. % водорода [12, 14]. Большой интерес представляет замена в интерметаллических соединениях типа AB3 тяжелого и дорогого лантана на легкий и дешевый магний [16–18], так как он и его сплавы могут обратимо поглощать большое количество водорода [19, 20]. Известно, что структура интерметаллида LaNi3 состоит из чередующихся слоев LaNi2 и LaNi5, а во фрагментах LaNi2 возможна замена лантана на магний [16–18, 21]. Оказалось, что магнийсодержащие интерметаллиды типа AB3 обладают повышенной водородсорбционной емкостью и являются перспективными материалами для металлогидридного хранения водорода и для никель-металлогидридных перезаряжаемых источников тока [18, 22–27]. В работе [28] показано, что при выплавке магнийсодержащих соединений происходит испарение части магния, вследствие чего состав образующихся сплавов не соответствует ожидаемому, а количество и состав примесных фаз могут отличаться в зависимости от условий плавки. Поэтому при получении магнийсодержащих интерметаллидов и сплавов проводят последующий гомогенизационный отжиг.
Интересно было изучить влияние замены La на Mg в интерметаллиде LaCo3 на его водородсорбционные свойства. В литературе отсутствуют данные об интерметаллидах с такой полной заменой, но показано, что это возможно в интерметаллидах типа АВ3 с небольшим содержанием кобальта [26, 27]. Поэтому можно ожидать, что, как и в случае с никельсодержащими интерметаллидами [16–18, 21, 22], введение в их состав магния улучшит водородсорбционные характеристики. Замена лантана на магний существенно уменьшает молярную массу сплава, а это, в свою очередь, увеличивает водородоемкость. В работах [16–18, 21] показано, что в случае с никельсодержащими интерметаллидами заменить лантан на магний в слоях АВ5 методом плавки не удается. Это связано, скорее всего, с тем, что интерметаллид MgNi5 не существует. Поскольку замена лантана на магний происходит только в слоях АВ2, а структура АВ3 состоит из чередующихся слоев АВ5 и АВ2 в соотношении 1 : 2, составом с максимальной заменой лантана на магний будет LaMg2Co9, и еще необходимо синтезировать составы с меньшим содержанием магния, чтобы исследовать водородсорбционные свойства соединений этого ряда во всем диапазоне концентраций магния. Поэтому цель настоящей работы – получение и изучение водородсорбционных свойств интерметаллических соединений La3 – xMgxCo9 (x = 1.2, 1.5, 2).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования были интерметаллические соединения La1.8Mg1.2Co9, La1.5Mg1.5Co9 и LaMg2Co9.
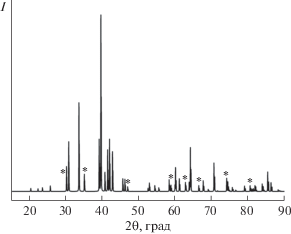
Фазовый состав сплавов и их гидридов изучали методом рентгенофазового анализа (РФА) при комнатной температуре на дифрактометре ДРОН 1М (CuKα-излучение) с последующей обработкой дифрактограмм с помощью специальной программы PowderCell, как и в работе [18]. Поскольку гидриды изучаемых интерметаллических соединений неустойчивы на воздухе, проводили их пассивацию монооксидом углерода [12, 17]. Для этого автоклав с образцом гидрида погружали в жидкий азот и сбрасывали избыточное давление водорода. Затем к системе подключали баллон с монооксидом углерода и оставляли на сутки под давлением, после чего извлекали образец гидрида из автоклава в сухом аргоновом боксе.
Исходные сплавы исследовали на оборудовании Аналитических центров коллективного пользования Института проблем химической физики РАН и Научного центра Российской академии наук в Черноголовке. Элементный состав интерметаллидов контролировали химическим анализом. Содержание La находили гравиметрически – селективным осаждением гидроксида редкоземельного металла аммиаком из раствора образца сплава в кислоте. Содержание магния и кобальта измеряли с использованием атомно-адсорбционной спектроскопии паров в ацетилен-воздушном пламени при λ = 285.2 нм (Mg) и 240.7 нм (Co). Содержание водорода в гидридных фазах после снятия изотерм сорбция–десорбция определяли методом сжигания образца в токе кислорода с последующим поглощением образовавшейся воды безводным перхлоратом магния. Для этого навеску исследуемого образца в кварцевом стаканчике помещали в кварцевую трубку, которая в токе кислорода нагревалась до 1273 К. Образующаяся при этом вода улавливалась перхлоратом магния в поглотительной трубке. Содержание водорода вычисляли по формуле:
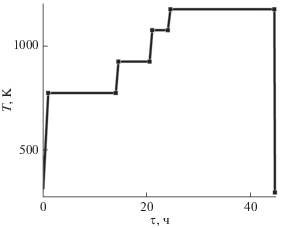
где m1 – привес поглотительной трубки, мг; m2 – масса навески гидрида, мг; k – содержание водорода в воде (0.1119).Синтез интерметаллических соединений типа АВ3 из элементов обычно затрудняется тем, что сложно контролировать содержание магния в полученном сплаве, так как при аргоновой плавке температура составляет ∼3000 K. Поэтому было предложено использовать прекурсор, который уже содержал магний и был достаточно хорошо изучен в литературе, – интерметаллическое соединение LaMg3. Этот сплав получали сплавлением чистых металлов La (98%) и Mg (99.9%) в муфельной печи при температуре 1473 K. Затем к полученному прекурсору добавляли рассчитанные количества кобальта (99.7%) и лантана (98%) и полученную смесь подвергали электродуговой плавке в атмосфере аргона. Выплавленные сплавы измельчали в планетарно-шаровой мельнице в атмосфере водорода (250 оборотов, 1 ч, mшаров/mобразца = = 10/1, ${{P}_{{{{H}_{2}}}}}$ = 30 атм). Помол в водородной среде был использован нами ранее в случае с интерметаллидом Y2MgNi9, что способствовало активации сплава, поэтому и в данной работе была выбрана та же газовая среда. Полученный порошок прессовали в таблетки (10 атм), которые затем помещали в кварцевую ампулу. Таблетки отжигали согласно температурному профилю (рис. 1) с последующей закалкой в холодной воде для увеличения доли основной фазы АВ3 и равномерного распределения магния в образцах. Такой режим отжига интерметаллических соединений уже использовался для термической обработки никельсодержащих сплавов типа АВ3 [17, 18, 24]. Было показано, что именно отжиг при температуре 1173 K дает наименьшее количество примесей.
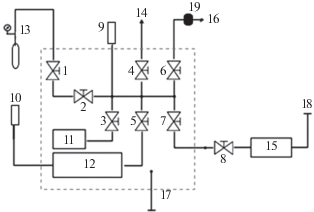
Водородсорбционные свойства сплавов изучали с помощью установки, схема которой представлена на рис. 2.
Рис. 2.
Схема установки для гидрирования образцов: 1 – запорный вентиль; 2–8 – регулирующие вентили; 9 – датчик давления до 25 атм; 10 – датчик давления до 1 атм; 11 – пробоотборник 50 мл; 12 – пробоотборник 300 мл; 13 – аккумулятор водорода; 14 – форвакуумный насос; 15 – автоклав; 16 – сброс давления; 17, 18 – термопары, 19 – огнепреградитель, пунктирный контур – термостат.
Перед началом измерений все образцы 40 мин активировали в вакууме при 673 K. Затем выполняли один цикл полной абсорбции–десорбции, после которого проводили измерения. Изотермы давление водорода–содержание водорода в гидриде в системе интерметаллид–водород были построены в интервале давлений 0.1–25 атм при температурах 303, 313, 323, 333 и 343 K. Следует отметить, что примесная фаза LaCo5 при данных условиях не образует гидрид [29]. Интервал температур 303–343 K был выбран в связи с возможностью поддерживать температуру в автоклаве с помощью водного термостата и сравнивать в дальнейшем построенные изотермы с изотермами для других систем.
Для расчета количества поглощенного или выделившегося водорода применяли уравнение идеального газа, так как в данной работе использовали относительно невысокие температуры и давления.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фазовый и элементный состав исследуемых сплавов
Химический анализ полученного нами прекурсора показал, что он содержит 66.9 ± 3.0 мас. % La и 32.3 ± 0.7 мас. % Mg. Соотношение La и Mg соответствует брутто-формуле LaMg2.6 ± 0.2. По данным РФА, кроме основной (целевой) фазы со структурным типом CeMg3 в выплавленном сплаве присутствует ∼10% примеси состава LaMg2 со структурным типом LaMg2.
Результаты анализа на содержание компонентов в интерметаллических соединениях La3 – xMgxCo9 (x = 1.2, 1.5, 2) представлены в табл. 1. Поскольку из литературы [28] известно, что при выплавке магнийсодержащих соединений трудно добиться теоретически ожидаемого состава из-за испарения части магния, для удобства сравнения рассчитаны брутто-формулы La1.71Mg1.29Co9, La1.51Mg1.49Co9 и La1.17Mg1.83Co9. Разница между ожидаемым и рассчитанным составом, как оказалось, связана с наличием примесной фазы LaCo5.
Таблица 1.
Результаты химического анализа образцов La3– xMgxCo9 (x = 1.2, 1.5, 2)
| Образец | Содержание (теор.), мас. % | ||
|---|---|---|---|
| La | Mg | Co | |
| La1.8Mg1.2Co9 | 29.7 ± 2.4 (30.9) | 3.9 ± 0.5 (3.6) | 65.7 ± 3.7 (65.5) |
| La1.5Mg1.5Co9 | 26.7 ± 3.6 (26.9) | 4.7 ± 0.5 (4.7) | 68.3 ± 5.6 (68.4) |
| LaMg2Co9 | 21.7 ± 2.9 (19.4) | 6.0 ± 0.4 (6.8) | 72.1 ± 4.1 (73.9) |
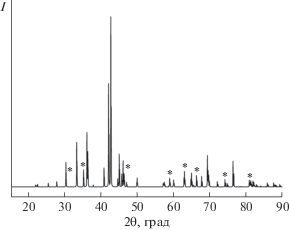
По данным РФА, отожженные сплавы на 80% состоят из основной (целевой) фазы со структурным типом PuNi3 (рис. 3). Все сплавы в качестве примеси содержали ∼20% LaCo5. Согласно расчетам параметров элементарных ячеек сплавов, объем и параметры элементарной ячейки уменьшаются при добавлении магния к исходному сплаву La1.8Mg1.2Co9 (табл. 2). Это, скорее всего, связано с тем, что атомный радиус магния (1.72 Å) практически вдвое меньше атомного радиуса лантана (2.74 Å). Исходя из анализа литературных данных о невозможности замены части La на Mg в структурном типе CaCu5 [16–18, 21] и при полном соответствии параметров элементарной ячейки примесной фазы LaCo5 известным в литературе для фазы LaCo5, можно полагать, что Mg практически не растворяется в примесной фазе.
Водородсорбционные свойства исследуемых сплавов
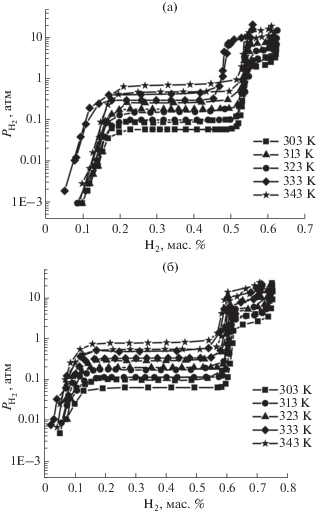
Для образцов La1.8Mg1.2Co9 и LaMg2Co9 были построены изотермы абсорбции–десорбции водорода при температурах 303, 313, 323, 333 и 343 K (рис. 4). На всех изотермах наблюдаются два плато. Максимальное содержание водорода в гидридах при температуре 303 K составило 0.62 ± 0.08 мас. % для La1.8Mg1.2Co9 и 0.75 ± 0.09 мас. % для LaMg2Co9, что отвечает брутто-формулам La1.8Mg1.2Co9H5.3 и LaMg2Co9H6.1. Образец La1.5Mg1.5Co9 поглотил около 0.3 мас. % водорода при 30 атм в интервале температур 303–343 K, поэтому для данного интерметаллида изотермы не построены.
Химический анализ на содержание водорода показал, что гидриды сплавов содержат 0.60 ± ± 0.05 (La1.8Mg1.2Co9), 0.28 ± 0.06 (La1.5Mg1.5Co9) и 0.72 ± 0.05 (LaMg2Co9) мас. % водорода.
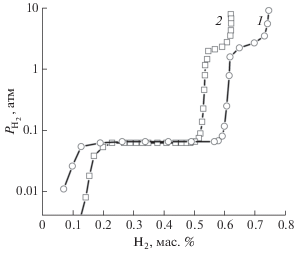
Для сравнительного анализа на рис. 5 приведены изотермы десорбции, построенные для систем LaMg2Co9–H2 и La1.8Mg1.2Co9–H2 при одной и той же температуре (303 K). Из полученных кривых четко прослеживается влияние содержания магния в образцах на их водородсорбирующие свойства: увеличение количества магния в интерметаллиде практически не меняет равновесное давление, но максимальная водородоемкость при этом увеличивается.
По уравнению Вант-Гоффа построены зависимости давления от обратной температуры для систем La1.8Mg1.2Co9–H2 (рис. 6а) и LaMg2Co9–H2 (рис. 6б). По этим графикам рассчитаны значения энтальпии и энтропии при дегидрировании (табл. 3).
Рис. 6.
Зависимости давления от обратной температуры для систем La1.8Mg1.2Co9–H2 (а) и LaMg2Co9–H2 (б).
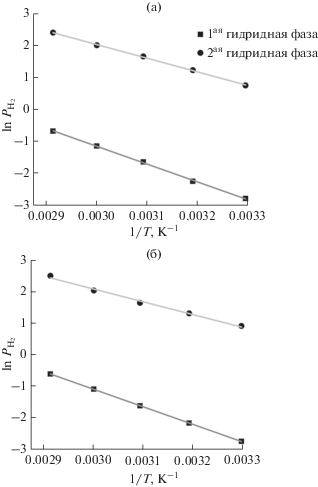
Таблица 3.
Изменение энтальпии и энтропии при дегидрировании образцов La3– xMgxCo9H5.3–6.1
| Гидрид | ΔН, кДж/моль H2 | ΔS, Дж/K моль H2 |
|---|---|---|
| La1.8Mg1.2Co9H5.3 | 33.2 ± 1.4 | 118 ± 2 |
| LaMg2Co9H6.1 | 35.1 ± 1.3 | 111 ± 2 |
Можно заметить, что практически отсутствуют корреляции между параметрами элементарной ячейки исходного соединения, равновесным давлением гидридообразования и энтальпией реакции. Аналогичную картину мы наблюдали и в случае никельсодержащих сплавов [17, 18]. Возможно, это обусловлено наличием примесей, но пока это предположение нуждается в дополнительном изучении.
По данным РФА, гидриды состоят на 80% из основной (целевой) фазы со структурным типом PuNi3 (рис. 7). Анализ рассчитанных параметров элементарных ячеек гидридов La1.8Mg1.2Co9H5.3 и LaMg2Co9H6.1, приведенных в табл. 4, показал, что в случае образца La1.8Mg1.2Co9 объем ячейки при гидрировании увеличивается на 13.8%, а для LaMg2Co9 – на 16.5%.
Таблица 4.
Параметры элементарной ячейки La3 ‒ xMgxNi9Hy
| Образец | а, Å | с, Å |
|---|---|---|
| La1.8Mg1.2Co9H5.3 | 5.301 ± 0.009 | 24.88 ± 0.03 |
| LaMg2Co9H6.1 | 5.190 ± 0.005 | 24.08 ± 0.04 |
Поскольку и в исходном сплаве, и в их гидридах присутствует примесная фаза LaCo5, можно сделать вывод о том, что она не гидрируется при используемых температурах и давлениях, хотя не исключено ее каталитическое влияние на кинетику гидрирования сплавов.
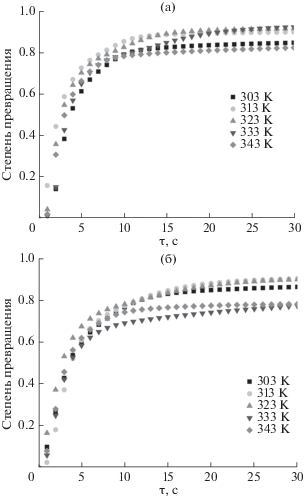
Получены кривые поглощения водорода интерметаллидами в интервале температур 303–343 K (рис. 8). Установлено, что наименьшая скорость поглощения водорода сплавами La1.8Mg1.2Co9 и LaMg2Co9 наблюдается при 343 K, а наибольшая – при 333 K (La1.8Mg1.2Co9) и 313 K (LaMg2Co9). Для снятия кривых в автоклав подавалось давление водорода намного выше равновесного (22 атм). Показания давления фиксировались датчиком с интервалом 0.2 с, а затем пересчитывались для степени превращения. На графиках прослеживается сложная зависимость скорости гидрирования от температуры, возможно, она обусловлена наличием примесей.
В табл. 5 приведено время гидрирования интерметаллидов, затрачиваемое для достижения определенной степени превращения. Следует отметить, что увеличение температуры влияет на скорость поглощения водорода сплавом LaMg2Co9 больше, чем сплавом La1.8Mg1.2Co9. Видно также, что замена никеля на кобальт значительно уменьшает максимальную водородоемкость, однако скорость гидрирования увеличивается почти в 1.5 раза.
Таблица 5.
Время взаимодействия (τ) в системах La1.8Mg1.2Co9–H2, LaMg2Co9–H2 и La2MgNi9–H2 при температуре 303 K
| Степень превращения | La1.8Mg1.2Co9–H2 | LaMg2Co9–H2 | La2MgNi9–H2 [18] | |||
|---|---|---|---|---|---|---|
| τ, с | содержание Н2, мас. % | τ, с | содержание Н2, мас. % | τ, с | содержание Н2, мас. % | |
| 0.3 | 2.6 | 0.19 | 2.2 | 0.23 | 6 | 0.5 |
| 0.5 | 3.8 | 0.31 | 3.9 | 0.38 | 12 | 0.8 |
| 0.8 | 9 | 0.48 | 12 | 0.60 | 41 | 1.2 |
ЗАКЛЮЧЕНИЕ
Синтезированы интерметаллические соединения La3– xMgxCo9 (x = 1.2, 1.5, 2) с примесью фазы LaCo5. Установлено, что при их взаимодействии с водородом образуются две гидридные фазы, при этом примесная фаза LaCo5 не гидридрируется. Показано, что замена лантана на магний в интерметаллидах LaCo3 уменьшает водородоемкость, но существенно увеличивает скорость гидрирования. Рассчитаны изменения энтропии и энтальпии десорбции в системах La1.8Mg1.2Co9–H2 и LaMg2Co9–H2. Установлено, что при гидрировании сплавов объем элементарных ячеек увеличивается на 13.8% в случае La1.8Mg1.2Co9 и на 16.5% для интерметаллида LaMg2Co9.
Список литературы
Tarasov B.P., Lototskii M.V., Yartys’ V.A. // Russ. J. Gen. Chem. 2007. V. 77. № 4. P. 694. [Тарасов Б.П., Лотоцкий М.В., Яртысь В.А. // Рос. хим. журн. 2006. Т. 50. № 6. С. 34.] https://doi.org/10.1016/j.ijhydene.2014.12.093
Tarasov B.P. // Int. J. Hydrogen Energy. 2011. V. 36. № 1. P. 1196. https://doi.org/10.1016/j.ijhydene.2010.07.002
Tarasov B.P., Bocharnikov M.S., Yanenko Y.B. et al. // Int. J. Hydrogen Energy. 2018. V. 43. № 9. P. 4415. https://doi.org/10.1016/j.ijhydene.2018.01.086
Yan H., Xiong W., Wang L. et al. // Int. J. Hydrogen Energy. 2017. V. 42. P. 2257. https://doi.org/10.1016/j.ijhydene.2016.09.049
Hubkowska K., Soszko M., Krajewski M. et al. // Electrochem. Commun. 2019. V. 100. P. 100. https://doi.org/10.1016/j.elecom.2019.02.007
Lodziana Z., Debski A., Cios G. et al. // Int. J. Hydrogen Energy. 2019. V. 44. P. 1760. https://doi.org/10.1016/j.ijhydene.2018.11.10
Tai S., Jie H., De M. et al. // Int. J. Hydrogen Energy. 2018. V. 43. P. 17318. https://doi.org/10.1016/j.ijhydene.2018.07.086
Wei T.Y., Lim K.L., Tseng Y.S. et al. // Renew. Sustain. Energy Rev. 2017. V. 79. P. 1122. https://doi.org/10.1016/j.rser.2017.05.132
Liu J., Zheng Z., Cheng H. et al. // J. Alloys Compd. 2018. V. 731. P. 172. https://doi.org/10.1016/j.jallcom.2017.10.042
Dymek M., Nowak M., Jurczyk M. et al. // J. Alloys Compd. 2019. V. 780. P. 697. https://doi.org/10.1016/j.jallcom.2018.11.196
Zhang Y., Li Y., Shang H. et al. // Int. J. Hydrogen Energy. 2018. V. 43. P. 1643. https://doi.org/10.1016/j.ijhydene.2017.11.112
Бурнашева В.В., Тарасов Б.П., Семененко К.Н. // Журн. неорган. химии. 1982. Т. 27. № 12. С. 3039.
Ben Belgacem Y., Khaldi C., Lamloumi J. // Int. J. Hydrogen Energy. 2017. V. 42. P. 12797. https://doi.org/10.1016/j.ijhydene.2016.12.143
Liu W., Webb C.J., Gray E.MacA. // Int. J. Hydrogen Energy. 2016. V. 41. P. 3485. https://doi.org/10.1016/j.ijhydene.2015.12.054
Xin G., Yuan H., Yang K. et al. // Int. J. Hydrogen Energy. 2016. V. 41. P. 21261. https://doi.org/10.1016/j.ijhydene.2016.07.259
Yartys V., Denys R. // J. Alloys Compd. 2015. V. 645. P. 412. https://doi.org/10.1016/j.jallcom.2014.12.091
Сон В.Б., Шимкус Ю.Я., Тарасов Б.П. и др. // Международный научный журнал “Альтернативная энергетика и экология”. 2015. № 21. С. 100. https://doi.org/10.15518/isjaee.2015.21.011
Son V.B., Volodin A.A., Tarasov B.P. et al. // Russ. Chem. Bull. 2016. V. 65. № 8. P. 1971. [Сон В.Б., Володин А.А., Тарасов Б.П. и др. // Изв. АН. Сер. хим. 2016. № 8. С. 1971.] https://doi.org/10.1007/s11172-016-1538-1
Fokin V.N., Fursikov P.V., Fokina E.E. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 1081. [Фокин В.Н., Фурсиков П.В., Фокина Э.Э. и др. // Журн. неорган. химии. 2019. Т. 64. № 9. С. 909. https://doi.org/10.1134/S0036023619090122
Fokin V.N., Fokina E.E., Tarasov B.P. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1605. [Фокин В.Н., Фокина Э.Э., Тарасов Б.П. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1589.] https://doi.org/10.1134/S0036023618120082
Hassen J., Luc A., Walid D. et al. // J. Solid State Chem. 2018. V. 260. P. 73. https://doi.org/10.1016/j.jssc.2018.01.015
Zhang L., Wang J., Du W. et al. // J. Alloys Compd. 2015. V. 653. P. 498. https://doi.org/10.1016/j.jallcom.2015.09.049
Ouyang L., Huang J., Wang H. et al. // Mater. Chem. Phys. 2017. V. 200. P. 164. https://doi.org/10.1016/j.matchemphys.2017.07.002
Volodin A.A., Denys R.V., Tsirlina G.A. et al. // J. Alloys Compd. 2015. V. 645. P. 288. https://doi.org/10.1016/j.jallcom.2014.12.201
Volodin A.A., Wan ChuBin, Denys R.V. et al. // Int. J. Hydrogen Energy. 2016. V. 41. P. 9954. https://doi.org/10.1016/j.ijhydene.2016.01.089
Lan Z., Li J., Wei B. et al. // J. Rare Earths. 2016. V. 34. № 4. P. 401. https://doi.org/10.1016/S1002-0721(16)60040-6
Cai X., Wei F., Xu X. et al. // J. Rare Earths. 2016. V. 34. № 12. P. 1235. https://doi.org/10.1016/S1002-0721(16)60159-X
Zhang L., Han S., Li Y., Liu J. // Int. J. Hydrogen Energy. 2013. V. 38. P. 10431. https://doi.org/10.1016/j.ijhydene.2013.05.129
Kohta A., Yoshiaki I., Masuo O. // J. Alloys Compd. 2005. V. 389. P. 215. https://doi.org/10.1016/j.jallcom.2004.05.081
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии